Allergia alimentare: differenze tra le versioni
→Localizzazione delle manifestazioni: ins. ref.s |
→Patologie associate: ins. ref.s |
||
| Riga 335: | Riga 335: | ||
===Patologie associate=== |
===Patologie associate=== |
||
* '''Immunologiche e reumatologiche''': [[vasculite|vasculiti]] (è stata riscontrata un'associazione con la [[porpora di Schönlein-Henoch]]) <ref>{{cita pubblicazione |quotes= |cognome=Robinson |nome=BW |linkautore= |coautori= |anno=1977 |mese=Feb |titolo=Henoch-Schonlein purpura due to food sensitivity. |rivista=Br Med J. |volume=19 |numero=1 |pagine=510-11 |id=PMID 556968 |url= |lingua= |accesso= |abstract= }}</ref>, [[artrite|artriti]]: in particolare è stato osservato che nella mucosa intestinale di soggetti con [[artrite idiopatica giovanile]] sono presenti [[linfocita|linfociti]] citotossici attivati, similmente a quanto avviene in corso di allergie. Ciò può far supporre un possibile ruolo degli allergeni alimentari nella patogenesi di questa malattia <ref>{{cita pubblicazione |quotes= |cognome=Arvonen |nome=M |linkautore= |coautori=Ikni L, Augustin M, Karttunen TJ, Vähäsalo P |anno=2010 |mese=Jan-Feb |titolo=Increase of duodenal and ileal mucosal cytotoxic lymphocytes in juvenile idiopathic arthritis |rivista=Clin Exp Rheumatol |volume=1 |numero=28 |pagine=128-34 | |
* '''Immunologiche e reumatologiche''': [[vasculite|vasculiti]] (è stata riscontrata un'associazione con la [[porpora di Schönlein-Henoch]]) <ref>{{cita pubblicazione |quotes= |cognome=Robinson |nome=BW |linkautore= |coautori= |anno=1977 |mese=Feb |titolo=Henoch-Schonlein purpura due to food sensitivity. |rivista=Br Med J. |volume=19 |numero=1 |pagine=510-11 |id=PMID 556968 |url= |lingua= |accesso= |abstract= }}</ref>, [[artrite|artriti]]: in particolare è stato osservato che nella mucosa intestinale di soggetti con [[artrite idiopatica giovanile]] sono presenti [[linfocita|linfociti]] citotossici attivati, similmente a quanto avviene in corso di allergie. Ciò può far supporre un possibile ruolo degli allergeni alimentari nella patogenesi di questa malattia <ref>{{cita pubblicazione |quotes= |cognome=Arvonen |nome=M |linkautore= |coautori=Ikni L, Augustin M, Karttunen TJ, Vähäsalo P |anno=2010 |mese=Jan-Feb |titolo=Increase of duodenal and ileal mucosal cytotoxic lymphocytes in juvenile idiopathic arthritis |rivista=Clin Exp Rheumatol |volume=1 |numero=28 |pagine=128-34 |PMID 20346253 |url= |lingua= |accesso= |abstract= }}</ref> <ref> {{cita pubblicazione |quotes= |cognome=Kokkonen |nome=J |linkautore= |coautori=Arvonen M, Vähäsalo P, Karttunen TJ |anno=2007 |mese=Sep-Oct |titolo=Intestinal immune activation in juvenile idiopathic arthritis and connective tissue disease |rivista=Scand J Rheumatol |volume=5 |numero=36 |pagine=386-9 |PMID 17963169 |url= |lingua= |accesso= |abstract= }}</ref>. |
||
* '''Neurologiche e psichiatriche''': [[emicrania]] (fra le varie ipotesi patogenetiche molti autori hanno ipotizzato il ruolo di alcuni allergeni alimentari)<ref>Victorino CC |
* '''Neurologiche e psichiatriche''': [[emicrania]] (fra le varie ipotesi patogenetiche molti autori hanno ipotizzato il ruolo di alcuni allergeni alimentari)<ref name="Victorino-2009">{{Cita pubblicazione | cognome = Victorino | nome = CC. | coauthors = AH. Gauthier | titolo = The social determinants of child health: variations across health outcomes - a population-based cross-sectional analysis. | rivista = BMC Pediatr | volume = 9 | numero = | pagine = 53 | mese = | anno = 2009 | doi = 10.1186/1471-2431-9-53 | id = PMID 19686599 }}</ref> <ref name="Speight-2006">{{Cita pubblicazione | cognome = Speight | nome = N. | coauthors = | titolo = Best practice: migraine. | rivista = Arch Dis Child | volume = 91 | numero = 6 | pagine = 541 | mese = Jun | anno = 2006 | doi = | id = PMID 16714736 }}</ref> <ref name="Merrett-1983">{{Cita pubblicazione | cognome = Merrett | nome = J. | coauthors = RC. Peatfield; FC. Rose; TG. Merrett | titolo = Food related antibodies in headache patients. | rivista = J Neurol Neurosurg Psychiatry | volume = 46 | numero = 8 | pagine = 738-42 | mese = Aug | anno = 1983 | doi = | id = PMID 6886717 }}</ref>. Tra i pazienti affetti è stata inoltre riscontrata un'aumentata incidenza di disturbi psichici quali [[ansia]], sintomi [[depressione|depressivi]], aggressività e [[insonnia|disturbi del sonno]], nonché un aumento del rischio di suicidio <ref name="Postolache-2008">{{Cita pubblicazione | cognome = Postolache | nome = TT. | coauthors = H. Komarow; LH. Tonelli | titolo = Allergy: a risk factor for suicide? | rivista = Curr Treat Options Neurol | volume = 10 | numero = 5 | pagine = 363-76 | mese = Sep | anno = 2008 | doi = | id = PMID 18782509 }}</ref>. |
||
| ⚫ | * '''Renali e genito-urinarie''': in alcuni casi di [[enuresi]] del bambino è stato osservato un effetto scatenante di particolari alimenti <ref name="Esperanca-1969">{{Cita pubblicazione | cognome = Esperanca | nome = M. | coauthors = JW. Gerrard | titolo = Nocturnal enuresis: comparison of the effect of imipramine and dietary restriction on bladder capacity. | rivista = Can Med Assoc J | volume = 101 | numero = 12 | pagine = 65-8 | mese = Dec | anno = 1969 | doi = | id = PMID 5362303 }}</ref>. Anche alcune forme di [[sindrome nefrosica]] possono avere un nesso con l'allergia: in particolare è stato ipotizzato che l'[[interleuchina]] 13, una [[citochina]] coinvolta nella risposta immunitaria IgE-mediata, possa essere responsabile della proteinuria nei pazienti con [[glomerulopatia a lesioni minime]] per la sua capacità di indurre l'espressione di una molecola, detta CD80, sulla superficie dei [[podocita|podociti]]. <ref name="Abdel-Hafez-2009">{{Cita pubblicazione | cognome = Abdel-Hafez | nome = M. | coauthors = M. Shimada; PY. Lee; RJ. Johnson; EH. Garin | titolo = Idiopathic nephrotic syndrome and atopy: is there a common link? | rivista = Am J Kidney Dis | volume = 54 | numero = 5 | pagine = 945-53 | mese = Nov | anno = 2009 | doi = 10.1053/j.ajkd.2009.03.019 | id = PMID 19556042 }}</ref> Fra gli allergeni individuati quali possibili cause scatenanti di sindrome nefrosica (particolarmente in età infantile) vi sono le proteine del latte <ref name="de Sousa-1995">{{Cita pubblicazione | cognome = de Sousa | nome = JS. | coauthors = FC. Rosa; A. Baptista; H. Fonseca; G. Sá | titolo = Cow's milk protein sensitivity: a possible cause of nephrotic syndrome in early infancy. | rivista = J Pediatr Gastroenterol Nutr | volume = 21 | numero = 2 | pagine = 235-7 | mese = Aug | anno = 1995 | doi = | id = PMID 7472914 }}</ref> |
||
headache patients. J Neurol Neurosurg Psychiatry. 1983 Aug;46(8):738-42. PMID 6886717</ref>. Tra i pazienti affetti è stata inoltre riscontrata un'aumentata incidenza di disturbi psichici quali [[ansia]], sintomi [[depressione|depressivi]], aggressività e [[insonnia|disturbi del sonno]], nonché un aumento del rischio di suicidio. <ref>Postolache TT, Komarow H, Tonelli LH. Allergy: a risk factor for suicide? Curr Treat Options Neurol. 2008 Sep;10(5):363-76. PubMed PMID 18782509;</ref> |
|||
. |
|||
| ⚫ | * '''Renali e genito-urinarie''': in alcuni casi di [[enuresi]] del bambino è stato osservato un effetto scatenante di particolari alimenti <ref>Esperanca M |
||
| ⚫ | * '''[[ORL]]''': di recente (maggio 2010) sono state segnalate come complicanza non comune, in corso di allergia alimentare, forme di [[rinite allergica]] <ref>{{cita pubblicazione |quotes= |cognome=Cingi|nome= C.|linkautore= |coautori= Demirbas D, Songu M.|anno= 2010|mese= May|titolo=Allergic rhinitis caused by food allergies. |rivista=Arch Otorhinolaryngol.|volume= |numero= |pagine= |PMID 20490817.|url= |lingua= |accesso= |abstract= }}</ref>. |
||
| ⚫ | * '''[[ORL]]''': di recente (maggio 2010) sono state segnalate come complicanza non comune, in corso di allergia alimentare, forme di [[rinite allergica]] <ref>{{cita pubblicazione |quotes= |cognome=Cingi|nome= C.|linkautore= |coautori= Demirbas D, Songu M.|anno= 2010|mese= May|titolo=Allergic rhinitis caused by food allergies. |rivista=Arch Otorhinolaryngol.|volume= |numero= |pagine= | |
||
<gallery> |
<gallery> |
||
</gallery> |
</gallery> |
||
Versione delle 11:00, 3 lug 2010
Template:Disclaimer medico Template:Infobox Malattia
«Quod aliis cibus est aliis fuat acre venenum.»
«Quello che è cibo per un uomo è veleno per un altro.»
L'allergia alimentare è una rapida ed esagerata reazione patologica del sistema immunitario nei confronti di un alimento ingerito. Spesso è scambiata erroneamente con l'intolleranza alimentare (o ipersensibilità alimentare). Schematicamente, le differenze principali sono:
| Patologia | Cause (esempi) |
|---|---|
| Allergia alimentare | reazione immunomediata alle proteine degli alimenti |
| Reazione a: farmaci/sostanze chimiche | caffeina, formaggio/vino: tiramina, sgombro: istamina; additivi alimentari: conservanti, coloranti, ecc |
| Tossinfezione alimentare | tossine batteriche: stafilotossina |
| Intolleranza alimentare | intolleranza al lattosio (deficit di lattasi), intolleranza al glutine: Celiachia |
Manifestazioni di allergia alimentare si osservano nel 6% circa dei bambini e nell'1-2% degli adulti [1]; secondo altri autori, nelle popolazioni occidentali, si arriva fino all'8% nei bambini e il 2 [2] - 3,7% [3] Recenti dati USA del CDC/National Center for Health Statistics mostrano un impressionante aumento di questa patologia.[4]
Questa patologia, se pur raramente, può manifestarsi con quadri clinici pericolosi per la vita come lo shock anafilattico.[5] Le allergie alimentari causa di anafilassi potenzialmente fatale, sono dovute per l'80% dei casi ad arachidi e nocciole[6] .La reazione allergica determinata dagli alimenti è causa di una variegata sintomatologia che può manifestarsi su vari organi ed apparati come la pelle, l'apparato gastrointestinale, l'apparato respiratorio. Le reazioni allergiche comportano un coinvolgimento di meccanismi immunitari, IgE mediati e cellulo-mediati, che in termini fisiopatologici fanno parte delle ipersensibilità immediata di tipo I.
È opinione condivisa che questa patologia sia dovuta ad una soppressione dei normali meccanismi di tolleranza immunologica alle proteine ingerite con il cibo. Tra gli alimenti maggiormente coinvolti nelle allergie alimentari vi sono il latte, le uova, la soia, le arachidi, le nocciole, il pesce, i crostacei e molti altri alimenti capaci di far degranulare l'istamina contenuta nei mastociti. Per la diagnosi occorre un'attenta anamnesi, seguita da accertamenti di laboratorio, e anche se necessario da test di scatenamento.
Solitamente la gestione della patologia consiste nell'educare il paziente ad evitare rigidamente l'allergene responsabile delle manifestazioni allergiche e contestualmente, in caso di ingestione non intenzionale dello stesso, iniziare una terapia antiallergica. Talvolta è anche possibile una prevenzione farmacologica.

Cenni storici

I primi ad identificare le reazioni avverse agli alimenti furono Ippocrate (460-370 A.C.), il quale comprese che il cibo poteva essere causa di manifestazioni patologiche come l'orticaria e la cefalea, e successivamente Galeno (131-210 D.C.) che pare curasse malati di allergia alimentare.
Nei primi decenni del XX secolo sono state identificate le allergie alle proteine del latte e delle uova.
Le conoscenze sull'allergia alimentare nella storia si inquadrano necessariamente con le conoscenze più generali dell'allergia e dell'immunologia come scienza medica. In questa chiave la prima segnalazione giunta a noi riguarda la reazione a punture di vespe che pare abbia colpito, uccidendolo, il faraone egiziano Menfis vissuto tra il 3640 a.C. e il 3300 a.C..[7] Pare, inoltre, che Nerone debba parte della sua fortuna nell'ascesa al trono dell'Impero romano ad un'allergia del fratello Claudio ai cavalli, che gli impediva di cavalcare insieme all'imperatore Claudio suo padre.[8]
Dobbiamo aspettare i primi anni dell'800 per vedere le prima scoperte che riguarderanno l'immunologia così come la intendiamo oggi. Fu John Bostock, nel 1819, a comprendere che la reazione al fieno (nota come "febbre da fieno") nulla aveva a che vedere con la febbre vera e propria. Ottanta anni dopo, il medico inglese Charles Harrison Blackley mise a punto i primi test allergologici, consistenti nell'applicazione intradermica della sostanza sospetta. La risposta era positiva quando dopo 30 minuti circa appariva un intenso arrossamento, provocato dalla risposta infiammatoria locale all'agente estraneo (chiamato "allergene").
Nel 1902 i francesi C. Richet e P. Portier introdussero per la prima volta il termine di anafilassi, come causa di risposta acuta e grave a sostanze estranee all'organismo come i farmaci. Il primo ad introdurre il termine di allergia fu il pediatra austriaco Clemens von Pirquet, dopo avere osservato pazienti colpiti da difterite.
Le moderne basi della moderna immunologia come la conosciamo oggi, ebbero origine nel 1911 grazie agli studi dei medici L. Noon e J. Freeman, che intuirono il potenziale terapeutico della terapia desensibilizzante vaccinale. Nel 1963 fu proposta la classificazione delle malattie allergiche da Philip Gell e Robin Coombs, e con essa i quattro tipi di reazioni di ipersensibilità.
Mentre la scoperta del primo farmaco utile per le allergie: il primo antistaminico è del 1937 ad opera di Daniel Bovet. Successivamente nel 1949 si è avuta la scoperta degli ormoni steroidei, ad opera di P. Hench insieme a E. Kendall; scoperte queste che hanno posto le basi per la terapia dell'allergia nelle sue manifestazioni sintomatologiche. Negli anni successivi si sono avute la scoperta di altre molecole come: i cromoni e gli antileucotrienici; molecole queste che hanno ulteriormente ampliato il bagaglio terapeutico oggi a disposizione del medico. Nel prossimo futuro potremmo aspettarci novità dal fronte della ricerca sull'ingegneria genetica.
In Italia la storia dell'immunologia si è avuta grazie ai dei medici pionieri che furono: C. Frugoni, G. Sanarelli ed A. Zironi con i loro studi di inizio '900; mentre solo nel 1954 si ha la nascita in Italia dell'"Associazione Italiana per lo studio dell'Allergia", successivamente ribattezzata: "Società Italiana di Allergologia e Immunopatologia".[9]
Epidemiologia
L'allergia alimentare ha la più alta prevalenza nei primissimi anni di vita; affligge, infatti, circa il 6% dei bambini con età inferiore ai tre anni. Questa tende a diminuire con l'età, raggiungendo a 10 anni di età l'incidenza che si riscontra negli adulti.
Non si conoscono eventi legati alla razza; tra i bambini il sesso più coinvolto è quello maschile mentre tra gli adulti il sesso più coinvolto è quello femminile.[10]
Nei bambini più piccoli gli alimenti che causano maggiormente l'allergia alimentare, sono: il latte vaccino (2,5%), l'uovo (1,3%), le arachidi (0,8%), la soia (0,4%), il pesce (0,1%) e i crostacei (0,1%). Le forme dovute al latte, uova e soia, nell'80% dei casi, si risolvono con l'età scolare.[11] Al contrario le allergie agli arachidi, noccioline e pesci sono considerate permanenti; il 20% dei bambini con queste allergie ha una risoluzione in 5 anni, anche se recidive sono sempre possibili.[12][13][14]
Il Mount Sinai Medical Center-USA in un'indagine telefonica condotta su più di 13.500 persone ha rilevato un aumento delle allergie alimentari alle arachidi con una prevalenza che è passata dal 1997 al 2008 dallo 0,6% al 2,1% nei bambini a fronte di tassi sostanzialmente immutati negli adulti, pur con i limiti del tipo di ricerca condotta il dato è indicativo del costante aumento nei bambini a questo tipo di allergia alimentare.[15]
Gli adulti invece sono maggiormente esposti alle allergie alimentari dovute a: crostacei (2%), arachidi (0,6%), noccioline (0,5%), e pesce (0,4%).[16]
Le reazioni allergiche agli additivi alimentari nei cibi non proteici sono poco comuni [17]. Le reazioni ai vegetali sono relativamente comuni con un'incidenza del 5%, ma non sono generalmente severe. Viene, anche, riportato un aumento dell'allergia ai semi di sesamo, comunemente usato nei prodotti da forno [18] [19] [20].
Viene riconosciuta una familiarità per malattie atopiche e le allergie alimentari [21], anche se i fattori ambientali hanno un ruolo decisivo nel manifestarsi della patologia, come viene evidenziato specialmente per l'allergia alimentare alle arachidi [22][23] [24].
In USA le allergie sono al VI posto tra le malattie croniche più frequenti [25]; inoltre, il 2-3 % dei ricoveri è dovuto a reazioni allergiche da farmaci [26].
Le allergie cutanee sono la tipica manifestazione dell'allergia alimentare, e sono la malattia della pelle più frequente nei bambini con meno di 11 anni; queste forme sono aumentate dal 3% degli anni '60 al 10% degli anni '90. L'orticaria e l'angioedema che cono le manifestazioni cutanee più comuni delle allergie alimentari e colpiscono circa il 15% della popolazione ogni anno [27]. Infine vi sono più di 100 persone che ogni anno muoiono negli USA per reazioni anafilattiche causate dall'ingestione di alimenti [28].
La situazione in Italia
Secondo questi dati pubblicati dall'Agenzia giornalistica ANSA del 08 05 2010[29] il problema delle allergie alimentari, specie in età pediatrica, in Italia è molto serio; infatti si hanno:
- 40 morti per shock anafilattico (stima);
- 570.000 allergici < 18 anni;
- 270.000 allergici tra 0-5 anni;
- 150.000 allergici tra 10-18 anni;
- 80.000 allergici alle uova;
- 40-50.000 allergici a grano, pomodoro, soia, crostacei, frutta e verdura, noci e arachidi,
- 100.000 bambini devono usare latti ipoallergenici per un costo di 50 milioni di euro ogni anno che grava esclusivamente sulle famiglie;
- 1.500.000 gli adulti con allergia agli alimenti.
A questi numeri va aggiunta la scarsa conoscenza delle procedura di emergenza da implementare in caso di crisi anafilattica, sempre possibile in questi pazienti; in particolare rispetto l'uso di adrenalina sotto cute con l'autoinettore, dal 2005 prescrivibile a carico del SSN.
La Regione Veneto dal 2003 concede la penna di adrenalina e svolge corsi per il trattamento delle emergenze da allergia alimentare.[30]
Mortalità e morbilità
L'assunzione di cibo può anche essere fatale in soggetti che hanno precedenti di asma (specie quelli con cattivo controllo dei sintomi), precedenti episodi di anafilassi con l'alimento incriminato, mancato riconoscimento dei sintomi precosi di anafillassi e/o ritardo nell'uso dell'adrenalina [31] [32].
Gli adolescenti e i giovani adulti sembrano essere la popolazione più a rischio[33].
La mortalità dovuta all'assunzione del latte è aumentata in modo notevole negli ultimi anni [32]. Gli alimenti più frequentemente implicati sono: arachidi, nocciole, pesce e crostacei, anche se altri cibi possono determinare l'anafilassi.
I sintomi più frequentemente osservati sono: prurito orofaringeo, angioedema/edema laringeo, stridore, tosse, dispnea, asma, nausea, vomito, diarrea, arrossamento, orticaria e angioedema. I casi fatali presentano: edema laringeo severo, broncospasmo irreversibile, ipotensione resistete ai trattamenti (shock) o una combinazione di questi.
Un'indagine condotta presso il Dipartimento di Emergenza dell'Ospedale Maggiore della Carità di Novara (nel periodo 1 gennaio 2003-31 dicembre 2006), tra i ricoveri ospedalieri per anafilassi o per allergia alimentare; su 165.120 ricoveri in rianimazione con 6107 casi di reazione allergica sospetta; i casi sospetti di allergia alimentare sono stati: (1.4%) allergie alimentari e (0.8%) casi di anafilassi [34].
Eziologia
Allergeni alimentari
Principali tipi di alimenti allergizzanti e rispettivi epitopi.
| Alimento | Caratteristiche | Sintomatologia prevalente | Tolleranza a | Direttiva 2007/68/CE |
|---|---|---|---|---|
| Latte | Comune, specie sotto i 3 anni | 1, 2, 3, 4, 5 FDEIA, Procto ed enterocoliti | Latte di cammello e asina | Si anche lattosio |
| Uova | Comune, specie sotto i 3 anni; rara negli adulti | 1, 2, 3, 4 | cottura (parziale) | Si anche derivati |
| Arachidi | Comune, duratura, spesso mortale | 1, 2, 3, 4, 5 da OAS a Shock | cottura (parziale) | Si anche derivati |
| Soia | Comune | 1, 2, 3, 4, 5 OAS, FDEIA | cottura (parziale) | Si anche derivati (E322: Lecitina) |
| Sesamo | Gravi, comune in aree geografiche definite | 1, 2, 3, 4, 5, OAS | cottura (parziale) | Si anche derivati |
| Gamberi | ||||
| Vongole | ||||
| Anacardo | Comune come frutta a guscio | 1, 2, 3, 4 OAS | cottura (parziale) | Si eccetto aromi |
| Nocciola | ||||
| Noce brasiliana | ||||
| Ciliegia | 1, 2, 3, 4 | cottura (parziale) | No | |
| Grano | 1, 2, 3, 4, Celiachia, FDEIA | cottura (parziale) | Si anche derivati |
Legenda: 1= cutanea; 2= Respiratoria; 3= GI; 4= Sistemica; 5= Anafilassi mortale: Recentemente all' Congress of the European Academy of Allergy and Clinical Immunology a Londra sono presentati i risultati di ricerche che riguardano nuove varietà di arachidi modificate geneticamente che potranno ridurre l'impatto delle allergie alimentari per una minore presenza di epitopi allergizzanti [35].
Allergeni chimici
I principali allergeni chimici, causa di allergie alimentari, sono di seguito indicati:
| Categoria | Classificazione: E | Allergeni chimici |
|---|---|---|
| Coloranti | da E 100 a E 199 | Giallo crinolina, giallo-arancio S, azorubina, amaranto, eritrosina, Ponceau 4R, blue patent, indigo carminio, nero brillante, ossido di ferro rosso, cocciniglia, tartrazina |
| Preservanti | da E 200 a E 299 | Acido sorbico, Benzoato di sodio, Metabisolfito di sodio, Nitrato di sodio |
| Antiossidanti | da E 300 a E 321 | Butilidrossianisolo (BHA), propil-gallate, butilidrossitoluolo (BHT), tocoferolo |
| Esaltatori di sapore | E621 | Glutammato monosodico |
| Sostanze naturali | Vari | Acido salicilico, ammine biogene, acido p-idrossi-benzoico, esteri acidi, fragranze |
Patogenesi
Generalità
Meccanismi fisiopatologici delle allergie
I meccanismi fisiopatologici dell'allergia propri delle reazioni di ipersensibilità immediata di tipo I, la cui manifestazione clinica più grave è l'anafilassi, si manifestano sia come reazioni locali che sistemiche. La reazione sistemica generalmente fa seguito alla somministrazione endovenosa di un antigene precedentemente somministrato a cui l'ospite si è precedentemente sensibilizzato; questo porta ad un stato di shock anche fatale.
La natura della reazione locale varia in funzione della porta di ingresso dell'antigene; essa può assumere la forma di un edema cutaneo localizzato (allergia cutanea o orticaria); secrezione nasale e congiuntivite (rinite allergica e congiuntivite), febbre da fieno o asma e manifestazioni gastrointestinali (vomito, diarrea, dolori addominali). Le reazioni da ipersensibilità di tipo I si manifestano in due fasi:
1. fase immediata
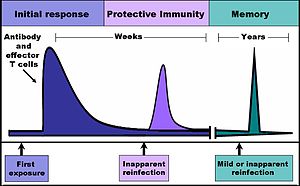
- fase di sensibilizzazione (prima esposizione all'antigene)
- fase di scatenamento
2. fase ritardata o secondaria
Il mastocita (vedi immagine) ha un ruolo cruciale nello sviluppo della patologia. Esso è posto anatomicamente in zone strategiche per la risposta immunitaria, come i vasi sanguigni, le mucose, i nervi. L'attivazione del mastocita avviene grazie un legame tra i recettori e le IgE. Un'altra tappa cellulare importante nel processo di ipersensibilità immediata di tipo I è quella determinata dalle cellule Th2: esse ricevono il segnale dalle cellule presentanti l'antigene (macrofagi e cellule dendritiche), dopo di che le Th2 si differenziano e producono varie citochine; queste ultime servono per attivare la produzione delle IgE da parte delle cellule B (fase di sensibilizzazione). I mastociti insieme ai basofili esprimono i recettori di membrana FcεR, dotati di elevata affinità per le IgE. Quando i mastociti sono ricoperti di IgE sulla superficie dopo una prima fase di sensibilizzazione, il successivo contatto con gli antigeni determina il legame tra 2 molecole di IgE ed il recettore FcεR. Questo legame (antigene + 2 IgE + recettore FcεR) determina una attivazione dei processi di trasduzione di segnale citoplasmatici del mastocita Ca++ dipendenti, che comportano la fusione delle vescicole lisosomiali piene di mediatori, soprattuto di istamina, con la superficie interna della membrana del mastocita e conseguente liberazione dei mediatori chimici immagazzinati (fase di scatenamento). Questi mediatori sono i responsabili dei sintomi tipici delle reazioni di ipersensibilità di tipo I sia sistemiche che localizzate ed inoltre attivano anche le risposte di tipo tardivo.
-
Fasi delle risposta immune.
-
I mastociti sono coinvolti nella patogenesi dell'allergia. La degranulazione dei mastociti è scatenata dagli anticorpi di classe IgE, specifici per un singolo allergene.
-
Processi di degranulazione del mastocita:1 - antigene; 2 - IgE anticorpo; 3 - recettore FcεRI ; 4 - mediatori contenuti dei granuli: (istamina, proteasi, chemochine, eparina; 5 - granuli; 6 - mast cell o mastocita; 7 - mediatori neo-formati (prostaglandine, leucotrieni, trombossano, PA).
-
Reazione immunitaria: Ipersensibilità immediata di tipo I.
Meccanismi fisiopatologici delle allergie alimentari
Generalità
Le manifestazioni della risposta immune, in corso di allergia alimentare, sono molto variabili tra gli individui, tant'è che alcuni individui, pur producendo IgE specifiche per certi apteni proteici, non manifestano alcuna sintomatologia in seguito all'assunzione dell'alimento incriminato <[36], anche se l'aumento dell'assunzione è correlato ad un aumento del rischio [33].
Le caratteristiche biochimiche di un alimento da sole non riescono spiegare la sua allergenicità. Infatti la naturale conseguenza di esposizione a nuovi cibi è lo sviluppo di una fisiologica tolleranza immunologica. La tolleranza immunologica orale dipende da una barriera intatta e immunologicamente attiva dell'intero tratto gastrointestinale. Questa barriera include le cellule epiteliali unite da giunzioni strette e da uno spesso strato di muco, così come l'orletto a spazzola; inoltre gli enzimi, sali biliari, e i picchi di pH contribuiscono degradandoli a rendere meno immunogeni gli antigeni proteici.
Ipotesi enzimatica
Tra i fattori responsabili dello scatenamento di una manifestazione allergica legati all'ospite vi è l'attività della PAF acetilidrolasi, enzima che degrada la PAF; questa provoca un aumento della gravità delle reazioni anafilattoidi [37] [38] [39] [40].
Ipotesi resistenza-proteica
Tra i fattori legati all'alimento va considerata la stabilità delle proteine contenute alla digestione e alla frammentazione chimico/enzimatica intestinale di certi semi (arachidi, cumino, anacardi). Queste proteine, infatti, rimangono integre più facilmente e possono scatenare reazioni allergiche alimentari anche molto gravi [41] [42] [43] [44].
Ipotesi iposecrezione acida
In modo strettamente correlato alla precedente ipotesi, l'aumento delle manifestazioni di esofagite eosinofila, una forma di allergia alimentare, che è aumentata negli ultimi anni pare debba ricondursi all'uso di IPP (inibitori di pompa protonica); ciò perché la diminuita cloridia conseguente all'uso di questi farmaci rende più difficile la digestione delle proteine da parte dell'organismo con la conseguente aumentata permeabilità delle stesse proteine nella mucosa intestinale. L'ipotesi benché ancora non confermata, da studi sull'uomo, è molto plausibile ed interessante [45].
La letteratura scientifica a supporto in tal senso è relativamente cospicua e recente: [46] [47] [48] [49] [50] e ben si correla con l'ipotesi della resistenza proteica.
Ipotesi citochinica
Un recente studio [51] mette in relazione la quantità prodotta di IL-9 con la permeabilità intestinale alle proteine e la successiva esasperata risposta dei mastociti. L'IL-9, infatti, stimola il rilascio da parte delle mastcellule dell'istamina e delle proteasi e favorisce l'espressione del FcεRIα [52]. Anche il TNF ha un ruolo nella genesi delle enteropatie delle allergie alimentari [53].
Ipotesi Leaky gut
Una cospicua e recente letteratura getta le basi molecolari per la comprensione delle cause della sensibilizzazione alimentare da parte di antigeni proteici in persone sensibili [54]. Uno dei fattori predisponenti, da tempo ipotizzato per le malattie gastrointestinali è l'alterata funzione di barriera, denominata: leaky gut [55] [56] [57].
I parenti di primo grado di pazienti con malattie infiammatorie intestinali (IBD), hanno un aumento della permeabilità intestinale in assenza di sintomi clinici [58] [56] [59].
I pazienti con allergia alimentare che hanno anche un aumento della permeabilità intestinale, hanno un aumento della gravità dei loro sintomi clinici [55]. Anche se le anomalie costitutive della permeabilità intestinale non sono state osservate sempre nei pazienti con allergia alimentare, si ipotizza che gli eventi ambientali, tra cui le infezioni e lo stress, possono alterare la permeabilità intestinale e promuovere la sensibilizzazione da parte dell'antigene alimentare [56].
Ipotesi microbiologica
Un altro aspetto di recente messo in evidenza mette in relazione le allergie alimentare con l'equilibrio dell'ecositema microbico dell'intestino e i meccanismi di difesa dell'ospite [60]. Secondo autori Giapponesi, infatti, nell'evitare le eccessive reazioni infiammatorie nell'intestino assumono un ruolo le componenti microbiche regolano direttamente le funzioni dei mastociti attraverso i recettori Toll-like. Questo può spiegare il motivo con il quale le manifestazioni allergiche sono in funzione di un non corretto mantenimento della flora simbiontica intestinale [61].
Una recente ricerca mette in relazione l'infezione virale da reovirus come causa di modifiche immunologiche tali da innescare la risposta patologica delle allergie alimentari [62].
Il ruolo protettivo dei probiotici nei confronti della salute umana si estende ad una gamma di manifestazioni patologiche e tra queste spiccano le manifestazioni allergiche [63] [64].
Probabilmente tutte le ipotesi sopradescritte concorrono in varia misura nella etiopagenesi delle allergie alimentare, e tutte offrono importanti chiavi di lettura e ricerca per la comprensione e la ricerca di soluzioni per questa diffusa patologia del benessere.
Tipi di allergie alimentari
Comunemente i meccanismi causa di allergie alimentare e la conseguente classificazione fatta sulla base deii meccanismi etio-patologici viene suddivisa in tre categorie:
Tipicamente i comuni e "maggiori" allergeni alimentari responsabili delle forme IgE mediate sono delle glicoproteine solubili in acqua, con dimensioni comprese tra da 10 a 70 kDalton, esse sono relativamente stabili al calore, agli acidi, e alle proteasi del tratto gastroenterico.
Inoltre, la presenza di altri fattori immunostimolanti nel cibo possono anche contribuire alla sensibilizzazione immunologica di genere. Ad esempio, l'allergene delle arachidi è una glicoproteina (Ara h 1) che non solo è molto stabile e resistente al calore digestivo e alla degradazione enzimatica, ma agisce anche come coadiuvante dei linfociti T-helper2 (TH2) a causa della espressione di un "glycan adduct" [67]. L'immunità innata è rappresentata nell'intestino dalle: cellule natural killer, leucociti polimorfonucleati, macrofagi, cellule epiteliali fell'orletto a spazola, recettori Toll-like e l'immunità acquisita è, invece, rappresentata dai linfociti intraepiteliali e dalla lamina propria, dalle placche di Peyer, dalle IgA, e dalle [[|citochina|citochine]]; insieme forniscono una barriera capace di bloccare l'ingresso degli antigeni.
È noto come l'allergia alimentare sia più comune nei bambini: infatti la maggior permeabilità della mucosa intestinale nei neonati e la precoce esposizione agli antigeni allergizzanti sono stati proposti come possibile causa di sensibilizzazione nei neonati [68]. Tuttavia è stato dimostrato che la mucosa gastrointestinale raggiunge la sua piena maturità in termini di permeabilità dopo solo 2-3 giorni dalla nascita e l'aumento della permeabilità osservato in alcuni bambini con allergia alimentare sembra essere più una conseguenza, che la causa, della risposta infiammatoria di tipo allergico [69] [70] [71].
Al contrario, l'esposizione precoce agli alimenti potrebbe impedire lo sviluppo di allergie alimentari in alcune condizioni. Questo fatto è suggerito da un recente studio che ha dimostrato che i bambini israeliani, che spesso consumano un popolare spuntino a base di arachidi prima del 1 anno di età, hanno una prevalenza 10 volte inferiore nello sviluppare allergie alle arachidi, rispetto ai bambini degli Stati Uniti e del Regno Unito, dove le arachidi sono consumate raramente prima dei 12 mesi di età [72]; sono stati proposti per questo motivo altri fattori aggiuntivi come necessari per superare la fisiologica tolleranza orale.
Tra i fattori in grado di ridurre la tolleranza alimentare agli allergeni alimentari vi sono:
- l'aumento della permeabilità intestinale per fenomeni infiammatori della mucosa [73];
- l'aumento della permeabilità intestinale della mucosa per fenomeni irritativi dovuta a farmaci (aspirina) [74];
- la presentazione delle proteine alimentari per vie alternative come la mucosa respiratoria o cutanea [75]. In circa un terzo dei bambini con allergia alimentare coesiste l'asma [76];
- l'alterazione dell'equilibrio immunologico tra TH2 e l'antigene maggiore di istocompatibilità (MHC). Spesso dovuto all'assunzione delle proteine del altte vaccino durante l'allattamento [77]
. Ciò sembra (dovuto ad una perdita della funzionalità regolatoria determinata da CD4+, (TGF)-β, IL-10, CD25+ (queste sono T cells regolatorie), a favore della CD8+ (che è un tipo di T cells soppressoria). Le alterazioni sono dovute ad una anomalia genica che regola l'espressione del fattore FOXp3) [78]. L'IL-4 sembra avere un ruolo regolatatorio sulla suscettibilità intestinale all'infiammazione in corso di allergia alimentare [79].
Tra i fattori alimentari scatenanti sono stati recentemente ipotizzati come causa di allergie:
- diminuzione delle competenze immunologiche nei confronti in genere di batteri/virus/elminti (la cosiddetta ipotesi igienica);
- sbilanciamento a favore degli omega-6 a danno degli omega-3;
- diminuzione dell'assunzione degli antiossidanti alimentari e incremento/decremento della vitamina D della dieta [80].
Le forme non IgE mediate delle allergie alimentari sono una minoranza rispetto al totale e si verificano in assenza di anticorpi IgE specifici dimostrabili per gli alimenti sulla pelle o nel siero. Esse sono meno ben caratterizzate, ma in genere sono dovute ad una infiammazione acuta o cronica nel tratto gastrointestinale, dove gli eosinofili e le cellule T sembrano svolgere un importante ruolo nella genesi della manifestazione patologica [81] [82] [83] . Nei pazienti con enterocolite indotta dal cibo il TNF-α ha un ruolo importante: esso, infatti, può essere misurato in vitro nei monociti di bambini con enterocolite indotta da alimenti proteici [84]. Chung e colleghi hanno anche trovato un aumento della colorazione per il TNF-α in biopsie duodenali dei bambini con enterocolite indotta dal cibo [85].
Per le forme miste come l'esofagite eosinofila, gli eosinofili e fattori chemiotattici svolgono un ruolo fondamentale. In questi soggetti l'Eotaxin-3 è del 50% sovraespressa nel tessuto esofageo rispetto ai controlli con esofagite cronica [86].
Genetica delle allergie alimentari
L'allergia alimentare potrebbe essere almeno in parte geneticamente determinata [87] [88] [89] [90]. Il rischio di allergia alle arachidi, per esempio, è circa dieci volte maggiore in un bambino con un fratello anch'esso allergico alle arachidi rispetto alla popolazione generale; tuttavia, ad oggi geni specifici non sono stati identificati. Così anche per le allergie alimentari non IgE-mediate [91] [92], nelle quali è stata riscontrata una grande differenza etnica e familiare nell'incidenza, con la predominanza dei maschi caucasici.
Nelle famiglie ove più di un parente ha allergie, il rischio per i figli di avere allergie alimentari è molto alto, anche se non si possono predire le allergie alimentari piuttosto che altri tipi di allergia .
- 80 % di probabilità di allergia se entrambi i genitori sono atopici con diverse manifestazioni associate (p. e. Asma e allergia alimentare insieme)
- 40 -60 % di probabilità di allergia se entrambi i genitori sono atopici
- 25- 40 % di probabilità di allergia quando uno solo dei genitori è affetto da allergia
- 20- 25 % di probabilità di allergia quando un fratello è allergico
Localizzazione delle manifestazioni
Il risiedere delle cellule T stabilmente negli organi bersaglio può spiegare perché alcune malattie allergiche alimentari sono localizzate, e non hanno caratteristiche sistemiche come è il caso della dermatite atopica [93] e della esofagite eosinofila[73] [94] [95]. Le manifestazioni e la prevelenza della allergie alimentari sono il risultato di un complesso, non del tutto conosciuto, meccanismo di relazioni tra ospite, ambiente, cause genetiche e alimentari; cosa, questa, che rende tra l'altro difficile lo sviluppo di terapie causali [54] [96] [97].
Complicanze
La complicanza più temuta delle allergie alimentari è lo shock di tipo allergico.
Anatomia patologica
Cambia in base alle manifestazioni cliniche ed organi coinvolti.
Clinica
Segni e sintomi
I quadri clinici tipici delle allergie alimentari, si distinguono in quattro tipi di manifestazioni principali e due occasionali, che possono essere presenti anche in varia combinazione tra loro nelle reazioni IgE mediate:
- Gastrointestinali: coliche intestinali, meteorismo, diarrea, nausea, vomito, Sindrome Allergica Orale (OAS), anafilassi gastrointestinale;
- Cutanee: Orticaria, dermatite atopica e flushing, eczemi o dermatiti da contatto ematogene;
-
Dermografismo segno tipico (patognomonico) dell'orticaria
-
Dermatite atopica
-
Eruzione da farmaci
- Respiratorie: rinocongiuntivite acuta, broncospasmo e/o asma allergico, (wheezing), angioedema;
-
Angioedema: nel bambino
-
Angioedema: nell'adulto
-
Asma: prima e dopo l'episodio
-
Asma: prevalenza
- Generalizzate: shock anafilattico/anafilassi [98] [99] [100].
Patologie associate
- Immunologiche e reumatologiche: vasculiti (è stata riscontrata un'associazione con la porpora di Schönlein-Henoch) [101], artriti: in particolare è stato osservato che nella mucosa intestinale di soggetti con artrite idiopatica giovanile sono presenti linfociti citotossici attivati, similmente a quanto avviene in corso di allergie. Ciò può far supporre un possibile ruolo degli allergeni alimentari nella patogenesi di questa malattia [102] [103].
- Neurologiche e psichiatriche: emicrania (fra le varie ipotesi patogenetiche molti autori hanno ipotizzato il ruolo di alcuni allergeni alimentari)[104] [105] [106]. Tra i pazienti affetti è stata inoltre riscontrata un'aumentata incidenza di disturbi psichici quali ansia, sintomi depressivi, aggressività e disturbi del sonno, nonché un aumento del rischio di suicidio [107].
- Renali e genito-urinarie: in alcuni casi di enuresi del bambino è stato osservato un effetto scatenante di particolari alimenti [108]. Anche alcune forme di sindrome nefrosica possono avere un nesso con l'allergia: in particolare è stato ipotizzato che l'interleuchina 13, una citochina coinvolta nella risposta immunitaria IgE-mediata, possa essere responsabile della proteinuria nei pazienti con glomerulopatia a lesioni minime per la sua capacità di indurre l'espressione di una molecola, detta CD80, sulla superficie dei podociti. [109] Fra gli allergeni individuati quali possibili cause scatenanti di sindrome nefrosica (particolarmente in età infantile) vi sono le proteine del latte [110]
.
- ORL: di recente (maggio 2010) sono state segnalate come complicanza non comune, in corso di allergia alimentare, forme di rinite allergica [111].
Test ed esami di laboratorio
Diario dietetico
Il diario dietetico consiste nel tenere un registro degli alimenti assunti in ordine cronologico e dei relativi aventi avversi e sintomi correlati con l'assunzione dell'alimento.
- È un sistema di facile attuazione non costoso che permette di documentare la frequenza e la relazione di causa/effetto con i cibi assunti, con il vantaggio di focalizzare i pazienti sulla corretta gestione della loro dieta.
- L'utilità diagnostica è però limitata, specie se gli alimenti manifestano reazioni a distanza di tempo dalla loro assunzione.
- Questo diario è inoltre, raramente utile per identificare gli alimenti implicati in una reazione avversa, infatti non permette di fare la diagnosi con certezza specie quando i sintomi sono in ritardo o rari.
Dieta di eliminazione
Viene comunemente usata per fare diagnosi e per finalità terapeutiche.
Il suo uso per fini diagnostici consiste nell'eliminare tutti gli alimenti o gruppi di alimenti sospetti per un certo periodo di tempo (circa 7-10 giorni) contemporaneamente ad un controllo della diminuzione dei sintomi.
La dieta di eliminazione è più utile nel valutare le situazioni croniche. Il successo di questa dipende dalla certezza di aver eliminato dalla dieta l'alimento sospetto. Le limitazioni di questo metodo sono legate solo ai pregiudizi del medico e del paziente, specie se nel tempo il paziente non sopporta la limitazione che questa dieta comporta.
Una volta individuati gli allergeni, questi vengono rimossi dalla dieta del paziente a tempo indeterminato, salvo la risoluzione della patologia nel tempo.
Test cutanei
Generalità
Sono usati correntemente per la diagnosi delle allergie alimentari, sono i test di screening più comuni per le allergie alimentari e possono anche essere eseguite sui neonati nei primi mesi di vita (sopo però affidabili dopo i 3 anni). Tuttavia, l'affidabilità dei risultati dipende da molteplici fattori, quali l'utilizzo opportuno degli allergeni da testare insieme ad una precisa tecnica di somministrazione, nonché la contemporanea assunzione di farmaci che possono interferire con i test come per esempio gli: antistaminici o i cortisonici
Quando questi test vengono utilizzati con opportuni controlli standard, per esempio un test con un campione positivo a base di istamina ed uno negativo a base di soluzione salina; forniscono criteri precisi per la diagnosi facilmente riproducibili con un costo minimo e con rischi per i pazienti tracurabili. Questo medoto è generalmente affidabile per escludere le allergia alimentari IgE mediate; con precisione predittiva del 90% se l'il risiltato è negativo ; mentre questa precisione scende al 50 % se positivo. Ciò limita l'interpretazione clinica del risultato, e quindi insieme ai testi in vitro occorre valutare attentamente anche l'anamnesi.
Il risultato va confermato sempre da un test di risomministrazione dell'alimento incorminato, a meno che il paziente abbia già una storia certa di allergia alimentari.
Metodica
I test intradermici sono:
- prick test
- prick by prick (dall'inglese: to prick = pungere)
- scracth test
- patch test.
Questi sono usati sia per le allergie alimentari che per le allergie respiratorie.[112]
Per l'interpretazione dei test è richiesta esperienza e competenza; i risultati ottenuti, infatti, vanno sempre correlati ai sintomi e all'anamnesi del paziente e spesso sono necessari ulteriori test per porre una diagnosi di certezza.
Durante l'esecuzione di tali esami è necessario tenere a portata di mano un kit d'emergenza; si possono infatti, seppur raramente, manifestare reazioni gravi, fino allo shock anafilattico.
Il prick test, se ripetuto più volte con lo stesso allergene, può determinare a sua volta sensibilizzazione.
Il prick by prick viene usato solo per le allergie alimentari; in questa metodica la lancetta utilizzata per scalfire la cute del paziente viene inoculata preventivamente nell'alimento che si vuole testare (frutta o verdura).
Lo scracth test è simile al prick test ma è meno sensibile e di più lunga esecuzione, perciò attualmente poco usato. Dopo la pulizia della cute si pratica con uno strumento acuminato un leggero graffio (in inglese, scratch) di 2 mm di lunghezza evitando il sanguinamento, dopo di che una goccia della soluzione contenente l'allergene viene posta al di sopra della lesione provocata e delicatamente si effettua uno sfregamento sull'area graffiata per farla penetrare la soluzione nella lesione; la lettura viene eseguita dopo 10-30 min.
Il patch test è indicato nella diagnosi delle dermatiti allergiche da contatto. Consiste nell'applicazione sulla cute della schiena di cerotti medicati con l'allergene; sono testati routinariamente 31 allergeni. Il cerotto si rimuove dopo 24-72 ore, e si controlla se nella zona della cute di applicazione si è verificato un arrossamento. Questo test viene usato nelle allergie alimentari per verificare la reattività ad alimenti in caso di esofagite eosinofila [113] , enterocolite [114] e dermatite atopica [115]. Il valore di questo test è però incerto e andrebbe confermato da studi più oggettivi rispetto quelli fin qui effettuati [116].
- Vengono fatti sulla regione volare dell'avambraccio con opportune lancette a punta sottile che iniettano l'allergene da testare; è importante usare una lancetta per ogni allergene, rispettando dellle distanze minimine tra un allergene ed un altro (2,5 mm).
- Vanno fatti confronti con dei controlli negativi con soluzione salina e con controllo positivo con l'istamina (10 ng/mL in sol. fisiologica).
- La lettura va fatta dopo 5 min per l'istamina e dopo 15 per gli allergeni, è consigliato l'uso di un cronometro. Sono di dubbia interpretazione le rispote che si presentano dopo 15-20 min.
- I test sono poco rischiosi, ma è bene fare una prova preliminare con l'allergene non inoculato sottocute con la lacetta e verificare se si presenta così una reazione; in tal caso è bene non eseguire il test per il rischio di una reazione grave di tipo anafilattico (oltre che per l'inutilità del test in tale circostanza).
Limiti dei test cutanei
In generale questi test si utilizzano su soggetti di età non inferiore a 3 anni. Non vanno però effettuati nei seguenti casi:
- lesioni da grattamento o da patologie dermatologiche nella zona di somministrazione del test.
- pazienti con dermografismo, per una accentuata reattività da parte della cute da parte di questi pazienti.
- uso di farmaci antistaminici e/o steroidi e/o immunosoppressori, che inibiscono i meccanismi immunologici e quindi la reattività della cute (stesso effetto possono avere, sebbene in misura molto minore, i betabloccanti).
-
Prick test
-
Scracth test
-
Pacht test
-
Esempio di reazioni cutanee al test
Sierologia
I test sierologici in vitro sono di semplice esecuzione, alcuni però sono fatti con una metodica radioimmunologica che complica alquanto il test e fa aumentare i costi.
Conta degli eosinofili
Per poter fare la conta degli eosinofili va fatta prima una diagnosi differenziale con: le infezioni (causa di elevato numero di neutrofili), con le anomalie congenite delle ossa turbinate, con l'irritazione da agenti irritanti, ed altre eziologie di natura non allergiche.
Benché il numero degli eosinofili si possa ottenere come conta differenziale rispetto al numero dei leucociti totali, si usano per il conteggiosi degli stessi metodiche più sofisticate che colorano gli eosinofili in modo specifico (soluzioni di Pilot o Tannen). Il numero totale degli eosinofili per mm 3 va da 0 a 450 nell'adulto, da 50 a 700 nel bambino e da 20 a 850 nel neonato.
Dosaggio totale delle IgE
Un elevato livello di IgE sieriche può avvalorare il sospetto diagnostico di una malattia allergica. Poiché, però, esiste un certo grado di sovrapposizione tra i valori di IgE nei soggetti normali e negli allergici, una quantità normale di IgE non esclude una diagnosi di allergopatia.
Attualmente le IgE vengono valutate con una metodica radioimmunologica: il cosiddetto PRIST (Paper Radio Immuno Sorbent Test o test di radio-immuno-assorbimento su carta). Questo test utilizza un substrato solido di carta; cui sono legati gli anticorpi anti-IgE. dopo opportuni lavaggi, se sono presenti IgE nel siero in esame, queste vengono legate dagli anticorpi attaccati al dischetto di carta. Si usano anticorpi anti-IgE marcati con 125I. che fissano le IgE legate al dischetto e quindi, dopo un ulteriore lavaggio, si effettua la lettura del dischetto di carta in un contatore per emissioni gamma. La radioattività del complesso sarà direttamente proporzionale alla concentrazione delle IgE nel siero in esame. Nell'adulto i valori normali di IgE sieriche sono inferiori a 0,025 mg/dl.
Dosaggio delle IgE specifiche
È più importante del dosaggio delle IgE totali; infatti, è utile per confermare casi dubbi ai test cutanei e soprattutto per la valutazione in bambini piccoli o soggetti con gravi dermopatie.
Si utilizza un test detto RAST (Radio Allergo Sorbent Test, test di radio-allergo-assorbimento) che ha qualche analogia con il PRIST. L'allergene è legato covalentemente ad un dischetto di carta e reagisce con l'anticorpo IgE specifico eventualmente presente nel siero in esame. Dopo che le IgE non specifiche sono state eliminate con lavaggi, si aggiungono anticorpi anti-IgE marcati con 125I, i quali si legano al complesso disco-allergene-IgE. Si legge a questo punto la radioattività in un contatore per emittenti gamma. Questa sarà proporzionale alla quantità di IgE specifiche presenti.
Il RAST è meno sensibile ma è più specifico del test cutaneo, oggi poi le nuove tecniche laboratoristiche come il CAP Sistem FEIA o UniCAP, ne hanno elevato la sensibilità e la praticità d'uso .
Metodi rapidi domiciliari
Point of care test
Di recente si sono affermati per la loro praticità i metodi di auto indagine domiciliare (point of care testing); tra questi in ambito allergologico merita una segnalazione l'apparecchiatura di una Azienda Svedese: ImmunoCAP Rapid (ICR). Questo appariecchetto simile ad un glucomentro per l'analisi domiciliare della glicemia, analizza una goccia di sangue periferico ed è utile per la diagnosi di primo livello di: asma, eczemi e riniti. Tra gli allergeni alimentari testati vi sono: uova, latte, insieme ad altri comuni allergeni non alimentari.
La riproducibilità del dato è buona, con una percentuale di falsi positivi dell'1% [117]. L'apperecchio risulta quindi utile per una prima diagnosi ambulatoriale delle più comuni allergie, soprattuto in ambito respiratorio [118].
Prova da scatenamento orale
La prova da scatenamento orale è utilizata per confermare la diagnosi di allergia alimentare ad un alimento.
Essa viene condotta sotto controllo medico, consiste nella somministrazione del cibo sospetto per via orale in modo graduale; con una valutazione attenta degli eventuali sintomi subbentranti. In caso di presentazione di questi si deve sospendere la somministrazione ed eventualmente si somministrano farmaci sintomatici. Le prove da scatenamento sono preceduta da un opportuno periodo di eliminazione del cibo sospettato, il test è condotto a condizione che il paziente non usi farmaci che posso interferire; inoltre la prova va effettuata in ambiente ospedaliero ed è una buona norma prudenziale che il paziente abbia già effettuato un accesso venoso (catetere già inserito in vena), per un eventuale rapida somministazione di farmaci di emergenza in caso di shock subbentrante.
La metodica più affidabile è quella condotta in doppio cieco (ne il paziente ne il medico devono conoscere quale è il campione con il cibo incriminato); ma spesso si accetta il singolo cieco, in questocaso solo il paziente non conoce quale è il campione con il cibo incriminato.
Le prove da sacatenamneto non si effettuano quando c'è il sospetto di una reazione anfilattica o quando i test già effettuati permettono una certezza diagnostica nei confronti dell'alimento incriminato dell'allergia alimentare.
Le varie tipologie di prove da scatenamento orale sono:
- test in aperto: il cibo è assunto in modo solito, però quando il risultato è ambiguo va eseguita la prova in cieco.
- test in cieco singolo: il cibo sospetto va miscelato ad altro cibo e deve essere non riconoscibile da parte del paziente; in questo caso un errore di valutazione per una soggettività da parte del medico è possibile, per quanto questo errore è considerato statisticamente modesto.
- test in doppio cieco con placebo: l'alimento sospetto và inserito in capsule, esse sono di 2 tipi: con il cibo e senza il cibo. Queste vanno assunte a distanza di giorni le une dalle altre. Con questo tipo di esame l'errore di valutazione del medico e del paziente si riduce al minimo. Questa procedura è considerata il criterio standard per la diagnosi di allergia alimentare, ed è usata soprattutto nelle indagini di ricerca. Attualmente è l'unico metodo completamente oggettivo per avere la certezza di una reazione avversa al cibo.
Procedure diagnostiche per le allergie alimentari
Per porre una diagnosi di certezza di allergia alimentare verso uno o più alimenti, occorre eseguire in seguenza una serie di accertamenti diagnostici:
- I livello
- Test cutanei:
- Prick testo o prick by prick
- Misura delle IgE specifiche (RAST test)
- II livello
- Dieta di eliminazione
- Prova da scatenamento orale in doppio cieco
-NB: altri tipi di accertamenti diagnostici sono prospetticamente interessanti, ma non sono validati in modo univoco dalla comunità scientifica; per cui vanno considerati un complemento dei test e accertamenti sopraindicati.
Per riconoscere un'allergia alimentare rispetto una intolleranza alimentare occorre fare una diagnosi differenziale.
Diagnosi differenziale
Allergia vs intolleranza
La prima differenza va fatta tra allergia alimentare vera e intolleranza alimentare, nella tavola seguente sono mostrate le differenze:
| Allergia alimentare | Intolleranza alimentare |
|---|---|
| Il sistema immunitario è coinvolto (con reazioni di tipo anafilassi) | Il sistema immunitario non è coinvolto (con reazioni di tipo anafilassi) |
| Ha un ristretto numero di cause | Le cause sono diverse |
| La reaziona in genere si verifica poco dopo l'ingestione del cibo, (da min a ore) | I sintomi di solito si verificano dopo qualche tempo la ingestione del cibo (giorni) |
| Un singolo ed una piccola quantità di allergene è sufficiente a scatenare una reazione rapida e violenta, dopo l'avvenuta sensibilizzazione | Sono necessarie grandi quantità o un'assunzione regolare dell'alimento |
| I sintomi sono inequivocabilmente riconducibili all'allergia in genere | I sintomi non sono di solito così facilmente riconducibili ad una causa particolare; il perché non è chiaro. |
| Può essere pericolosa per la vita | Non pericolosa per la vita |
| Le manifestazioni cliniche rimangono costanti all'esposizione dello stesso allergene | La reazione alla sostanza che la provoca spesso può variare a seconda di condizioni e/o circostanze della persona |
Patologie varie
La diagnosi differenziale va anche posta con le seguenti patologie:
- Ernia iatale
- Costipazione
- Malattia infiammatoria intestinale
- Diverticolite
- Intolleranza al lattosio
- Diverticoli uretrali
- Disordine della motilità intestinale
- Disordini della motilità esofagea (acalasia)
- Spasmi dell'esofago
- Disfunzione delle corde vocali
- Esofagite
- Orticaria
- Avvelenamento
- Gastrite acuta
- Gastrite cronica
- VIPoma
- Malattia di Whipple
Classificazioni
Classificazione etiologica
- Deficienze enzimatiche :
- Lattasi [119]
- Galattochinasi [120]
- Galattosio-1-fosfato-uridiltransferasi
- Fenilalanina 4-monossigenasi (fenilchetonuria) [121][122].
- Ammine vasoattive [123]:
- Istamina [124]: Pesce (sgombro specialmente in scatola), crauti, salsiccia, vino
- Tiramina [125]: Formaggio, vino,
- Feniletilamina: Cioccolato [126]
- Serotonina [127]: Banane
- Reazioni pseudo allergiche:
- Additivi alimentari [128]
- Reazioni ad inquinanti/impurità [129] [130]: alimenti contaminati con batteri, sostanze chimiche
Classificazione etio-patologica
L'inguadramento nosografico delle manifestazioni patologiche mediate dagli alimenti conseguenza di reazioni allergiche e non, è complesso ed oggetto di ricerche in continua evoluzione. Di seguito sono indicate i diversi schemi classificativi:
- il primo valuta solo le manifestazioni di tipo allergico e non principali con una sintesi delle manifestazioni cliniche, delle cause immunopatologiche e dei principali alimenti scatenanti;
- il secondo valuta la totalità delle manifestazioni allergiche e non nella loro totalità distinguendole per organo ed apparato colpito.
| Patologia | Patogenesi | Manifestazioni cliniche | Immunopatologia | Alimenti scatenanti più comuni | Diagnosi [132] |
|---|---|---|---|---|---|
| Orticaria [133] [134], Angioedema [135], Anafilassi [136][137] | IgE | Cutanee, gastrointestinali, sintomi respiratori | Reazione crociata con IgE che provoca il rilascio dei mediatori | Allergeni principali: latte, uovo, frumento, soia, arachidi, nocciole, pesce e crostacei | Storia clinica e Prick test o RAST positivo; test da scatenamento orale |
| Sindrome Allergica Orale (OAS) [138] [139] [140] [141] [142] | IgE | Sintomi orofaringei moderati, primariamente: prurito, angioedema | Sensibilizzazione primaria alle proteine omologhe alle proteine del cibo di certi tipi di frutta/verdura | Frutta e vegetali crudi | Soria clinica e prick test positivo a rilevanti allergeni alimentari (Prick + Prist); test da scatenamento orale con cibi fresci, negativo con cibi cotti |
| Anafilassi esercizio indotta cibo-dipendente (FDEIA) [143] [144] [145] [146] [147] | IgE | Anafilassi scatenata dal cibo solo se l'ingestione è seguita dall'esercizio fisico | Incremento del rilascio dei mastociti e alterazione della permeabilità intestinale quando l'assunzione del cibo è seguita dall'esercizio fisico | Frumento, crostacei e sedano sono i cibi più comunemente scatenanti | |
| Dermatite atopica / Eczema [148] [149] [150][151][152][153][154][155] [156] | Mista: IgE/ non-IgE | Infiammazione cronica della pelle con prurito | Attivazione IgE mediata dai mastociti (mast cell) cutanei; fase ritardata: infiltrazione di cellule infiammatorie, inclusi gli eosinofili e cellule T | Uova, frumento, latte, soia e altri | |
| Gastroenteropatia Eosinofila [157] [158][159][160][161] | Mista: IgE/ non-IgE | Disfagia, crescita modesta, disturbi addominali: nausea e vomito | Infiltrazione Eosinofila del tratto gastrointesinale, giocano un ruolo cruciale i mediatori degli eosinofili, p.e.: IL-5 e eotassina | Diversi cibi | Storia clinica, Prick test, endoscopia e biopsia, dieta di eliminazione e test da scatenamento orale |
| Enterocoliti indotte dalle proteine alimentari (FPIES) [162] [163] [164] [165] | non-IgE | Emesi ritardata, diarrea 2 ore dopo l'ingestione, nei casi severi: nel 15% ipertensione | Incremento del TNFα, decremento del TGFα | Latte,soia, cereali | Negatività a prick test: dieta di eliminazione di proteine alimentari con scomparsa dei sintomi in 24-72 h e ricorrenza dopo 1-2 h la risomministrazione; possibile ipotenzione (shock) |
| Proctocoliti indotte dalle proteine alimentari [166] | non-IgE | Strie di sangue nelle feci dei bambini | Infiltrazione eosinofila del colon | Latte, e soia, insorge anche assumendo il latte materno | NNegatività a prick test: dieta di eliminazione di proteine alimentari con scomparsa dei sintomi in 24-72 h dei sanguinamenti; endoscopia e biopsia; test da scatenamento induce sanguinamento in 72 h |
Classificazione patologica
Reazione avverse ai cibi;[167]
- Reazioni avverse agli alimenti non immuno-mediate
- Metaboliche:
- Deficit dell'enzima disaccaridasi: deficit di lattasi
- Favismo: deficit di glucosio-6-fosfato deidrogenasi
- Insufficienza pancreatica: fibrosi cistica
- Farmacologiche
- Tossiche
- Dolcificanti e conservanti: metabisolfito di sodio [168][169]
- Coloranti: tartazina [170]
- Tossine batteriche e fungine: C. botulinum, aflatossina [171], Claviceps purpurea
- Veleno di pesce: scromboide, ciguatera [172]
- Contaminanti: metalli pesanti: piombo, stagno, rame, zinco, mercurio, pesticidi, bifenili policlorurati (PCBs) [173], bifenili polibromurati (PBBs), insetticidi, erbicidi, fungicidi, fertilizzanti, auxinici (antibiotici),
- Metaboliche:
- Reazioni avverse agli alimenti immuno-mediate
- Allergie Ig-E-mediate per organo:
- Gastrointestinali
- Ipersensibilità gastrica immediata
- Sindrome Allergica Orale (Sind. allergica alimentare associata al polline)
- Stipsi e IgE sensibilizzazione al latte di mucca
- Dermatologiche
- Orticaria acuta ed angioedema
- Respiratorie (rare)
- Anafilassi (Sistemica multiorgano)
- Anafilassi esercizio indotta cibo-dipendente (FDEIA)
- Gastrointestinali
- Reazioni avverse agli alimenti non immuno-mediate
- Gastrointestinali
- Enterocolite indotta dalle proteine alimentari
- Proctite indotta dalle proteine alimentari
- Enteropatia indotta dalle proteine alimentari
- Malattia Celiaca
- Dermatologiche
- Respiratorie
- Sind. di Heiner [177] [178](emosiderosi polmonare indotta dagli alimenti)
- Gastrointestinali
Diagnosi precoce
La diagnosi di allergia alimentare si basa ancora principalmente sulla storia clinica dettagliata e un completo esame fisico del soggetto. Test clinici o di laboratorio servono solo come strumento aggiuntivo per confermare la diagnosi. Le indagini standard comprendono i test cutanei come il prick test e test in vitro per gli anticorpi IgE specifichi, e le prove orali da scatenamento alimentari. Queste ultime quando correttamente eseguite continueranno ad essere il gold standard nell'iter diagnostico. Recentemente, i metodi diagnostici non convenzionali vengono sempre più frequentemente utilizzati, ma non possono sostituirsi ai precedenti; per il rischio che i risultati non siano correlati con l'alimento causa di allergia.
Risvolti psicologici
La mancanza di opportuni strumenti di indagine sull'impatto psicologico delle allergie alimentari nei pazienti e nei loro familiari, rende difficile quantizzare le implicazioni psicopatologiche di questa patologia di frequente risconttro nella popolazione specie giovanile [179]. Fermo restando che i fattori psicologici non permettono di prevedere la severità dei sintomi nei pazienti ipersensibilità da allergia alimentare [180].
Il primo studio che conferma la presenza di un 'associazione tra allergie e disturbi dell'umore e d'ansia secondo i criteri del DMS IV è lo studio canadese di Patten SB, e Williams JV del 2007 [181]. Lillestøl K, et al. 2010 [182] valuta la depressione e l'ansia, con opportune scale e questionari, in soggetti con diagnosi di IBS e allergia alimentare (auto segnalata); rilevando con i criteri del DSM IV un aumento della patologia ansiosa del 34% e del 16% per quella depressiva .
Herbert LJ, et al. nel 2008 rileva che in soggetti con allergia alimentare, che hanno esperito un episodio di anafilassi rispetto soggetti allergici che non hanno avuto episodi, i livelli di autostima sono più bassi e sono rilevabili tratti ansiosi e depressivi, indicando così come un episodio di anafillassi può essere un indicatore affidabile di stress psicologico [183].
Nella celiachia si riscontrano tassi elevati di depressione.[184]
L'uso di farmaci per le allergie (specie respiratorie, FDEIA compresa) come i cortisonici sistemici o gli inibitori dei lucotrieni, sono associati ad alti tassi di insonnia, depressione e anche di rischio di suicidio; cosa che impone una attenta vigilanza in tal senso da parte dei clinici [185]. La FDA di nell'agosto del 2009 ha emanato un'avvertenza (box warning) riferito al rischio di suicidio indotto da inibitori dei lucotrieni: Montelukast, Zafirlukast e Zileuton.[186]
Trattamenti
Terapia non farmacologica
- Dieta di evitamento: evitare l'alimento sospetto il più che possibile.
- Counselling dietetico: istruire riguardo gli allergeni e mantenere una dieta bilanciata per quanto possibile.
- Manipolazioni dietetiche: in caso di pseudoallergia la dieta di eliminazione è seguita da una reintroduzione ogni 3 giorni di un nuovo alimento.
Terapia farmacologica di emergenza
- Kit di emergenza antiallergico: nei pazienti che hanno una allergia di tipo I e che possono sviluppare un episodio di tipo anafilattico: Il kit deve contenere un"auto iniettore di adrenalina",[187] antistaminici e steroidi iniettabili, utile una segnalazione nei propri documenti del tipo di allergia.
Dosaggi dell'adrenalina
Adulto
- 0.3 mL IM in sol. acquosa al 1:1000 iniettabile; il range normale è 0,2-0,5 mL in 10-15 min. Potrebbe essere necessario ridurre la dose di ml 0,2 nelle persone anziane o con noti problemi cardiaci.
- dispositivo auto-iniettabile 0,33 mg (Fastieckt 0,33 mg)[188]
prescrivibile in Fascia H[189] Pediatrico
- IM di dosaggio nei bambini è in base al peso: 0,01 ml/kg IM di diluizione 1:1000, non superare 0,3 ml IM in diluizione 1:2000 in 10-15min.
- dispositivo auto-iniettabile 0.165 mg (Fastieckt 0,165 mg)[190] prescrivibile in Fascia H[191]
Terapia farmacologica sintomatica
- Antiistaminici:[192] sono correntemente usati sia nella fase di mantenimento sia nelle fasi acute. Possono provocare sedazione, rischiosa in soggetti impegnati in attivita che richiedono vigilanza (ad esempio la guida), specie i preparati di vecchia generazione.
- Antileucotrienici: hanno indicazione nella manifestazioni allergiche polmonari, il loro uso nelle allergie alimentari è da considerare sperimentale [193].
- Steroidi: nella fase acuta delle manifestazioni allergiche. Sono in assoluto i farmaci più efficaci sui sintomi dell'allergia alimentare e in generale sull'infiammazione; ma sono gravati da importanti effetti collaterali sistemici specie nell'uso prolungato. Le posologie di questi farmaci sono variabili tra le varie molecole in funzione di un rapporto di equivalenza posologica esistente tra i vari steroidi; e soprattutto in funzione della gravità e dal tipo di manifestazione patologica.
- Cromoglicato di sodio[194][195] o DSCG o Cromolyn: in pazienti con sintomi e segni gastrointestinali va usato nella fase di mantenimento a scopo profilattico per evitare o ridurre le eventuali recidive e la loro gravità, [196] ha la caratteristica di non essere assorbito per os, e di avere un'ottima tollerabilità.
Nella esofagite eosinofila [197] il sodio cromoglicato mostra una certa efficacia [198] [199] [200] [201]. Inoltre, in bambini con dermatite atopica l'uso per os dello stesso è in grado di ridurre la permeabilità intestinale patologica alle macromolecole allergizzanti; [202] [203]; mentre è controverso, a tutt'oggi, l'uso per via topica.[204][205]
Il Sodio Cromoglicato o Cromolyn sodico per uso orale (sotto forma di fialoidi) negli USA è indicato nella mastocitosi sistemica, grave patologia orfana, riuscendo in questa patologia a alleviare i sintomi gastrointestinali associati [206].
Terapia etiologica
- La terapia di desensibilizzazione orale è suggerita solo nei casi di allergia di tipo I confermata per il latte o per le uova, poco efficace per le allergie al polline; i dosaggi dell'allergene in questo caso vanno incrementati regolarmente.
Se vi è un'allergia crociata tra un alimento e i pollini, la terapia desensibilizzante è utile contro i pollini nel 60% dei pazienti.
Terapie sperimentali
- Immunizzazione con DNA plasmidico (pDNA)[207]
- L'uso di probiotici come il Lactobacillus rhamnosus [208]
- Immunoterapia con allergeni di Listeria monocytogenes uccisi da calore come adiuvanti, che inducono la produzione di IFN-c [209]
- Medicina tradizionale cinese [210].
Prognosi
- Sviluppo della tolleranza
- In generale, la maggior parte di lattanti e dei bambini diventano clinicamente tolleranti all'ipersensibilità alimentare. In particolare, la maggior parte delle allergie "maggiori" sono al: latte, uova, soia e grano. Le allergie alle arachidi, alle noci, al pesce e frutti di mare sono le più persistenti [211].
- Studi basati sulla popolazione generale, mostrano che l'85% dei bambini piccoli superano la loro allergia al latte o all'uovo all'età di età 3-5 anni [212].
- Tuttavia, studi recenti hanno segnalato una maggiore incidenza delle allergie alle uova e al latte; in questi soggetti solo il 50% circa dei pazienti supera a 8-12 anni il disturbo [213] [214]; gli stessi bambini hanno, però, continuato a ridurre nel tempo le percentuali di incidenza della loro allergia durante adolescenza.
- Circa il 20% dei lattanti e dei bambini guariscono della loro allergia alle arachidi quando raggiungono un'età scolastica [215].
- I bambini con allergie alimentari non-IgE mediate come la proctocoliti e l'enterocolite tipicamente risolvono le loro allergie alimentari nei primi anni di vita [216].
- L'esofagite allergica eosinofila sembra essere un disturbo persistente [217].
- Prevenzione dagli allergeni: l'evitamento rigido dell'allergene è la misura terapeutica, strategicamente necessaria, per evitare reazioni allergiche. Tuttavia come l'evitamento rigido o come esposizioni accidentali alterino il corso naturale delle allergie alimentari rimane poco chiaro [218] [219].
- La prevenzione della malattia atopica attraverso la dieta [220]:
- Numerosi studi hanno valutato il ruolo della dieta materno-infantile sugli esiti della malattia atopica (Asma, dermatite atopica, allergia alimentare), in particolare grazie a studi su neonati a rischio sulla base storia di atopia familiare (almeno 1 parente di primo grado con una documentata malattia atopica). La maggior parte degli studi si sono concentrati sulla eliminazione di allergeni o su un ritardo nella loro introduzione nella fase di svezzamento. Tuttavia, le limitazioni nei disegni degli studi e il limitato numero di studi hanno minimizzato la capacità di trarre conclusioni certe, su una serie di possibili interventi.
Mancano prove certe che dimostrerebbero come l'evitamento di allergeni durante la gravidanza abbia un effetto protettivo; tuttavia, alcune evidenze sostengono che si ha una riduzione della dermatite atopica quando gli allergeni sono stati evitati dalla madre durante l'allattamento.
- Per i neonati a rischio, ma si è visto che l'allattamento esclusivo con latte materno per almeno 3 mesi protegge contro asma dei primi anni di vita. Negli studi di neonati a rischio che non sono stati allattati esclusivamente al seno per 4-6 mesi, evidenze deboli mostrano che l'utilizzo di specifiche formule a base di caseina parzialmente idrolizzata riescono a ridurre o ritardare il rischio di dermatite atopica rispetto alla alimentazione con latte vaccino intero; mentre le formule di latte a base di soia non sembrano offrire un vantaggio rispetto più comune latte artificiale a base di latte vaccino intero.
- Nessuna prova convincente sostiene la necessità di uno svezzamento con alimenti nuovi dopo i 4-6 mesi di la vita.
- Una volta che la malattia allergica è diagnosticata, è necessaria l'eliminazione degli allergeni dalla dieta.
- Studi futuri chiariranno il ruolo della dieta di eliminazione nella prevenzione delle allergie alimentari.
Postumi e follow up
Prevenzione
Svezzamento dal latte materno
L'allattamento al seno evita l'allergia alle proteine del latte vaccino fino allo svezzamento.
Le raccomandazioni dell'Organizzazione mondiale della sanità (OMS) suggeriscono di ritardare questa fase di diversificazione alimentare;[221] ritenendo che un eventuale immaturità del sistema immunitario dei bambini, può essere causa di allergie in futuro. Non vi è, però, alcuna prova sperimentale che ciò sia in grado di ridurre i problemi delle allergie in età pediatrica [222]. Al contrario, modelli animali tendono a mostrare che l'esposizione precoce ad allergeni alimentari riesce ad indurre meglio la tolleranza orale e ridurre quindi il rischio di sviluppare allergie in età pediatrica [223]. Ciò sembra confermato anche da alcuni studi osservazionali [224].
Il problema, pertando, della scelta tra lo svezzamento precoce o ritardato nel tempo resta a tutt'oggi irrisolto.
Prevenzione dalle reazioni ai vaccini
Vi sono dati scientifici che suggeriscono la somministrazione rutinaria della dose unica di vaccino per il morbillo-parotite-rosolia a tutti i pazienti con allergia all'uovo, anche quelli con gravi reazioni anafilattiche dopo l'ingestione di uova [225].
Nel bambino con una storia precedente di reazione al vaccino morbillo-parotite-rosolia, va considerata la possibilità di un'allergia alla gelatina, neomicina, o un altro componente presente nel vaccino. Se il paziente ha una storia clinica di allergia all'uovo ed ha avuto reazioni sistemiche (ad esempio: anafilassi) in seguito all'ingestione di uovo, la somministrazione del vaccino dell'influenza necessita di speciali esami diagnostici [226].
Dopo aver esaminato i rischi e i benefici, la pelle del paziente può essere testata con preparati diluiti del vaccino influenzale (prove intradermiche cutanee). Se i risultati al test cutaneo con il vaccino diluito sono positivi, il vaccino può essere somministrato in modo graduato nel tempo, con un regime multidose; se viceversa il risultato della prova cutanea è negativo, il vaccino può essere somministrato in modo rutinario con dose unica.
Linee guida
Le linee guida tra tutti i tipi di lavori scientifici prodotti danno: raccomandazioni di comportamento clinico; esse, infatti, sono prodotte con un processo di revisione sistematica periodica della conoscenza scientifica al fine di assistere clinici e pazienti, nei confronti delle problematiche valutate.
Le Linee Guida internazionali pubblicate al maggio 2010 sono: 43; di seguito alcune delle Linee Guida Internazionali più autorevoli e recenti in materia di:
- Allergie alimentari
- Food allergy: a practice parameter. 2006 [227].
- Test diagnostici
- Work Group report: oral food challenge testing. 2009 [228].
- Oral food challenge in children: an expert review. 2009 [229].
- Skin testing with food allergens. Guideline of the German Society of Allergology and Clinical Immunology (DGAKI), the Physicians' Association of German Allergologists (ADA) and the Society of Pediatric Allergology (GPA) together with the Swiss Society of Allergology. 2008 [230].
- Allergy diagnostic testing: an updated practice parameter. Part 2. 2008 [231].
- Gastroenterologia
- Eosinophilic gastrointestinal diseases(EGIDs). [232]
- Dermatologia
- Vaccini
- Recommendations for administering the triple viral vaccine and antiinfluenza vaccine in patients with egg allergy. [235].
- Svezzamento
- Food allergy and the introduction of solid foods to infants: a consensus document. [236]
- Prevenzione scolastica
- School guidelines for managing students with food allergies. 2006 [237].
Normative
Aspetti medico-legali
- Quando si eseguono test di scatenamento orale, occorre essere sempre pronti nel riconoscere e trattare immediatamente gli eventuali sintomi clinici avversi.
- Il personale deve essere adeguatamente qualificato e si deve disporre delle attrezzature necessarie per il trattamento delle reazioni anafilattiche come lo shock. Queste devono essere disponibili durante tutta la durata della prova di scatenamento alimentare orale e durante il periodo di osservazione; per il rischio reale di innescare una reazione allergica.
- I pazienti non dovono mai essere istruiti ad eseguire autonomamente un test al proprio domicilio.
- Se il paziente ha una storia di reazioni allergiche gravi dopo l'ingestione di allergeni alimentari, va fornita una specifica consulenza sotto forma di un piano di emergenza scritto con i trattamenti del caso.
- Inoltre, il paziente va educato su come assumere farmaci di emergenza (ad esempio, adrenalina iniettabile, antistaminici, ecc) atto a gestire al meglio l'eventualità di una crisi anafilattica pericolosa per l avita del soggetto.
- Inoltre, se il caso esiste, vanno incoraggiati i pazienti a custodire e portare con i farmaci di emergenza sempre, in modo che in qualsiasi momento essi dovessero servire devono essere prontamente disponibili.
Normativa sulla etichettatura degli alimenti
Le etichette di tutti gli alimenti sono regolate dalla Direttiva 2003/89/CE[238] e successive modifiche.
Scopo di questa direttiva è quello di dare ai consumatori informazioni complete sulla composizione dei prodotti con una etichettatura esauriente, specie rispetto il rischio di allergia o di intolleranza alimentare dovute all'assunzione di particolari alimenti.
Questa norma elimina una precedente disposizione che dava facoltà al produttore di non indicare i prodotti presenti in misura inferiore al 25% (regola del 25%), oggi il legislatore comunitario consente di non indicare i singoli ingredienti dei prodotti composti quando essi costituiscono meno del 2%; inoltre indica un preciso elenco degli allergeni alimentari che obbligatoriamente devono essere indicati sulle etichette dei prodotti alimentari. Inoltre, con questa direttiva non è più necessario indicare in ordine decrescente gli ingredienti e non è necessario indicare l'ingrediente che è presente più volte come ingrediente semplice o composto. L'elenco di questi alimenti allergizzanti è indicato nell'allegato III bis[239] introdotto con la direttiva 2003/89/CE[240] e successiva modifica 2006/142/CE.[241]
Gli alimenti allergizzanti che vanno sempre indicati in etichetta, secondo l'allegato III bis della dalla Direttiva 2003/89/CE (articolo 6, paragrafi 3 bis, 10 e 11) sono:
- Cereali contenenti glutine (cioè grano, segale, orzo, avena, farro, kamut o i loro ceppi ibridati) e prodotti derivati, tranne:
- a) sciroppi di glucosio a base di grano, incluso destrosio;[242]
- b) maltodestrine a base di grano;[242]
- c) sciroppi di glucosio a base d'orzo;
- d) cereali utilizzati per la fabbricazione di distillati o di alcol etilico di origine agricola per liquori ed altre bevande alcoliche.
- Crostacei e prodotti a base di crostacei.
- Uova e prodotti a base di uova.
- Pesce e prodotti a base di pesce, tranne:
- a) gelatina di pesce utilizzata come supporto per preparati di vitamine o carotenoidi;
- b) gelatina o colla di pesce utilizzata come chiarificante nella birra e nel vino.
- Arachidi e prodotti a base di arachidi.
- Soia e prodotti a base di soia, tranne:
- a) olio e grasso di soia raffinato;
- b) tocoferoli misti naturali (E306), tocoferolo D-alfa naturale, tocoferolo acetato D-alfa naturale, tocoferolo succinato D-alfa naturale a base di soia;
- c) oli vegetali derivati da fitosteroli e fitosteroli esteri a base di soia;
- d) estere di stanolo vegetale prodotto da steroli di olio vegetale a base di soia.
- Latte e prodotti a base di latte (incluso lattosio), tranne:
- a) siero di latte utilizzato per la fabbricazione di distillati o di alcol etilico di origine agricola per liquori ed : altre bevande alcoliche;
- b) lattitolo.
- Frutta a guscio, cioè mandorle (Amygdalus communis L.), nocciole (Corylus avellana), noci comuni (Juglans regia), noci di anacardi (Anacardium occidentale), noci di pecan (Carya illinoiesis (Wangenh.) K. Koch), noci del Brasile (Bertholletia excelsa), pistacchi (Pistacia vera), noci del Queensland (Macadamia ternifolia) e prodotti derivati, tranne:.
- a) frutta a guscio utilizzata per la fabbricazione di distillati o di alcol etilico di origine agricola per liquori ed altre bevande alcoliche.
- Sedano e prodotti a base di sedano.
- Senape e prodotti a base di senape.
- Semi di sesamo e prodotti a base di semi di sesamo.
- Anidride solforosa e solfiti in concentrazioni superiori a 10 mg/kg o 10 mg/l espressi come SO2.
- Lupini e prodotti a base di lupini.
- Molluschi e prodotti a base di molluschi.
Obblighi per gli esercizi pubblici
I pubblici esercizi e i laboratori artigiani come le: pasticcerie, gelaterie, panetterie, gastronomie, pescherie ecc, se utilizzano e/o vendono cibi con ingredienti allergizzanti sono sottoposti all'ordinanza del 29 gennaio 2010 (GU n.40 del 18-2-2010) del Ministero della Salute,[243] valida fino al 31 dicembre 2010.
L'ordinanza recita testualmente all'art. 2 comma 2:
Chiunque operi nel settore della ristorazione deve informare il consumatore sull'eventuale presenza di allergeni di cui al decreto legislativo n. 114 del 2006, di cui alle premesse, negli additivi e miscele di additivi impiegati. .
Sanzioni
Il Decreto Legislativo n. 146 del 2 agosto 2007 stabilisce che il produttore di un alimento qualora violi la norma di indicare gli alimenti segnalati nell'allegato III bis della dalla Direttiva 2003/89/CE, è sottoposto al giudizio del Garante della Concorrenza e del Mercato, disponendo che la multa da 5.000 euro, venga portata a 500.000 euro con l'obbligo, in più, di modificare le etichette incomplete.
Ciò per evitare come in passato che per l'esiguità delle sanzioni le norme venissero disattese.
Note
Bibliografia
Generale
- Dan L. Fauci, Harrison's Principles of Internal Medicine, McGraw-Hill, 2005, ISBN 0-07-140235-7.
- Brunton, Lazo, Parker, Goodman & Gilman - Le basi farmacologiche della terapia, 11ª ed., McGraw Hill, 2006, ISBN 0-07-142280-3.
- Warrell, Cox, Firth Benz, Oxford Textbook of Medicine 4th edition, Oxford Press, 2003, ISBN 0-19-262922-0.
- Claudio Rugarli, Medicina interna sistematica., Elsevier, 2005, ISBN 8821427927.
- Carlo Zanussi, Terapia Medica Pratica, Milano, UTET, 2007, ISBN 88-02-05600-5.
Specifica
- Patterson, Greenberger, Leslie, Grammer, Patterson's Allergic Diseases 6th edition, Lippincott Williams & Wilkins Publishers, 2009, ISBN 1-58829-616-4.
- Shils, Olson, Shike, Ross, Modern Nutrition in Health and Disease 9th edition, Lippincott, Williams & Wilkins, 1999, ISBN 0-683-30769-X.
Pubblicazioni
- (EN) F. Rancé, Promising treatments in development for food allergies, in Expert Opin Emerg Drugs, vol. 9, n. 2, novembre 2004, pp. 257-68, PMID 15571483.
- (EN) Matthew I Fogg, Jonathan M Spergel, Management of food allergies, in Expert Opin. Pharmacother, vol. 4, n. 7, 2003, pp. 1025-1037, PMID 12831331.
- (EN) SH Sicherer, Sampson HA, Food allergy (Review), in J Allergy Clin Immunol., vol. 117, 2 Suppl. Mini-Primer, febbraio 2006, pp. S470-5, PMID 16455349.
- (EN) G. Patriarca, Food allergy and food intolerance: diagnosis and treatment, in Intern Emerg Med., vol. 4, n. 1, febbraio 2009, pp. 11-24, PMID 18709496.
- (EN) RA Wood, The natural history of food allergy, in Pediatrics, n. 111, 2003, pp. 1631-7, PMID 12777603.
- (EN) J. Wang, Sampson, HA., Food allergy: recent advances in pathophysiology and treatment, in Allergy Asthma Immunol Res., vol. 1, n. 1, ottobre 2009, pp. 19-29, PMID 20224666.
- (EN) SH. Sicherer, Muñoz-Furlong A, Sampson HA., Prevalence of peanut and tree nut allergy in the United States determined by means of a random digit dial telephone survey: a 5-year follow-up study, in J Allergy Clin Immunol, vol. 112, n. 6, dicembre 2003, pp. 1203-7, PMID 14657884.
- (EN) JO Hourihane, Roberts SA, Warner JO., Resolution of peanut allergy:case-control study, in BMJ., vol. 316, n. 7140, aprile 1998, pp. 1271-5, PMID 9554896.
- (EN) DM. Fleischer, Conover-Walker MK, Christie L, Burks AW, Wood RA., The natural progression of peanut allergy: resolution and the possibility of recurrence, in J Allergy Clin Immunol, n. 112, 2003, pp. 183-9, PMID 9554896.
- (EN) MH. Ho, et al., Early clinical predictors of remission of peanut allergy in children, in J Allergy Clin Immunol., vol. 121, n. 3, marzo 2008, pp. 731-6, PMID 18234313.
- (EN) M. Osterballe, et al., The prevalence of food hypersensitivity in young adults, in Pediatr Allergy Immunol., vol. 20, n. 7, novembre 2009, pp. 686-92, PMID 19594854.
- RW Weber, Food additives and allergy., in Ann Allergy., vol. 2, 70(3), Mar 1993, pp. 183-90, PMID 9554896.
- CJ, Gowland MH, Hourihane JO, Sesame allergy in Britain: a questionnaire survey of members of the Anaphylaxis Campaign., in Pediatr Allergy Immunol, vol. 16, 2005, pp. 171-5, PMID 15787876.
- P. Permaul, et al.,, Sesame allergy: role of specific IgE and skin-prick testing in predicting food challenge results., in Allergy Asthma Proc., vol. 30, n. 6, Nov-Dec 2009, pp. 643-8, PMID 20031010.
- L, Zuidmeer, et al.,, The prevalence of plant food allergies: a systematic review., in J Allergy Clin Immunol., vol. 121, n. 5, May 2008, pp. 1210-1218, PMID 18378288.
Voci correlate
- Asma
- Orticaria
- Orticaria colinergica
- Orticaria solare
- Orticaria cronica
- Dermatite atopica
- Eczema
- Angioedema
- Shock anafilattico
- Reazioni di ipersensibilità
- Intolleranza
- Intolleranza al lattosio
- Pronto soccorso
- Allergia
- Immunologia
- Mastociti
- Mastocitosi
- Mastocitosi sistemica
- Mastocitosi cutanea
- Antistaminico
- Steroide
- Cromone
- Additivi alimentari
- Disturbi dell'alimentazione
Altri progetti
 Wikizionario contiene il lemma di dizionario «allergia alimentare»
Wikizionario contiene il lemma di dizionario «allergia alimentare» Wikimedia Commons contiene immagini o altri file su allergia alimentare
Wikimedia Commons contiene immagini o altri file su allergia alimentare
Collegamenti esterni
- Società Italiana di Allergologia ed Immunologia Clinica
- Soc. Italiana di Dermatologia Allergologica e Professionale
- EFIC The European Food Information Concil
- Associazione Italiana Allergie Alimentari
- (EN) Sito con un completo data base allergologico per alimenti
- (EN) Elenco Maggiori Siti mondiali sulle allergie alimentari
- (EN) European Academy of Allergy and clinical Immunology
- (EN) CDC.gov - p. Allergie alimentari
- (EN) American Academy of Allergy Asthma & Immunology - p. Allergie alimentari
- (EN) Asthma and Allergy Foundation of America
- (NL) p. Allergie alimentari
- (DE) Banca dati su oltre 4000 allergeni
- Elenco completo dei vari epitopi classificati per ogni alimento
- Nomenclatura degli allergeni
- Database delle proteine allergeniche
Riviste scientifiche
Video
Template:Mvideo Template:Mvideo
- ^ Rancé
- ^ Fogg
- ^ Sicherer
- ^ http://www.cdc.gov/nchs/data/databriefs/db10.htm
- ^ Patriarca
- ^ Wang
- ^ http://www.farmaci-e-vita.it/cap_5_1_1.aspx?cap=5¶g=cap5parag1
- ^ http://www.farmaci-e-vita.it/cap_5_1_1.aspx?cap=5¶g=cap5parag1
- ^ http://www.siaic.net/it/
- ^ Sicherer
- ^ Wood
- ^ Hourihane
- ^ Fleischer
- ^ Ho
- ^ http://www.mountsinai.org/about-us/newsroom/press-releases/rate-of-childhood-peanut-allergies-more-than-tripled-between-1997-and-2008
- ^ Osterballe
- ^ Weber
- ^ Derby
- ^ Permaul
- ^ (EN) Zuidmeer L, et al., The prevalence of plant food allergies: a systematic review. J Allergy Clin Immunol. 2008 May;121(5):1210-1218.e4. Epub 2008 Apr 18. PMID 18378288
- ^ Zuidmeer
- ^ CW, Lee, Sheffer AL., Peanut allergy., in Allergy Asthma Proc., vol. 24, n. 4, Jul-Aug 2003, pp. 259-64, PMID 12974192.
- ^ T. Buie, et al.,, Evaluation, diagnosis, and treatment of gastrointestinal disorders in individuals with ASDs: a consensus report., in Pediatrics., vol. 125, Suppl 1, Jan 2010, pp. S1-18, PMID 20048083.
- ^ J. Wang, Sampson HA. Food allergy: recent advances in pathophysiology and treatment., in Allergy Asthma Immunol Res., vol. 1, n. 1, Oct; 2009, pp. 19-29., PMID 20224666.
- ^ L. Cox, et al., American College of Allergy, Asthma and Immunology Test Task Force; American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force., Pearls and pitfalls of allergy diagnostic testing: report from the American College of Allergy, Asthma and Immunology/American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force., in Ann Allergy Asthma Immunol., vol. 101, n. 6, Dec 2008, pp. 580-92., PMID 9119701.
- ^ RD. DeSwarte, Drug allergy--problems and strategies., in J Allergy Clin Immunol., vol. 74, 3 Pt 1, Sep 1984.
- ^ R.F., Horan, Schneider, L.C., Sheffer, A.L., Allergic Disorders and Mastocytosis, in Journal of the American Medical Association, vol. 268, 1992, pp. 2858-68, PMID 1433701.
- ^ AA, Anaphylaxis in Schools and Other Childcare Settings, in Journal of Allergy and Clinical Immunology., vol. 102, 1998, pp. 173-76., PMID 9723657.
- ^ http://www.ansa.it/web/notizie/rubriche/scienza/2010/05/08/visualizza_new.html_1790249961.html
- ^ http://www.europass.parma.it/page.asp?IDCategoria=553&IDSezione=0&ID=362247
- ^ Pumphrey RS, Gowland MH, Further fatal allergic reactions to food in the United Kingdom, 1999-2006, in J. Allergy Clin. Immunol., vol. 119, n. 4, April 2007, pp. 1018–9, DOI:10.1016/j.jaci.2007.01.021.
- ^ a b Bock SA, Muñoz-Furlong A, Sampson HA, Further fatalities caused by anaphylactic reactions to food, 2001-2006, in J. Allergy Clin. Immunol., vol. 119, n. 4, April 2007, pp. 1016–8, DOI:10.1016/j.jaci.2006.12.622. Errore nelle note: Tag
<ref>non valido; il nome "Bock" è stato definito più volte con contenuti diversi - ^ a b Sampson HA, Mendelson L, Rosen JP, Fatal and near-fatal anaphylactic reactions to food in children and adolescents, in N. Engl. J. Med., vol. 327, n. 6, August 1992, pp. 380–4. Errore nelle note: Tag
<ref>non valido; il nome "Sampson" è stato definito più volte con contenuti diversi - ^ C. Dantonio, Suspected acute allergic reactions: analysis of admissions to the Emergency Department of the AOU Maggiore della Carità Hospital in Novara from 2003 to 2007., in Eur Ann Allergy Clin Immunol, vol. 40, n. 4, Dec 2008, pp. 122-9, PMID 19227647.
- ^ http://www.foodnavigator-usa.com/Science-Nutrition/New-hope-for-peanut-allergy-sufferers-thanks-to-low-allergy-nuts
- ^ SH. Sicherer, 9. Food allergy., in J Allergy Clin Immunol, vol. 117, 2 Suppl Mini-Primer, Feb 2006, pp. S470-5, DOI:10.1016/j.jaci.2005.05.048, PMID 16455349.
- ^ P. Vadas, Platelet-activating factor, PAF acetylhydrolase, and severe anaphylaxis., in N Engl J Med, vol. 358, n. 1, Jan 2008, pp. 28-35, DOI:10.1056/NEJMoa070030, PMID 18172172.
- ^ C. Incorvaia, Anaphylaxis: an update on its understanding and management., in Recent Pat Inflamm Allergy Drug Discov, vol. 4, n. 2, Jun 2010, pp. 124-9, PMID 20100165.
- ^ K. Arias, Concurrent blockade of platelet-activating factor and histamine prevents life-threatening peanut-induced anaphylactic reactions., in J Allergy Clin Immunol, vol. 124, n. 2, Aug 2009, pp. 307-14, 314.e1-2, DOI:10.1016/j.jaci.2009.03.012, PMID 19409603.
- ^ AW. Burks, Factoring PAF in anaphylaxis., in N Engl J Med, vol. 358, n. 1, Jan 2008, pp. 79-81, DOI:10.1056/NEJMe078159, PMID 18172180.
- ^ (EN) Steckelbroeck S, Ballmer-Weber BK,Vieths S. 2008. Potential, pitfalls, and prospects of food allergy diagnostics using recombinant allergens or synthetic sequential epitopes. J. Allergy Clin. Immunol. 121:1323–30. PMID 18472149
- ^ Cabanillas B, Pedrosa MM, Rodríguez J, González A, Muzquiz M, Cuadrado C,Crespo JF, Burbano C. Effects of enzymatic hydrolysis on lentil allergenicity.Mol Nutr Food Res. 2010 Mar 19. [Epub ahead of print] PMID 20306474.
- ^ López-Expósito I, Chicón R, Belloque J, Recio I, Alonso E, López-Fandiño R. Changes in the ovalbumin proteolysis profile by high pressure and its effect on IgG and IgE binding. J Agric Food Chem. 2008 Dec 24;56(24):11809-16. PMID 19053365.
- ^ Chicón R, Belloque J, Alonso E, Martín-Alvarez PJ, López-Fandiño R. Hydrolysis under high hydrostatic pressure as a means to reduce the binding of beta-lactoglobulin to immunoglobulin E from human sera. J Food Prot. 2008 Jul;71(7):1453-9. PMID 18680946.
- ^ SN. Merwat, Might the use of acid-suppressive medications predispose to the development of eosinophilic esophagitis?, in Am J Gastroenterol, vol. 104, n. 8, Aug 2009, pp. 1897-902, DOI:10.1038/ajg.2009.87, PMID 19661930.
- ^ M. Bohm, Esophageal dilation: simple and effective treatment for adults with eosinophilic esophagitis and esophageal rings and narrowing., in Dis Esophagus, Mar 2010, DOI:10.1111/j.1442-2050.2010.01051.x, PMID 20353444.
- ^ J. Molina-Infante, Acid-suppressive therapy and eosinophilic esophagitis: friends or foes?, in Am J Gastroenterol, vol. 105, n. 3, Mar 2010, pp. 699-700, DOI:10.1038/ajg.2009.590, PMID 20203650.
- ^ R. Fass, Refractory GERD: what is it?, in Curr Gastroenterol Rep, vol. 10, n. 3, Jun 2008, pp. 252-7, PMID 18625135.
- ^ SP. Pentiuk, Eosinophilic esophagitis in infants and toddlers., in Dysphagia, vol. 22, n. 1, Jan 2007, pp. 44-8, DOI:10.1007/s00455-006-9040-9, PMID 17024545.
- ^ S. Baxi, Clinical presentation of patients with eosinophilic inflammation of the esophagus., in Gastrointest Endosc, vol. 64, n. 4, Oct 2006, pp. 473-8, DOI:10.1016/j.gie.2006.03.931, PMID 16996334.
- ^ EE. Forbes, IL-9- and mast cell-mediated intestinal permeability predisposes to oral antigen hypersensitivity., in J Exp Med, vol. 205, n. 4, Apr 2008, pp. 897-913, DOI:10.1084/jem.20071046, PMID 18378796.
- ^ J. Louahed, Interleukin 9 promotes influx and local maturation of eosinophils., in Blood, vol. 97, n. 4, Feb 2001, pp. 1035-42, PMID 11159534.
- ^ M. Heyman, Cytokine-induced alteration of the epithelial barrier to food antigens in disease., in Ann N Y Acad Sci, vol. 915, 2000, pp. 304-11, PMID 11193593.
- ^ a b KR. Groschwitz, Intestinal barrier function: molecular regulation and disease pathogenesis., in J Allergy Clin Immunol, vol. 124, n. 1, Jul 2009, pp. 3-20; quiz 21-2, DOI:10.1016/j.jaci.2009.05.038, PMID 19560575. Errore nelle note: Tag
<ref>non valido; il nome "Groschwitz-2009" è stato definito più volte con contenuti diversi - ^ a b MT. Ventura, Intestinal permeability in patients with adverse reactions to food., in Dig Liver Dis, vol. 38, n. 10, Oct 2006, pp. 732-6, DOI:10.1016/j.dld.2006.06.012, PMID 16880015.
- ^ a b c M. Heyman, Gut barrier dysfunction in food allergy., in Eur J Gastroenterol Hepatol, vol. 17, n. 12, Dec 2005, pp. 1279-85, PMID 16292078.
- ^ A. Fasano, Mechanisms of disease: the role of intestinal barrier function in the pathogenesis of gastrointestinal autoimmune diseases., in Nat Clin Pract Gastroenterol Hepatol, vol. 2, n. 9, Sep 2005, pp. 416-22, DOI:10.1038/ncpgasthep0259, PMID 16265432.
- ^ D. Hollander, Permeability in Crohn's disease: altered barrier functions in healthy relatives?, in Gastroenterology, vol. 104, n. 6, Jun 1993, pp. 1848-51, PMID 8500744.
- ^ M. Peeters, Clustering of increased small intestinal permeability in families with Crohn's disease., in Gastroenterology, vol. 113, n. 3, Sep 1997, pp. 802-7, PMID 9287971.
- ^ SM. Edelman, Symbiotic commensal bacteria direct maturation of the host immune system., in Curr Opin Gastroenterol, vol. 24, n. 6, Nov 2008, pp. 720-4, DOI:10.1097/MOG.0b013e32830c4355, PMID 19122522.
- ^ K. Takahashi, Interaction between the intestinal immune system and commensal bacteria and its effect on the regulation of allergic reactions., in Biosci Biotechnol Biochem, vol. 74, n. 4, 2010, pp. 691-5, PMID 20378987.
- ^ RJ. Fecek, Enteric reovirus infection stimulates peanut-specific IgG2a responses in a mouse food allergy model., in Immunobiology, Mar 2010, DOI:10.1016/j.imbio.2010.02.004, PMID 20356650.
- ^ GT. Rijkers, Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research., in J Nutr, vol. 140, n. 3, Mar 2010, pp. 671S-6S, DOI:10.3945/jn.109.113779, PMID 20130080.
- ^ E. Isolauri, Probiotics: use in allergic disorders: a Nutrition, Allergy, Mucosal Immunology, and Intestinal Microbiota (NAMI) Research Group Report., in J Clin Gastroenterol, 42 Suppl 2, Jul 2008, pp. S91-6, DOI:10.1097/MCG.0b013e3181639a98, PMID 18542035.
- ^ J. Wang, Food allergy: recent advances in pathophysiology and treatment., in Allergy Asthma Immunol Res, vol. 1, n. 1, Oct 2009, pp. 19-29, DOI:10.4168/aair.2009.1.1.19, PMID 20224666.
- ^ SH. Sicherer, Food allergy: recent advances in pathophysiology and treatment., in Annu Rev Med, vol. 60, 2009, pp. 261-77, DOI:10.1146/annurev.med.60.042407.205711, PMID 18729729.
- ^ WG. Shreffler, The major glycoprotein allergen from Arachis hypogaea, Ara h 1, is a ligand of dendritic cell-specific ICAM-grabbing nonintegrin and acts as a Th2 adjuvant in vitro., in J Immunol, vol. 177, n. 6, Sep 2006, pp. 3677-85, PMID 16951327.
- ^ M. Chehade, Oral tolerance and its relation to food hypersensitivities., in J Allergy Clin Immunol, vol. 115, n. 1, Jan 2005, pp. 3-12; quiz 13, DOI:10.1016/j.jaci.2004.11.008, PMID 15637539.
- ^ M. Heyman, Symposium on 'dietary influences on mucosal immunity'. How dietary antigens access the mucosal immune system., in Proc Nutr Soc, vol. 60, n. 4, Nov 2001, pp. 419-26, PMID 12069393.
- ^ M. Heyman, Antigen absorption by the jejunal epithelium of children with cow's milk allergy., in Pediatr Res, vol. 24, n. 2, Aug 1988, pp. 197-202, PMID 3186332.
- ^ LT. Weaver, Enhanced intestinal permeability in preterm babies with bloody stools., in Arch Dis Child, vol. 59, n. 3, Mar 1984, pp. 280-1, PMID 6424585.
- ^ G. Du Toit, Early consumption of peanuts in infancy is associated with a low prevalence of peanut allergy., in J Allergy Clin Immunol, vol. 122, n. 5, Nov 2008, pp. 984-91, DOI:10.1016/j.jaci.2008.08.039, PMID 19000582.
- ^ a b G. Vighi, Allergy and the gastrointestinal system., in Clin Exp Immunol, 153 Suppl 1, Sep 2008, pp. 3-6, DOI:10.1111/j.1365-2249.2008.03713.x, PMID 18721321.
- ^ Y. Suzuki, Analysis of the mechanism for the development of allergic skin inflammation and the application for its treatment: aspirin modulation of IgE-dependent mast cell activation: role of aspirin-induced exacerbation of immediate allergy., in J Pharmacol Sci, vol. 110, n. 3, Jul 2009, pp. 237-44, PMID 19609060.
- ^ GS. Choi, Occupational asthma caused by inhalation of bovine serum albumin powder., in Allergy Asthma Immunol Res, vol. 1, n. 1, Oct 2009, pp. 45-7, DOI:10.4168/aair.2009.1.1.45, PMID 20224670.
- ^ JA. Bird, Food allergy and asthma., in Prim Care Respir J, vol. 18, n. 4, Dec 2009, pp. 258-65, DOI:10.4104/pcrj.2009.00036, PMID 19588055.
- ^ IA. Penttila, Immune modulation in suckling rat pups by a growth factor extract derived from milk whey., in J Dairy Res, vol. 68, n. 4, Nov 2001, pp. 587-99, PMID 11928955.
- ^ TR. Torgerson, Severe food allergy as a variant of IPEX syndrome caused by a deletion in a noncoding region of the FOXP3 gene., in Gastroenterology, vol. 132, n. 5, May 2007, pp. 1705-17, DOI:10.1053/j.gastro.2007.02.044, PMID 17484868.
- ^ CR. Cardoso, IL-4 regulates susceptibility to intestinal inflammation in murine food allergy., in Am J Physiol Gastrointest Liver Physiol, vol. 296, n. 3, Mar 2009, pp. G593-600, DOI:10.1152/ajpgi.90431.2008, PMID 19136382.
- ^ G. Lack, Epidemiologic risks for food allergy., in J Allergy Clin Immunol, vol. 121, n. 6, Jun 2008, pp. 1331-6, DOI:10.1016/j.jaci.2008.04.032, PMID 18539191.
- ^ LA. Lee, Food allergies: prevalence, molecular characterization, and treatment/prevention strategies., in Annu Rev Nutr, vol. 26, 2006, pp. 539-65, DOI:10.1146/annurev.nutr.26.061505.111211, PMID 16602930.
- ^ BM. Yan, Primary eosinophilic disorders of the gastrointestinal tract., in Gut, vol. 58, n. 5, May 2009, pp. 721-32, DOI:10.1136/gut.2008.165894, PMID 19052023.
- ^ HC. Gray, Rice-induced enterocolitis in an infant: TH1/TH2 cellular hypersensitivity and absent IgE reactivity., in Ann Allergy Asthma Immunol, vol. 93, n. 6, Dec 2004, pp. 601-5, PMID 15609772.
- ^ N. Benlounes, The time-course of milk antigen-induced TNF-alpha secretion differs according to the clinical symptoms in children with cow's milk allergy., in J Allergy Clin Immunol, vol. 104, 4 Pt 1, Oct 1999, pp. 863-9, PMID 10518834.
- ^ HL. Chung, Expression of transforming growth factor beta1, transforming growth factor type I and II receptors, and TNF-alpha in the mucosa of the small intestine in infants with food protein-induced enterocolitis syndrome., in J Allergy Clin Immunol, vol. 109, n. 1, Jan 2002, pp. 150-4, PMID 11799382.
- ^ KJ. Abernathy-Carver, Milk-induced eczema is associated with the expansion of T cells expressing cutaneous lymphocyte antigen., in J Clin Invest, vol. 95, n. 2, Feb 1995, pp. 913-8, DOI:10.1172/JCI117743, PMID 7532192.
- ^ HJ. Tsai, Familial aggregation of food allergy and sensitization to food allergens: a family-based study., in Clin Exp Allergy, vol. 39, n. 1, Jan 2009, pp. 101-9, DOI:10.1111/j.1365-2222.2008.03111.x, PMID 19016802.
- ^ G. Lack, Factors associated with the development of peanut allergy in childhood., in N Engl J Med, vol. 348, n. 11, Mar 2003, pp. 977-85, DOI:10.1056/NEJMoa013536, PMID 12637607.
- ^ JO. Hourihane, Peanut allergy in relation to heredity, maternal diet, and other atopic diseases: results of a questionnaire survey, skin prick testing, and food challenges., in BMJ, vol. 313, n. 7056, Aug 1996, pp. 518-21, PMID 8789975.
- ^ SM. Tariq, Cohort study of peanut and tree nut sensitisation by age of 4 years., in BMJ, vol. 313, n. 7056, Aug 1996, pp. 514-7, PMID 8789974.
- ^ X. Liu, Genetic and environmental contributions to allergen sensitization in a Chinese twin study., in Clin Exp Allergy, vol. 39, n. 7, Jul 2009, pp. 991-8, DOI:10.1111/j.1365-2222.2009.03228.x, PMID 19302247.
- ^ SH. Sicherer, Genetics of peanut allergy: a twin study., in J Allergy Clin Immunol, vol. 106, 1 Pt 1, Jul 2000, pp. 53-6, DOI:10.1067/mai.2000.108105, PMID 10887305.
- ^ R. Rokaite, Gastrointestinal disorders in children with atopic dermatitis., in Medicina (Kaunas), vol. 41, n. 10, 2005, pp. 837-45, PMID 16272830.
- ^ CR. Cardoso, B cells are involved in the modulation of pathogenic gut immune response in food-allergic enteropathy., in Clin Exp Immunol, vol. 154, n. 2, Nov 2008, pp. 153-61, DOI:10.1111/j.1365-2249.2008.03748.x, PMID 18778361.
- ^ A. Vojdani, Detection of IgE, IgG, IgA and IgM antibodies against raw and processed food antigens., in Nutr Metab (Lond), vol. 6, 2009, p. 22, DOI:10.1186/1743-7075-6-22, PMID 19435515.
- ^ Y. Kondo, Oral allergy syndrome., in Allergol Int, vol. 58, n. 4, Dec 2009, pp. 485-91, DOI:10.2332/allergolint.09-RAI-0136, PMID 19847095.
- ^ S. Khaldi, Cryptosporidium parvum isolate-dependent postinfectious jejunal hypersensitivity and mast cell accumulation in an immunocompetent rat model., in Infect Immun, vol. 77, n. 11, Nov 2009, pp. 5163-9, DOI:10.1128/IAI.00220-09, PMID 19687199.
- ^ Chen YH, Wu HJ, Tsai JJ, Lee MF. Anaphylactic shock caused by a 33-kDa alpha S1-casein-like allergen in kingfish caviar. J Investig Allergol Clin Immunol.2009;19(3):245-6. PMID 19610275.
- ^ Pertierra Cortada A, Cambra Lasaosa FJ, Caritg Bosch J, Palomeque Rico A, Plaza Martín AM. [Shock and digestive symptoms in a neonate: a severe presentation of allergy to cow's milk proteins]. An Pediatr (Barc). 2006 Apr;64(4):392-3. Spanish. PMID 16606579.
- ^ Khodoun M, Strait R, Orekov T, Hogan S, Karasuyama H, Herbert DR, Köhl J, Finkelman FD. Peanuts can contribute to anaphylactic shock by activating complement. J Allergy Clin Immunol. 2009 Feb;123(2):342-51. Epub 2009 Jan 3. PMID 19121857
- ^ BW Robinson, Henoch-Schonlein purpura due to food sensitivity., in Br Med J., vol. 19, n. 1, Feb 1977, pp. 510-11, PMID 556968.
- ^ M Arvonen, Ikni L, Augustin M, Karttunen TJ, Vähäsalo P, Increase of duodenal and ileal mucosal cytotoxic lymphocytes in juvenile idiopathic arthritis, in Clin Exp Rheumatol, vol. 1, n. 28, Jan-Feb 2010, pp. 128-34.
- ^ J Kokkonen, Arvonen M, Vähäsalo P, Karttunen TJ, Intestinal immune activation in juvenile idiopathic arthritis and connective tissue disease, in Scand J Rheumatol, vol. 5, n. 36, Sep-Oct 2007, pp. 386-9.
- ^ CC. Victorino, The social determinants of child health: variations across health outcomes - a population-based cross-sectional analysis., in BMC Pediatr, vol. 9, 2009, p. 53, DOI:10.1186/1471-2431-9-53, PMID 19686599.
- ^ N. Speight, Best practice: migraine., in Arch Dis Child, vol. 91, n. 6, Jun 2006, p. 541, PMID 16714736.
- ^ J. Merrett, Food related antibodies in headache patients., in J Neurol Neurosurg Psychiatry, vol. 46, n. 8, Aug 1983, pp. 738-42, PMID 6886717.
- ^ TT. Postolache, Allergy: a risk factor for suicide?, in Curr Treat Options Neurol, vol. 10, n. 5, Sep 2008, pp. 363-76, PMID 18782509.
- ^ M. Esperanca, Nocturnal enuresis: comparison of the effect of imipramine and dietary restriction on bladder capacity., in Can Med Assoc J, vol. 101, n. 12, Dec 1969, pp. 65-8, PMID 5362303.
- ^ M. Abdel-Hafez, Idiopathic nephrotic syndrome and atopy: is there a common link?, in Am J Kidney Dis, vol. 54, n. 5, Nov 2009, pp. 945-53, DOI:10.1053/j.ajkd.2009.03.019, PMID 19556042.
- ^ JS. de Sousa, Cow's milk protein sensitivity: a possible cause of nephrotic syndrome in early infancy., in J Pediatr Gastroenterol Nutr, vol. 21, n. 2, Aug 1995, pp. 235-7, PMID 7472914.
- ^ C. Cingi, Demirbas D, Songu M., Allergic rhinitis caused by food allergies., in Arch Otorhinolaryngol., May 2010.
- ^ http://medicinaeprevenzione.paginemediche.it/it/283/esami/allergologia/detail_1130_prick-test.aspx?c1=1&c2=0
- ^ Spergel JM, Brown-Whitehorn T, Beausoleil JL, Shuker M, Liacouras CA. Predictive values for skin prick test and atopy patch test for eosinophilic esophagitis. J Allergy Clin Immunol. Feb 2007;119(2):509-11.
- ^ Fogg MI, Brown-Whitehorn TA, Pawlowski NA, Spergel JM. Atopy patch test for the diagnosis of food protein-induced enterocolitis syndrome. Pediatr Allergy Immunol. Aug 2006
- ^ Mehl A, Rolinck-Werninghaus C, Staden U, Verstege A, Wahn U, Beyer K, et al. The atopy patch test in the diagnostic workup of suspected food-related symptoms in children. J Allergy Clin Immunol. Oct 2006;118 (4):923-9.
- ^ Bernstein IL, Li JT, Bernstein DI, Hamilton R, Spector SL, Tan R, et al. Allergy diagnostic testing: an updated practice parameter. Ann Allergy Asthma Immunol. Mar 2008;100(3 Suppl 3):S1-148. 18431959
- ^ Sarratud T, Donnanno S, Terracciano L, Trimarco G, Martelli A, Petersson CJ, Borres MP, Fiocchi A, Cavagni G.Accuracy of a point-of-care testing device in children with suspected respiratory allergy.Allergy Asthma Proc. 2010 Mar;31(2):e11-7. Epub 2010 Mar 16. PMID 20236576
- ^ Eigenmann PA, Kuenzli M, D'Apuzzo V, Kehrt R, Joerg W, Reinhardt M, Rudengren M, Borres MP, Lauener RP.The ImmunoCAP Rapid Wheeze/Rhinitis Child test is useful in the initial allergy diagnosis of children with respiratory symptoms. Pediatr Allergy Immunol. 2009 Dec;20(8):772-9. Epub 2009 Jun 22. PMID 19549098
- ^ [Determination of lactose intolerance frequency in children with food allergy] Hutyra T, Iwańczak B. Pol Merkur Lekarski. 2008 Oct;25(148):340-4. PMID 19145933
- ^ Delayed anaphylaxis, angioedema, or urticaria after consumption of red meat in patients with IgE antibodies specific for galactose-alpha-1,3-galactose. Commins SP, Satinover SM, Hosen J, Mozena J, Borish L, Lewis BD, Woodfolk JA, Platts-Mills TA. J Allergy Clin Immunol. 2009 Feb;123(2):426-33. Epub 2008 Dec 13. PMID 19070355
- ^ Food additives and sensitivities. Rangan C, Barceloux DG. Dis Mon. 2009 May;55(5):292-311. Review. No abstract available. PMID 19362177
- ^ Aspartame: review of safety.Butchko HH, Stargel WW, Comer CP, Mayhew DA, Benninger C, Blackburn GL, de Sonneville LM, Geha RS, Hertelendy Z, Koestner A, Leon AS, Liepa GU, McMartin KE, Mendenhall CL, Munro IC, Novotny EJ, Renwick AG, Schiffman SS, Schomer DL, Shaywitz BA, Spiers PA, Tephly TR, Thomas JA, Trefz FK. Regul Toxicol Pharmacol. 2002 Apr;35(2 Pt 2):S1-93. Review. PMID 1218049
- ^ Intolerance to dietary biogenic amines: a review. Jansen SC, van Dusseldorp M, Bottema KC, Dubois AE. Ann Allergy Asthma Immunol. 2003 Sep;91(3):233-40; quiz 241-2, 296. Review. PMID 14533654
- ^ Scombroid poisoning: A review. Hungerford JM. Toxicon. 2010 Feb 10. PMID 20152850
- ^ Controversies in food allergy. Muñoz-López F. Allergol Immunopathol (Madr). 2006 Mar-Apr;34(2):43-5. PMID 16606544
- ^ Chocolate-induced prolonged angiooedema in an elderly patient. Kannayiram A, Rezaie A, Hadi S. Age Ageing. 2008 Jul;37(4):479-80. Epub 2008 Apr 3. PMID 18388162
- ^ 5-HT 3 receptors mediate the time-dependent vagal afferent modulation of nociception during chronic food allergen-sensitized visceral hyperalgesia in rats. Chen S, Li J, Zhang L, Dong X, Gao W, Mo J, Chen H, Xiao S, Li Y. Neurogastroenterol Motil. 2009 Nov;21(11):1222-e113. Epub 2009 May 26. PMID 19558425
- ^ [Food additives--not just a problem for allergic patients] Flemmer A. Kinderkrankenschwester. 2009 Oct;28(10):407-12. German. PMID 19886214
- ^ Oral sensitivity to fatty acids, food consumption and BMI in human subjects. Stewart JE, Feinle-Bisset C, Golding M, Delahunty C, Clifton PM, Keast RS. Br J Nutr. 2010 Mar 3:1-8. PMID 20196892
- ^ Effects of industrial processing on the immunogenicity of commonly ingested fish species. Sletten G, Van Do T, Lindvik H, Egaas E, Florvaag E. Int Arch Allergy Immunol. 2010;151(3):223-36. Epub 2009 Sep 29. PMID 19786803
- ^ (EN) .Wang J., Sampson H. A. Food allergy: recent advances in pathophysiology and treatment. Allergy Asthma Immunol Res. 2009 October;1(1):19-29. doi: 10.4168/aair.2009.1.1.19
- ^ Sampson HA. Food allergy: recent advances in pathophysiology and treatment. J Allergy Clin Immunol. 2003;111(suppl):S540-S547 PMID 20224666
- ^ Cow's milk protein allergy in children: a practical guide. Caffarelli C, Baldi F, Bendandi B, Calzone L, Marani M, Pasquinelli P; on behalf of EWGPAG. Ital J Pediatr. 2010 Jan 15;36(1):5.PMID 20205781
- ^ Martorell Aragonés A. [Etiologic implication of foods in atopic dermatitis:evidence against]. Allergol Immunopathol (Madr). 2002 May-Jun;30(3):120-6.Spanish. PubMed PMID 11988142
- ^ The pattern of sesame sensitivity among infants and children. Dalal I, Binson I, Levine A, Somekh E, Ballin A, Reifen R. Pediatr Allergy Immunol. 2003 Aug;14(4):312-6.PMID 12911511
- ^ Cow's milk protein allergy in children: a practical guide. Caffarelli C, Baldi F, Bendandi B, Calzone L, Marani M, Pasquinelli P; on behalf of EWGPAG. Ital J Pediatr. 2010 Jan 15;36(1):5.PMID 20205781
- ^ Anaphylaxis to mango fruit and crossreactivity with Artemisia vulgaris pollen. Silva R, Lopes C, Castro E, Ferraz de Oliveira J, Bartolomé B, Castel-Branco MG. J Investig Allergol Clin Immunol. 2009;19(5):420-2. No abstract available. PMID 19862948
- ^ Oral Allergy Syndrome (OAS). General and stomatological aspects. Ausukua M, Dublin I, Echebarria MA, Aguirre JM. Med Oral Patol Oral Cir Bucal. 2009 Nov 1;14(11):e568-72. Review.PMID 19680197
- ^ Staikūniene J, Japertiene LM, Sakalauskas R. [Influence of sensitization to pollen and food allergens on pollinosis clinical symptoms]. Medicina (Kaunas). 2005;41(3):208-16. PMID 15827387
- ^ Fujimura M, Ohmori K, Masuda K, Tsujimoto H, Sakaguchi M. Oral allergy syndrome induced by tomato in a dog with Japanese cedar (Cryptomeria japonica) pollinosis. J Vet Med Sci. 2002 Nov;64(11):1069-70. PubMed PMID 12499698
- ^ Fernández Rivas M. [Cross-reactivity between fruit and vegetables]. Allergol Immunopathol (Madr). 2003 May-Jun;31(3):141-6. Review. Spanish. PubMed PMID 12783764
- ^ Kondo Y, Urisu A. Oral allergy syndrome. Allergol Int. 2009 Dec;58(4):485-91. Epub 2009 Oct 25. PubMed PMID 19847095
- ^ Morita E, Matsuo H, Chinuki Y, Takahashi H, Dahlström J, Tanaka A. Food-dependent exercise-induced anaphylaxis -importance of omega-5 gliadin and HMW-glutenin as causative antigens for wheat-dependent exercise-induced anaphylaxis- Allergol Int. 2009 Dec;58(4):493-8. Epub 2009 Oct 25.PMID 19847096
- ^ Suzuki Y, Ra C. Analysis of the mechanism for the development of allergic skin inflammation and the application for its treatment: aspirin modulation of IgE-dependent mast cell activation: role of aspirin-induced exacerbation of immediate allergy. J Pharmacol Sci. 2009 Jul;110(3):237-44. Review. PubMed PMID 19609060
- ^ Teo SL, Gerez IF, Ang EY, Shek LP. Food-dependent exercise-induced anaphylaxis - a review of 5 cases. Ann Acad Med Singapore. 2009 Oct;38(10):905-9. PubMed PMID 19890584.
- ^ Bito T, Kanda E, Tanaka M, Fukunaga A, Horikawa T, Nishigori C. Cows milk-dependent exercise-induced anaphylaxis under the condition of a premenstrual or ovulatory phase following skin sensitization. Allergol Int. 2008 Dec;57(4):437-9. Epub 2008 Dec 1. PubMed PMID 18797181.
- ^ Fujii H, Kambe N, Fujisawa A, Kohno K, Morita E, Miyachi Y. Food-dependent exercise-induced anaphylaxis induced by low dose aspirin therapy. Allergol Int.2008 Mar;57(1):97-8. Epub 2008 Mar 1. PubMed PMID 18089939
- ^ Worth A, Sheikh A. Food allergy and atopic eczema. Curr Opin Allergy Clin Immunol. 2010 Apr 6. PMID 20375880
- ^ Immunotherapy for food allergy. Kurihara K. Allergol Int. 2010 Mar;59(1):9-14. Epub 2010 Feb 25. PMID 20093850
- ^ Thygarajan A, Burks AW. American Academy of Pediatrics recommendations on the effects of early nutritional interventions on the development of atopic disease. Curr Opin Pediatr. 2008 Dec;20(6):698-702. Review. PubMed PMID 19005338
- ^ Matsuura H, Ishiguro A, Abe H, Mamada Y, Suzuki T, Kohda K, Shimbo T. Elevation of plasma eotaxin levels in children with food allergy. Nihon Rinsho Meneki Gakkai Kaishi. 2009 Jun;32(3):180-5. PubMed PMID 19564714.
- ^ van den Oord RA, Sheikh A. Filaggrin gene defects and risk of developing allergic sensitisation and allergic disorders: systematic review and meta-analysis. BMJ. 2009 Jul 9;339:b2433. doi: 10.1136/bmj.b2433. Review. PubMed PMID 19589816
- ^ Suzuki Y, Ra C. Analysis of the mechanism for the development of allergic skin inflammation and the application for its treatment: aspirin modulation of IgE-dependent mast cell activation: role of aspirin-induced exacerbation of immediate allergy. J Pharmacol Sci. 2009 Jul;110(3):237-44. Review. PubMed PMID 19609060.
- ^ García BE, Gamboa PM, Asturias JA, López-Hoyos M, Sanz ML, Caballero MT, García JM, Labrador M, Lahoz C, Longo Areso N, Martínez Quesada J, Mayorga L, Monteseirín FJ; Clinical Immunology Committee; Spanish Society of Allergology and Clinical Immunology. Guidelines on the clinical usefulness of determination of specific immunoglobulin E to foods. J Investig Allergol Clin Immunol. 2009;19(6):423-32. PubMed PMID 20128415.
- ^ Caffarelli C, Baldi F, Bendandi B, Calzone L, Marani M, Pasquinelli P; on behalf of EWGPAG. Cow's milk protein allergy in children: a practical guide. Ital J Pediatr. 2010 Jan 15;36(1):5. PubMed PMID 20205781
- ^ Oh SY, Chung J, Kim MK, Kwon SO, Cho BH.Antioxidant nutrient intakes and corresponding biomarkers associated with the risk of atopic dermatitis in young children. Eur J Clin Nutr. 2010 Mar;64(3):245-52. Epub 2010 Jan 27. PMID 20104235
- ^ Food allergy and eosinophilic esophagitis: learning what to avoid. Hong S, Vogel NM. Cleve Clin J Med. 2010 Jan;77(1):51-9. Review.PMID 20048030
- ^ DeBrosse CW, Rothenberg ME. Allergy and eosinophil-associated gastrointestinal disorders (EGID). Curr Opin Immunol. 2008 Dec;20(6):703-8. Epub 2008 Sep 11. Review. PubMed PMID 18721876
- ^ Vicario M, Blanchard C, Stringer KF, Collins MH, Mingler MK, Ahrens A, Putnam PE, Abonia JP, Santos J, Rothenberg ME. Local B cells and IgE production in the oesophageal mucosa in eosinophilic oesophagitis. Gut. 2010 Jan;59(1):12-20. Epub . PubMed PMID 19528036
- ^ Domínguez-Ortega J, Pérez-Bedmar J, Rodríguez-Jiménez B, Butrón M, Kindelan C, Ledesma A. Eosinophilic esophagitis due to profilin allergy. J Investig Allergol Clin Immunol. 2009;19(4):338-9. PubMed PMID 19639743.
- ^ Cianferoni A, Spergel JM. Food allergy: review, classification and diagnosis. Allergol Int. 2009 Dec;58(4):457-66. Epub 2009 Oct 25. PubMed PMID 19847094.
- ^ Cytokine expression in CD3+ cells in an infant with food protein-induced enterocolitis syndrome (FPIES): case report. Mori F, Barni S, Cianferoni A, Pucci N, de Martino M, Novembre E. Clin Dev Immunol. 2009;2009:679381. PMID 20011655
- ^ Kabuki T, Joh K. Extensively hydrolyzed formula (MA-mi) induced exacerbation of food protein-induced enterocolitis syndrome (FPIES) in a male infant. Allergol Int. 2007 Dec;56(4):473-6. Epub 2007 Nov 1. PubMed PMID 17965587
- ^ Zapatero Remón L, Alonso Lebrero E, Martín Fernández E, Martínez Molero MI. Food-protein-induced enterocolitis syndrome caused by fish. Allergol Immunopathol (Madr). 2005 Nov-Dec;33(6):312-6. PubMed PMID 16371218
- ^ Nowak-Wegrzyn A, Sampson HA, Wood RA, Sicherer SH. Food protein-induced enterocolitis syndrome caused by solid food proteins. Pediatrics. 2003 Apr;111(4 Pt 1):829-35. PubMed PMID 12671120.
- ^ Allergic proctocolitis, food-induced enterocolitis: immune mechanisms, diagnosis and treatment. Boné J, Claver A, Guallar I, Plaza AM. Allergol Immunopathol (Madr). 2009 Jan-Feb;37(1):36-42. Review.PMID 19268060
- ^ Matthew I Fogg, Jonathan M. Spergel, Management of food allergies, Expert Opin Pharmacother. 2003 Jul;4(7):1025-37. Review.PMID 12831331
- ^ Pacor ML, Di Lorenzo G, Martinelli N, Mansueto P, Rini GB, Corrocher R., Monosodium benzoate hypersensitivity in subjects with persistent rhinitis, Allergy. 2004 Feb;59(2):192-7.PMID 14763933
- ^ Madan V, Walker SL, Beck MH., Sodium metabisulfite allergy is common but is it relevant?, Contact Dermatitis. 2007 Sep;57(3):173-6.PMID 17680867
- ^ Hong SP, Park HS, Lee MK, Hong CS., Oral provocation tests with aspirin and food additives in asthmatic patients., Yonsei Med J. 1989 Dec;30(4):339-45.PMID 2626838
- ^ Renwick AG., Structure-based thresholds of toxicological concern--guidance for application to substances present at low levels in the diet., Toxicol Appl Pharmacol. 2005 Sep 1;207(2 Suppl):585-91. Review.PMID 16019047
- ^ Chegini S, Metcalfe DD., Contemporary issues in food allergy: seafood toxin-induced disease in the differential diagnosis of allergic reactions., Allergy Asthma Proc. 2005 May-Jun;26(3):183-90. Review.PMID 16119031
- ^ Tsai PC, Huang W, Lee YC, Chan SH, Guo YL., Genetic polymorphisms in CYP1A1 and GSTM1 predispose humans to PCBs/PCDFs-induced skin lesions., Chemosphere. 2006 May;63(8):1410-8. Epub 2006 Apr 3.PMID 16580705
- ^ Di Prisco MC, Hagel I, Lynch NR, Jiménez JC, Rojas R, Gil M, Mata E., Association between giardiasis and allergy., Ann Allergy Asthma Immunol. 1998 Sep;81(3):261-5.PMID 9759805
- ^ Arvola T, Ruuska T, Keränen J, Hyöty H, Salminen S, Isolauri E., Rectal bleeding in infancy: clinical, allergological, and microbiological examination., Pediatrics. 2006 Apr;117(4):e760-8.PMID 16585287
- ^ Gonzalez-Quintela A, Gude F, Boquete O, Aguilera A, Rey J, Meijide LM, Fernandez-Merino MC, Vidal C., Association of hepatitis A virus infection with allergic sensitization in a population with high prevalence of hepatitis A virus exposure., Allergy. 2005 Jan;60(1):98-103.PMID 15575938
- ^ Food-induced anaphylaxis. Celestin J, Heiner DC. West J Med. 1993 Jun;158(6):610-1. PMID 8337856
- ^ Milk-induced pulmonary disease in infants (Heiner syndrome). Moissidis I, Chaidaroon D, Vichyanond P, Bahna SL. Pediatr Allergy Immunol. 2005 Sep;16(6):545-52. PMID 16176405
- ^ Cummings AJ, Knibb RC, King RM, Lucas JS.The psychosocial impact of food allergy and food hypersensitivity in children, adolescents and their families: a review.Allergy. 2010 Feb 22. [Epub ahead of print] PMID 20180792
- ^ Lind R, Lied GA, Lillestøl K, Valeur J, Berstad A.Do psychological factors predict symptom severity in patients with subjective food hypersensitivity?Scand J Gastroenterol. 2010 May 2. [Epub ahead of print] PMID 20433401
- ^ Patten SB, Williams JV.Self-reported allergies and their relationship to several Axis I disorders in a community sample. Int J Psychiatry Med. 2007;37(1):11-22. PMID 17645194
- ^ Lillestøl K, Berstad A, Lind R, Florvaag E, Arslan Lied G, Tangen T.Anxiety and depression in patients with self-reported food hypersensitivity.Gen Hosp Psychiatry. 2010 Jan-Feb;32(1):42-8. Epub 2009 Oct 1.PMID 20114127
- ^ Herbert LJ, Dahlquist LM.Perceived history of anaphylaxis and parental overprotection, autonomy, anxiety, and depression in food allergic young adults. J Clin Psychol Med Settings. 2008 Dec;15(4):261-9. Epub 2008 Sep 30. PMID 19104982
- ^ http://www.aicpiemonte.it/uploads/news/57_file.pdf
- ^ Postolache TT, Komarow H, Tonelli LH.Allergy: a risk factor for suicide?Curr Treat Options Neurol. 2008 Sep;10(5):363-76. PMID 18782509
- ^ http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/DrugSafetyInformationforHeathcareProfessionals/ucm165489.htm
- ^ http://www.carloanibaldi.com/terapia/schede/FASTJEKT.htm,asp
- ^ http://www.torrinomedica.it/farmaci/schedetecniche/FASTJEKT.asp
- ^ http://www.aslsa1.it/cms/image_re/Fastjeckt.pdf
- ^ http://www.torrinomedica.it/farmaci/schedetecniche/FASTJEKT.asp
- ^ http://www.aslsa1.it/cms/image_re/Fastjeckt.pdf
- ^ http://www.guidausofarmaci.it/ricerca_nel_sito.asp?x=0&y=0&ricerca=antistaminici.asp it
- ^ AR Gupte, PV Draganov. Esofagite eosinofila. World J Gastroenterol. 2009 7 gennaio, 15 (1) :17-24. Review. PubMed PMID 19115464.
- ^ http://www.carloanibaldi.com/terapia/schede/GASTROFRENAL.htm.asp it] [http://www.drugs.com/ingredient/cromolyn.html.asp
- ^ http://www.guidausofarmaci.it/scheda.asp?livello_nuovo=12.02.01.03%20%28Cromoglicati%29&idsez=26&titolo=Sodio%20cromoglicato.asp it
- ^ (EN) Patriarca G. et al., Food allergy and food intolerance: diagnosis and treatment. Intern Emerg Med (2009) 4:11–24. DOI 10.1007/s11739-008-0183-6
- ^ Liacouras CA, Ruchelli E. Eosinophilic esophagitis. Curr Opin Pediatr. 2004Oct;16(5):560-6. Review. PMID 15367851.
- ^ Martín de Carpi J, Gómez Chiari M, Castejón Ponce E, Masiques Mas ML, VilarEscrigas P, Varea Calderón V. [Increasing diagnosis of eosinophilic esophagitisin Spain]. An Pediatr (Barc). 2005 Apr;62(4):333-9. Spanish. PMID 15826562.
- ^ Pérez Millán A, Martín-Lorente JL, López-Morante A, Yuguero L, Sáez-Royuela F. Subserosal eosinophilic gastroenteritis treated efficaciously with sodium cromoglycate. Dig Dis Sci. 1997; 42:342-44.PMID
- ^ Moots RJ, Prouse P, Gumpel IM. Near fatal eosinophilic gastroenteritis responding to oral sodium cromoglycate. Gut. 1995;29:1282-85. PMID
- ^ Van Dellen RG, Lewis JC. Oral administration of cromolyn in a patient with protein-losing enteropathy, food allergy and eosinophilic gastroenteritis. Mayo Clin Proc. 1994;69:441-4.PMID
- ^ (EN) Ventura A, et al. Soy allergy and DSCG in atopic eczema: "much ado about nothing"? Pediatr Med Chir 1996;18(3):283–8. PMID 8858643
- ^ (EN) Lindskov R, Knudsen L. Oral disodium cromoglycate treatment of atopic dermatitis. Allergy 1983;38(3):161–5. PMID 6405650
- ^ (EN) Moore C, et al., Topical sodium cromoglycate in the treatment of moderate-to-severe atopic dermatitis. Ann Allergy Asthma Immunol 1998;81(5 Pt 1):452–8. PMID 9860040
- ^ (EN) Ariyanayagam M, et al., Topical sodium cromoglycate in the management of atopic eczema – a controlled trial. Br J Dermatol 1985;112(3):343–8. PMID 3919754
- ^ http://www.azurpharma.com/pdf/gastrocrom/Gastrocrom-PI-Azur.pdf
- ^ (EN) Huang CK, et al (1999) Strain-dependent protection from allergic reactions by peanut allergen plasmid DNA immunization in mice (Abstract). J Allergy Clin Immunol 103:S238. PMID
- ^ (EN) Majamaa H, Isolauri E (1997) Probiotics: a novel approach in the management of food allergy. J Allergy Clin Immunol 99:179–185 . PMID
- ^ (EN) Frick OL, et al., (2001) Allergen immunotherapy with heat-killed Listeria monocytogenes (HKL) as adjuvant prevents allergic reactions in highly food sensitized dogs [Abstract]. J Allergy Clin Immunol 107:S232. PMID
- ^ (EN) Li XM, et al., (2001) Food allergy herbal formula-1 (FAHF-1) blocks peanut-induced anaphylaxis in a murine model. J Allergy Clin Immunol 108:639–646. PMID
- ^ Wood RA., The natural history of food allergy., in Pediatrics, 111(6 Pt 3), Jun 2003, pp. 1631-7.
- ^ Skripak JM, Matsui EC, Mudd K, Wood RA., The natural history of IgE-mediated cow's milk allergy., in J Allergy Clin Immunol., 120(5), Nov 2007, pp. 1172-7.
- ^ Savage JH, Matsui EC, Skripak JM, Wood RA., The natural history of egg allergy., in J Allergy Clin Immunol., 120(6), Dec 2007, pp. 1413-7.
- ^ leischer DM, Conover-Walker MK, Christie L, Burks AW, Wood RA., The natural progression of peanut allergy: Resolution and the possibility of recurrence, in J Allergy Clin Immunol., 112(1), Jul2003, pp. 183-9.
- ^ Fleischer DM, Conover-Walker MK, Christie L, Burks AW, Wood RA., The natural progression of peanut allergy: Resolution and the possibility of recurrence., in J Allergy Clin Immunol., 112(1), Jul 2003, pp. 183-9.
- ^ Mehr S, Kakakios A, Frith K, Kemp AS., Food protein-induced enterocolitis syndrome: 16-yearexperience., in Pediatrics., 123(3), Mar 2009, pp. e459-64.
- ^ Assa'ad AH, Putnam PE, Collins MH, Akers RM, Jameson SC, Kirby CL, et al., Pediatric patients with eosinophilic esophagitis: an 8-year follow-up., in J Allergy Clin Immunol., 119(3), Mar 2007, pp. 731-8.
- ^ Pastorello EA, Stocchi L, Pravettoni V, et al., Role of the elimination diet in adults with food allergy., in J Allergy Clin Immunol., 84(4 Pt 1), Oct 1989, pp. 475-83.
- ^ Lemon-Mule H, Sampson HA, Sicherer SH, Shreffler WG, Noone S, Nowak-Wegrzyn A., Immunologic changes in children with egg allergy ingesting extensively heated egg, in J Allergy Clin Immunol., 122 (5), Nov 2008, pp. 977-983.
- ^ Lemon-Mulé H, Sampson HA, Sicherer SH, Shreffler WG, Noone S, Nowak-Wegrzyn A. Immunologic changes in children with egg allergy ingesting extensively heated egg. J Allergy Clin Immunol. 2008 Nov;122(5):977-983.e1. PMID 18851876
- ^ (FR) http://www.who.int/nutrition/publications/infantfeeding/gs_infant_feeding_fre.pdf
- ^ Zeiger RS, Heller S,, The development and prediction of atopy in high-risk children: follow-up at age seven years in a prospective randomized study of combined maternal and infant food allergen avoidance [archive], in J Allergy Clin Immunol., vol. 95, 1995, pp. 1179-1190., DOI:0091-6749/95.
- ^ Ngan J, Kind LS,, Suppressor T cells for IgE and IgG in Peyer's patches of mice made tolerant by the oral administration of ovalbumin, in J Immunol, vol. 120, 1978, pp. 861-865.
- ^ Poole JA, Barriga K, Leung DY et al.,, Timing of initial exposure to cereal grains and the risk of wheat allergy, in Pediatrics, vol. 117, 2006, pp. 2175-2182, DOI:10.1542/peds.2005-1803.
- ^ James JM, Burks AW, Roberson PK, Sampson HA. Safe administration of the measles vaccine to children allergic to eggs. N Engl J Med. May 11 1995;332(19):1262-6. PMID 9821418
- ^ James JM, Zeiger RS, Lester MR, et al. Safe administration of influenza vaccine to patients with egg allergy. J Pediatr. Nov 1998;133(5):624-8. PMID 9821418
- ^ (EN) American College of Allergy, Asthma, & Immunology. Food allergy: a practice parameter. Ann Allergy Asthma Immunol 2006 Mar;96(3 Suppl 2):S1-68. . PMID 16597066
- ^ (EN) Nowak-Wegrzyn A, Assa'ad AH, Bahna SL, Bock SA, Sicherer SH, Teuber SS; Work Group report: oral food challenge testing. Adverse Reactions to Food Committee of American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2009 Jun;123(6 Suppl):S365-83. PMID 19500710
- ^ (EN) Rancé F, et al., SFAIC and SP2A Workgroup on OFC in Children Oral food challenge in children: an expert review.Eur Ann Allergy Clin Immunol. 2009 Apr;41(2):35-49. PMID 19585859
- ^ (EN) Henzgen M, Ballmer-Weber BK, Erdmann S, Fuchs T, Kleine-Tebbe J, Lepp U, Niggemann B, Raithel M, Reese I, Saloga J, Vieths S, Zuberbier T, Werfel T; German Society of Allergology and Clinical Immunology (DGAKI); Physicians' Association of German Allergologists (ADA); Society of Pediatric Allergology (GPA); Swiss Society of Allergology. Skin testing with food allergens. Guideline of the German Society of Allergology and Clinical Immunology (DGAKI), the Physicians' Association of German Allergologists (ADA) and the Society of Pediatric Allergology (GPA) together with the Swiss Society of Allergology.J Dtsch Dermatol Ges. 2008 Nov;6(11):983-8. PMID 18992038
- ^ (EN) Bernstein IL, Li JT, Bernstein DI, Hamilton R, Spector SL, Tan R, Sicherer S, Golden DB, Khan DA, Nicklas RA, Portnoy JM, Blessing-Moore J, Cox L, Lang DM, Oppenheimer J, Randolph CC, Schuller DE, Tilles SA, Wallace DV, Levetin E, Weber R, American Academy of Allergy, Asthma and Immunology, American College of Allergy, Asthma and Immunology. Allergy diagnostic testing: an updated practice parameter. Part 2. Ann Allergy Asthma Immunol 2008 Mar;100(3 Suppl 3):S66-S121. PMID 18431959
- ^ GT Furuta, Forbes D, Boey C, Dupont C, Putnam P, Roy S, Sabrá A, SalvatierraA, Yamashiro Y, Husby S;, Eosinophilic Gastrointestinal Diseases Working Group.Eosinophilic gastrointestinal diseases (EGIDs), in J Pediatr Gastroenterol Nutr., vol. 47, n. 2, Aug 2008, pp. 234-8., PMID 18664881..
- ^ (EN) Greer FR, Sicherer SH, Burks AW; American Academy of Pediatrics Committee on Nutrition; American Academy of Pediatrics Section on Allergy and Immunology. Effects of early nutritional interventions on the development of atopic disease in infants and children: the role of matern al dietary restriction, breastfeeding, timing of introduction of complementary foods, and hydrolyzed formulas. Pediatrics. 2008 Jan;121(1):183-91. PMID 18166574
- ^ (EN) .American Academy of Allergy, Asthma and Immunology; American College of Allergy, Asthma and Immunology.Contact dermatitis: a practice parameter.Ann Allergy Asthma Immunol. 2006 Sep;97(3 Suppl 2):S1-38. PMID 17039663
- ^ M. Piquer-Gibert, Plaza-Martín A, Martorell-Aragonés A, Ferré-Ybarz L,Echeverría-Zudaire L, Boné-Calvo J, Nevot-Falcó S;, Food Allergy Committee of the Sociedad Española de Inmunología Clínica y Alergología Pediátrica.Recommendations for administering the triple viral vaccine and antiinfluenzavaccine in patients with egg allergy., in Allergol Immunopathol (Madr), vol. 35, n. 2, Sep-Oct 2007, pp. 209-12., PMID 17923075.
- ^ A. Fiocchi, Assa'ad A, Bahna S; Adverse Reactions to Foods Committee; American College of Allergy, Asthma and Immunology., Food allergy and the introduction ofsolid foods to infants: a consensus document. Adverse Reactions to FoodsCommittee, American College of Allergy, Asthma and Immunology, in Ann Allergy Asthma Immunol., vol. 97, n. 1, Jul 2006, pp. 10-20., PMID 16892776.
- ^ (EN) .[No authors listed] School guidelines for managing students with food allergies. School Nurse News. 2006 May;23(3):13-4. PMID 16736988
- ^ http://ec.europa.eu/food/food/labellingnutrition/foodlabelling/fl_com2003-89_it.pdf
- ^ http://eur-lex.europa.eu/Notice.do?mode=dbl&lang=en&ihmlang=en&lng1=en,it&lng2=bg,cs,da,de,el,en,es,et,fi,fr,hu,it,lt,lv,mt,nl,pl,pt,ro,sk,sl,sv,&val=460213:cs&page=
- ^ http://ec.europa.eu/food/food/labellingnutrition/foodlabelling/guidelines_6_10.pdf
- ^ http://ec.europa.eu/food/food/labellingnutrition/foodlabelling/2nd_guid_art6_11_200013ec_en.pdf
- ^ a b E prodotti derivati, purché il processo subito non aumenti il livello di allergenicità valutato dall'EFSA per il prodotto di base dal quale sono derivati.
- ^ http://www.altalex.com/index.php?idnot=49502