Acido 4-idrossibenzoico
| Acido 4-idrossibenzoico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido 4-idrossibenzoico | |
| Abbreviazioni | |
| 4-HBA; PHBA | |
| Nomi alternativi | |
| acido para idrossibenzoico, acidp p-idrossibenzoico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H6O3 |
| Massa molecolare (u) | 138,12 |
| Numero CAS | |
| Numero EINECS | 202-804-9 |
| PubChem | 135 |
| DrugBank | DB04242 |
| SMILES | C1=CC(=CC=C1C(=O)O)O |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 318 - 335 |
| Consigli P | 280 - 305 + 351 + 338 + 310 |
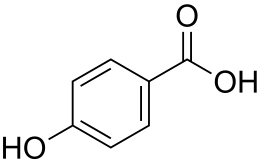
L'acido 4-idrossibenzoico in sigla 4-HBA, noto anche come acido p-idrossibenzoico o paraidrossibenzoico, è un acido monoidrossibenzoico.
La struttura è costituita da un anello benzenico con un gruppo carbossilico (-COOH), come nell'acido benzoico, e un gruppo idrossilico (-OH) come sostituente in posizione 4 dell'anello benzenico. È un solido cristallino bianco leggermente solubile in acqua e cloroformio ma più solubile in solventi organici polari come alcol, etere e acetone. L'acido 4-idrossibenzoico come altri acidi fenolici è particolarmente bioattivo, agendo come antimicrobico oltre che come blando antiossidante. È noto per il suo impiego come substrato nella produzione dei suoi esteri, classificati come parabeni, che vengono utilizzati come conservanti nei cosmetici e in alcune formulazioni farmaceutiche. Come conservante cosmetico ha nome INCI: 4-HYDROXYBENZOIC ACID. È un isomero dell'acido 3-idrossibenzoico e dell'acido 2-idrossibenzoico, noto come acido salicilico, precursore dell'aspirina.[1]
Il 4-HBA, con una nota aromatica di nocciola e fenolo, dal JECFA e dal regolamento UE è classificato come aroma in ambito alimentare.[2][3]
L'acido 4-idrossibenzoico o suoi esteri e glucosidi, sono presenti in molte specie viventi appartenenti a famiglie e generi diversi: dai batteri alle alghe, dai funghi all'uomo. Negli esseri umani, l'acido 4-idrossibenzoico è coinvolto nella biosintesi dell'ubichinone.
Metabolismo[modifica | modifica wikitesto]
In varie specie viventi sono state individuate molte reazioni biochimiche di sintesi (anabolismo) e di degradazione (catabolismo) del 4-HBA. Il 4-HBA è inoltre intermedio in alcune reazioni biochimiche che avvengono in natura.
Anabolismo[modifica | modifica wikitesto]
La corismato liasi[4] è un enzima che trasforma il corismato in 4-idrossibenzoato e piruvato. Questo enzima catalizza il primo passo nella biosintesi dell'ubichinone in Escherichia coli e altri batteri Gram-negativi.
La benzoato 4-monoossigenasi[5] è un enzima che utilizza benzoato, NADPH, H + e O 2 per produrre 4-idrossibenzoato, NADP + e H 2 O. Questo enzima può essere trovato in Aspergillus niger.
L'enzima 4-metossibenzoato monoossigenasi (O-demetilazione)[6] trasforma il 4-metossibenzoato, un accettore di elettroni AH 2 e O 2 in 4-idrossibenzoato, formaldeide, il prodotto di riduzione A e H 2 O. Questo enzima partecipa alla degradazione del 2,4-diclorobenzoato in Pseudomonas putida.
L'enzima 4-idrossibenzaldeide deidrogenasi[7] utilizza 4-idrossibenzaldeide, NAD + e H 2 O per produrre 4-idrossibenzoato, NADH e H +. Questo enzima partecipa alla degradazione del toluene e dello xilene in batteri come Pseudomonas mendocina. Si trova anche nelle carote (Daucus carota).
L'enzima che il 2,4'-diidrossiacetofenone diossigenasi[8] trasforma il 2,4'-diidrossiacetofenone e l'O 2 in 4-idrossibenzoato e formiato. Questo enzima partecipa alla degradazione del bisfenolo A. Può essere trovato nelle specie Alcaligenes.
L'enzima 4-clorobenzoato dealogenasi[9] utilizza 4-clorobenzoato e H 2 O per produrre 4-idrossibenzoato e cloruro. Può essere trovato nelle specie Pseudomonas.
L'enzima 4-idrossibenzoil-CoA tioesterasi[10] utilizza 4-idrossibenzoil-CoA e H 2 O per produrre 4-idrossibenzoato e CoA. Questo enzima partecipa alla degradazione del 2,4-diclorobenzoato. Può essere trovato nelle specie Pseudomonas.
Catabolismo[modifica | modifica wikitesto]
L'enzima 4-idrossibenzoato 1-idrossilasi[11] trasforma il 4-idrossibenzoato, NAD (P) H, 2 H + e O 2 in idrochinone, NAD (P) +, H 2 O e CO 2. Questo enzima partecipa alla degradazione del 2,4-diclorobenzoato. Può essere trovato nella parapsilosi da Candida.
L'enzima 4-idrossibenzoato 3-monoossigenasi trasforma 4-idrossibenzoato, NADPH, H + e O 2 in protocatechuate, NADP + e H 2 O. Questo enzima partecipa alla degradazione del benzoato tramite idrossilazione e degradazione del 2,4-diclorobenzoato. Può essere trovato in Pseudomonas putida e Pseudomonas fluorescens.
L'enzima 4-idrossibenzoato 3-monoossigenasi[12] utilizza 4-idrossibenzoato, NADH, NADPH, H + e O 2 per produrre 3,4-diidrossibenzoato (acido protocatecuico), NAD +, NADP + e H 2 O Questo enzima partecipa alla degradazione del benzoato tramite idrossilazione e degradazione del 2,4-diclorobenzoato. Può essere trovato in Corynebacterium cyclohexanicum e in Pseudomonas sp.
L'enzima 4-idrossibenzoato decarbossilasi[13] utilizza 4-idrossibenzoato per produrre fenolo e CO 2. Questo enzima partecipa alla degradazione del benzoato tramite la legatura del coenzima A (CoA). Può essere trovato in Klebsiella aerogenes (Aerobacter aerogenes).
L'enzima 4-idrossibenzoato — CoA ligasi[14] trasforma ATP, 4-idrossibenzoato e CoA per produrre AMP, difosfato e 4-idrossibenzoil-CoA. Questo enzima partecipa alla degradazione del benzoato tramite legatura CoA. Può essere trovato in Rhodopseudomonas palustris.
Coniochaeta hoffmannii è un patogeno delle piante che abita comunemente un terreno fertile. È noto per metabolizzare composti aromatici a basso peso molecolare, come l'acido p- idrossibenzoico.
Come intermedio[modifica | modifica wikitesto]
L'enzima 4-idrossibenzoato polipreniltransferasi[15] utilizza un poliprenil difosfato e 4-idrossibenzoato per produrre difosfato e 4-idrossi-3-poliprenilbenzoato. Questo enzima con il 4-HBA legato ad un radicale poliprenico partecipa alla biosintesi dell'ubichinone.
L'enzima 4-idrossibenzoato geraniltransferasi[16] utilizza geranil difosfato e 4-idrossibenzoato per produrre 3-geranil-4-idrossibenzoato e difosfato. Biosinteticamente, l'alcanina è prodotta nelle piante dagli intermedi acido 4-idrossibenzoico e geranil pirofosfato. Questo enzima è coinvolto nella biosintesi della shikonina. Può essere trovato in Lithospermum erythrorhizon.
L'enzima 4-idrossibenzoato — CoA ligasi[14] utilizza ATP, 4-idrossibenzoato e CoA per produrre AMP, difosfato e 4-idrossibenzoil-CoA. Si trova nella Thauera aromatica.
L'enzima 4-idrossibenzoato 4- O- beta - d -glucosiltransferasi[17] trasforma l'UDP-glucosio e il 4-idrossibenzoato in UDP e 4- (beta - d -glucosilossi) benzoato. Si trova nel polline di Pinus densiflora.
Sono note altre reazioni[18][19] biochimiche sia per la biosintesi di metaboliti secondari che di fenilpropanoidi.
Occorrenza in natura[modifica | modifica wikitesto]
Il 4-HBA è stato isolato da radici e parti aeree di molte piante; ad esempio: Vitex agnus-castus, Vitex negundo, Vitis vinifera, Hypericum perforatum, Daucus carota, Elaeis guineensis, Euterpe oleracea, Fagara macrophylla, Xanthophyllum rubescens, Paratecoma peroba, Tabebuia impetiginosa, Pterocarpus santalinus, Catalpa bignonioides, Areca catechu, Roystonea regia, Mespilus germanica, Arabidopsis thaliana, Phyllanthus acidus,Macrotyloma uniflorum[20][21][22][23][24][25][26][27]
Si trova anche in varie alghe: Spongiochloris spongiosa, Anacystis nidulans, Sargassum tenerrimum, Sargassum ilicifolium, Sargassum cinereum.[28]
Si suppone che sia uno dei componenti attivi di un fungo che ha avuto per lungo tempo un utilizzo medicinale: Ganoderma lucidum.[29] È stato isolato anche in molti funghi di vari generi: Agaricus, Boletus, Cantharellus, Clitocybe, Laccaria, Lactarius, Pleurotus, Russula, Suillus, Termitomyces, ecc.[30]
Il metabolismo di vari batteri comporta la produzione di 4-HBA: Cryptanaerobacter phenolicus, Clostridium hydroxybenzoicum, Sporotomaculum hydroxybenzoicum.[31][32]
Il Coniochaeta hoffmannii è un patogeno delle piante che abita comunemente un terreno fertile. È noto per metabolizzare composti aromatici a basso peso molecolare, come l'acido p- idrossibenzoico.
Occorrenza negli alimenti[modifica | modifica wikitesto]
La grande diffusione in natura del 4-HBA oltre che al massivo utilizzo di suoi esteri nella cosmesi hanno prodotto la necessità di definirne i livelli di esposizione nell'uomo. Molte ricerche hanno rilevato le concentrazioni di 4-HBA negli alimenti.
| Concentrazioni (mg/100g) di 4-HBA in alcuni alimenti[33][34][35] | |
|---|---|
| Mirtillo rosso Vaccinium parvifolium | 55,3 |
| Mirtillo Vaccinium virgatum | 51,835 |
| Coriandolo | 41,75 |
| Cipolla Allium cepa | 10,7 |
| Nespole del Giappone Eriobotrya japonica | 4,656 |
| Mirtillo gigante americano Vaccinium corymbosum | 4,32 |
| Oliva | 3,699 |
| Fragola | 3,267 |
| Bietola | 3,225 |
| Carota | 2,779 |
| Melissa | 2,300 |
| Camomilla tedesca Matricaria recutita | 2,000 |
| Lampone rosso Rubus idaeus | 1,567 |
| Birra | 1,475 |
| Dragoncello Artemisia dracunculus | 1,400 |
| Arachidi | 1,400 |
| Rafano | 1,400 |
| Timo comune | 1,400 |
| Basilico dolce | 1,300 |
| Prezzemolo | 1,300 |
| Mirtillo rosso americano Vaccinium macrocarpon | 1,291 |
| Mirtillo sempreverde Vaccinium ovatum | 1,215 |
| Issopo | 1,200 |
| Salvia comune | 1,200 |
| Cicoria | 1,100 |
| Mirtillo palustre Vaccinium uliginosum | 0,895 |
| Mirtillo rosso europeo Vaccinium oxycoccos | 0,78 |
| Rosmarino | 0,7 |
| Mirtillo rosso a cascata Vaccinium deliciosum | 0,69500 |
| Maggiorana dolce | 0,6 |
| pane di segale | 0,425 |
| Ribes nero | 0,3 |
| Frumento tenero | 0,25 |
| Lenticchie | 0,21937 |
| Avena | 0,213 |
| Aceto | 0,19831 |
| Riso | 0,19587 |
| Mais | 0,16514 |
| Mirtillo a foglia ovale Vaccinium ovalifolium | 0,16333 |
| Mirtillo nero americano Gaylussacia baccata | 0,15333 |
| Vino | 0,15332 |
| Pompelmo | 0,1075 |
Produzione[modifica | modifica wikitesto]
L'acido 4-idrossibenzoico è prodotto commercialmente da fenato di potassio e anidride carbonica in una reazione di Kolbe-Schmitt:
In laboratorio la produzione può avvenire riscaldando il salicilato di potassio con carbonato di potassio a 240 °C, seguito dal trattamento in ambiente acido (acido cloridrico).
Può anche essere ottenuto biologicamente, attraverso la fermentazione del glucosio da batteri, in genere E. coli geneticamente modificato, ma anche non geneticamente modificato. Per preparare il 4-HBA, può essere utilizzato un microbo ingegnerizzato per convertire il glucosio in acido shikimico. Tutti i sette atomi di carbonio dell'acido shikimico derivano dal glucosio. Dopo la purificazione dal brodo cellulare, l'acido shikimico viene convertito cataliticamente in 4-HBA.[36]Tutti e sette gli atomi di carbonio nel prodotto derivano dall'acido shikimico.
Utilizzo[modifica | modifica wikitesto]
Oltre che come substrato per la massiva produzione di parabeni il 4-HBA ha vari utilizzi industriali come intermedio nella produzione di pesticidi, antimicrobici e farmaci.
Vectran è una fibra prodotta, filata da un polimero a cristalli liquidi. Chimicamente è un poliestere aromatico prodotto dalla policondensazione di acido 4-idrossibenzoico e acido 6-idrossinaftalene-2-carbossilico. La fibra ha dimostrato di esibire una forte capacità schermante le radiazioni.
Il 4-HBA può essere convertito in p-acetossibenzoil-cloruro. Questo cloruro reagisce con il fenolo per dare, dopo la deacetilazione, 4,4′-diidrossibenzofenone, un additivo per materie plastiche in grado di filtrare la radiazione ultravioletta.
Esempi di farmaci a base di 4-HBA includono nifuroxazide, orthocaine, ormeloxifene e proxymetacaine.
Tossicologia[modifica | modifica wikitesto]
L'utilizzo massivo dell'acido 4-idrossibenzoico nella produzione di conservanti cosmetici o di additivi alimentari è in parte dovuto alla sua tossicità acuta molto bassa: LD 50 è 2200 mg / kg nei topi (orale).
Come precursore, ma anche come metabolita, dei parabeni è stato oggetto di indagine per una sospetta attività estrogenica. Uno studio valido e affidabile con somministrazione ripetuta di dosaggi orali fino a 1000 mg / kg di peso corporeo utilizzando ratti (42 giorni) e studi validi e affidabili su ratti e topi femmine immaturi con somministrazione ripetuta di dosaggi fino a 100 mg / kg di peso corporeo per 3 giorni consecutivi (saggi uterotrofici) erano disponibili e principalmente utilizzati per la valutazione.
Lo studio di tossicità a dose ripetuta nei ratti (Nagao et al., 1997) non ha indicato alcun effetto sugli organi riproduttivi di ratti femmine e maschi o / e aspetti funzionali della fertilità da parte dell'acido p-idrossibenzoico. I test uterotrofici affidabili (Twomey 2000b, Hossaini et al. 2000) sono risultati negativi per l'acido p-idrossenzoico in ratti e topi in concentrazioni fino a 100 mg / kg di peso corporeo.
In sintesi, esiste un numero sufficiente di studi sufficientemente affidabili e validi per la valutazione dei possibili effetti estrogenici dell'acido p-idrossibenzoico. Nessuno di questi studi ha mostrato un effetto estrogenico dell'acido p-idrossibenzoico.[37][38]
Note[modifica | modifica wikitesto]
- ^ Ministry of Environment of the Czech Republic - SUBSTANCE EVALUATION REPORT 4-hydroxybenzoic acid, su echa.europa.eu.
- ^ HYDROXY- AND ALKOXY-SUBSTITUTED BENZYL DERIVATIVES (JECFA Food Additives Series 48), su inchem.org. URL consultato il 17 marzo 2021.
- ^ REGOLAMENTO DI ESECUZIONE (UE) N. 872/2012 DELLA COMMISSIONE del 1 ottobre 2012 che adotta l'elenco di sostanze aromatizzanti di cui al regolamento (CE) n. 2232/96, su eur-lex.europa.eu.
- ^ KEGG REACTION: R01302, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01295, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01306, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01293, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01305, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01307, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01301, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01297, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01298, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01238, su genome.jp. URL consultato il 17 marzo 2021.
- ^ a b KEGG REACTION: R01300, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R05000, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R09040, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01304, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R01308, su genome.jp. URL consultato il 17 marzo 2021.
- ^ KEGG REACTION: R05603, su genome.jp. URL consultato il 17 marzo 2021.
- ^ Dr. Duke's Phytochemical and Ethnobotanical Databases - 4-HYDROXY-BENZOIC-ACID, su phytochem.nal.usda.gov. URL consultato il 13 marzo 2021 (archiviato dall'url originale il 26 marzo 2021).
- ^ Human Metabolome Database: Showing metabocard for 4-Hydroxybenzoic acid (HMDB0000500), su hmdb.ca. URL consultato il 14 marzo 2021.
- ^ Jiri Gruz, Faik Ahmet Ayaz e Hülya Torun, Phenolic acid content and radical scavenging activity of extracts from medlar (Mespilus germanica L.) fruit at different stages of ripening, in Food Chemistry, vol. 124, n. 1, 2011-01, pp. 271-277, DOI:10.1016/j.foodchem.2010.06.030. URL consultato il 14 marzo 2021.
- ^ Debabrata Sircar e Adinpunya Mitra, Accumulation of p-hydroxybenzoic acid in hairy roots of Daucus carota 2: Confirming biosynthetic steps through feeding of inhibitors and precursors, in Journal of Plant Physiology, vol. 166, n. 13, 2009-09, pp. 1370-1380, DOI:10.1016/j.jplph.2009.02.006. URL consultato il 14 marzo 2021.
- ^ Khim Phin Chong, Stephen Rossall e Markus Atong, In Vitro Antimicrobial Activity and Fungitoxicity of Syringic Acid, Caffeic Acid and 4-hydroxybenzoic Acid against Ganoderma Boninense, in Journal of Agricultural Science, vol. 1, n. 2, 17 novembre 2009, DOI:10.5539/jas.v1n2p15. URL consultato il 14 marzo 2021.
- ^ Vidhu Aeri, D B Anantha Narayana e Dharya Singh, Powdered Crude Drug Microscopy of Leaves and Barks, Elsevier, 2020, pp. 297-302, ISBN 978-0-12-818092-1. URL consultato il 14 marzo 2021.
- ^ Moumita Chakraborty, Kingsuk Das e Gargi Dey, Unusually high quantity of 4-hydroxybenzoic acid accumulation in cell wall of palm mesocarps, in Biochemical Systematics and Ecology, vol. 34, n. 6, 2006-06, pp. 509-513, DOI:10.1016/j.bse.2005.11.011. URL consultato il 14 marzo 2021.
- ^ Lisbeth A. Pacheco-Palencia, Susanne Mertens-Talcott e Stephen T. Talcott, Chemical composition, antioxidant properties, and thermal stability of a phytochemical enriched oil from Acai (Euterpe oleracea Mart.), in Journal of Agricultural and Food Chemistry, vol. 56, n. 12, 25 giugno 2008, pp. 4631-4636, DOI:10.1021/jf800161u. URL consultato il 13 marzo 2021.
- ^ Masuma M. Hakim e Illa C. Patel, A review on phytoconstituents of marine brown algae, in Future Journal of Pharmaceutical Sciences, vol. 6, n. 1, 9 dicembre 2020, p. 129, DOI:10.1186/s43094-020-00147-6. URL consultato il 14 marzo 2021.
- ^ Sandrina A. Heleno, Isabel C. F. R. Ferreira e Ana P. Esteves, Antimicrobial and demelanizing activity of Ganoderma lucidum extract, p-hydroxybenzoic and cinnamic acids and their synthetic acetylated glucuronide methyl esters, in Food and Chemical Toxicology: An International Journal Published for the British Industrial Biological Research Association, vol. 58, 2013-08, pp. 95-100, DOI:10.1016/j.fct.2013.04.025. URL consultato il 13 marzo 2021.
- ^ Pavel Kalač, Edible mushrooms: chemical composition and nutritional value, 2016, pp. 92-98, ISBN 978-0-12-804502-2, OCLC 936379304. URL consultato il 13 marzo 2021.
- ^ Xiaoming Zhang e Juergen Wiegel, Reversible Conversion of 4-Hydroxybenzoate and Phenol by Clostridium hydroxybenzoicum, in Applied and Environmental Microbiology, vol. 60, n. 11, 1994-11, pp. 4182-4185. URL consultato il 14 marzo 2021.
- ^ Pierre Juteau, Valérie Côté e Marie-France Duckett, Cryptanaerobacter phenolicus gen. nov., sp. nov., an anaerobe that transforms phenol into benzoate via 4-hydroxybenzoate, in International Journal of Systematic and Evolutionary Microbiology, vol. 55, Pt 1, 2005-01, pp. 245-250, DOI:10.1099/ijs.0.02914-0. URL consultato il 13 marzo 2021.
- ^ Showing all foods in which the polyphenol 4-Hydroxybenzoic acid is found - Phenol-Explorer, su phenol-explorer.eu. URL consultato il 13 marzo 2021.
- ^ Showing Compound 4-Hydroxybenzoic acid (FDB010508) - FooDB, su foodb.ca. URL consultato il 13 marzo 2021.
- ^ (EN) Francisco A. Tomás‐Barberán e Michael N. Clifford, Dietary hydroxybenzoic acid derivatives – nature, occurrence and dietary burden, in Journal of the Science of Food and Agriculture, vol. 80, n. 7, 2000, pp. 1024-1032, DOI:10.1002/(SICI)1097-0010(20000515)80:73.0.CO;2-S. URL consultato il 14 marzo 2021.
- ^ (EN) Norma Francenia Santos-Sánchez, Raúl Salas-Coronado e Beatriz Hernández-Carlos, Shikimic Acid Pathway in Biosynthesis of Phenolic Compounds, in Plant Physiological Aspects of Phenolic Compounds, 31 gennaio 2019, DOI:10.5772/intechopen.83815. URL consultato il 17 marzo 2021.
- ^ OECD SIDS (a cura di), 4-HYDROXYBENZOIC ACID (PDF), su inchem.org, UNEP Pubblications, 24 settembre 2015. URL consultato il 13 marzo 2021 (archiviato dall'url originale il 24 settembre 2015).
- ^ SCIENTIFIC COMMITTEE ON CONSUMER PRODUCTS SCCP Extended Opinion on the Safety Evaluation of Parabens (PDF), su ec.europa.eu.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Acido 4-idrossibenzoico
Wikimedia Commons contiene immagini o altri file su Acido 4-idrossibenzoico
