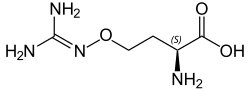
Canavanina
| Canavanina | |
|---|---|
 | |
| Nome IUPAC | |
| Acido 2-ammino-4(diamminometildeneammino)ossibutanoico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H12N4O3 |
| Massa molecolare (u) | 176,17 g/mol |
| Numero CAS | |
| Numero EINECS | 624-714-2 |
| PubChem | 439202 |
| DrugBank | DB01833 |
| SMILES | N[C@@H](CCON=C(N)N)C(O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,61 g·cm−3 |
| Solubilità in acqua | 103 g·L−1 |
| Temperatura di fusione | 184 °C |
| Temperatura di ebollizione | 366 °C |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| Frasi H | 302 - 312 - 332 |
| Consigli P | 261 - 264 - 270 - 271 - 280 - 301+317 - 302+352 - 304+340 - 317 - 321 - 330 - 362+364 - 501 [1] |
La canavanina è un amminoacido non proteinogenico contenuto in alcune leguminose.[2] Essa si accumula principalmente nei semi, dove funziona sia da composto difensivo altamente dannoso contro gli erbivori sia da fonte di azoto per l'embrione in crescita.[3]
Struttura[modifica | modifica wikitesto]

La canavanina è strutturalmente molto simile all'amminoacido arginina, con la sola differenza di un atomo di ossigeno, che viene sostituito da CH2 nell'arginina. Questa somiglianza è alla base della tossicità della canavanina in quanto le cellule che la consumano la scambiano per arginina e la integrano nelle proteine, rendendole però non funzionanti. La rimozione dell'amminoacido da una proteina avviene ad opera dell'enzima arginasi, che però produce la molecola canalina, un potente insetticida.
L'enantiomero L, abbondante nell'erba Medicago sativa, si è rivelato essere causa di sintomi riconducibili al lupus eritematoso sistemico, oltre che ad altre malattie autoimmuni. L'arresto del consumo di Medicago sativa inverte il problema.[4][5]
L'enantiomero D è stato osservato essere biologicamente attivo in Manduca sexta, dove causa deformità nello sviluppo larvale, probabilmente a causa della sua inclusione nelle proteine dello sviluppo.[6]
Tolleranza[modifica | modifica wikitesto]
La tolleranza alla L-canavanina è caratteristica di alcuni erbivori specializzati che probabilmente la metabolizzano in modo efficiente o ne evitano l'incorporazione nelle proteine. Un esempio di tolleranza è quello di Heliothis virescens, che può sopravvivere usando enormi quantità di canavanina. Queste larve evitano meticolosamente l'incorporazione della canavanina nelle proteine, presumibilmente in virtù della selettività del loro enzima arginina-tRNA ligasi, che sintetizza l'arginil-tRNA usando esclusivamente arginina. Al contrario, le larve di Manduca sexta possono tollerare solo piccole quantità (1 µg/kg di peso corporeo) perché la loro arginina-tRNA ligasi ha poca o nessuna capacità discriminatoria.[2] Studi comparativi sull'incorporazione proteica di L-arginina e L-canavanina hanno dimostrato che in Manduca sexta, il rapporto è di circa 3 a 1.
Il coleottero Caryedes brasiliensis è in grado di tollerare bene la canavanina poiché possiede una delle arginina-tRNA ligasi più discriminatorie tra quelle conosciute. Inoltre, questo coleottero utilizza la canavanina come fonte di azoto per sintetizzare i suoi altri amminoacidi. In questo insetto, il livello di L-canavanina radiomarcata incorporata nelle proteine di nuova sintesi è appena misurabile.[7]
Note[modifica | modifica wikitesto]
- ^ https://pubchem.ncbi.nlm.nih.gov/compound/275#section=Safety-and-Hazards
- ^ a b Rosenthal GA, Dahlman DL, L-Canavanine and protein synthesis in the tobacco hornworm Manduca sexta, in Proc. Natl. Acad. Sci. U.S.A., vol. 83, n. 1, gennaio 1986, pp. 14–8, PMC 322781, PMID 3455753.
- ^ (EN) PubChem, L-canavanine, su pubchem.ncbi.nlm.nih.gov. URL consultato il 23 aprile 2022.
- ^ (EN) Anthony Montanaro e Emil J. Bardana, Dietary Amino Acid-Induced Systemic Lupus Erythematosus, in Rheumatic Disease Clinics of North America, vol. 17, n. 2, 1º maggio 1991, pp. 323–332, DOI:10.1016/S0889-857X(21)00573-1. URL consultato il 23 aprile 2022.
- ^ (EN) V Herbert e T S Kasdan, Alfalfa, vitamin E, and autommune disorders, in The American Journal of Clinical Nutrition, vol. 60, n. 4, 1º ottobre 1994, pp. 639–640, DOI:10.1093/ajcn/60.4.639. URL consultato il 23 aprile 2022.
- ^ (EN) G. A. Rosenthal, l-Canavanine: a higher plant insecticidal allelochemical, in Amino Acids, vol. 21, n. 3, 1º novembre 2001, pp. 319–330, DOI:10.1007/s007260170017. URL consultato il 23 aprile 2022.
- ^ (EN) Gerald A. Rosenthal, Charlie G. Hughes e Daniel H. Janzen, L-Canavanine, a Dietary Nitrogen Source for the Seed Predator Caryedes brasiliensis (Bruchidae), in Science, vol. 217, n. 4557, 23 luglio 1982, pp. 353–355, DOI:10.1126/science.217.4557.353. URL consultato il 23 aprile 2022.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su canavanina
Wikimedia Commons contiene immagini o altri file su canavanina