Cisteina
| Cisteina | |
|---|---|
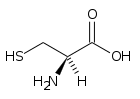 | |
| Nome IUPAC | |
| acido 2(R)-ammino-3-mercaptopropanoico | |
| Abbreviazioni | |
| C CYS | |
| Nomi alternativi | |
| L-cisteina acido α-ammino-β-mercaptopropionico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H7NO2S |
| Massa molecolare (u) | 121,16 |
| Aspetto | solido cristallino incolore |
| Numero CAS | |
| Numero EINECS | 200-158-2 |
| PubChem | 5862 |
| DrugBank | DB00151 |
| SMILES | C(C(C(=O)O)N)S |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 293 K | pK1: 1,92 pK2: 10,70 |
| Punto isoelettrico | 5,05 |
| Solubilità in acqua | 10 g/L |
| Temperatura di fusione | 224 °C (497 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −534,1 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 |
| Consigli P | ---[1] |
La cisteina è un amminoacido apolare[senza fonte] e una molecola chirale.
Descrizione[modifica | modifica wikitesto]
L'enantiomero L è uno dei 20 amminoacidi ordinari, il suo gruppo laterale reca un gruppo funzionale tiolo.
Per l'organismo umano adulto non è un amminoacido essenziale, in quanto può essere ottenuto dalla metionina tramite due reazioni successive: la transmetilazione, che trasforma la metionina in omocisteina, seguita dalla transolforazione, che trasforma l'omocisteina in cisteina. Nei bambini e durante lo sviluppo o in caso di carenza di vitamina B oppure di alcolismo se ne raccomanda invece assunzione mediante la dieta, in quanto questa trasformazione è inibita o meno efficiente.[2][3]

Due gruppi -SH, posti in ambiente ossidante possono legarsi tramite un ponte disolfuro (-S-S-). Legami di questo tipo permettono a due unità di cisteina poste in punti diversi della catena polipeptidica (o su due polipeptidi diversi) di legarsi tra loro, plasmando in maniera decisiva le strutture terziaria e quaternaria della proteina, da cui dipende l'azione biologica della proteina medesima.
Due molecole di cisteina legate da un ponte disolfuro formano una molecola di cistina.
La cistina, e quindi la cisteina da cui deriva, è indispensabile per il processo di cheratinizzazione ed è presente in grandi quantità nello strato esterno della cuticola del pelo. Nell'animale si è dimostrato che un'alimentazione priva o povera solo di cistina determina una netta diminuzione nella produzione di tessuto pilare. La cisteina inoltre, insieme al glutammato e alla glicina, è fondamentale per la biosintesi del glutatione.
Il derivato N-acetilico della cisteina, la N-acetil-cisteina (o NAC) è usato in medicina come antidoto nell'avvelenamento cronico da metalli pesanti e altre sostanze come il paracetamolo, dato che entra direttamente nella sintesi del glutatione. È utilizzato anche come mucolitico, dato che il suo gruppo sulfidrilico è capace di aprire i ponti disolfuro delle glicoproteine nel muco, aumentandone la fluidità e favorendo la clearance muco-ciliare.
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 07.01.2011
- ^ Imura K, Okada A, Amino acid metabolism in pediatric patients, in Nutrition, vol. 14, n. 1, 1998, pp. 143–148, DOI:10.1016/S0899-9007(97)00230-X, PMID 9437700.
- ^ FAO/WHO/UNU, PROTEIN AND AMINO ACID REQUIREMENTS IN HUMAN NUTRITION (PDF), su whqlibdoc.who.int, WHO Press, 2007., pagine 145-146, 150
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «l-cisteina»
Wikizionario contiene il lemma di dizionario «l-cisteina» Wikimedia Commons contiene immagini o altri file su l-cisteina
Wikimedia Commons contiene immagini o altri file su l-cisteina
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) cysteine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 22920 · LCCN (EN) sh2014002134 · J9U (EN, HE) 987007588328405171 |
|---|