Acido maleico
| Acido maleico | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| acido Z-butendioico | |
| Nomi alternativi | |
| acido cis-butendioico acido toxalico acido cis-1,4-butendioico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H4O4 |
| Massa molecolare (u) | 116.07 |
| Aspetto | polvere bianca |
| Numero CAS | |
| Numero EINECS | 203-742-5 |
| PubChem | 444266 |
| DrugBank | DB04299 |
| SMILES | C(=CC(=O)O)C(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1.59 |
| Costante di dissociazione acida (pKa) a 298 K | 1,8; 6,1 |
| Solubilità in acqua | 788 g/L |
| Temperatura di fusione | 137 °C (410 K) |
| Temperatura di ebollizione | 202 °C |
| Indicazioni di sicurezza | |
| Limiti di esplosione | inferiore a 2.7% |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 - 315 - 319 - 335 - 317 |
| Consigli P | 280 - 302+350 - 305+351+338 [1] |
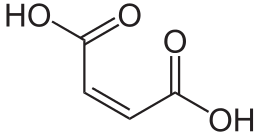
L'acido maleico (o acido cis-butendioico) è un acido bicarbossilico. A temperatura ambiente si presenta come una fine polvere cristallina bianca, dal vago odore acidulo.
Ha una pKa di prima ionizzazione che si aggira sull'1,9 quindi è molto acido; mentre una pKa di seconda ionizzazione (pKa') che vale circa 6.
Il suo corrispondente isomero trans è l'acido fumarico. Visto che è presente un doppio legame carbonio-carbonio la rotazione e quindi il passaggio dall'acido maleico all'acido fumarico sono impossibili senza l'utilizzo di un certo quantitativo di energia, dato dall'idrolisi dell'ATP.
La loro diversa struttura influenza profondamente le proprietà chimiche dei due acidi: l'acido maleico è tossico per il nostro organismo, mentre quello fumarico è un importantissimo intermedio di molte reazioni biochimiche.
L'acido maleico riesce a rilasciare più facilmente un protone per la presenza del gruppo carbossilico in cis che rende possibile una delocalizzazione per risonanza della carica negativa dell'anione su quattro differenti atomi di ossigeno, e non solo due, come nell'acido fumarico.
Essendo già carico negativamente, per repulsione elettrostatica l'acido maleico subisce più difficilmente la seconda dissociazione, mentre la lontananza dei due gruppi carbossilici nell'acido fumarico riduce le interazioni intramolecolari rendendo più facile il distacco del secondo ione idrogeno.
In sintesi l'acido maleico è più acido del fumarico nella prima dissociazione, meno nella seconda.
I derivati dell'acido maleico sono noti come maleati (da non confondersi con i malati che derivano dall'acido malico).
Viene ottenuto industrialmente dall'idrolisi dell'anidride maleica, a sua volta ottenuta per ossidazione del n-butano o del benzene (quest'ultimo è un processo un po' obsoleto).
Note[modifica | modifica wikitesto]
- ^ scheda dell'acido maleico su IFA-GESTIS
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acido maleico
Wikimedia Commons contiene immagini o altri file su acido maleico
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) maleic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4168704-8 |
|---|