Elettrone
| Elettrone | |
|---|---|
 | |
| Classificazione | Particella elementare |
| Famiglia | Fermioni |
| Gruppo | Leptoni |
| Generazione | Prima |
| Interazioni | Gravitazionale, elettromagnetica, debole |
| Simbolo | e−, β− |
| Antiparticella | Positrone (e+) |
| Teorizzata | Richard Laming (1838-1851)
G. Johnstone Stoney (1874) |
| Scoperta | J.J. Thomson (1897) |
| Proprietà fisiche | |
| Massa | |
| Vita media | Stabile |
| Carica elettrica | -1 e -1,602176634×10−19 C[5] |
| Carica di colore | No |
| Spin | ½[6] |
L'elettrone è una particella subatomica con carica elettrica negativa che si ritiene essere una particella elementare.[7]
Insieme ai protoni e ai neutroni, è un componente dell'atomo e, sebbene contribuisca alla sua massa totale per meno dello 0,06%, ne caratterizza sensibilmente la natura e ne determina le proprietà chimiche: il legame chimico covalente si forma in seguito alla redistribuzione della densità elettronica tra due o più atomi.[8] Il moto dell'elettrone genera un campo magnetico, mentre la variazione della sua energia e della sua accelerazione causano l'emissione di fotoni; è inoltre responsabile della conduzione della corrente elettrica e del calore.
La maggior parte degli elettroni presenti nell'universo è stata prodotta dal Big Bang, ma possono essere generati anche dal decadimento beta degli isotopi radioattivi e in collisioni ad alta energia, mentre possono essere annichilati dalla collisione con i positroni o assorbiti in un processo di nucleosintesi stellare.
L'avvento dell'elettronica e il relativo sviluppo dell'informatica hanno reso l'elettrone protagonista dello sviluppo tecnologico del ventesimo secolo. Le sue proprietà vengono sfruttate in svariate applicazioni, come i tubi a raggi catodici, i microscopi elettronici, la radioterapia e il laser.
Storia[modifica | modifica wikitesto]
Origine del termine[modifica | modifica wikitesto]

I termini "elettricità, "elettrico" derivano dalla parola greca ἤλεκτρον (pronuncia èlectron), il cui significato è ambra,[9] una resina lucente, ma stava a indicare anche una lega, o amalgama, di oro e argento.[10][11] Tale nome è storicamente dovuto al fatto che l'ambra ebbe un ruolo fondamentale nella scoperta dei fenomeni elettrici: in particolare a partire dal VII secolo a.C. gli antichi Greci erano a conoscenza del fatto che strofinando un oggetto di ambra con un panno di lana, l'oggetto in questione acquisiva la capacità di attirare a sé corpuscoli leggeri, quali ad esempio granelli di polvere. Questa proprietà che si manifestava e il bagliore del fulmine furono i primi contatti a quei tempi con i fenomeni dovuti all'elettricità.[12] Queste evidenze sperimentali vennero riprese nel XVI secolo da William Gilbert, che individuò numerose sostanze, tra cui il diamante e lo zolfo, che presentavano lo stesso comportamento dell'ambra. Egli diede il nome di "forza elettrica" alla forza che attirava i corpuscoli, e chiamò "elettrizzati" i materiali che manifestavano tale proprietà.[13]
Gli studi sull'elettricità e sul magnetismo furono continuati in epoca moderna fra gli altri da Benjamin Franklin e Michael Faraday, e in questo periodo nel contesto dell'atomismo fu avanzata l'idea che anche l'elettricità potesse essere costituita da piccoli corpuscoli indivisibili.[14] L'idea di una quantità fondamentale di carica elettrica fu introdotta dal filosofo Richard Laming nel 1838 per spiegare le proprietà chimiche dell'atomo.[15]
Nel 1874 il fisico irlandese George Stoney introdusse il concetto di "unità di carica fondamentale".[16] Nel 1891 ne stimò il valore e coniò il termine "elettrone" per riferirsi a tali "unità",[17] scrivendo:
«... an estimate was made of the actual amount of this most remarkable fundamental unit of electricity, for which I have since ventured to suggest the name electron»
«... è stata fatta una stima dell'ammontare effettivo di questa notevolissima unità fondamentale dell'elettricità, per la quale da allora ho osato suggerire il nome di elettrone[18]»
La terminazione -on (-one in italiano) di «elettrone» e di «protone» (scoperto nel 1920) venne usata in seguito per designare altre particelle subatomiche scoperte successivamente, come il neutrone, il mesone, il pione etc.[19][20]
La scoperta[modifica | modifica wikitesto]

Le prime prove sperimentali dell'esistenza di questa particella si ebbero nel 1860, quando il fisico e chimico inglese Sir William Crookes effettuò esperimenti con il tubo di Geissler, inserendovi due lamine metalliche e collegandole a un generatore di corrente continua a elevato potenziale (circa 30000 V). Durante tale esperimento, Crookes si accorse che si generava una luce avente una colorazione differente a seconda del gas utilizzato. Tale emissione luminosa aveva origine dal catodo (polo negativo) e fluiva verso l'anodo (polo positivo).
In seguito all'esperienza di Crookes, anche il fisico tedesco Johann Wilhelm Hittorf nel 1869, mentre si stava dedicando ad uno studio sulla conduttività elettrica dei gas, evidenziò un bagliore emesso dal catodo e verificò che aumentava in intensità con il decrescere della pressione del gas. Nel 1876 il fisico tedesco Eugen Goldstein mostrò che i raggi di tale bagliore proiettano un'ombra e li chiamò "raggi catodici".[21] Durante gli anni settanta del XIX secolo, Crookes sviluppò il primo tubo catodico con un vuoto spinto all'interno,[22] dimostrando che i raggi luminescenti che appaiono all'interno del tubo trasportano energia e si muovono dal catodo all'anodo. Inoltre, applicando un campo magnetico, fu in grado di deflettere i raggi, dimostrando che il fascio si comporta come se fosse carico negativamente.[23][24] Nel 1879, Crookes avanzò l'idea che queste proprietà potessero essere spiegate da quella che denominò "materia radiante" e suggerì che si doveva trattare di un nuovo stato della materia, consistente di molecole cariche negativamente che sono espulse ad alta velocità dal catodo.[25]
Il fisico inglese di origini tedesche Arthur Schuster proseguì gli esperimenti di Crookes posizionando delle piastre metalliche parallele ai raggi catodici e applicando un potenziale elettrico fra loro. Il campo deflesse i raggi verso la piastra carica positivamente, confermando che i raggi trasportano carica negativa. Misurando l'ammontare della deflessione per una data intensità di corrente elettrica, nel 1890 Schuster fu in grado di stimare il rapporto fra la massa e la carica dei componenti dei raggi catodici. Tuttavia, tale stima fu ritenuta poco attendibile dai suoi contemporanei poiché risultò migliaia di volte superiore alle attese.[23][26]

Negli ultimi anni dell'Ottocento numerosi fisici sostennero la possibilità che l'elettricità fosse costituita da unità discrete, alle quali vennero conferiti vari nomi, ma delle quali non vi fu alcuna prova sperimentale convincente. Nel 1896, il fisico britannico J. J. Thomson, con i suoi colleghi John S. Townsend e H. A. Wilson,[26] svolsero una serie di esperimenti che dimostrarono che i raggi catodici erano costituiti da singole particelle, piuttosto che onde, atomi o molecole come si riteneva in precedenza.[27] Thomson stimò in maniera accurata la carica e la massa, trovando che le particelle dei raggi catodici, che lui chiamò "corpuscoli", avevano probabilmente una massa migliaia di volte inferiore a quella dell'idrogenione (H+), lo ione più leggero che si conoscesse a quel tempo.[27][28] Thomson mostrò come il rapporto carica/massa (e/m), uguale a 5,273×1017 e/g, fosse indipendente dal materiale del catodo. Inoltre mostrò come le particelle cariche negativamente prodotte dai materiali radioattivi, dai materiali riscaldati e dai raggi catodici fossero riconducibili tutte alla stessa entità.[27][29]
Il nome "elettrone" fu nuovamente proposto per identificare tali particelle dal fisico irlandese George FitzGerald e da allora il nome venne universalmente accettato.[23] Mentre studiava i minerali naturalmente fluorescenti nel 1896, il fisico francese Henri Becquerel scoprì che essi emettono radiazione senza l'intervento di una sorgente di energia esterna. Tali materiali radioattivi divennero argomento di grande interesse da parte degli scienziati, fra cui anche il fisico neozelandese Ernest Rutherford, il quale scoprì che emettevano particelle, da lui chiamate particelle alfa e beta, sulla base della loro capacità di penetrare la materia.[30] Nel 1900, Becquerel mostrò che i raggi beta emessi dal radio potevano essere deflessi da un campo elettrico e che il loro rapporto massa-carica era lo stesso dei raggi catodici.[31] Tale evidenza sperimentale suggeriva che gli elettroni esistevano come componenti degli atomi.[32][33]

La carica degli elettroni fu misurata con maggiore precisione dal fisici americani Robert Millikan e Harvey Fletcher nel loro esperimento della goccia d'olio del 1909, i cui risultati furono pubblicati nel 1911. In tale esperimento venne usato un campo elettrico per frenare la caduta, dovuta alla gravità, di una goccia d'olio elettricamente carica. Grazie a tale apparato strumentale, fu possibile misurare la carica elettrica prodotta da pochi ioni (tra 1 e 150) con un margine di errore inferiore allo 0,3%. Si ottenne un valore pari a −1,602×10−19 C e fu quindi possibile stimare che la massa dell'elettrone dovesse valere 9,109×10−31 kg. Un simile esperimento era stato condotto in precedenza dal gruppo di Thomson,[27] usando nubi di gocce di acqua cariche generate tramite l'elettrolisi,[26] e nel 1911 da Abram Ioffe, che ottenne in maniera indipendente lo stesso risultato di Millikan usando microparticelle di metallo cariche, pubblicando i risultati nel 1913.[34] Tuttavia, le gocce d'olio risultavano più stabili di quelle dell'acqua a causa della loro bassa velocità di evaporazione e quindi maggiormente adatte per svolgere esperimenti precisi per un lungo periodo di tempo.[35]
Attorno all'inizio del ventesimo secolo, fu scoperto che sotto certe condizioni una particella carica che si muove ad elevata velocità causa una condensazione di vapore acqueo sovrassaturo lungo il suo cammino. Nel 1911, Charles Wilson sfruttò tale principio per sviluppare la prima camera a nebbia, uno strumento che permette di tracciare e fotografare il percorso seguito da particelle cariche, come gli elettroni veloci.[36]
Teoria atomica[modifica | modifica wikitesto]

A partire dal 1914, gli esperimenti dei fisici Ernest Rutherford, Henry Moseley, James Franck e Gustav Hertz stabilirono definitivamente che l'atomo è formato da un nucleo massivo carico positivamente circondato da elettroni di massa minore.[37] Nel 1913, il fisico danese Niels Bohr postulò che gli elettroni si trovassero in stati di energia quantizzata, con l'energia determinata dal momento angolare delle orbite degli elettroni attorno al nucleo. La teoria avanzata da Bohr prevedeva inoltre che gli elettroni potessero muoversi tra questi stati (o orbite) in seguito all'assorbimento o all'emissione di un quanto di energia, un fotone di specifica frequenza. Tale teoria era in grado di spiegare la comparsa delle linee di emissione spettrale dell'idrogeno come conseguenza del suo contenuto energetico attraverso riscaldamento o facendolo attraversare da corrente elettrica. Nonostante ciò, il modello di Bohr non era in grado di predire l'intensità delle relative linee e di spiegare la struttura dello spettro di atomi più complessi.[37]
La formazione di legami chimici tra atomi fu spiegata nel 1916 da Gilbert Newton Lewis, il quale asserì che il legame covalente sia generato dalla condivisione di una coppia di elettroni tra due atomi,[38] mentre una descrizione completa sulla formazione di queste coppie e dei legami chimici venne fornita da Walter Heitler e Fritz London nel 1923 grazie alla meccanica quantistica.[39] Nel 1919 il chimico statunitense Irving Langmuir rielaborò il modello statico dell'atomo di Lewis ipotizzando che tutti gli elettroni fossero distribuiti in una serie di gusci (shell) sferici approssimativamente concentrici, tutti di uguale spessore";[40] tali gusci erano a loro volta suddivisi in celle, ognuna delle quali conteneva una coppia di elettroni. Tramite questo modello, Langmuir spiegò qualitativamente le proprietà chimiche di tutti gli elementi,[39] le quali si ripetono secondo un ordine preciso stabilito dalla tavola periodica.[41]
Nel 1924, il fisico austriaco Wolfgang Pauli osservò che la struttura a strati di un atomo poteva essere spiegata attraverso un insieme di quattro parametri che definivano univocamente lo stato quantico di un elettrone, e che un singolo stato non poteva essere occupato da più di un singolo elettrone (questa legge è nota come principio di esclusione di Pauli).[42] Nonostante la sua intuizione, Pauli non riuscì a spiegare il significato fisico del quarto parametro, il quale poteva assumere solo due valori. La spiegazione teorica di tale parametro si deve invece ai fisici olandesi Samuel Goudsmit e George Uhlenbeck, i quali suggerirono che un elettrone, oltre al momento angolare associato alla sua orbita, può possedere un proprio momento angolare intrinseco.[37][43] Fu così introdotto il concetto di spin e con questa scoperta era possibile spiegare anche la separazione delle linee spettrali osservata con uno spettrografo ad alta definizione.[44]
Meccanica quantistica[modifica | modifica wikitesto]

Nel 1929, il fisico francese Louis de Broglie vinse il premio Nobel per la fisica per aver scoperto che anche gli elettroni, oltre alla luce, sono caratterizzati da una doppia natura, una corpuscolare e una ondulatoria.[45] Questa nuova proprietà, presentata per la prima volta nella sua dissertazione del 1924 dal titolo Recherches sur la théorie des quanta (Ricerca sulla teoria dei quanti) è nota come dualismo onda-particella e comporta la possibilità di osservare fenomeni di interferenza fra elettroni sotto appropriate condizioni:
«The electron can no longer be conceived as a single, small granule of electricity; it must be associated with a wave and this wave is no myth; its wavelength can be measured and its interferences predicted.»
«L'elettrone non può più essere concepito come un singolo, piccolo granulo di energia elettrica, esso deve essere associato con un'onda e questa onda non è mito; la sua lunghezza d'onda può essere misurata e la sua interferenza prevista.[46]»
L'interferenza è una proprietà di tutte le onde: ad esempio nel caso della luce, se tra una sorgente luminosa e uno schermo illuminato da tale sorgente viene interposto un foglio con delle fessure parallele, la luce prodotta dalla sorgente attraversa tali fessure e si proietta sullo schermo producendo delle figure a bande in corrispondenza dello schermo. Nel 1927 furono osservati gli effetti dell'interferenza con un fascio di elettroni dal fisico inglese George Paget Thomson con una sottile pellicola metallica e dai fisici americani Clinton Davisson e Lester Germer, i quali studiarono il fenomeno di scattering degli elettroni incidenti su una lastra di nickel monocristallino.[47] Niels Bohr nello stesso anno incluse l'ipotesi di de Broglie e queste evidenze sperimentali nel principio di complementarità, secondo il quale una descrizione completa dell'elettrone e della luce non può fare riferimento solo alla sua natura ondulatoria o solo alla sua natura particellare, ma deve necessariamente includerle entrambe.[48] Infatti la natura ondulatoria dell'elettrone si manifesta ad esempio nel fenomeno dell'interferenza, mentre la natura corpuscolare fa sì che un fascio di elettroni riesca a fare girare un piccolo mulinello posizionato lungo il suo tragitto.
Il successo della previsione di de Broglie portò alla pubblicazione dell'equazione di Schrödinger, formulata nel 1926 da Erwin Schrödinger, che descrive l'evoluzione temporale di uno stato quantico (e quindi della relativa funzione d'onda).[49] Piuttosto che cercare una soluzione che determinasse la posizione di un elettrone nel tempo, questa equazione era usata per prevedere la probabilità di trovare un elettrone in un volume finito o infinitesimo dello spazio. Da questo approccio ebbe origine la branca della fisica denominata "meccanica quantistica", che garantì la possibilità di ricavare teoricamente i livelli energetici di un elettrone nell'atomo di idrogeno in buon accordo con i dati sperimentali.[50] Una volta che vennero presi in considerazione lo spin e l'interazione fra più elettroni, la meccanica quantistica fu in grado di ricostruire l'andamento delle proprietà chimiche tipiche degli elementi nella tavola periodica.[51]
Nel 1928, basandosi sul lavoro di Wolfgang Pauli, Paul Dirac formulò un modello dell'elettrone coerente con la teoria della relatività ristretta, applicando considerazioni relativistiche e di simmetria alla formulazione hamiltoniana della meccanica quantistica per un elettrone in un campo elettromagnetico; questa trattazione portò alla formulazione dell'equazione di Dirac.[52] Per risolvere i problemi della sua equazione relativistica (in primo luogo l'esistenza di soluzioni a energia negativa), nel 1930 lo stesso Dirac sviluppò un modello del vuoto come un mare infinito di particelle con energia negativa, che fu poi chiamato mare di Dirac. Questo permise di prevedere l'esistenza del positrone, la corrispettiva antiparticella dell'elettrone,[53] che fu scoperta sperimentalmente nel 1932 da Carl David Anderson[54]. Anderson propose di chiamare gli elettroni negatroni e di usare il termine elettroni per indicare genericamente una delle varianti della particella sia a carica positiva che negativa. Questo uso del termine negatroni è occasionalmente utilizzato tuttora, anche nella sua forma abbreviata negatone.[55][56]
Gli elettroni nel mare di Dirac furono introdotti con lo scopo di impedire la perdita di energia senza limiti degli elettroni reali osservati. In questo contesto, i fotoni (cioè i quanti della radiazione elettromagnetica) possono essere assorbiti dagli elettroni del mare, permettendo a questi ultimi di uscire fuori da esso. Come risultato netto si generano degli elettroni a carica negativa e delle lacune di carica positiva nel mare. Una lacuna potrà essere rioccupata dall'elettrone che perde energia rilasciando in questo modo nuovamente un altro fotone.[57]
Nel 1947 Willis Lamb, lavorando in collaborazione con lo studente Robert Retherford, trovò che certi stati quantistici dell'elettrone nell'atomo di idrogeno, che avrebbero dovuto avere la stessa energia, erano spostati uno rispetto all'altro e tale deviazione fu chiamata spostamento di Lamb. Circa nello stesso periodo, Polykarp Kusch, lavorando con Henry M. Foley, scoprì che il momento magnetico dell'elettrone è di poco più grande di quanto previsto dell'equazione di Dirac. Questa piccola differenza fu successivamente chiamata "momento magnetico di dipolo anomalo dell'elettrone". Per risolvere questo e altri problemi, una teoria avanzata chiamata elettrodinamica quantistica fu sviluppata da Sin-Itiro Tomonaga, Julian Schwinger e Richard P. Feynman alla fine degli anni quaranta.[58]
Acceleratori di particelle[modifica | modifica wikitesto]
Con lo sviluppo degli acceleratori di particelle nella prima metà del XX secolo, i fisici iniziarono ad approfondire le proprietà delle particelle subatomiche.[59] Le proprietà di corpuscolo elementare puntiforme dell'elettrone hanno reso questa particella una sonda perfetta per esplorare la struttura dei nuclei atomici. Il primo tentativo riuscito di accelerare elettroni usando l'induzione elettromagnetica fu ad opera di Donald William Kerst nel 1942: il suo primo betatrone raggiunse energie di 2,3 MeV, mentre quelli successivi raggiunsero i 300 MeV.[60] Nel 1947 fu scoperta la radiazione di sincrotrone con un sincrotrone di 70 MeV della General Electric; questa radiazione era causata dall'accelerazione degli elettroni che, in un campo magnetico, raggiungono velocità prossime a quelle della luce.[61]
Il primo acceleratore di particelle ad alte energie è stato ADONE, con un fascio di particelle di energia pari a 1,5 GeV; questa struttura, operativa a partire dal 1968,[62] accelerava elettroni e positroni in direzioni opposte, raddoppiando in pratica l'energia prodottasi nelle loro collisioni se paragonata a quella ottenuta nelle collisioni degli elettroni con un bersaglio fisso.[63] Il Large Electron-Positron Collider (LEP) al CERN, che operò dal 1989 al 2000, raggiunse energie di collisione pari a 209 GeV e fece importanti misure in merito al modello standard.[64][65] Il Large Hadron Collider (LHC), l'ultimo acceleratore del CERN, sostituisce gli elettroni con adroni, perché questi ultimi sono meno soggetti alla perdita di energia per radiazione di sincrotrone e quindi il rapporto fra energia acquisita dalla particella e l'energia spesa per ottenerla è maggiore.[66]
Classificazione[modifica | modifica wikitesto]

Nel modello standard della fisica delle particelle l'elettrone, avendo spin semi intero, è un fermione[67], e in particolare fa parte del gruppo dei leptoni. Si ritiene sia una particella elementare e appartiene alla prima generazione di particelle fondamentali, mentre alla seconda e alla terza generazione appartengono altri leptoni carichi, il muone e il tauone, che possiedono identica carica e spin, ma massa a riposo maggiore. A differenza dell'elettrone, che è una particella stabile, il muone e il tauone sono soggetti a decadimento.[68] L'elettrone e tutti i leptoni sono soggetti all'interazione gravitazionale, a quella debole e a quella elettromagnetica, ma differiscono dagli altri componenti fondamentali della materia, i quark, in quanto non risentono dell'interazione nucleare forte.[69]
Proprietà[modifica | modifica wikitesto]
Proprietà fondamentali[modifica | modifica wikitesto]
L'elettrone possiede una massa a riposo di 9,1093837015(28)×10−31 kg, che, in base al principio di equivalenza massa-energia, corrisponde a un'energia a riposo di 0,511 MeV, con un rapporto rispetto alla massa del protone di circa 1 a 1836. Si tratta della particella subatomica stabile più leggera che si conosca tra quelle dotate di carica elettrica.[70] Misure astronomiche hanno mostrato che il rapporto fra le masse del protone e dell'elettrone è rimasto costante per almeno metà dell'età dell'universo, come è previsto nel modello standard.[71]
L'elettrone ha una carica elettrica pari a −1,602176634×10−19 C, definita come "carica elementare" ed usata come unità standard per la carica delle particelle subatomiche. Entro i limiti dell'errore sperimentale, il valore della carica dell'elettrone è uguale a quella del protone, ma con il segno opposto.[72] Il valore della carica elementare è indicato con il simbolo e, mentre l'elettrone viene comunemente indicato con il simbolo e−, dove il segno meno indica il fatto che tale particella presenta carica negativa; analogamente, per la sua antiparticella, il positrone, che ha la stessa massa e carica di segno opposto, è utilizzato come simbolo e+.[73]
L'elettrone non ha sottostrutture conosciute[7][74] e viene descritto come una particella puntiforme,[67] dal momento che esperimenti effettuati con la trappola di Penning hanno mostrato che il limite superiore per il raggio della particella è di 10−22 metri.[75] Esiste inoltre una costante fisica, il raggio classico dell'elettrone, a cui corrisponde un valore di 2,8179×10−15 m; questa costante deriva tuttavia da un calcolo che trascura gli effetti quantistici presenti.[76][N 1] Si ritiene che l'elettrone sia stabile poiché, dal momento che è la particella carica con massa più piccola e il suo decadimento violerebbe la legge di conservazione della carica elettrica, assumendo vero il principio di conservazione dell'energia.[77] Il limite inferiore sperimentale per la vita media dell'elettrone è di 4,6×1026 anni, con un intervallo di confidenza al 90%.[78]
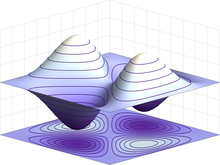
Proprietà quantistiche[modifica | modifica wikitesto]
In meccanica quantistica l'elettrone può essere trattato sia come onda che come particella, in accordo con il dualismo onda-particella.[N 2] Nel formalismo delle funzioni d'onda l'elettrone è descritto matematicamente da una funzione a valori complessi, la funzione d'onda appunto. Il quadrato del valore assoluto della funzione d'onda rappresenta una densità di probabilità, cioè la probabilità che l'elettrone sia osservato nell'intorno di una determinata posizione.[79][N 3] Da tale distribuzione si può calcolare l'incertezza della posizione dell'elettrone. Un calcolo analogo si può fare sulla quantità di moto dell'elettrone. Le incertezze sulla posizione e la quantità di moto sono legate dal principio di indeterminazione di Heisenberg.
Gli elettroni sono particelle identiche, ovvero non possono essere distinte l'una dall'altra per le loro proprietà fisiche intrinseche: è possibile cambiare la posizione di una coppia di elettroni interagenti senza che si verifichi un cambiamento osservabile nello stato del sistema. La funzione d'onda dei fermioni, di cui gli elettroni fanno parte, è antisimmetrica: il segno della funzione d'onda cambia quando la posizione dei due elettroni viene scambiata,[N 4] ma il valore assoluto non varia con il cambio di segno e il valore della probabilità resta immutato. Questo differenzia i fermioni dai bosoni, che hanno una funzione d'onda simmetrica.[79]
Il momento angolare intrinseco è caratterizzato dal numero quantico di spin, pari a 1/2 in unità di ħ,[73] e l'autovalore dell'operatore di spin è √3⁄2 ħ.[N 5] Il risultato di una misura della proiezione dello spin su ognuno degli assi di riferimento può inoltre valere soltanto ±ħ⁄2.[N 6] Oltre allo spin, l'elettrone ha un momento magnetico intrinseco, allineato al suo spin, che ha un valore approssimativamente simile al magnetone di Bohr,[80][N 7] che è una costante fisica che vale 9,27400949(80)×10−24 J/T. La proiezione del vettore di spin lungo la direzione della quantità di moto definisce la proprietà delle particelle elementari conosciuta come elicità.[81]
L'evoluzione temporale della funzione d'onda di una particella è descritta dall'equazione di Schrödinger,[N 8] che nel caso di un sistema di elettroni interagenti mostra una probabilità nulla che una coppia di elettroni occupi lo stesso stato quantico: questo fatto è responsabile del principio di esclusione di Pauli, il quale afferma che due elettroni del sistema non possono avere i medesimi numeri quantici. Tale principio è alla base di molte proprietà dei sistemi con molti elettroni, in particolare genera la loro configurazione all'interno degli orbitali atomici.[79]
Proprietà relativistiche[modifica | modifica wikitesto]
Quando un elettrone si muove con velocità prossima a quella della luce è necessario ricorrere alla teoria della relatività speciale per descriverne il moto. Secondo tale teoria, la massa relativistica dell'elettrone aumenta dal punto di vista di un osservatore esterno, e di conseguenza è necessaria una forza sempre più intensa per mantenere costante l'accelerazione. In questo modo un elettrone non può mai raggiungere la velocità della luce nel vuoto c, essendo richiesta un'energia infinita. Tuttavia, se un elettrone che si muove a una velocità prossima a quella della luce entra in un mezzo dielettrico, per esempio l'acqua, in cui la velocità della luce è significativamente minore di quella dell'elettrone, l'interazione con esso può generare un fronte d'onda di luce causato dall'effetto Čerenkov. Tale effetto è simile al boom sonico, che accade quando un oggetto supera la velocità del suono.
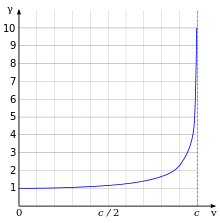
L'effetto della relatività speciale è descritto da una quantità nota come fattore di Lorentz, definita da:
dove è la velocità della particella e l'energia cinetica associata a un elettrone che si muove con velocità è:
dove me è la massa a riposo dell'elettrone. Per esempio, l'acceleratore lineare di Stanford (SLAC) può accelerare un elettrone a circa 51 GeV.[82] Questo fornisce un valore per vicino a 100 000, dal momento che la massa a riposo dell'elettrone è circa 0,51 MeV/c2. La quantità di moto relativistica è 100 000 volte la quantità di moto dell'elettrone prevista dalla meccanica classica alla stessa velocità.[N 9]
Dal momento che l'elettrone ha anche un comportamento ondulatorio, a una data velocità esso ha una caratteristica lunghezza d'onda di de Broglie. Questa è data da λe = h/p dove h è la costante di Planck e p è la quantità di moto.[46] Per un elettrone con energia di 51 GeV, come quelle raggiunte dall'acceleratore SLAC, la lunghezza d'onda è di circa 2,4×10−17 m, piccola a sufficienza per esplorare la scala infinitesima del nucleo atomico e dei protoni.[83]
Proprietà quantistiche relativistiche[modifica | modifica wikitesto]

La teoria quantistica dei campi interpreta i fenomeni di interazione fra gli elettroni e la radiazione elettromagnetica in termini di scambi di particelle generate nel vuoto dalle fluttuazioni quantistiche. Ad esempio, secondo l'elettrodinamica quantistica, gli elettroni e il campo elettromagnetico interagiscono fra loro puntualmente tramite lo scambio di fotoni e particelle virtuali aventi vita breve e non direttamente osservabili. Le fluttuazioni quantistiche creano continuamente nel vuoto coppie di particelle virtuali, fra le quali vi sono l'elettrone e il positrone, che si annichilano in breve tempo senza poter essere misurate effettivamente.[84] In base al principio di indeterminazione di Heisenberg, la variazione dell'energia necessaria a produrre la coppia di particelle e la loro vita media non si possono conoscere contemporaneamente,[N 10][85] tuttavia se la vita media è estremamente breve l'incertezza riguardo all'energia è molto ampia, e il processo e la fluttuazione possono avvenire senza violare la conservazione dell'energia.
La presenza delle particelle virtuali, sebbene non direttamente osservabile, è responsabile tuttavia della differenza delle caratteristiche dell'elettrone al variare della scala di energie dei processi in cui è coinvolto.[86] Le correzioni virtuali sono all'origine di correzioni divergenti di tipo logaritmico della massa dell'elettrone rispetto al valore nominale classico.[87] La rimozione di queste divergenze, alla base della teoria della rinormalizzazione, comporta una ridefinizione del concetto di costante fisica, che viene ad assumere nel contesto quantistico un valore differente in base alla scala di osservazione. Per esempio la carica elettrica dell'elettrone non è costante e aumenta lentamente all'aumentare dell'energia dei processi in cui è coinvolto.[88][89][N 11]
Questo importante risultato delle teorie di campo quantistiche può essere interpretato come l'effetto di schermo prodotto dalle particelle virtuali. La presenza di un elettrone isolato permette attraverso il campo elettromagnetico di creare una coppia positrone-elettrone dal vuoto; il positrone virtuale appena creato, di carica positiva, sarà attratto dall'elettrone isolato, mentre l'elettrone virtuale ne sarà respinto. Questo fenomeno produce uno schermo positivo attorno all'elettrone isolato, la cui carica a grande distanza sarà quindi considerevolmente ridotta rispetto a quella a corta distanza. Una particella carica ad alta energia sarà in grado di penetrare lo schermo e per questo motivo entra in interazione con una carica elettrica efficace più alta.[90] In base a processi analoghi, anche la massa dell'elettrone tende a crescere quando le scale di energie crescono. Questo tipo di comportamento delle costanti fisiche è caratteristico di tutte le teorie che presentano un polo di Landau, come l'elettrodinamica quantistica.[91]
La mutua interazione fra fotoni e elettroni spiega anche la piccola deviazione dal momento magnetico intrinseco dell'elettrone dal magnetone di Bohr.[80][92][93] I fotoni virtuali, responsabili del campo elettrico, possono permettere infatti all'elettrone di avere un moto agitato nell'intorno della sua traiettoria classica,[94] che genera l'effetto globale di un moto circolare con una precessione. Questo moto produce sia lo spin che il momento magnetico dell'elettrone.[67][95] Negli atomi, poi, la creazione di fotoni virtuali spiega lo spostamento di Lamb osservato nelle linee spettrali e il fenomeno del decadimento spontaneo di elettrone da uno stato eccitato a uno di energia inferiore.[96] Questo tipo di polarizzazione è stata confermata sperimentalmente nel 1997 usando l'acceleratore giapponese TRISTAN.[97]
Atomi e molecole[modifica | modifica wikitesto]
L'elettrone è responsabile delle proprietà chimiche fondamentali degli atomi e delle molecole. L'interazione elettromagnetica fra gli elettroni è infatti all'origine dei legami fra gli atomi e della struttura macroscopica della materia, oggetto di studio della chimica e della fisica dello stato solido.
Atomi[modifica | modifica wikitesto]
Gli elettroni sono i costituenti fondamentali degli atomi, assieme a protoni e neutroni. Essi sono confinati nella regione in prossimità del nucleo atomico e nel caso di un atomo neutro isolato sono in numero pari al numero atomico, cioè al numero di protoni contenuti nel nucleo. Se il numero di elettroni è differente dal numero atomico, l'atomo è detto ione e possiede una carica elettrica netta.
Secondo la meccanica classica, un elettrone in moto circolare uniforme attorno al nucleo, essendo accelerato, emetterebbe radiazione elettromagnetica per effetto Larmor, perdendo progressivamente energia e impattando infine sul nucleo. Il collasso degli atomi è smentito dall'osservazione sperimentale della stabilità della materia: per questo motivo il modello atomico di Bohr è stato introdotto nel 1913 per fornire una descrizione semiclassica nella quale un elettrone può muoversi soltanto su alcune determinate orbite non-radiative caratterizzate da precisi valori dell'energia e del momento angolare. Nello sviluppo successivo della meccanica quantistica, per rappresentare lo stato degli elettroni nell'atomo, la traiettoria classica è stata sostituita dalla funzione d'onda nota con il nome di orbitale atomico.

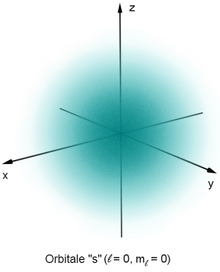
Ad ogni orbitale è associato uno degli stati energetici degli elettroni che interagiscono con il potenziale elettrico generato dal nucleo. Il valore della funzione d'onda associata a tali stati è fornito dalla soluzione dell'equazione d'onda di Schrödinger, che può essere risolta per l'atomo di idrogeno notando la simmetria radiale del potenziale elettrico indotto dal nucleo. Le soluzioni dell'equazione d'onda sono enumerate da numeri quantici che assumono un insieme discreto di valori, che rappresentano il valore di aspettazione dell'energia e del momento angolare,[98] in particolare:
- il numero quantico principale n, che definisce il livello energetico e il numero totale di nodi della funzione d'onda radiale, considerando come nodo anche una superficie sferica a distanza infinita dal nucleo; può assumere valori interi non inferiori a 1;
- il numero quantico azimutale l, o numero quantico angolare, che definisce il momento angolare orbitale; può assumere valori interi positivi compresi tra 0 ed n-1 e sulla base di questa osservabile è possibile determinare informazioni circa il numero di nodi non sferici e, indirettamente, sulla simmetria dell'orbitale;
- il numero quantico magnetico ml, che definisce la componente z del momento angolare orbitale; può assumere valori interi compresi tra +l e -l ed è responsabile della geometria degli orbitali;
- il numero quantico di spin ms, associato alla componente z dello spin dell'elettrone; può assumere solo due valori, +1/2 o -1/2 in unità di ħ.
Gli atomi con più elettroni richiedono una descrizione degli stati più complessa di quella dell'atomo di idrogeno, in quanto è necessaria l'introduzione di approssimazioni a causa dell'impossibilità di risolvere esattamente l'equazione di Schrödinger per via analitica. Le approssimazioni più utilizzate sono il metodo di Hartree-Fock, che sfrutta la possibilità di scrivere la funzione d'onda degli elettroni come un determinante di Slater, l'accoppiamento di Russell-Saunders e l'accoppiamento jj, che invece riescono ad approssimare l'effetto dovuto all'interazione spin-orbita nel caso di nuclei rispettivamente leggeri (con numero atomico minore di 30) e pesanti.
Per il principio di esclusione di Pauli, due o più elettroni non possono trovarsi nel medesimo stato, cioè non possono essere descritti dai medesimi numeri quantici. Questo fatto determina la distribuzione degli elettroni negli orbitali. Gli orbitali sono occupati dagli elettroni in modo crescente rispetto all'energia. Lo stato di momento angolare è definito dal numero quantico azimutale l; dove il quadrato del valore assoluto del momento angolare è . Il numero quantico magnetico può assumere valori interi compresi tra -l e +l: il numero di tali valori è il numero delle coppie di elettroni, con valore di spin opposto, che possiedono il medesimo numero quantico azimutale. Ad ogni livello energetico corrisponde un numero crescente di possibili valori del numero quantico azimutale, a ogni valore del numero quantico azimutale corrispondono 2l + 1 valori di ml, e a ogni valore di ml corrispondono i due valori possibili di spin.
All'interno della nuvola elettronica è possibile che un elettrone effettui una transizione da un orbitale a un altro principalmente attraverso l'emissione o l'assorbimento di fotoni (cioè di quanti di energia[99]), ma anche in seguito alla collisione con altre particelle o tramite l'effetto Auger.[100] Quando un elettrone acquista un'energia pari alla differenza di energia con uno stato non occupato all'interno degli orbitali, esso effettua una transizione in tale stato. Una delle applicazioni più importanti di tale fenomeno è l'effetto fotoelettrico, in cui l'energia fornita da un fotone è tale da separare l'elettrone dall'atomo.[101] Inoltre, dal momento che l'elettrone è carico, il suo moto attorno al nucleo, che in una descrizione semiclassica è circolare uniforme, produce un momento di dipolo magnetico proporzionale al momento angolare orbitale. Il momento magnetico totale di un atomo è equivalente alla somma vettoriale dei momenti di dipolo magnetici e di spin di tutti i suoi elettroni e dei costituenti del nucleo. Il momento magnetico dei costituenti del nucleo è tuttavia trascurabile rispetto a quello degli elettroni.[102] L'interazione tra il momento di dipolo magnetico e il momento di spin è descritto dall'interazione spin-orbita, mentre l'interazione con un campo magnetico esterno è descritta dai limiti di Paschen-Back e Zeeman, a seconda che l'interazione spin-orbita sia rispettivamente trascurabile o meno rispetto al campo applicato.
Molecole e composti ionici[modifica | modifica wikitesto]
Nelle molecole gli atomi sono uniti dal legame chimico covalente, in cui uno o più elettroni sono condivisi fra due o più atomi.[103] In una molecola gli elettroni si muovono sotto l'influenza attrattiva dei nuclei e il loro stato è descritto da orbitali molecolari, più grandi e complessi di quelli di un atomo isolato, che in prima approssimazione si possono ottenere attraverso la sommatoria di più orbitali degli atomi considerati singolarmente.[104] Differenti orbitali molecolari hanno differenti distribuzioni spaziali di densità di probabilità: nel caso di una molecola costituita da due atomi, per esempio, gli elettroni che ne formano l'eventuale legame si troveranno con maggiore probabilità in una ristretta regione posta fra i due nuclei.[105]
Un composto ionico può essere definito come un composto chimico formato da ioni, aventi ciascuno una carica elettrica positiva o negativa, ma l'insieme di tali ioni ha carica elettrica complessiva neutra. Alla base dei composti ionici vi è il legame ionico, di natura elettrostatica, che si forma quando le caratteristiche chimico-fisiche dei due atomi sono nettamente differenti e vi è una notevole differenza di elettronegatività. Per convenzione si suole riconoscere un legame ionico tra due atomi quando la differenza di elettronegatività Δχ è maggiore di 1,9. Al diminuire di tale differenza cresce il carattere covalente del legame.
Interazione con le forze fondamentali[modifica | modifica wikitesto]
L'elettrone genera un campo elettrico che esercita una forza attrattiva su particelle con una carica positiva (come il protone) e una forza repulsiva su particelle con carica negativa. L'intensità di tale forza è determinata dalla legge di Coulomb. Un elettrone in movimento genera un campo magnetico: tale proprietà prende il nome di "induzione elettromagnetica" ed è responsabile ad esempio della generazione del campo magnetico che permette il funzionamento del motore elettrico.[106] Tramite la legge di Ampère tale movimento rispetto all'osservatore può essere messo in relazione al campo magnetico generato. In generale, i campi elettrici e magnetici prodotti da cariche o correnti elettriche sono calcolati risolvendo le equazioni di Maxwell. Il campo elettromagnetico di una particella carica in movimento è espresso tramite il potenziale di Liénard-Wiechert, anche quando la velocità della particella è prossima a quella della luce.

Quando un elettrone è in moto in corrispondenza di un campo magnetico è soggetto alla forza di Lorentz, la quale esercita una variazione della componente della velocità dell'elettrone perpendicolare al piano definito dal campo magnetico e dalla velocità iniziale dell'elettrone e la forza centripeta che viene generata costringe l'elettrone a seguire una traiettoria elicoidale. L'accelerazione che deriva da questo moto curvilineo, nel caso di velocità relativistiche, causa una radiazione di energia da parte dell'elettrone sotto forma di radiazione di sincrotrone.[107][108][N 12] L'emissione di energia causa a sua volta un rinculo dell'elettrone, conosciuto come forza di Abraham-Lorentz-Dirac, che rallenta il moto dell'elettrone; questa forza è generata da un effetto di retroazione del campo dell'elettrone su sé stesso.[109]
In elettrodinamica quantistica, l'interazione elettromagnetica tra le particelle è trasmessa dai fotoni: un elettrone isolato nello spazio vuoto che non subisce un'accelerazione non è in grado di emettere o di assorbire un fotone reale, poiché così facendo violerebbe le leggi di conservazione dell'energia e della quantità di moto. Invece i fotoni virtuali possono trasferire la quantità di moto tra due particelle cariche ed è questo scambio di fotoni virtuali che genera, per esempio, la forza di Coulomb.[110] L'emissione di energia può avvenire quando un elettrone viene deviato da una particella carica, come per esempio un protone; l'accelerazione dell'elettrone porta all'emissione della radiazione di frenamento o bremsstrahlung.[111]
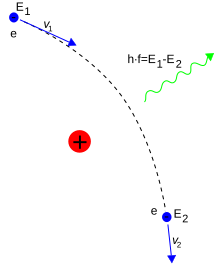
Una collisione anelastica tra un fotone e un elettrone libero produce l'effetto Compton: questo urto è associato a un trasferimento dell'energia e della quantità di moto tra le particelle, che porta alla variazione della lunghezza d'onda del fotone incidente.[N 13] Il valore massimo di questa variazione della lunghezza d'onda è h/mec ed è noto come lunghezza d'onda Compton e per l'elettrone vale 2,43×10−12 m.[112] Se la lunghezza d'onda della luce incidente è sufficientemente lunga (come ad esempio quella della luce visibile, che ha una lunghezza d'onda che va da 0,4×10−6 a 0,7×10−6 m), la variazione della lunghezza d'onda dovuta all'effetto Compton diventa trascurabile e l'interazione tra radiazione e particelle può essere descritta tramite lo scattering Thomson.[113]
La forza dell'interazione elettromagnetica tra due particelle cariche è data dalla costante di struttura fine α che è una quantità adimensionale formata dal rapporto di due contributi energetici: l'energia elettrostatica di attrazione o repulsione data dalla separazione di una lunghezza d'onda Compton e dall'energia a riposo della carica. Il suo valore è 7,297353×10−3, che è possibile approssimare con la frazione 1/137.[114]
Quando elettroni e positroni collidono si annichilano l'un l'altro, originando due o più fotoni dei raggi gamma. Se invece la quantità di moto dell'elettrone e del positrone è trascurabile si può formare il positronio prima che il processo di annichilamento porti alla formazione di due o tre fotoni dei raggi gamma con un'energia totale di 1,022 MeV.[115][116] D'altra parte i fotoni molto energetici possono trasformarsi in un elettrone e in un positrone tramite un processo chiamato produzione di coppia, ma questo avviene solo in presenza di una particella carica nelle vicinanze, come un nucleo atomico.[117][118]
Nella teoria dell'interazione elettrodebole la componente sinistrorsa della funzione d'onda dell'elettrone forma un doppietto di isospin debole con il neutrino elettronico, cioè a causa dell'interazione elettrodebole il neutrino si comporta come un elettrone. Ciascuna componente di questo doppietto può subire l'interazione della corrente debole carica tramite l'emissione o l'assorbimento di un bosone W e può essere trasformata nell'altra componente. La carica è conservata durante questo processo poiché anche il bosone W porta una carica che annulla ogni variazione netta durante la reazione. Le interazioni della corrente debole carica sono responsabili del decadimento beta negli atomi radioattivi. Sia l'elettrone che il neutrino possono subire l'interazione della corrente debole neutra tramite uno scambio di bosoni Z e questo è responsabile dello scattering elastico tra elettrone e neutrino.[119]
Elettroni nei corpi macroscopici[modifica | modifica wikitesto]

Se un corpo ha un numero di elettroni maggiore o minore rispetto a quelli necessari per bilanciare la carica positiva dei nuclei, esso presenterà una carica elettrica netta: nel caso di un eccesso di elettroni, il corpo è carico negativamente, mentre nel caso di un difetto di elettroni, il corpo è carico positivamente; se invece il numero di elettroni e il numero di protoni sono uguali, le loro cariche si annullano a vicenda e il corpo è dunque elettricamente neutro. Un corpo macroscopico può sviluppare una carica elettrica ad esempio attraverso lo sfregamento, per via dell'effetto triboelettrico.[123]
Gli elettroni indipendenti che si muovono nel vuoto sono detti elettroni liberi e anche gli elettroni nei metalli hanno un comportamento simile a quelli liberi. Il flusso di carica elettrica dovuto al moto degli elettroni liberi o in un materiale è detto corrente elettrica. I materiali sono classificati in base alla resistenza che oppongono al passaggio di corrente: si dividono in conduttori, semiconduttori e dielettrici.
In generale, ad una data temperatura, ciascun materiale ha una conducibilità elettrica che determina il valore della corrente quando è applicato un potenziale elettrico. Esempi di buoni conduttori, cioè materiali capaci di far scorrere facilmente al proprio interno elettricità, sono i metalli come il rame e l'oro, mentre vetro e plastica sono cattivi conduttori. I metalli sono spesso anche buoni conduttori di calore. Nonostante questo, al contrario della conducibilità elettrica, la conducibilità termica è quasi indipendente dalla temperatura; ciò è espresso matematicamente dalla legge di Wiedemann-Franz,[124] la quale afferma che il rapporto fra la conduttività termica e la conduttività elettrica è proporzionale alla temperatura.
Cristalli e struttura a bande[modifica | modifica wikitesto]
Le proprietà di conduzione di un solido cristallino sono determinate dagli stati quantistici degli elettroni, la cosiddetta struttura elettronica a bande. Nel caso di solidi amorfi, cioè senza struttura cristallina, la descrizione è più complessa.
Nei solidi cristallini gli atomi sono disposti regolarmente in un reticolo. La simmetria di tale distribuzione spaziale permette di semplificare il calcolo degli stati energetici degli elettroni nel cristallo e ricavare la struttura a bande. Con questa descrizione è possibile approssimare il comportamento degli elettroni nei solidi con quello di elettroni liberi, ma con una diversa massa, detta massa efficace.[125] Un elettrone all'interno di un reticolo cristallino è descritto da una funzione d'onda detta funzione di Bloch, alla quale è associato un vettore detto quasi-impulso o impulso cristallino, che è l'analogo della quantità di moto per gli elettroni liberi. L'analogia con gli elettroni liberi è particolarmente adeguata per alcuni valori di impulso cristallino, per i quali si ha una relazione di dispersione quadratica, come nel caso libero.[126]
Nei solidi gli elettroni sono trattati come quasiparticelle poiché, a causa dell'interazione reciproca e con gli atomi del reticolo, assumono delle proprietà diverse da quelle degli elettroni liberi. Inoltre, nei solidi si introduce una quasiparticella, detta lacuna, che descrive la "mancanza" di un elettrone. Tale particella ha una sua massa efficace ed ha carica positiva, uguale in valore assoluto a quella dell'elettrone.

Nei materiali isolanti gli elettroni rimangono confinati in prossimità dei loro rispettivi nuclei. Al contrario, i metalli hanno una struttura elettronica a bande, alcune delle quali sono parzialmente riempite dagli elettroni. La presenza di queste bande permette agli elettroni nei metalli di muoversi come elettroni liberi o delocalizzati; essi non sono associati a uno specifico atomo e quindi, quando è applicato un campo elettrico, si muovono liberamente come un gas, chiamato gas di Fermi.[124] Un'altra categoria di materiali è quella dei semiconduttori, in cui la conducibilità può variare di molto fra i valori estremi di conduzione e isolante.[127]
A causa delle collisioni fra elettroni e atomi la velocità di deriva degli elettroni in un conduttore è dell'ordine di pochi millimetri per secondo. Ciò nonostante, la velocità di propagazione di un segnale elettrico, cioè la velocità con la quale si propaga la variazione di corrente in un conduttore, è tipicamente di circa il 75% della velocità della luce.[128] Questo accade perché i segnali elettrici si propagano come onde, con una velocità dipendente dalla costante dielettrica del materiale.[129]
Il disordine termico nel reticolo cristallino del metallo causa un aumento della resistività del materiale, producendo quindi la dipendenza dalla temperatura per la corrente elettrica.[130]
Superconduttività[modifica | modifica wikitesto]
Quando alcuni materiali sono raffreddati al di sotto di una certa temperatura critica, avviene una transizione di fase a causa della quale essi perdono la resistività alla corrente elettrica, in un processo noto come superconduttività. Nella teoria BCS, gli elettroni sono legati in coppie che entrano in uno stato quantistico noto come condensato di Bose-Einstein. Tali coppie, dette coppie di Cooper, si accoppiano nel loro moto per mezzo delle vibrazioni di reticolo chiamate fononi, evitando le collisioni con gli atomi che normalmente causano la resistività elettrica[131] (le coppie di Cooper hanno un raggio di circa 100 nm, quindi si possono scavalcare a vicenda).[132] La teoria BCS non descrive tutti i materiali superconduttori, e non esiste ancora un modello teorico in grado di spiegare completamente la superconduttività ad alte temperature.
Altri effetti[modifica | modifica wikitesto]
Gli elettroni all'interno dei solidi conduttivi, che sono a loro volta trattati come quasi-particelle, quando sono strettamente confinati intorno a temperature vicine alle zero assoluto si comportano globalmente come due nuove differenti quasi-particelle: gli spinoni e gli oloni.[133][134] Il primo trasporta spin e momento magnetico, mentre il secondo la carica elettrica. Gli elettroni possono, secondo la teoria di Eugene Paul Wigner, formare essi stessi una struttura cristallina, disponendosi nei punti di un reticolo. Tale stato della materia è detto cristallo di Wigner.
Formazione[modifica | modifica wikitesto]

Per spiegare gli istanti iniziali dell'evoluzione dell'universo è stata sviluppata la teoria del Big Bang, che è la più accettata dalla comunità scientifica.[135] Nel primo millisecondo dell'esistenza dell'universo noto, la temperatura era di circa un miliardo di kelvin e i fotoni avevano un'energia media nell'ordine del milione di elettronvolt; questi fotoni erano sufficientemente energetici da poter reagire l'un l'altro per formare coppie di elettroni e positroni:
dove è il fotone, è il positrone e è l'elettrone. Contemporaneamente le coppie elettrone-positrone si annichilivano e producevano fotoni energetici. I due processi erano in equilibrio durante la prima fase di evoluzione dell'universo, ma dopo 15 secondi la temperatura dell'universo calò sotto la soglia di formazione delle coppie di elettroni-positroni. La maggior parte degli elettroni e positroni rimasti si annichilirono e produssero raggi gamma che in breve tempo irradiarono l'universo.[136]
Per ragioni non ancora ben comprese, durante il processo di leptogenesi vi era un numero maggiore di elettroni rispetto a quello dei positroni,[137] perciò circa un elettrone ogni miliardo sopravvisse durante il processo di annichilazione. Questo eccesso era analogo a quello dei protoni sugli antiprotoni, in una condizione nota come asimmetria barionica, perciò la carica netta presente nell'universo risultava nulla.[138][139] I protoni e i neutroni superstiti iniziarono a interagire nel processo della nucleosintesi primordiale, durato fino a circa 5 minuti dopo l'istante iniziale, in cui si assistette alla formazione dei nuclei degli isotopi di idrogeno, elio e in minima parte litio.[140] I neutroni rimasti subirono il decadimento beta, con una vita media di circa quindici minuti, con la formazione di un protone, un elettrone e un antineutrino:
dove è il neutrone, è il protone e è l'antineutrino elettronico. Per i successivi 300 000-400 000 anni gli elettroni liberi erano troppo energetici per legarsi ai nuclei atomici;[141] passato questo periodo, seguì un processo di ricombinazione, in cui gli elettroni si legarono ai nuclei atomici per formare atomi elettricamente neutri e a causa di ciò l'universo divenne trasparente alla radiazione elettromagnetica.[142]
Circa un milione di anni dopo il Big Bang, si iniziò a formare la prima generazione di stelle;[142] all'interno di queste stelle, la nucleosintesi portò alla produzione di positroni derivanti dalla fusione di nuclei atomici e queste particelle di antimateria si annichilirono immediatamente con gli elettroni formando raggi gamma. Ciò portò a una continua riduzione nel numero di elettroni e a un corrispettivo aumento di neutroni; nonostante questo il processo di evoluzione stellare portò alla sintesi di isotopi radioattivi i quali potevano decadere con un decadimento di tipo beta, emettendo in questo modo un elettrone e un antineutrino dal nucleo.[143]

Alla fine della sua vita, una stella di massa superiore di 20 volte la massa solare può subire un collasso gravitazionale e formare un buco nero;[144] in base alle leggi della fisica classica, questo oggetto stellare massivo esercita un'attrazione gravitazione così grande da impedire a qualsiasi cosa, anche alla radiazione elettromagnetica, di potergli sfuggire una volta che è stato superato il raggio di Schwarzschild. Si pensa tuttavia che gli effetti quantistici possano permettere l'emissione di una radiazione di Hawking a tale distanza, infatti si ritiene che sull'orizzonte degli eventi di questi oggetti vengano prodotte coppie virtuali di elettroni e positroni e quando esse vengono formate in prossimità dell'orizzonte degli eventi, la distribuzione spaziale casuale di queste particelle può permettere a una particella della coppia di apparire all'esterno dell'orizzonte grazie all'effetto tunnel. Il potenziale gravitazionale del buco nero può fornire l'energia sufficiente per trasformare la particella virtuale in una particella reale, facendo in modo da diffonderla nello spazio,[145] mentre all'altra particella della coppia è stata fornita energia negativa e ciò comporta una perdita netta di energia del buco nero. La velocità della radiazione di Hawking cresce con il diminuire della massa e questo comporta l'evaporazione del buco nero che alla fine esplode.[146]
Un altro modo di formazione degli elettroni è dato dall'interazione dei raggi cosmici con gli strati alti dell'atmosfera: i raggi cosmici sono particelle che viaggiano nello spazio con energie anche dell'ordine dei 3×1020 eV[147] e, quando esse collidono con le particelle presenti nell'alta atmosfera terrestre, vi è la produzione di una cascata di particelle, tra le quali pioni e muoni,[148] con questi ultimi che sono i responsabili di più della metà della radiazione cosmica osservata a Terra. Il decadimento del pione porta alla formazione dei muoni tramite il seguente processo:
mentre a suo volta il muone può decadere formando elettroni:
Osservazioni sperimentali[modifica | modifica wikitesto]

Le prime osservazioni degli elettroni come particella, hanno sfruttato fenomeni elettrostatici o la produzione di raggi catodici. Oggi si eseguono esperimenti in laboratorio in cui vengono osservati elettroni sia per lo studio delle proprietà di queste particelle, sia per studiare le proprietà di corpi macroscopici.
In condizioni di laboratorio, l'interazione di elettroni individuali possono essere osservate con l'uso di rilevatori di particelle, che permettono misure precise di specifiche proprietà come energia, spin e carica elettrica[150]. Lo sviluppo della trappola ionica quadrupolare ha permesso di contenere particelle in piccole regioni dello spazio per lunghi periodi. Questo ha permesso la misura precisa delle proprietà particellari. Per esempio in una misurazione si è riusciti a contenere un singolo elettrone per un periodo di dieci mesi.[151] Il momento magnetico di un elettrone fu misurato con una precisione di 11 cifre significative, che, nel 1980, è la misura migliore di una costante fisica.[152]
La prima immagine video della distribuzione di energia di un elettrone è stata catturata da un team dell'università di Lund in Svezia, nel febbraio 2008. Gli scienziati hanno usato flash estremamente piccoli di luce, che hanno permesso di osservare il moto di un elettrone per la prima volta.[153][154]
Tramite la misura dell'energia irradiata da elettroni, gran parte delle misure spettroscopiche sono collegati allo studio degli elettroni liberi o legati, misurando l'energia dei fotoni emessi.
Per esempio, nell'ambiente ad alta energia come la corona di una stella, gli elettroni liberi formano un plasma che emette energia per gli effetti di Bremsstrahlung. Il gas elettronico può formare delle oscillazioni di plasma, ovvero oscillazioni regolari della densità degli elettroni, e queste possono produrre emissioni di energia che possono essere rilevate usando i radiotelescopi.[155]
Nel caso di atomi e molecole, un elettrone confinato a muoversi attorno a un nucleo può transire fra i diversi livelli energetici di questo consentiti, assorbendo o emettendo fotoni di frequenza caratteristica. Per esempio, quando un atomo è irraggiato da una sorgente con uno spettro continuo, appariranno delle distinte linee spettrali per la radiazione trasmessa. Ciascun elemento o molecola esibisce un insieme caratteristico proprio di serie di linee spettrali, che lo distinguono dagli altri atomi, come per esempio il noto caso delle serie dello spettro dell'atomo di idrogeno. Lo studio dell'intensità e la larghezza di queste linee permette di indagare le proprietà fisico-chimiche delle sostanze in analisi.[156][157]
La distribuzione di elettroni nei materiali solidi può essere visualizzata dallo spettroscopio ARPES (Angle resolved photoemission spectroscopy, ovvero spettroscopia fotoelettrica angolarmente risolta). Questa tecnica si basa sull'effetto fotoelettrico per misurare il reticolo reciproco, una rappresentazione matematica della struttura periodica di un cristallo. ARPES può essere usato per determinare la direzione, la velocità e la diffusione di elettroni nel materiale.[158]
Applicazioni[modifica | modifica wikitesto]

I fasci di elettroni sono usati nella saldatura di materiali,[160] permettendo di raggiungere densità di energia superiori ai 107 W·cm−2 nello stretto diametro focale di 0,1-1,3 mm e spesso non richiedono un materiale di riempimento. Questa tecnica di saldatura deve essere eseguita nel vuoto, in modo tale che gli elettroni non interagiscano con l'aria prima di raggiungere il bersaglio e può essere usata per unire materiali conduttori che altrimenti sarebbero difficili da saldare.[161][162]
La litografia a fasci di elettroni (EBL) è un metodo per stampare i semiconduttori a risoluzioni più basse del micron.[163] Questa tecnica è limitata dagli alti costi, basse performance, dalla necessità di operare con fascio nel vuoto e dalla tendenza degli elettroni a essere diffusi nei solidi. L'ultimo problema limita la risoluzione a circa 10 nm. Per questa ragione, l'EBL è principalmente usata per la produzione di un piccolo numero di circuiti integrati specializzati.[164]
La lavorazione con fasci di elettroni è usata per irradiare i materiali in modo da cambiare le loro proprietà fisiche o per la sterilizzazione medica e la produzione di cibo.[165] Nella radioterapia, i fasci di elettroni generati da acceleratori lineari sono usati per il trattamento di tumori superficiali: dato che un fascio di elettroni può penetrare solamente uno spessore limitato prima di essere assorbito, tipicamente intorno a 5 cm per elettroni di energia nel range 5–20 MeV, la radioterapia è utile per il trattamento di lesioni della cute come il carcinoma basocellulare. Un fascio di elettroni può essere usato per integrare il trattamento di aree che sono state irraggiate da raggi X.[166][167]
Gli acceleratori di particelle usano campi elettrici per far raggiungere agli elettroni e alle loro antiparticelle alte energie. Nel momento in cui queste particelle passano in una regione in cui c'è campo magnetico, questi emettono radiazione di sincrotrone. L'intensità di questa radiazione dipende dallo spin e questo può permettere la polarizzazione dei fasci di elettroni in un processo noto come effetto Sokolov-Ternov.[168] La polarizzazione di fasci di elettroni può essere molto utile per numerosi esperimenti. La radiazione di sincrotrone può anche essere usata per raffreddare il fascio di elettroni, in modo da ridurre la quantità di moto persa dalle particelle. Una volta che le particelle sono state accelerate sino alla energia richiesta, i fasci separati di elettroni e positroni sono portati alla collisione e la risultante emissione di radiazione è osservata dai rivelatori di particelle ed è studiata dalla fisica particellare.[169]
Produzione di immagini[modifica | modifica wikitesto]

Gli elettroni possono essere utilizzati anche per ottenere immagini microscopiche grazie ai microscopi elettronici, che indirizzano un fascio focalizzato direttamente sul campione. A causa dell'interazione del fascio con il materiale, alcuni elettroni cambiano le loro proprietà, come una variazione della direzione, della fase relativa e dell'energia. Registrando questi cambiamenti del fascio elettronico, si possono produrre immagini a risoluzione atomica del materiale.[170] Questa elevata risoluzione, maggiore dei microscopi ottici (che è di circa 200 nm in luce blu), è possibile poiché i microscopi elettronici sono limitati dalla lunghezza d'onda di De Broglie degli elettroni (a titolo d'esempio, un elettrone ha una lunghezza d'onda di 0,0037 nm quando questo viene accelerato da un potenziale di 100 kV).[171][172] Il microscopio elettronico a trasmissione corretto in aberrazione è in grado di avere una risoluzione inferiore a 0,05 nm, che è sufficiente per risolvere i singoli atomi.[173] Queste caratteristiche tecniche rendono il microscopio elettronico uno strumento di laboratorio utile per le immagini ad alta risoluzione; a fronte di questi vantaggi, i microscopi elettronici sono strumenti molto costosi da mantenere.
Vi sono due tipi di microscopi elettronici: a trasmissione e a scansione. Il primo funziona in maniera analoga a una lavagna luminosa, ovvero il fascio di elettroni passa attraverso una parte del campione e viene successivamente proiettato tramite lenti su diapositive o su un CCD. Nel secondo invece l'immagine è prodotta con un fascio elettronico molto fine che scansione riga per riga una piccola regione del campione; l'ingrandimento varia da 100× a 1 000 000× o più per entrambi i microscopi. Un altro tipo di microscopio elettronico è quello a effetto tunnel sfrutta l'effetto tunnel quantistico degli elettroni che fluiscono da una punta conduttrice appuntita al materiale di interesse e può riprodurre immagini a risoluzione atomica delle superfici.[174][175][176]
Altre tecniche permettono di studiare la struttura cristallina dei solidi; una tecnica che sfrutta questo principio è la diffrazione di elettroni a bassa energia (LEED) che permette di visualizzare su uno schermo fluorescente la figura di diffrazione di un cristallo utilizzando un fascio collimato di elettroni avente un'energia tra i 20 e i 200 eV.[177] Un altro metodo che sfrutta la diffrazione è la diffrazione di elettroni ad alta energia per riflessione (RHEED, da reflection high-energy electron diffraction) che sfrutta la riflessione di un fascio di elettroni incidente a piccoli angoli in modo da caratterizzare la superficie del materiale di studio; l'energia tipica del fascio è tra 8 e 20 keV, mentre l'angolo di incidenza varia tra 1° e 4°.[178][179]
Altre applicazioni[modifica | modifica wikitesto]

Nel laser a elettroni liberi, un fascio di elettroni a energia relativistica passa attraverso una coppia di ondulatori che contengono una serie di dipoli magnetici, i cui campi sono orientati in direzioni alternate; l'elettrone emette radiazione di sincrotrone che, a turno, interagisce coerentemente con lo stesso elettrone e ciò porta a un grosso aumento del campo di radiazione alla frequenza di risonanza. Il laser può emettere una radiazione elettromagnetica coerente ad alta radianza con un ampio intervallo di frequenze, che va dalle microonde ai raggi X morbidi. Questo strumento potrà essere utilizzato per l'industria, per le comunicazioni e per varie applicazioni mediche, come la chirurgia dei tessuti molli.[180]
Gli elettroni sono fondamentali per il funzionamento dei tubi catodici, che sono largamente usati nei dispositivi come computer e televisori.[181] In un tubo fotomoltiplicatore ogni fotone che colpisce il fotocatodo dà inizio a una cascata di elettroni che produce un impulso di corrente rivelabile.[182] I tubi a vuoto sfruttano il flusso di elettroni per manipolare i segnali elettrici e svolgono un ruolo importante nello sviluppo nell'elettronica; nonostante ciò essi sono stati in gran parte soppiantati dai dispositivi a semiconduttori come i transistor.[183]
Annotazioni[modifica | modifica wikitesto]
- ^ Il raggio classico dell'elettrone è ottenuto nel seguente modo: si assume la carica dell'elettrone distribuita uniformemente all'interno di una sfera, che assume così un'energia potenziale elettrostaica. L'energia eguaglia l'energia a riposo dell'elettrone, definita dalla relatività ristretta come E=mc2. In elettrostatica l'energia potenziale di una sfera con raggio r e carica e è data da:
- ^ Tale risultato è mostrato attraverso l'importante esperimento della doppia fenditura, in cui si mostra la natura ondulatoria dell'elettrone, che attraversa le due fenditure contemporaneamente causando una figura di interferenza.
- ^ La probabilità che la particella si trovi nell'intervallo al tempo t è:
- ^ Lo scambio di due elettroni comporta che la funzione d'onda diventi , dove le variabili e corrispondono rispettivamente alle posizioni del primo e del secondo elettrone.
- ^ L'equazione agli autovalori per l'osservabile di spin al quadrato è:
- ^ L'equazione agli autovalori per l'osservabile di spin nella direzione dell'asse z è
- ^ Il magnetone di Bohr è definito come:
- ^ La scrittura generale dell'equazione di Schrödinger è:
- ^ Risolvendo per la velocità dell'elettrone, e usando l'approssimazione di grandi , si ottiene:
- ^ Nello specifico si ha che ΔE·Δt ≥ ħ
- ^ La costante di struttura fine , che in unità naturali è legata alla carica elettrica dell'elettrone attraverso la formula:
- ^ La radiazione proveniente da elettroni non relativistici è a volte chiamata radiazione di ciclotrone.
- ^ Il cambiamento della lunghezza d'onda Δλ dipende dall'angolo di rinculo θ dalla seguente relazione:
Note[modifica | modifica wikitesto]
- ^ M. Born, R.J. Blin-Stoyle; J.M. Radcliffe, Atomic Physics, Courier Dover, 1989, p. 26, ISBN 0-486-65984-4.
- ^ Electron mass, su physics.nist.gov, NIST. URL consultato il 3 luglio 2019.. La versione frazionaria è l'inverso del valore decimale (con un'incertezza di 4,4×10−10)
- ^ [1]
- ^ https://physics.nist.gov/cgi-bin/cuu/Value?mec2mev
- ^ La carica dell'elettrone è il negativo della carica elementare (che è la carica positiva del protone). Valore del CODATA accessibili tramite il NIST alla pagina carica elementare
- ^ (EN) IUPAC Gold Book, "electron"
- ^ a b Eichten e Peskin, pp. 811-814.
- ^ Pauling, pp. 4-10.
- ^ Lorenzo Rocci, Vocabolario Greco Italiano, 37ª ed., Società editrice Dante Alighieri, 1993, p. 850.
- ^ DIZIONARIO GRECO ANTICO - Greco antico - Italiano, su www.grecoantico.com. URL consultato il 13 marzo 2024.
- ^ Giuseppe Rigutini, Vocabolario Greco-Italiano e Italiano-Greco, 13ª ed., Firenze, G. Barbera, 1925, p. 375.
- ^ Joseph T. (Joseph Twadell) Shipley, Dictionary of word origins, New York, Philosophical Library, 1945, p. 133. URL consultato il 13 marzo 2024.
- ^ Benjamin Park Cornell University Library, A history of electricity (The intellectual rise in electricity) from antiquity to the days of Benjamin Franklin, New York, J. Wiley, 1898, pp. 315, 484–485. URL consultato il 13 marzo 2024.
- ^ (EN) "The electron and the light-quant from the experimental point of view" (PDF), su nobelprize.org. URL consultato il 29 aprile 2014.
- ^ Arabatzis, pp. 70-74.
- ^ Dahl, p. 46.
- ^ Dahl, p. 188.
- ^ G.J. Stoney, Of the "Electron," or Atom of Electricity, in Philosophical Magazine, vol. 38, n. 5, 1894, pp. 418–420.
- ^ A.H. Soukhanov, Word Mysteries & Histories, Houghton Mifflin Company, 1986, p. 73, ISBN 0-395-40265-4.
- ^ D.B. Guralnik, Webster's New World Dictionary, Prentice Hall, 1970, p. 450.
- ^ Dahl (1997:55–58).
- ^ R.K. DeKosky, William Crookes and the quest for absolute vacuum in the 1870s, in Annals of Science, vol. 40, n. 1, 1983, pp. 1-18, DOI:10.1080/00033798300200101.
- ^ a b c H.M. Leicester, The Historical Background of Chemistry, Courier Dover Publications, 1971, pp. 221-222, ISBN 0-486-61053-5.
- ^ Dahl (1997:64–78).
- ^ P. Zeeman, Sir William Crookes, F.R.S, in Nature, vol. 77, n. 1984, 1907, pp. 1-3, Bibcode:1907Natur..77....1C, DOI:10.1038/077001a0.
- ^ a b c Dahl (1997:99).
- ^ a b c d J.J. Thomson, Cathode Rays, in Philosophical Magazine, vol. 44, 1897, p. 293.
- ^ R. Wilson, Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe, CRC Press, 1997, p. 138, ISBN 0-7484-0748-0.
- ^ J.J. Thomson, Nobel Lecture: Carriers of Negative Electricity (PDF), su nobelprize.org, Fondazione Nobel, 1906. URL consultato il 25 agosto 2008 (archiviato dall'url originale il 10 ottobre 2008).
- ^ T.J. Trenn, Rutherford on the Alpha-Beta-Gamma Classification of Radioactive Rays, in Isis, vol. 67, n. 1, 1976, pp. 61-75, DOI:10.1086/351545, JSTOR 231134.
- ^ H. Becquerel, Déviation du Rayonnement du Radium dans un Champ Électrique, in Comptes Rendus de l'Académie des Sciences, vol. 130, 1900, pp. 809-815. (FR)
- ^ Buchwald and Warwick (2001:90–91).
- ^ W.G. Myers, Becquerel's Discovery of Radioactivity in 1896, in Journal of Nuclear Medicine, vol. 17, n. 7, 1976, pp. 579-582, PMID 775027.
- ^ I.K. Kikoin, I.S. Sominskiĭ, Abram Fedorovich Ioffe (on his eightieth birthday), in Soviet Physics Uspekhi, vol. 3, n. 5, 1961, pp. 798-809, Bibcode:1961SvPhU...3..798K, DOI:10.1070/PU1961v003n05ABEH005812. Pubblicazione originale in russo: И.К. Кикоин, М.С. Соминский, Академик А.Ф. Иоффе (PDF), in Успехи Физических Наук, vol. 72, n. 10, 1960, pp. 303-321.
- ^ R.A. Millikan, The Isolation of an Ion, a Precision Measurement of its Charge, and the Correction of Stokes' Law, in Physical Review, vol. 32, n. 2, 1911, pp. 349-397, Bibcode:1911PhRvI..32..349M, DOI:10.1103/PhysRevSeriesI.32.349.
- ^ N.N. Das Gupta, S.K. Ghosh, A Report on the Wilson Cloud Chamber and Its Applications in Physics, in Reviews of Modern Physics, vol. 18, n. 2, 1999, pp. 225-290, Bibcode:1946RvMP...18..225G, DOI:10.1103/RevModPhys.18.225.
- ^ a b c Smirnov, pp. 4-10.
- ^ Gilbert N. Lewis, The Atom and the Molecule, in Journal of the American Chemical Society, vol. 38, n. 4, aprile 1916, pp. 762-786, DOI:10.1021/ja02261a002.
- ^ a b T. Arabatzis, K. Gavroglu, The chemists' electron, in European Journal of Physics, vol. 18, n. 3, 1997, pp. 150-163, Bibcode:1997EJPh...18..150A, DOI:10.1088/0143-0807/18/3/005.
- ^ Irving Langmuir, The Arrangement of Electrons in Atoms and Molecules (PDF), in Journal of the American Chemical Society, vol. 41, n. 6, 1919, pp. 868-934 (archiviato dall'url originale il 30 marzo 2012).
- ^ Eric R. Scerri, The Periodic Table, Oxford University Press US, 2007, pp. 205-226.
- ^ Michela Massimi, Pauli's Exclusion Principle, The Origin and Validation of a Scientific Principle, Cambridge University Press, 2005.
- ^ (DE) G. E. Uhlenbeck, S. Goudsmith, Ersetzung der Hypothese vom unmechanischen Zwang durch eine Forderung bezüglich des inneren Verhaltens jedes einzelnen Elektrons, in Die Naturwissenschaften, vol. 13, n. 47, 1925.
- ^ (DE) W. Pauli, Über die Gesetzmäßigkeiten des anomalen Zeemaneffektes, in Zeitschrift für Physik, vol. 16, n. 1, 1923, pp. 155-164.
- ^ The Nobel Prize in Physics 1929, su nobelprize.org. URL consultato il 6 aprile 2012.
- ^ a b Louis de Broglie, Nobel Lecture: The Wave Nature of the Electron (PDF), su nobelprize.org, Fondazione Nobel, 1929. URL consultato il 30 agosto 2008.
- ^ Clinton Davisson, Nobel Lecture: The Discovery of Electron Waves (PDF), su nobelprize.org, Fondazione Nobel, 1937. URL consultato il 30 agosto 2008.
- ^ (EN) Albert Einstein, Leopold Infeld, The Evolution of Physics, 1967, pp. 262-263, ISBN 978-0-671-20156-2.
- ^ Erwin Schrödinger, Quantisierung als Eigenwertproblem, in Annalen der Physik, vol. 385, n. 13, 1926, pp. 437-490, Bibcode:1926AnP...385..437S, DOI:10.1002/andp.19263851302. (DE)
- ^ John S. Rigden, Hydrogen, Harvard University Press, 2003, pp. 59-86, ISBN 0-674-01252-6.
- ^ Bruce Cameron Reed, Quantum Mechanics, Jones & Bartlett Publishers, 2007, pp. 275-350, ISBN 0-7637-4451-4.
- ^ Paul A. M. Dirac, The Quantum Theory of the Electron, in Proceedings of the Royal Society of London A, vol. 117, n. 778, 1928, pp. 610-624, DOI:10.1098/rspa.1928.0023.
- ^ , Paul A. M. Dirac, Nobel Lecture: Theory of Electrons and Positrons (PDF), su nobelprize.org, Fondazione Nobel, 1933. URL consultato il 1º novembre 2008.
- ^ Carl D. Anderson, The Positive Electron, in Physical Review, vol. 43, n. 6, 1933, pp. 491–494, Bibcode:1933PhRv...43..491A, DOI:10.1103/PhysRev.43.491.
- ^ Helge Kragh, Quantum Generations: A History of Physics in the Twentieth Century, Princeton University Press, 2002, p. 132, ISBN 0-691-09552-3.
- ^ Frank Gaynor, Concise Encyclopedia of Atomic Energy, The Philosophical Library, 1950, p. 117.
- ^ Felix Finster, The principle of the fermionic projector, American Mathematical Soc., 2006, p. 16, ISBN 0-8218-3974-8.
- ^ The Nobel Prize in Physics 1965, su nobelprize.org, Fondazione Nobel. URL consultato il 4 novembre 2008.
- ^ (EN) Wolfgang K.H. Panofsky, The Evolution of Particle Accelerators & Colliders (PDF), su slac.stanford.edu, 1997. URL consultato l'11 aprile 2010.
- ^ (EN) Malcom W. Browne, Donald William Kerst Dies at 81; Built Particle Accelerators in 40's, su nytimes.com, 20 agosto 1993. URL consultato l'11 aprile 2010.
- ^ Elder, Gurewitsch, Langmuir e Pollock, pp. 829-830.
- ^ Hoddeson, Brown, Riordan e Dresden, pp. 25-26.
- ^ Bernardini, pp. 156-183.
- ^ (EN) Testing the Standard Model: The LEP experiments, su public.web.cern.ch, 2008. URL consultato l'11 aprile 2010.
- ^ LEP reaps a final harvest, su cerncourier.com, 1º dicembre 2000. URL consultato l'11 aprile 2010.
- ^ (EN) Synchrotron Radiation (PDF), su asd.gsfc.nasa.gov, 2008.
- ^ a b c Curtis, p. 74.
- ^ Leptons, su hyperphysics.phy-astr.gsu.edu. URL consultato il 5 novembre 2022.
- ^ Povh.
- ^ Electron, su britannica.com. URL consultato il 26 luglio 2011.
- ^ Murphy, pp. 1611-1613.
- ^ Zorn, pp. 2566-2576.
- ^ a b Raith e Mulvey, pp. 777-781.
- ^ Gabrielse, pp. 030802(1-4).
- ^ Dehmelt, pp. 102-110.
- ^ Meschede, p. 168.
- ^ Steinberg, pp. 2582-2586.
- ^ Yao, pp. 77-115.
- ^ a b c Munowitz, pp. 162-218.
- ^ a b Odom, pp. 030801(1-4).
- ^ Anastopoulos, pp. 261-262.
- ^ (EN) Special Relativity, su www2.slac.stanford.edu, slac.stanford.edu. URL consultato il 5 aprile 2010.
- ^ Adams, p. 215.
- ^ Gordon Kane, Are virtual particles really constantly popping in and out of existence? Or are they merely a mathematical bookkeeping device for quantum mechanics?, su scientificamerican.com, 9 ottobre 2006. URL consultato il 9 aprile 2010 (archiviato dall'url originale il 10 agosto 2011).
- ^ Taylor, p. 464.
- ^ John Gribbin, More to electrons than meets the eye, su newscientist.com, 25 gennaio 1997. URL consultato il 9 aprile 2010.
- ^ Hitoshi Murayama, Supersymmetry Breaking Made Easy, Viable and Generic, Proceedings of the XLIInd Rencontres de Moriond on Electroweak Interactions and Unified Theories, La Thuile, 10–17 marzo 2006, arΧiv:0709.3041.
- ^ Mohr, Taylor e Newell, CODATA recommended values of the fundamental physical constants: 2006, 2008, p. 646.
- ^ Murray Gell-mann, Murray Gell-mann: Selected Papers, World Scientific Series in 20th Century Physics, 2010, p. 3, ISBN 978-981-283-684-7. URL consultato il 23 aprile 2012 (archiviato dall'url originale il 19 maggio 2012).
- ^ Current advances: The fine-structure constant and quantum Hall effect, su physics.nist.gov. URL consultato il 23 aprile 2012.
- ^ M. Göckeler, R. Horsley, V. Linke, P. Rakow, G. Schierholz, H. Stüben, Is there a Landau Pole Problem in QED?, 1997.
- ^ Schwinger, pp. 416-417.
- ^ Huang, pp. 123-125.
- ^ Foldy, pp. 29-36.
- ^ Sidharth, pp. 497-506.
- ^ Genz.
- ^ Levine, pp. 424-427.
- ^ Numeri quantici e livelli energetici, su sapere.it. URL consultato il 17 marzo 2014.
- ^ Mulliken, pp. 13-24.
- ^ Burhop, pp. 2-3.
- ^ Claus Grupen, Physics of Particle Detection, AIP Conference Proceedings, Instrumentation in Elementary Particle Physics, VIII, vol. 536, Istanbul, Dordrecht, D. Reidel Publishing Company, 28 giugno – 10 luglio, 1999, pp. 3-34, DOI:10.1063/1.1361756.
- ^ Jiles, pp. 280-287.
- ^ Löwdin, Brändas e Kryachko, pp. 393-394.
- ^ McQuarrie e Simon, pp. 280-287.
- ^ Daudel, pp. 1310-1320.
- ^ Crowell, pp. 129-152.
- ^ Munowitz, p. 160.
- ^ Mahadevan, Narayan e Yi, pp. 327-337.
- ^ Rohrlich, pp. 1109-1112.
- ^ Georgi, p. 427.
- ^ Blumenthal, pp. 237-270.
- ^ (EN) Compton wavelength λc, su physics.nist.gov. URL consultato l'11 aprile 2010.
- ^ Chen, Maksimchuk e Umstadter, pp. 653-655.
- ^ (EN) Fine-structure constant α, su physics.nist.gov. URL consultato l'11 aprile 2010.
- ^ Beringer e Montgomery, pp. 222-224.
- ^ Wilson e Buffa, p. 888.
- ^ Eichler, pp. 67-72.
- ^ Hubbell, pp. 614-623.
- ^ Chris Quigg, The Electroweak Theory, TASI 2000: Flavor Physics for the Millennium, Boulder, arXiv, 4-30 giugno 2000, p. 80, arΧiv:hep-ph/0204104v1.
- ^ Rakov, Vladimir A.; Uman, Martin A., Lightning: Physics and Effects, Cambridge University Press, 2007, p. 4, ISBN 0-521-03541-4.
- ^ Gordon R. Freeman, Triboelectricity and some associated phenomena, in Materials science and technology, vol. 15, n. 12, 1999, pp. 1454–1458.
- ^ Keith M. Forward, Daniel J. Lacks; R. Mohan Sankaran, Methodology for studying particle–particle triboelectrification in granular materials, in Journal of Electrostatics, vol. 67, n. 2-3, 2009, pp. 178–183, DOI:10.1016/j.elstat.2008.12.002.
- ^ Steven Weinberg, The Discovery of Subatomic Particles, Cambridge University Press, 2003, pp. 15–16, ISBN 0-521-82351-X.
- ^ a b J. M. Ziman, Electrons and Phonons: The Theory of Transport Phenomena in Solids, Oxford University Press, 2001, p. 260, ISBN 0-19-850779-8.
- ^ Liang-fu Lou, Introduction to phonons and electrons, World Scientific, 2003, pp. 162,164, ISBN 978-981-238-461-4.
- ^ (EN) Electrons in Crystals, su eng.fsu.edu. URL consultato il 13 aprile 2012.
- ^ M. K. Achuthan, Bhat, K. N., Fundamentals of Semiconductor Devices, Tata McGraw-Hill, 2007, pp. 49–67, ISBN 0-07-061220-X.
- ^ Peter Main, When electrons go with the flow: Remove the obstacles that create electrical resistance, and you get ballistic electrons and a quantum surprise, in New Scientist, vol. 1887, 12 giugno 1993, p. 30. URL consultato il 9 ottobre 2008.
- ^ Glenn R. Blackwell, The Electronic Packaging Handbook, CRC Press, 2000, pp. 6.39–6.40, ISBN 0-8493-8591-1.
- ^ Durrant, Quantum Physics of Matter: The Physical World, CRC Press, 2000, pp. 43, 71–78, ISBN 0-7503-0721-8.
- ^ Staff, The Nobel Prize in Physics 1972, su nobelprize.org, The Nobel Foundation, 2008. URL consultato il 13 ottobre 2008.
- ^ Alan M. Kadin, Spatial Structure of the Cooper Pair, in Journal of Superconductivity and Novel Magnetism, vol. 20, n. 4, 2007, pp. 285–292, DOI:10.1007/s10948-006-0198-z, arΧiv:cond-mat/0510279.
- ^ Discovery About Behavior Of Building Block Of Nature Could Lead To Computer Revolution, su ScienceDaily.com, 31 luglio 2009. URL consultato il 1º agosto 2009.
- ^ Yodchay Jompol, CJ Ford, JP Griffiths, I Farrer, GA Jones, D Anderson, DA Ritchie, TW Silk e AJ Schofield, Probing Spin-Charge Separation in a Tomonaga-Luttinger Liquid, in Science, vol. 325, n. 5940, 31 luglio 2009, pp. 597–601, DOI:10.1126/science.1171769, PMID 19644117. URL consultato il 1º agosto 2009.
- ^ Paul F. Lurquin, The Origins of Life and the Universe, Columbia University Press, 2003, p. 2, ISBN 0-231-12655-7.
- ^ Joseph Silk, The Big Bang: The Creation and Evolution of the Universe, 3ª ed., Macmillan, 2000, pp. 110–112, 134–137, ISBN 0-8050-7256-X.
- ^ Vic Christianto, Thirty Unsolved Problems in the Physics of Elementary Particles (PDF), in Progress in Physics, vol. 4, 2007, pp. 112–114 (archiviato dall'url originale il 10 settembre 2008).
- ^ Edward W. Kolb, The Development of Baryon Asymmetry in the Early Universe, in Physics Letters B, vol. 91, n. 2, 7 aprile 1980, pp. 217–221, DOI:10.1016/0370-2693(80)90435-9.
- ^ Eric Sather, The Mystery of Matter Asymmetry (PDF), su slac.stanford.edu, 1996. URL consultato il 12 aprile 2010.
- ^ Scott Burles, Kenneth M. Nollett; Michael S. Turner, Big-Bang Nucleosynthesis: Linking Inner Space and Outer Space, su arxiv.org, arXiv, University of Chicago, 19 marzo 1999. URL consultato il 12 aprile 2010.
- ^ A.M. Boesgaard, G. Steigman, Big bang nucleosynthesis – Theories and observations, in Annual review of astronomy and astrophysics, vol. 23, n. 2, 1985, pp. 319–378, DOI:10.1146/annurev.aa.23.090185.001535.
- ^ a b Rennan Barkana, The First Stars in the Universe and Cosmic Reionization, in Science, vol. 313, n. 5789, 18 agosto 2006, pp. 931–934, DOI:10.1126/science.1125644, PMID 16917052.
- ^ E. M. Burbidge et al., Synthesis of Elements in Stars, in Reviews of Modern Physics, vol. 29, n. 4, 1957, pp. 548-647, Bibcode:1957RvMP...29..547B, DOI:10.1103/RevModPhys.29.547.
- ^ C. L. Fryer, Mass Limits For Black Hole Formation, in Astrophysical Journal, vol. 522, n. 1, 1999, pp. 413-418, Bibcode:1999ApJ...522..413F, DOI:10.1086/307647, arXiv:astro-ph/9902315.
- ^ M. K. Parikh, F. Wilczek, Hawking Radiation As Tunneling, in Physical Review Letters, vol. 85, n. 24, 2000, pp. 5042-5045, Bibcode:2000PhRvL..85.5042P, DOI:10.1103/PhysRevLett.85.5042, PMID 11102182, arXiv:hep-th/9907001.
- ^ (EN) S. W. Hawking, Black hole explosions?, in Nature, vol. 248, 5443doi=10.1038/248030a0, 1974, pp. 30-31, Bibcode:1974Natur.248...30H.
- ^ (EN) F. Halzen, D. Hooper, High-energy neutrino astronomy: the cosmic ray connection, in Reports on Progress in Physics, vol. 66, n. 7, 2002, pp. 1025-1078, Bibcode:2002astro.ph..4527H, DOI:10.1088/0034-4885/65/7/201, arXiv:astro-ph/0204527.
- ^ (EN) J. F. Ziegler, Terrestrial cosmic ray intensities, in IBM Journal of Research and Development, vol. 42, n. 1, 1998, pp. 117-139, DOI:10.1147/rd.421.0117.
- ^ (EN) Stuart Wolpert, Scientists solve 30-year-old aurora borealis mystery, su universityofcalifornia.edu, 24 luglio 2008. URL consultato il 12 aprile 2010 (archiviato dall'url originale il 17 agosto 2008).
- ^ Murayama, Hitoshi (March 10–17, 2006). "Supersymmetry Breaking Made Easy, Viable and Generic". Proceedings of the XLIInd Rencontres de Moriond on Electroweak Interactions and Unified Theories. La Thuile, Italy. arXiv:0709.3041. —lists a 9% mass difference for an electron that is the size of the Planck distance.
- ^ Staff, The Nobel Prize in Physics 1989, su nobelprize.org, The Nobel Foundation, 2008. URL consultato il 24 settembre 2008.
- ^ Philip Ekstrom, The isolated Electron (PDF), in Scientific American, vol. 243, n. 2, 1980, pp. 91–101. URL consultato il 24 settembre 2008.
- ^ Electron filmed for the first time ever, su physorg.com, physorg. URL consultato il 30 marzo 2012.
- ^ (EN) J. Mauritsson et al., Coherent Electron Scattering Captured by an Attosecond Quantum Stroboscope, in Physical Review Letters, vol. 100, 2008, p. 073003, DOI:10.1103/PhysRevLett.100.073003.
- ^ Donald A. Gurnett e RR Anderson, Electron Plasma Oscillations Associated with Type III Radio Bursts, in Science, vol. 194, n. 4270, 10 dicembre 1976, pp. 1159–1162, DOI:10.1126/science.194.4270.1159, PMID 17790910.
- ^ W. C. Martin, Wiese, W. L., Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas, su physics.nist.gov, National Institute of Standards and Technology, maggio 2007. URL consultato l'8 gennaio 2007.
- ^ Grant R. Fowles, Introduction to Modern Optics, Courier Dover Publications, 1989, pp. 227–233, ISBN 0-486-65957-7.
- ^ Andrea Damascelli, Probing the Electronic Structure of Complex Systems by ARPES, in Physica Scripta, T109, 2004, pp. 61–74, DOI:10.1238/Physica.Topical.109a00061.
- ^ (EN) Image #: L-1975-02972, su grin.hq.nasa.gov. URL consultato il 12 aprile 2010 (archiviato dall'url originale il 7 dicembre 2008).
- ^ (EN) John Elmer, Standardizing the Art of Electron-Beam Welding, su llnl.gov, 3 marzo 2008. URL consultato il 12 aprile 2010 (archiviato dall'url originale il 20 settembre 2008).
- ^ Schultz, pp. 2-3.
- ^ Benedict, p. 273.
- ^ Faik S. Ozdemir, Electron beam lithography, Proceedings of the 16th Conference on Design automation, San Diego, IEEE Press, 25-27 giugno 1979, pp. 383-391. URL consultato il 12 aprile 2010.
- ^ Madou, pp. 53-54.
- ^ Jongen Yves e Arnold Herer, Electron Beam Scanning in Industrial Applications, APS/AAPT Joint Meeting, American Physical Society, 2-5 maggio 1996. URL consultato il 12 aprile 2010.
- ^ Beddar, p. 700.
- ^ Michael J. Gazda, Lawrence R. Coia, Principles of Radiation Therapy, su cancernetwork.com, 1º giugno 2007. URL consultato il 12 aprile 2010.
- ^ La polarizzazione di un fascio di elettroni significa che lo spin di tutti gli elettroni punta in una direzione. In altre parole, la proiezione dello spin di tutti gli elettroni lungo il loro vettore della quantità di moto ha lo stesso segno.
- ^ Chao, pp. 155, 188.
- ^ D. McMullan, Scanning Electron Microscopy: 1928–1965, su www-g.eng.cam.ac.uk, g.eng.cam.ac.uk, 1993. URL consultato il 9 febbraio 2012.
- ^ H. S. Slayter, Light and electron microscopy, Cambridge University Press, 1992, p. 1, ISBN 0-521-33948-0.
- ^ H. Cember, Introduction to Health Physics, McGraw-Hill Professional, 1996, p. 42–43, ISBN 0-07-105461-8.
- ^ R. Erni, et al., Atomic-Resolution Imaging with a Sub-50-pm Electron Probe, in Physical Review Letters, vol. 102, n. 9, 2009, p. 096101, Bibcode:2009PhRvL.102i6101E, DOI:10.1103/PhysRevLett.102.096101, PMID 19392535.
- ^ J. J. Bozzola, L. D. Russell, Electron Microscopy: Principles and Techniques for Biologists, Jones & Bartlett Publishers, 1999, p. 12, 197-199, ISBN 0-7637-0192-0.
- ^ S. L. Flegler, J. W. Heckman Jr., K. L. Klomparens, Scanning and Transmission Electron Microscopy: An Introductiom, Oxford University Press, 1995, pp. 43-45, ISBN 0-19-510751-9.
- ^ J. J. Bozzola, L. D. Russell, Electron Microscopy: Principles and Techniques for Biologists, 2ª ed., Jones & Bartlett Publishers, 1999, p. 9, ISBN 0-7637-0192-0.
- ^ Oura, pp. 1-45.
- ^ Ichimiya, p. 1.
- ^ Heppell, pp. 686-688.
- ^ H. P. Freund, T. Antonsen, Principles of Free-Electron Lasers, Springer Verlag, 1996, pp. 1-30, ISBN 0-412-72540-1.
- ^ J. W. Kitzmiller, Television Picture Tubes and Other Cathode-Ray Tubes: Industry and Trade Summary, DIANE Publishing, 1995, pp. 3-5, ISBN 0-7881-2100-6.
- ^ N. Sclater, Electronic Technology Handbook, McGraw-Hill Professional, 1999, pp. 227–228, ISBN 0-07-058048-0.
- ^ The History of the Integrated Circuit, su nobelprize.org, 2008. URL consultato il 10 febbraio 2012.
Bibliografia[modifica | modifica wikitesto]
Testi generici[modifica | modifica wikitesto]
- Paolo Mazzoldi, Massimo Nigro e Cesare Voci, Fisica Volume II, 2ª edizione, Edises, 2000, ISBN 88-7959-152-5.
- B. Povh, K. Rith e C. Scholz, Particelle e nuclei, Bollati Boringhieri, 1998, ISBN 88-339-5595-8.
- (EN) Steve Adams, Frontiers: Twentieth Century Physics, CRC Press, 2000, ISBN 0-7484-0840-1.
- (EN) Charis Anastopoulos, Particle Or Wave: The Evolution of the Concept of Matter in Modern Physics, Princeton University Press, 2008, ISBN 0-691-13512-6.
- (EN) Theodore Arabatzis, Representing Electrons: A Biographical Approach to Theoretical Entities, University of Chicago Press, 2006, ISBN 0-226-02421-0. URL consultato il 1º aprile 2010.
- (EN) Gary F. Benedict, Nontraditional Manufacturing Processes, CRC Press, 1987, ISBN 0-8247-7352-7.
- (EN) Eric H. S. Burhop, The Auger Effect and Other Radiationless Transitions, New York, Cambridge University Press, 1952, pp. 2–3.
- (EN) Alexander W. Chao, Maury Tigner, Handbook of Accelerator Physics and Engineering, World Scientific Publishing Company, 1999, ISBN 981-02-3500-3.
- (EN) Benjamin Crowell, Electricity and Magnetism, Light and Matter, 2000, ISBN 0-9704670-4-4.
- (EN) Lorenzo J. Curtis, Atomic Structure and Lifetimes: A Conceptual Approach, Cambridge University Press, 2003, ISBN 0-521-53635-9. URL consultato il 1º aprile 2010.
- (EN) Per F. Dahl, Flash of the Cathode Rays: A History of J J Thomson's Electron, CRC Press, 1997, ISBN 0-7503-0453-7. URL consultato il 1º aprile 2010.
- (EN) Henning Genz, Nothingness: The Science of Empty Space, Da Capo Press, 2001, ISBN 0-7382-0610-5.
- (EN) Howard Georgi, The New Physics, Cambridge University Press, 1989, ISBN 0-521-43831-4.
- (EN) M. C. Gupta, Atomic and Molecular Spectroscopy, New Age Publishers, 2001, ISBN 81-224-1300-5.
- (EN) Hermann Haken, Hans Christoph Wolf, W. D. Brewer, The Physics of Atoms and Quanta: Introduction to Experiments and Theory, Springer Verlag, 2005, ISBN 3-540-20807-0.
- (EN) Lillian Hoddeson, Laurie Brown, Michael Riordan, Max Dresden, The Rise of the Standard Model: Particle Physics in the 1960s and 1970s, Cambridge University Press, 1997, ISBN 0-521-57816-7.
- (EN) Kerson Huang, Fundamental Forces of Nature: The Story of Gauge Fields, World Scientific, 2007, ISBN 981-270-645-3.
- (EN) A. Ichimiya, P. I. Cohen, Reflection High-energy Electron Diffraction, Cambridge University Press, 2004, ISBN 0-521-45373-9.
- (EN) David Jiles, Introduction to Magnetism and Magnetic Materials, CRC Press, 1998, pp. 280–287, ISBN 0-412-79860-3.
- (EN) Per Olov Löwdin, Erkki Erkki Brändas, Eugene S. Kryachko, Fundamental World of Quantum Chemistry: A Tribute to the Memory of Per-Olov Löwdin, Springer Verlag, 2003, ISBN 1-4020-1290-X.
- (EN) Marc J. Madou, Fundamentals of Microfabrication: the Science of Miniaturization, 2ª ed., CRC Press, 2002, ISBN 0-8493-0826-7.
- (EN) Donald Allan McQuarrie, John Douglas Simon, Physical Chemistry: A Molecular Approach, University Science Books, 1997, ISBN 0-935702-99-7.
- (EN) Dieter Meschede, Optics, light and lasers: The Practical Approach to Modern Aspects of Photonics and Laser Physics[collegamento interrotto], Wiley-VCH, 2004, ISBN 3-527-40364-7.
- (EN) Michael Munowitz, Knowing, The Nature of Physical Law, Oxford University Press, 2005, ISBN 0-19-516737-6.
- (EN) K. Oura, V. G. Lifshits, A. A. Saranin, A. V. Zotov, M. Katayama, Surface Science: An Introduction, Springer Verlag, 2003, ISBN 3-540-00545-5.
- (EN) Linus C. Pauling, The Nature of the Chemical Bond and the Structure of Molecules and Crystals: an introduction to modern structural chemistry, 3ª ed., Cornell University Press, 1960, ISBN 0-8014-0333-2. URL consultato il 29 marzo 2010.
- (EN) Wilhelm Raith, Thomas Mulvey, Constituents of Matter: Atoms, Molecules, Nuclei and Particles, CRC Press, 2001, p. 777–781, ISBN 0-8493-1202-7.
- (EN) Helmut Schultz, Electron Beam Welding, Woodhead Publishing, 1993, ISBN 1-85573-050-2.
- (EN) Boris M. Smirnov, Physics of Atoms and Ions, Springer Verlag, 2003, ISBN 0-387-95550-X. URL consultato il 23 gennaio 2012.
- (EN) John Taylor, The New Physics, Cambridge University Press, 1989, ISBN 0-521-43831-4.
- (EN) Jerry Wilson, Anthony Buffa, College Physics, 4ª ed., Prentice Hall, 2000, ISBN 0-13-082444-5.
- (EN) Robert Wilson, Astronomy Through the Ages: The Story of the Human Attempt to Understand the Universe, CRC Press, 1997, ISBN 0-7484-0748-0. URL consultato il 1º aprile 2010.
Pubblicazioni scientifiche[modifica | modifica wikitesto]
- (EN) A. S. Beddar, Mobile linear accelerators for intraoperative radiation therapy (abstract), in AORN Journal, vol. 74, 2001, DOI:10.1016/S0001-2092(06)61769-9. URL consultato il 29 agosto 2021 (archiviato dall'url originale il 14 aprile 2013).
- (EN) R. Beringer, C. G. Montgomery, The Angular Distribution of Positron Annihilation Radiation, in Physical Review, vol. 61, n. 5-6, 1942, DOI:10.1103/PhysRev.61.222.
- (EN) C. Bernardini, AdA: The First Electron–Positron Collider, in Physics in Perspective, vol. 6, n. 2, 2004, Bibcode:2004PhP.....6..156B, DOI:10.1007/s00016-003-0202-y.
- (EN) G. J. Blumenthal, Bremsstrahlung, Synchrotron Radiation, and Compton Scattering of High-Energy Electrons Traversing Dilute Gases, in Reviews of Modern Physics, vol. 42, 1970, DOI:10.1103/RevModPhys.42.237.
- (EN) S. Chen, A. Maksimchuk, D. Umstadter, Experimental observation of relativistic nonlinear Thomson scattering, in Nature, vol. 396, 1998, DOI:10.1038/25303.
- (EN) R. Daudel, R.F.W. Bader, M.E. Stephens, D.S. Borrett, The Electron Pair in Chemistry, in Canadian Journal of Chemistry, vol. 52, 11 ottobre 1973, DOI:10.1139/v74-201. URL consultato il 7 aprile 2010 (archiviato dall'url originale l'8 gennaio 2014).
- (EN) Hans Dehmelt, A Single Atomic Particle Forever Floating at Rest in Free Space: New Value for Electron Radius, in Physica Scripta, T22, 1988, DOI:10.1088/0031-8949/1988/T22/016.
- (EN) J. Eichler, Electron–positron pair production in relativistic ion–atom collisions, in Physics Letters A, vol. 347, n. 1-3, 14 novembre 2005, DOI:10.1016/j.physleta.2005.06.105.
- (EN) F.R. Elder, A.M. Gurewitsch, R.V. Langmuir, H.C. Pollock, Radiation from Electrons in a Synchrotron, in Physical Review, vol. 71, n. 11, 1947, DOI:10.1103/PhysRev.71.829.5.
- (EN) E. J. Eichten, M. E. Peskin, New Tests for Quark and Lepton Substructure, in Physical Review Letters, vol. 50, n. 11, 1983, pp. 811–814, DOI:10.1103/PhysRevLett.50.811.
- (EN) L. L. Foldy, On the Dirac Theory of Spin 1/2 Particles and Its Non-Relativistic Limit, in Physical Review, vol. 78, 1950, DOI:10.1103/PhysRev.78.29.
- (EN) G. Gabrielse, D. Hanneke, T. Kinoshita, M. Nio, B. Odom, New Determination of the Fine Structure Constant from the Electron g Value and QED, in Physical Review Letters, vol. 97, 2006, DOI:10.1103/PhysRevLett.97.030802.
- (EN) T. A. Heppell, A combined low energy and reflection high energy electron diffraction apparatus, in Journal of Scientific Instruments, vol. 44, n. 9, 1967, Bibcode:1967JScI...44..686H, DOI:10.1088/0950-7671/44/9/311.
- (EN) J. H. Hubbell, Electron positron pair production by photons: A historical overview, in Radiation Physics and Chemistry, vol. 75, n. 6, 2006, Bibcode:2006RaPC...75..614H, DOI:10.1016/j.radphyschem.2005.10.008.
- (EN) I. Levine, D. Koltick, B. Howell, E. Shibata, J. Fujimoto, K. Tauchi, K. Abe, T. Abe, I. Adachi, Measurement of the Electromagnetic Coupling at Large Momentum Transfer, in Physical Review Letters, vol. 78, 1997, DOI:10.1103/PhysRevLett.78.424.
- (EN) R. Mahadevan, R. Narayan, I. Yi, Harmony in Electrons: Cyclotron and Synchrotron Emission by Thermal Electrons in a Magnetic Field, in Astrophysical Journal, vol. 465, 1996, DOI:10.1086/177422, arΧiv:astro-ph/9601073v1.
- (EN) R. S. Mulliken, Spectroscopy, Molecular Orbitals, and Chemical Bonding, in Science, vol. 157, n. 3784, 1967, DOI:10.1126/science.157.3784.13, PMID 5338306.
- (EN) M. T. Murphy, V. V. Flambaum, S. Muller, C. Henkel, Strong Limit on a Variable Proton-to-Electron Mass Ratio from Molecules in the Distant Universe, in Science, vol. 320, n. 5883, 20 giugno 2008, DOI:10.1126/science.1156352, PMID 18566280. URL consultato il 5 aprile 2010.
- (EN) B. Odom, D. Hanneke, B. D'Urso, G. Gabrielse, New Measurement of the Electron Magnetic Moment Using a One-Electron Quantum Cyclotron, in Physical Review Letters, vol. 97, 2006, DOI:10.1103/PhysRevLett.97.030801.
- (EN) F. Rohrlich, The self-force and radiation reaction, in American Journal of Physics, vol. 68, n. 12, 1999, DOI:10.1119/1.1286430.
- (EN) J. Schwinger, On Quantum-Electrodynamics and the Magnetic Moment of the Electron, in Physical Review, vol. 73, n. 4, 1948, DOI:10.1103/PhysRev.73.416.
- (EN) B. G. Sidharth, Revisiting Zitterbewegung, in International Journal of Theoretical Physics, vol. 48, 2008, DOI:10.1007/s10773-008-9825-8, arΧiv:0806.0985.
- (EN) R. I. Steinberg, K. Kwiatkowski, W. Maenhaut, N. S. Wall, Experimental test of charge conservation and the stability of the electron, in Physical Review D, vol. 61, n. 2, 1999, DOI:10.1103/PhysRevD.12.2582.
- (EN) W. M. Yao, Review of Particle Physics, in Journal of Physics G: Nuclear and Particle Physics, vol. 33, n. 1, luglio 2006, DOI:10.1088/0954-3899/33/1/001.
- (EN) J. C. Zorn, George E. Chamberlain, Vernon W. Hughes, Experimental Limits for the Electron-Proton Charge Difference and for the Charge of the Neutron, in Physical Review, vol. 129, n. 6, 1963, DOI:10.1103/PhysRev.129.2566.
Voci correlate[modifica | modifica wikitesto]
- Ambiti scientifici
- Particelle
- Aspetti chimici
- Elettrone spaiato
- Doppietto elettronico
- Trasferimento di elettroni
- Accettore di elettroni
- Donatore di elettroni
- Elettrone del guscio interno
- Elettrone solvatato
- Elettrone delocalizzato
- Configurazione elettronica
- Fenomeni fisici
- Costanti e unità di misura
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni sull'elettrone
Wikiquote contiene citazioni sull'elettrone Wikizionario contiene il lemma di dizionario «elettrone»
Wikizionario contiene il lemma di dizionario «elettrone» Wikimedia Commons contiene immagini o altri file su elettrone
Wikimedia Commons contiene immagini o altri file su elettrone
Collegamenti esterni[modifica | modifica wikitesto]
- elettrone, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- elettróne, su Vocabolario Treccani, Istituto dell'Enciclopedia Italiana.
- (EN) electron, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Particle Data Group, su pdg.lbl.gov.
- Raggio di elettroni in campo elettrico e magnetico incrociato, su bigs.de (archiviato dall'url originale il 20 dicembre 2010).
| Controllo di autorità | Thesaurus BNCF 3791 · LCCN (EN) sh85042423 · GND (DE) 4125978-6 · BNF (FR) cb13319069f (data) · J9U (EN, HE) 987007540957605171 · NDL (EN, JA) 00561425 |
|---|





































