Aterosclerosi
| Aterosclerosi | |
|---|---|
 | |
| Specialità | cardiologia |
| Classificazione e risorse esterne (EN) | |
| MeSH | D050197 |
| MedlinePlus | 000171 |
| eMedicine | 1950759 |
L'aterosclerosi o aterosi è una malattia vascolare cronica e progressiva che si manifesta tipicamente nell'età adulta o avanzata, causando clinicamente patologie cardiovascolari: coronaropatie (infarto cardiaco), aneurisma, accidenti cerebrovascolari (ischemia cerebrale), disturbi vascolari periferici.[1]
L'aterosclerosi è una forma di arteriosclerosi caratterizzata da infiammazione cronica della tonaca intima delle arterie di grande e medio calibro; infiammazione che è dovuta fondamentalmente, ma non solo, all'accumulo e alla ossidazione delle lipoproteine nella parete arteriosa[2] (chronic lipid-driven inflammatory disease)[3] e che produce un insieme dinamico di lesioni multifocali, la più tipica delle quali è la placca aterosclerotica.
L'aterosclerosi è causata dal concorso di fattori molteplici (eziologia multifattoriale), i fattori di rischio cardiovascolare (CV)[2]: fattori genetici (familiarità), fumo, ipercolesterolemia, sindrome metabolica, diabete mellito, ipertensione, obesità, iperomocisteinemia, sedentarietà. A questi si aggiungono altri fattori per i quali le evidenze sono spesso meno stringenti: alcool, agenti infettivi (prima fra tutti la Chlamydophila pneumoniae), parodontite, alcune malattie infiammatorie croniche quali la broncopneumopatia cronica ostruttiva, l'artrite reumatoide, le malattie renali croniche.[4][5][6]. La molteplicità dei possibili agenti eziologici e la pluridecennale evoluzione delle lesioni si riflettono nell'estrema complessità del processo di formazione della patologia (patogenesi).
Poiché è impensabile restituire integrità alle pareti vasali dell'intero sistema arterioso, l'intervento terapeutico deve essere rivolto in primo luogo alla prevenzione primaria (prevenzione della insorgenza della malattia aterosclerotica) attraverso il controllo dei fattori di rischio CV, con misure comportamentali (dieta, esercizio fisico e abitudini di vita) e farmacologiche (es. antidislipidemici, antipertensivi, ipoglicemizzanti, acidi grassi omega-3, acido acetilsalicilico). La terapia farmacologica è indispensabile nella prevenzione secondaria (prevenzione degli eventi CV nell'aterosclerosi sintomatica): i farmaci antiaggreganti piastrinici sono imprescindibili per impedire la formazione di trombi; le azioni delle statine e degli ACE-inibitori vanno ben oltre i loro effetti sulla colesterolemia e sulla pressione arteriosa. Tuttavia l'efficacia massima dei vari trattamenti farmacologici negli studi clinici non supera il 30-40% di riduzione degli eventi CV.[7] Le stenosi severe delle arterie possono essere trattate chirurgicamente (es. endoarteriectomia, stent, bypass).[8]
Intense ricerche hanno per oggetto lo studio dei fenomeni autoimmuni[9] nell'aterosclerosi e la preparazione di vaccini[10] che si spera possano limitare il danno della parete vasale. Un altro campo di nuova esplorazione è la ricerca di terapie efficaci lesion-targeted: farmaci che possano essere veicolati selettivamente nelle aree delle lesioni.[11][12]
Etimologia[modifica | modifica wikitesto]

Il termine ateroma[13] (dal greco athere, "pappa") è stato utilizzato dal fisiologo svizzero Albrecht von Haller nel 1755 nell'opera Opuscula Pathologica a indicare il materiale poltaceo contenuto nelle placche, per sottolineare le somiglianze con i "tumori" cistici, classificati anticamente in steatoma a contenuto sebaceo, ateroma a contenuto poltaceo e meliceride[14] a contenuto simile al miele. Nel 1829 il francese Jean Lobstein nel suo Traité d'Anatomie Pathologique introdusse il termine arteriosclerosi per descrivere l'ispessimento e l'aumento di consistenza delle arterie. Il termine aterosclerosi è stato invece suggerito da Marchand nel 1904 per indicare la presenza contemporanea dell'ateroma e dell'indurimento della parete arteriosa. In anni recenti è stata utilizzata la denominazione di aterotrombosi per evidenziare lo stretto legame tra aterosclerosi e trombosi;[15] Willerson parla di aterotrombosclerosi.[16].
Descrizione[modifica | modifica wikitesto]
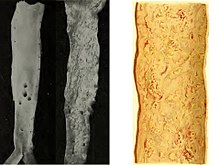
La lesione tipica dell'aterosclerosi è l'ateroma o placca aterosclerotica, ossia un ispessimento della tonaca intima dovuto principalmente all'accumulo di materiale lipidico (grasso) e a proliferazione di tessuto connettivo, che forma una cappa fibrosa (cicatriziale) al di sopra del nucleo lipidico.[17]
Le lesioni hanno sempre come caratteristiche specifiche la localizzazione nell'intima e la componente lipidica più o meno abbondante. Il loro comportamento è dinamico, cioè le lesioni si evolvono con il tempo: iniziano nell'infanzia come strie lipidiche (a carattere reversibile) e nel corso di pochi decenni tendono a divenire placche aterosclerotiche, soprattutto nelle persone predisposte e scarsamente attente al contenimento dei fattori di rischio.
Clinicamente l'aterosclerosi può essere asintomatica oppure può manifestarsi, di solito dai 40-50 anni in su, con fenomeni ischemici acuti o cronici che colpiscono principalmente cuore, encefalo, arti inferiori e intestino. Questi fenomeni ischemici sono la conseguenza della ostruzione, totale o parziale, delle arterie interessate dal processo aterosclerotico. Nella genesi dell'ostruzione arteriosa hanno un ruolo preponderante le piastrine che, aderendo alle aree vasali danneggiate, innescano la formazione di trombi occlusivi o di trombi non occlusivi che concorrono alla crescita delle placche.
Grazie all'impiego di metodiche non invasive, in particolare dell'ultrasonografia, è possibile formulare la diagnosi di aterosclerosi e valutarne la gravità anche in individui asintomatici.
Epidemiologia[modifica | modifica wikitesto]

I dati epidemiologici sull'aterosclerosi riguardano principalmente la mortalità per malattie cardiovascolari (CVD o cardiovascular diseases), la mortalità per malattia coronarica (CAD o coronary atherosclerotic disease; anche detta CHD o coronary heart disease) e la prevalenza delle lesioni anatomopatologiche.[18] Il Global Burden of Disease (GBD) è un "sistema" di misurazione della salute, presente come Health Topic nella pagina dell'Organizzazione mondiale della sanità.[19][20] Lo Studio GBD del 2010 ha fornito i dati sulla mortalità CVD riguardanti 187 nazioni, raggruppate in 7 macroaree. La percentuale delle morti da CVD è stata: 35,8% in High Income (Zona del Pacifico Asiatico, Europa occidentale, Australasia, Nord America, America Latina meridionale); 58,2% in Europa dell'Est-Asia centrale (Europa centrale, Europa orientale, Asia centrale); 35,7% nella Zona del Pacifico asiatico (Asia sud-orientale, Asia orientale, Oceania); 20,4% nell'Asia meridionale; 28,8% nell'America Latina/Caraibi (America Latina tropicale, America Latina centrale, America Latina andina, Caraibi); 42,3% in Nordafrica-Medio Oriente; 8,8% nell'Africa sub-sahariana.[21]
Nei Paesi occidentali le CVD rappresentano la prima causa di morte in entrambi i sessi, seguite, in ordine di frequenza, da neoplasie, morti accidentali, broncopneumopatie croniche e diabete.
Negli Stati Uniti nel 2013[22] le malattie cardiovascolari sono state causa di oltre il 30% di tutte le morti, la CAD di circa il 20% e lo stroke (ictus) di circa il 10-12%.[23] Poiché l'aterosclerosi è causa del 90% degli eventi coronarici e del 60% degli ictus cerebrali,[2] essa rappresenta la prima causa di morte. L'aterosclerosi è anche responsabile della maggioranza dei casi di scompenso cardiaco e di arteriopatie obliteranti periferiche[24] e del 30% dei casi di demenza.[2]
Il trend della mortalità per CVD negli Stati Uniti ha mostrato una flessione importante e continua a partire dagli anni 1960, flessione che si è accentuata nel corso degli anni 2000: nel 2002 si è ridotta di circa il 50% rispetto al 1980 e nel 2013 la riduzione è stata del 29% rispetto al 2003. Si ritiene che tale fenomeno sia dovuto in misura quasi uguale agli interventi sui fattori di rischio (in particolare fumo, ipertensione e ipercolesterolemia) e alle terapie mediche e chirurgiche.[2][23]

In Europa (dati OMS 2014)[23] le CVD sono responsabili di quasi la metà (46%) di tutte le morti (30% negli individui <65 anni e 37% in quelli <75 anni); anche qui la mortalità CVD è in flessione. Per la prima volta in 10 Paesi occidentali la mortalità CVD nei maschi è scesa al secondo posto dopo le neoplasie: Belgio, Danimarca, Paesi Bassi, Francia, Lussemburgo, San Marino, Spagna, Portogallo, Slovenia e Israele; in Danimarca le CVD sono passate al secondo posto fra le cause di morte anche nel sesso femminile.[23] La più alta mortalità CVD si registra nelle repubbliche dell'ex URSS: 915/100 000 per l'uomo nella Federazione Russa e 662/100 000 per la donna in Uzbekistan.
Anche il trend della mortalità CAD nei Paesi industrializzati dell'Occidente ha registrato dagli anni 1970 una flessione ininterrotta.
In Italia nel 2010 la mortalità CVD nell'uomo è stata di 196 decessi su 100 000 abitanti e di 131/100 000 nella donna, con una diminuzione del 33% negli ultimi dieci anni; la mortalità per CAD è stata, rispettivamente, 77/100 000 e 37/100 000, con una riduzione del 27% e del 28%.[23] Nel 2014 la CAD e le malattie cerebrovascolari sono state, rispettivamente, la prima (11,6%) e la seconda (9,6) causa di morte.[25]

I dati epidemiologici sulle lesioni aterosclerotiche si basano su una serie di studi autoptici sistematici che sono stati condotti su bambini e adulti a cominciare dagli anni 1950. Da essi risulta che: in tutte le popolazioni studiate il 100% dei bambini di 3 anni presenta strie lipidiche aortiche; nei Paesi occidentali le placche fibrose aortiche iniziano a comparire nel secondo decennio e dopo i 30 anni sono rilevabili nel 90% degli individui, anche se la loro estensione è molto variabile in dipendenza di età, razza ed esposizione ai fattori di rischio; nelle coronarie le lesioni compaiono alcuni anni più tardi rispetto a quelle aortiche.
La diagnostica per immagini ha consentito di studiare le lesioni aterosclerotiche in vivo. Lo studio prospettico PESA (Progression of Early Subclinical Atherosclerosis) fu condotto su 4 066 impiegati del Banco Santander di Madrid: gli individui reclutati avevano un'età compresa tra i 40 e i 54 anni ed erano asintomatici, i risultati sulla prevalenza dell'aterosclerosi sono riportati in tabella.

Nel 2008 sono stati pubblicati i risultati dello studio statunitense Olmsted County Study[26] che ha raccolto i dati di autopsie coronariche eseguite tra il 1981 e il 2004 in 425 individui di età compresa tra 16 e 64 anni, residenti in Olmsted County (Minnesota), deceduti per cause accidentali. Le lesioni erano classificate in 5 stadi a seconda del grado di stenosi dei vasi (da 0 al 100%). Lesioni aterosclerotiche coronariche erano presenti in oltre l'80% dei soggetti (nell'8% dei casi le stenosi superavano il 76% del lume). Anche se nell'intero arco dei 24 anni dello studio si registrava un declino della prevalenza delle lesioni, in accordo con il declino della mortalità per CAD, prendendo in considerazione soltanto i dati dei soggetti non anziani, il declino delle lesioni più severe si è arrestato nel 1995 e dal 2000 si registra una tendenza all'aumento. Il trend è stato confermato nell'estensione dello studio pubblicata nel 2015 (dati 2005-2009).[27] Pur trattandosi di osservazioni limitate, questi dati fanno temere che nei prossimi anni si possa assistere a una crescita della mortalità per CAD.
Eziologia[modifica | modifica wikitesto]
L'aterosclerosi è causata dal concorso di numerosi fattori che possono essere raggruppati in due classi: fattori sistemici e fattori locali.[2][17]
Fattori sistemici[modifica | modifica wikitesto]


I fattori sistemici sono rappresentati dai fattori di rischio cardiovascolare (CV): fattori che sono strettamente correlati, ma non necessariamente da un rapporto causa-effetto, con la malattia aterosclerotica. La loro identificazione ha richiesto lunghi studi epidemiologici; tra i più famosi: Framingham Heart Study, Multiple Risk Factors Intervention Trial (MRFIT), Pathobiological Determinants of Atherosclerosis in Youth Study (PDAY) e Atherosclerosis Risk in Communities Study (ARIC). I fattori di rischio CV comprendono fattori non modificabili (età, sesso e caratteristiche genetiche) e fattori modificabili (fumo, ipercolesterolemia totale e LDL, bassi livelli di colesterolo HDL, ipertensione, obesità, diabete, iperomocisteinemia, sedentarietà, ecc.). La presenza contemporanea di più fattori di rischio nello stesso individuo ha un effetto cumulativo.[28] L'importanza dei fattori di rischio CV "storici" emersi dagli studi epidemiologici è stata confermata da studi sperimentali e clinici e da studi clinici di intervento terapeutico.
Il concetto di fattore di rischio è distinto da quello di fattore causale (agente eziologico). Tutti i fattori di rischio permettono di prevedere la comparsa di futuri eventi CV, ma non tutti sono veri e propri fattori causali. È possibile cioè che un fattore di rischio non eserciti di per sé un'azione patogena, ma che abbia importanza in quanto strettamente legato a un altro fattore (conosciuto o meno) capace di provocare direttamente un danno. Ad esempio, i valori plasmatici di colesterolo totale sono sicuramente uno dei più importanti fattori di rischio CV, tuttavia, poiché il colesterolo è trasportato nel sangue dalle lipoproteine, quando si fa riferimento alla colesterolemia non si indica in realtà il solo colesterolo, ma piuttosto le lipoproteine: l'agente eziologico è costituito dalle LDL, VLDL e IDL.
Fattori di rischio cardiovascolare[modifica | modifica wikitesto]
| Modificabili |
|
| Non modificabili |
|
| Minori o non quantificabili |
|
| Dieta |
Il rapporto tra grassi alimentari e aterosclerosi è un campo controverso. Il Dipartimento dell'Agricoltura degli Stati Uniti d'America consiglia una dieta povera di grassi, in gran parte basata sulla convinzione che essi siano aterogenici. L'American Heart Association, l'American Diabetes Association e il National Cholesterol Education Program (tutti enti sanitari statunitensi) formulano raccomandazioni simili. Al contrario, il prof. Walter Willett (Harvard School of Public Health) raccomanda livelli molto più alti, in particolare di grassi monoinsaturi e polinsaturi.[47] Gary Taubes, in un articolo pubblicato su Science, formula considerazioni politiche e raccomandazioni agli organismi governativi.[48] Queste differenti visioni trovano un accordo contro il consumo di acidi grassi trans. |
Carenza alimentare di iodio e ipotiroidismo, che causano aumento del colesterolo nel sangue e aumento della perossidazione lipidica, possono avere un importante ruolo nello sviluppo dell'aterosclerosi: infatti il radio-iodio (I-131) è rilevabile nelle autoradiografie della pareti delle arterie elastiche (che più facilmente sviluppano l'arteriosclerosi) fino a oltre 14 giorni dalla iniezione sottocutanea, suggerendo uno specifico meccanismo protettivo, probabilmente antiossidante,[49] nelle pareti delle arterie.[50][51][52] Già Theodor Kocher aveva osservato che l'arteriosclerosi, patologia oggi riconosciuta in gran parte essere causata dai radicali liberi dell'ossigeno che causano perossidazione lipidica, si sviluppava frequentemente nei pazienti sottoposti a tiroidectomie e aveva suggerito che l'ipotiroidismo fosse causalmente associato all'aterosclerosi[34]. Pertanto i clinici europei usarono empiricamente in modo ampio gli ioduri orali e parenterali (negli anni 1930-1960) nei pazienti affetti da arteriosclerosi e da malattie cardiovascolari. Turner ha riportato l'efficacia degli ioduri e degli estratti essiccati di tiroide nella prevenzione della arteriosclerosi nei conigli di laboratorio[35]. L'azione antiossidante degli ioduri orali è stata inoltre descritta nella prevenzione e nella terapia di alcune malattie umane croniche oltre che nell'arteriosclerosi[36][37][38].
Il ruolo dello iodio nei pesci di mare (ricchi di iodio) e nei pesci di acqua dolce (iodio-carenti) non è completamente chiarito, ma è stato riportato che i pesci di acqua dolce sono più soggetti a malattie infettive, neoplastiche e arteriosclerotiche rispetto ai pesci di mare[38][53]. Un'alimentazione ricca di colesterolo nei salmoni dell'Atlantico allevati in acque dolci (carenti di iodio) innalza la colesterolemia e le LDL plasmatiche e provoca in essi severe lesioni aterosclerotiche, in particolare nelle coronarie[54].

A causa della molteplicità dei fattori di rischio, sono state elaborate tabelle per il calcolo del rischio individuale globale di eventi CV nei dieci anni successivi:[55][56] European SCORE, Framingham Score Assessment, PROCAM Risk Score. Queste tabelle prendono in considerazione sei fattori di rischio principali (sesso, età, diabete, abitudine al fumo, pressione arteriosa e colesterolemia) e consentono di limitare le discrepanze che spesso emergono quando si mettono in relazione gli eventi CV con uno o due soli fattori. Un esempio della necessità di tener conto del rischio globale viene dalla constatazione che circa il 40% delle morti coronariche si verifica in individui non fumatori con una colesterolemia al di sotto della media.[57] Le tabelle per il calcolo del rischio non sono applicabili oltre i 69 anni di età, né in presenza di pressione arteriosa sistolica > 200 mmHg o < 90 mmHg e neppure di colesterolemia totale > 320 mg/dL o < 130 mg/dL.
Le conoscenze sui fattori di rischio CV hanno reso possibile l'attuazione della prevenzione primaria della malattia aterosclerotica, che è rivolta a limitare l'esposizione a essi e, qualora l'esposizione fosse ormai stabilizzata, al loro trattamento. Le misure da adottare per la prevenzione primaria comprendono: controllo di fumo, stress psico-fisici eccessivi e sovrappeso; corretta alimentazione; attività fisica di almeno 30 minuti al giorno per 5 volte alla settimana; pressione arteriosa entro 140/90 mmHg; livelli di colesterolo totale sierico entro i 190 mg/dL; glicemia entro i 100 mg/dL a digiuno e i 140 mg/dL dopo il pasto.
Fra i fattori di rischio CV non è ancora ufficialmente compresa la frequenza cardiaca a riposo (RHR: resting heart rate), anche se una gran mole di dati epidemiologici e clinici indicano che il RHR è associato con una più elevata mortalità CV e totale sia nell'uomo sia nella donna, con o senza malattie cardiovascolari.[58] Nel 2005, il RHR è stato però inserito nel Cooper Clinic risk index per la mortalità totale.[59] Un RHR elevato sembra favorire la disfunzione endoteliale e la rottura della placca.
Le tabelle per il calcolo del rischio coronarico prendono in considerazione il rischio a dieci anni, ma un'analisi dei dati Framingham (2006) ha preso in esame la mortalità CV a lungo termine (a 95 anni di età o al decesso) fra i soggetti di entrambi i sessi che al basale avevano 50 anni ed erano esenti da malattie CV. Fra i circa 8 000 individui inclusi nell'indagine, quelli ad alto rischio avevano alte probabilità di decesso per cause CV (68% negli uomini e circa 50% nelle donne) con una sopravvivenza stimata, rispettivamente, di 28 e di 31 anni; i rispettivi valori per gli individui a basso rischio erano 5% e 8%, con sopravvivenza stimata di oltre 39 anni.[60]
Fattori locali[modifica | modifica wikitesto]
Anche se esistono alcuni dati contraddittori,[61] l'importanza dei fattori emodinamici locali è dimostrata dal fatto che, sebbene i fattori sistemici agiscano sull'intero sistema vascolare, le lesioni aterosclerotiche hanno carattere multifocale e si sviluppano tipicamente in alcune sedi di predilezione (atherosclerosis-prone areas o aree soggette ad aterosclerosi). Tale caratteristica è stata messa in rapporto con la distribuzione disomogenea degli stress meccanici, la cui intensità varia in base al calibro e alla geometria del vaso.[62][63] Le lesioni colpiscono soprattutto i tratti che sono maggiormente esposti alle variazioni delle forze emodinamiche:[64] curvature (parete concava della curva), biforcazioni (parete opposta all'angolo di biforcazione dell'arteria) e osti di origine dei rami arteriosi.
Nelle atherosclerosis-prone areas il flusso ematico è alterato (flusso disturbato), poiché soggetto a locali cambiamenti di direzione sia nel tempo (flusso senza una direzione prevalente, oscillante tra la direzione anterograda e quella retrograda), sia nello spazio (separazione di correnti di flusso e vortici). Con l'invecchiamento la situazione emodinamica peggiora, in quanto le arterie divengono meno elastiche e la pulsatilità del flusso si accentua (aumenta la differenza tra la pressione arteriosa sistolica e quella diastolica) e si estende verso la periferia.[65]
Patogenesi[modifica | modifica wikitesto]

Dall'idea di Albrecht von Haller (1755) che l'ateroma e la calcificazione fossero dovute alla deposizione nella parete arteriosa di un succo con capacità di ossificare ("succo osseo"), si è passati alle prime analisi chimiche delle concrezioni ateromatose che si rivelavano composte dal 65% di fosfato di calcio e dal 35% di "materia animale", come riportato nel "Trattato sulle malattie delle arterie e delle vene" di George Hodgson.[66]
Due avvenimenti hanno prodotto una svolta radicale nella comprensione della patologia. Il primo è la scoperta dei grassi e della colesterina (colesterolo)[67] da parte di Michel Eugène Chevreul (1811-1816); il secondo è l'evoluzione, a metà Ottocento, della microscopia, con relativi metodi di fissazione e di colorazione. Nel 1843 George Gulliver[68], grazie all'utilizzo combinato dell'osservazione microscopica e dell'analisi chimica, riconosceva la natura grassa della materia ateromatosa e parlava esplicitamente di degenerazione grassa delle arterie. La rilevanza data alla componente grassa delle lesioni ha assunto da allora sempre più grande considerazione e conferma dagli studi sugli animali, dall'identificazione delle lipoproteine, prima nel plasma e successivamente nelle lesioni, per finire ai grandi studi epidemiologici e clinici (es. ipercolesterolemia familiare) e agli importanti studi clinici con terapie ipolipemizzanti.
Se per lungo tempo l'aterosclerosi è stata considerata una malattia degenerativa delle arterie, oltre un secolo di studi ha portato alla conclusione che le lesioni aterosclerotiche sono il prodotto di un'infiammazione cronica della tonaca intima.[3] La serie interminabile di indagini ha permesso di identificare i due elementi cardine dell'aterogenesi (processo di formazione dell'ateroma): le lipoproteine e l'infiammazione limitata all'intima. Il terreno fisiopatologico nel quale questi due elementi interagiscono è costituito dall'ispessimento adattativo dell'intima che rappresenta una condizione preliminare allo sviluppo dell'aterosclerosi umana.
Le principali cellule che prendono parte all'aterogenesi sono: endotelio, cellule muscolari lisce, monociti/macrofagi e linfociti (che sono le cellule che caratterizzano tutte le infiammazioni croniche) e piastrine, congiuntamente ai fattori della coagulazione.
Gli eventi iniziali dell'aterogenesi vanno identificati nel danno dell'endotelio e nell'accumulo e modificazione (aggregazione, ossidazione e/o glicosilazione) delle lipoproteine a bassa densità (LDL) nell'intima delle arterie, due eventi che si verificano precocemente e che si potenziano a vicenda. L'accumulo delle LDL è dovuto in parte all'aumento della permeabilità dell'endotelio danneggiato (funzionalmente o anatomicamente), ma principalmente al loro legarsi ai costituenti della matrice extracellulare dell'intima, legame che ne prolunga il tempo di residenza in loco: l'ispessimento adattativo dell'intima intrappola le LDL e aumenta la probabilità che esse vengano modificate sia dai radicali liberi, prodotti dall'endotelio disfunzionale e dai leucociti, sia dagli enzimi idrolitici secreti da macrofagi e cellule muscolari lisce (fosfolipasi A2 secretorie, sfingomielinasi e proteasi). L'attivazione/disfunzione endoteliale comporta, inoltre, l'espressione sulla superficie endoteliale di molecole adesive (selectine, VCAM-1, ICAM-1) e la produzione di segnali chemiotattici[69] che inducono l'adesione e la migrazione di monociti e linfociti T nell'intima, avviando la reazione infiammatoria. Anche le cellule muscolari lisce situate negli ispessimenti adattativi intimali espongono molecole adesive sulla propria superficie (ICAM-1 e VCAM-1) e concorrono a trattenere i macrofagi nelle lesioni.[70][71] Partecipano all'aterogenesi anche le lipoproteine a densità molto bassa (VLDL).[72]

Penetrati nell'intima, i macrofagi fagocitano le lipoproteine modificate e, a causa dell'impossibilità di metabolizzare il colesterolo in esse contenuto, si trasformano nelle cellule schiumose (o spumose) caratteristiche delle strie lipidiche (fatty streaks). La produzione di citochine e fattori di crescita crea un ambiente proinfiammatorio favorevole al perpetuarsi del reclutamento di leucociti e induce la migrazione delle cellule muscolari lisce dalla media nell'intima, dove proliferano, si differenziano nel fenotipo “sintetico” e producono matrice extracellulare, determinando la trasformazione delle fatty streak in lesioni avanzate. La dipendenza del processo aterogenico dall'intervento dei macrofagi emerge chiaramente dagli studi sperimentali nei topi geneticamente predisposti all'aterosclerosi: incrociando topi con turbe del metabolismo delle lipoproteine (topi apoE-/apoE- o topi Ldr-/Ldr-) con topi osteopetrosici (op/op), con deficit dei macrofagi, è stata ottenuta la quasi totale prevenzione delle lesioni (-97%).[73]

Alla crescita delle lesioni contribuisce l'adesione di piastrine e il formarsi di trombi intramurali, conseguenti alla erosione/ulcerazione degli ateromi. Ampio spazio nella patogenesi dell'aterosclerosi trovano anche i meccanismi immunologici e autoimmuni, che sarebbero innescati dal danno endoteliale. Le cellule endoteliali stressate dai fattori di rischio CV e dalle forze emodinamiche esprimono sulla superficie proteine intracellulari HSP60 (heat shock proteins) che si comportano da antigeni riconosciuti da autoanticorpi e linfociti T autoreattivi. La perdita di tolleranza verso questi autoantigeni sarebbe conseguenza della loro liberazione nell'ambiente extracellulare in seguito alla necrosi cellulare e/o della loro reattività crociata con le HSP-60 batteriche.[74]
Se i macrofagi e i linfociti T sono le cellule immunitarie di gran lunga prevalenti, i mastociti rappresentano una popolazione minoritaria, ma importante per l'instabilità della placca ateromatosa. I mastociti elaborano mediatori che aumentano la permeabilità (istamina, prostaglandine e leucotrieni), citochine (Il-6, TNF-a), b-FGF (basic fibroblast growth factor o fattore angiogenico basico) e secernono proteoglicani eparinici e proteasi neutre (triptasi e chimasi) che attivano le metalloproteasi. Le metalloproteasi (collagenasi, stromelisina-1, gelatinasi B) sono prodotte come enzimi inattivi (proenzimi) da cellule endoteliali, muscolari lisce, macrofagi e linfociti T e, una volta attivate dalle proteasi neutre, degradano la matrice extracellulare, indebolendo la cappa fibrosa.
L'importanza dell'infiammazione nella genesi dell'aterosclerosi è stata dimostrata clinicamente dallo Studio Cantos (Canakinumab Anti-Inflammatory Thrombosis Outcome Study), studio randomizzato, in doppio cieco e placebo-controllato, nel quale è stata valutata l'efficacia di canakinumab (anticorpo monoclonale specifico per l'interleuchina β), su un endpoint primario comprendente infarto miocardico non fatale, stroke e mortalità CV.[75] Lo studio ha dimostrato che, nei pazienti con pregresso infarto, la terapia anti-infiammatoria con canakinumab è in grado di ridurre modestamente gli eventi cardiovascolari inclusi nell'endpoint primario (14% contro 15% del placebo, P=0,02074).
Fisiopatologia[modifica | modifica wikitesto]
Le manifestazioni cliniche dell'aterosclerosi compaiono in genere dopo i 40-50 anni di età e sono dovute alla ischemia (insufficienza di flusso ematico) nel letto vasale dipendente dall'arteria lesa.
Le manifestazioni croniche sono provocate dal restringimento stabile dell'arteria colpita, che rende il flusso ematico relativamente fisso, cioè incapace di aumentare adeguatamente quando necessario. Di conseguenza la sintomatologia, in particolare il dolore, tende a essere assente a riposo e a presentarsi in occasione di esercizio fisico, per scomparire dopo pochi minuti di riposo. Tipiche sindromi croniche sono: angina pectoris stabile, claudicatio intermittens, TIA, amaurosi transitoria.
Le manifestazioni acute sono invece il risultato della brusca caduta del flusso ematico provocato dall'occlusione totale o parziale del lume arterioso per formazione di un trombo o di un aggregato piastrinico oppure per arresto di un embolo (all'aggregazione piastrinica, ai leucociti e ai mastociti si deve anche vasocostrizione per il rilascio di mediatori vasoattivi: trombossano A2, serotonina e platelet activating factor). Il trombo si forma in corrispondenza di un'erosione (perdita dell'endotelio) o di una rottura (fissurazione) della cappa fibrosa.[16] Sono sindromi ischemiche acute: angina pectoris instabile, infarto miocardico acuto, morte cardiaca improvvisa, infarto intestinale, ictus ischemico e tromboembolie arteriose degli arti.
Nel caso delle sindromi coronariche acute, i trombi sono dovuti nel 60-75% dei casi a rottura della placca, nel 35-45% a erosione e nel 2-7% a nodulo calcificato.[76] Altre cause di sindromi coronariche acute sono l'occlusione dinamica per vasocostrizione (spasmo vasale), l'emorragia dei vasa vasorum (capillari che irrorano la parete arteriosa) intraplacca,[77] il brusco aumento delle necessità metaboliche tissutali (es. tachicardia) o il ridotto apporto di ossigeno (es. emorragia); raramente può essere in causa il solo spasmo vasale a livello di un ramo principale delle coronarie (angina di Prinzmetal).[3]
Affinché una stenosi arteriosa comporti una significativa riduzione del flusso è necessaria una riduzione del diametro del lume di almeno il 50%, che corrisponde a una riduzione del 75% dell'area del lume.[16] Particolarmente sensibile all'ipossia è la muscolatura sub-endocardica, la cui irrorazione è ostacolata dalla compressione dei vasi intramiocardici per opera dell'elevata pressione intraventricolare durante la sistole.
Instabilità della placca[modifica | modifica wikitesto]
Nelle placche vulnerabili prevalgono i macrofagi, i mastociti e i linfociti, mentre le cellule muscolari lisce sono relativamente scarse. I fattori responsabili della fissurazione dell'ateroma sono molteplici, ma due fenomeni sembrano di particolare importanza: l'infiammazione della placca e la presenza di un'abbondante componente lipidica associata a una sottile cappa fibrosa. Questi fattori rendono la placca meno resistente all'urto della corrente ematica.[76] Le cellule infiammatorie producono enzimi idrolitici (metalloproteasi) capaci di lisare il collagene della cappa, che diviene così vulnerabile agli stress emodinamici. La densità dei vasi neoformati è considerata un fattore di progressione della placca, in quanto fornisce un afflusso di monociti/macrofagi nelle lesioni.[78] Anche le emorragie all'interno della placca, originate dalla rottura dei vasi neoformati, possono contribuire a rendere instabile la placca.[2]
I fattori scatenanti la rottura sono principalmente di natura emodinamica e il loro carattere intermittente e variabile (soprattutto in funzione delle influenze simpatiche sulla frequenza cardiaca e sulla pressione arteriosa: attività fisica, forti emozioni) costituisce un'aggravante rispetto a stress meccanici costanti. Lo shear stress, lo stress circonferenziale, la compressione, la deformazione circonferenziale e longitudinale della placca sono tutti fattori che possono scatenare la rottura di una cappa fragile. L'interfaccia tra aree calcificate e sostanza molle circostante probabilmente costituisce un punto di minore resistenza all'insulto meccanico. La rottura della placca sembra essere più frequente in presenza di processi infiammatori sistemici, come infezioni acute e croniche, gengiviti croniche, artrite reumatoide[2].
Anatomia patologica[modifica | modifica wikitesto]
Anatomia macroscopica[modifica | modifica wikitesto]
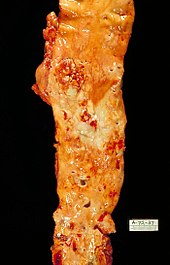

Nel suo trattato Die Cellularpathologie del 1859[79], Rudolf Virchow distingueva due tipi di lesioni arteriose a carattere lipidico: una lesione limitata allo strato più superficiale della parete arteriosa, la macchia, e una lesione più profonda, l'ateroma: esse erano considerate come manifestazioni indipendenti di degenerazione grassa delle arterie.
All'inizio del 1900 fu riconosciuta la relazione tra strie lipidiche e placche fibrose che venivano inquadrate in una stessa patologia.[80] Karl Aschoff nel 1924 considerava le strie lipidiche come lesioni tipiche dei bambini e le riteneva lo stadio iniziale che chiamava aterosi o ateromatosi. Negli infanti l'aterosi si presentava macroscopicamente come macchie giallastre, mentre verso la pubertà assumeva l'aspetto di strie giallastre. L'altro tipo di lesione compariva negli adulti ed era interpretato come stadio avanzato, cui Aschoff attribuiva il nome di aterosclerosi.
Nel 1958 l'Organizzazione mondiale della sanità (WHO) ha adottato la classificazione macroscopica dell'aterosclerosi seguita da Holman, Strong, Mc Gill e Geer nelle loro pionieristiche ricerche (1952-1957) sulla storia naturale della malattia. Vengono considerati tre tipi di lesioni fondamentali che rappresentano le fasi evolutive della patologia:[17]
- stria lipidica
- placca fibrosa
- lesione complicata
1) Le strie lipidiche (fatty streaks) sono macchie o strie allungate di 1–2 mm, ma talvolta raggiungono 1 cm o più; di colore giallastro e bordi netti, spiccano sul colore biancastro dell'intima. Sono di solito piatte e presentano una superficie liscia e continua compaiono nell'aorta durante il primo decennio d'età, nelle coronarie nel secondo decennio e nei vasi cerebrali nel terzo. Si tratta di lesioni che possono regredire, ma in presenza di fattori di rischio CV tendono a progredire nelle lesioni avanzate.
2) La placca fibrosa consiste di un ispessimento circoscritto, sporgente dall'intima, di colorito bianco perlaceo o lievemente giallognolo, di dimensioni varie, da qualche millimetro a diversi centimetri, che può arrivare ad abbracciare più o meno completamente la circonferenza del vaso. Alla sezione l'aspetto può essere omogeneo oppure variegato per la presenza di un centro decisamente giallo (lipid-rich core), molle, unto e asportabile (la cosiddetta pappa ateromasica), ricoperto verso l'intima da uno strato fibroso, detto cappa, duro e biancastro, rivestito da endotelio. La cappa fibrosa isola il materiale del core che ha un forte potere trombogeno per la ricchezza in lipidi e Fattore Tissutale. Le placche aortiche e coronariche iniziano a comparire nel secondo decennio d'età e tendono ad accrescersi progressivamente.
3) Le lesioni complicate (ulcerazione, emorragia, trombosi, calcificazione estesa) rappresentano lo stadio più avanzato. In caso di fissurazione (ulcerazione) della placca, il tessuto connettivo e il materiale necrotico-lipidico del core si trovano esposti alla corrente ematica e innescano la formazione di un trombo. Il trombo non fatale può essere incorporato nelle placche e ricoperto da endotelio (organizzazione del trombo), contribuendo alla crescita della lesione. Quando il sovvertimento della struttura della parete arteriosa è estremo, il risultato è la formazione di un aneurisma (dilatazione circoscritta dell'arteria con pareti gravemente alterate).
Come attestato dallo studio di Michael E. DeBakey su quasi 14 000 pazienti chirurgici,[81] le zone più colpite dall'aterosclerosi sono, in ordine decrescente: superficie dorso-laterale del tratto distale dell'aorta addominale, fino alla biforcazione delle arterie iliache; arterie coronarie, soprattutto la coronaria sinistra e i tratti prossimali dei suoi rami principali (primi 6 cm); arterie poplitee e femorali; aorta toracica, in particolare intorno agli osti delle arterie intercostali; carotidi interne (parete laterale del bulbo e tratto prossimale); circolo di Willis, (arteria vertebrale, arteria basilare, arteria carotide interna) e arteria cerebrale media. Sono invece di solito risparmiati i vasi delle estremità superiori e le arterie mesenteriche e renali (con l'eccezione dei loro osti).[82] La gravità delle lesioni aortiche è di regola maggiore di quella delle coronarie.
Anatomia microscopica[modifica | modifica wikitesto]
Sotto l'aspetto microscopico, i quattro elementi costitutivi delle lesioni sono: i depositi lipidici intra- ed extracellulari, l'infiltrato infiammatorio mononucleato (macrofagi e linfociti), la proliferazione delle cellule muscolari lisce e la deposizione di nuova matrice extracellulare (connettivo fibroso). La caratteristica si riconosce nella presenza della componente lipidica e colesterolica. Il primo ricercatore che ha identificato il colesterolo nelle lesioni è stato Adolf Otto Reinhold Windaus, nel 1910.
Il Committee on Vascular Lesions of the Council on Arteriosclerosis dell'American Heart Association (1992-1995) ha proposto una classificazione microscopica che prevede sei tipi di lesioni, indicate con numeri romani da I a VI: lesioni iniziali, strie lipidiche, lesioni intermedie, ateroma, fibroateroma, lesioni complicate.[83][84] I primi tre tipi appaiono macroscopicamente come strie lipidiche, anche se il tipo I è di regola osservato solo al microscopio; i tipi IV (ateroma) e V (fibroateroma) si presentano macroscopicamente come placche fibrose, con un voluminoso core necrotico-lipidico nel tipo IV.
Nelle lesioni precoci (tipi I e II),[84] i lipidi si accumulano in gocce e in vacuoli citoplasmatici nelle cellule dell'intima, che così si trasformano in foam cells. Queste cellule derivano da macrofagi e da cellule muscolari lisce che acquisiscono lipidi per endocitosi recettore-dipendente, per pinocitosi (endocitosi in fase fluida) e per patocitosi. Se nei tipi I e II i lipidi non si accumulano in misura significativa nello spazio extracellulare dell'intima, nel tipo III (pre-ateroma) i lipidi cominciano a raccogliersi anche in sede extracellulare, ma a differenza delle lesioni avanzate, non si verifica alcun sovvertimento della struttura dell'intima.

Le lesioni avanzate[85] (tipi IV e V) sono caratterizzate dalla reazione fibrosa (cicatriziale) e dall'abbondanza dei depositi lipidici extracellulari che possono stiparsi in un core lipidico in seno al tessuto fibroso. In questa fase, a causa degli eventi cicatriziali e della presenza di ammassi lipidici, la struttura dell'intima risulta profondamente alterata. La massa necrotico-lipidica (l'ateroma) deriva in parte dalle lipoproteine plasmatiche aggregate e modificate e in parte dall'apoptosi (autodistruzione) delle cellule schiumose.[86][87]
I cristalli di colesterolo possono avere un'origine sia intra- sia extra-cellulare,[88] sono in grado di indurre la sintesi di citochine proinfiammatorie da parte dei macrofagi, di causare necrosi delle foam cells e di danneggiare meccanicamente la cappa fibrosa, arrivando anche a perforarla.[89][90] La perforazione è provocata dalla forma acuminata dei cristalli e dal fatto che nel passaggio dallo stato liquido a quello cristallino il colesterolo monoidrato aumenta di volume. Un'eccezionale documentazione microscopica di questi eventi è fornita dai lavori di Abela.[89][91]
Le placche contengono spesso fibrina ed emosiderina, quale conseguenza dell'organizzazione di trombi o di emorragie intraplacca da rottura dei vasi neoformati che proliferano dai vasa vasorum della media e penetrano nella base della placca.[15] Prodotti della coagulazione, trombina e mediatori liberati dalle piastrine si associano alle citochine elaborate dall'infiltrato infiammatorio nel facilitare la crescita delle lesioni, giustificando l'uso del termine atero-trombosi.[15]
Frequentemente si rinvengono aree di calcificazione che possono presentarsi in forma di granuli (microcalcificazioni o spotty calcifications) o, meno spesso, di macrocalcificazioni (lamellar calcifications) con l'aspetto di scaglie dure e friabili o di schegge acuminate o, talora, di vere e proprie aree di ossificazione. Nei segmenti di estesa calcificazione, la parete è rigida e dura e diviene visibile radiologicamente. Le spotty calcifications prevalgono nelle fasi precoci dell'aterosclerosi, mentre le macrocalcificazioni sono tipiche delle forme avanzate. Nelle coronarie, calcificazioni sono rinvenute nei 20% dei giovani adulti, nel 60% degli adulti di età media e nel 90% dei vecchi.[92]
Evoluzione dell'aterosclerosi[modifica | modifica wikitesto]

Sulla base dei lavori sperimentali e delle indagini autoptiche è stato possibile ricostruire la storia naturale (sequenza evolutiva) dell'aterosclerosi.
Dagli studi autoptici emergono le seguenti considerazioni:
- Le strie lipidiche aortiche compaiono in tutti i soggetti a partire dalla prima infanzia,[95] indipendentemente da sesso, razza e paese di origine,[96] tanto che dopo i primi anni di vita non è più possibile fare una distinzione tra individui con o senza aterosclerosi.
- Le strie lipidiche aortiche non sono predittive né dello sviluppo delle lesioni avanzate, né della mortalità coronarica.[96]
- Esiste una notevole variazione, sia fra le popolazioni sia all'interno di una stessa popolazione, nella prevalenza e nell'estensione delle lesioni avanzate, in dipendenza dalla diversa esposizione ai fattori di rischio CV.[96]
- La prevalenza e l'estensione delle strie lipidiche coronariche e delle placche aortiche e coronariche risultano strettamente correlate con la mortalità per CAD. Nello studio IAP[96] la graduatoria dei vari paesi costruita in base alla estensione media delle lesioni avanzate a livello aortico o coronarico o della sommatoria delle due sedi risultava sovrapponibile, con una sola eccezione (Manila), alla graduatoria per mortalità per CAD. Di conseguenza i dati sulla mortalità per malattia coronarica possono essere presi come surrogato dell'epidemiologia delle lesioni aterosclerotiche avanzate.
Diagnosi[modifica | modifica wikitesto]
Rimane oggetto di discussione il rapporto costo/beneficio di una diagnosi strumentale di aterosclerosi subclinica (asintomatica); in particolare il problema di stabilire la soglia di rischio CV al di sopra della quale l'accertamento diagnostico sia utile al fine di iniziare una terapia medica più aggressiva. Alcune linee guida propongono come soglia un rischio a 10 anni del 10-20%.[97] Secondo una metanalisi del 2012 sembrerebbe che siano i soggetti a rischio CV intermedio i principali beneficiari di un approfondimento diagnostico strumentale.[98] Tuttavia il problema è ancora alla ricerca di una risposta definitiva; ancora nel 2013 l'American College of Cardiology/American Heart Association (ACC/AHA) non raccomandava l'uso della determinazione dello spessore intima/media carotideo (CIMT) nella pratica clinica.[99]
Le due indagini strumentali più impiegate sono l'ultrasonografia, per valutare lo spessore intima-media della carotide o la presenza di placche carotidee, e la tomografia computerizzata del torace, per accertare la presenza di calcificazioni coronariche. Per la diagnosi precoce delle arteriopatie degli arti inferiori è utile l'indice caviglia-braccio (ankle-brachial index o ABI) che misura la differenza di pressione arteriosa tra arti inferiori e superiori. Di più recente introduzione sono la misurazione della dilatazione flusso-mediata dell'arteria brachiale (flow-mediated dilation o FMD), la risonanza magnetica nucleare aortica o carotidea e l'ultrasonografia e la risonanza magnetica delle arterie femorali. L'Aragon Workers' Health Study (AWHS), pubblicato nel 2016, ha indagato l'associazione delle placche femorali e delle placche carotidee con i fattori di rischio CV e con le calcificazioni coronariche in circa 1 500 soggetti sani di età media.[100] Lo studio ARTPER (2018) ha invece esaminato il valore dell'indice ABI.[101]
Due studi in particolare hanno avuto tra i loro obiettivi quello di definire il valore della diagnostica per immagini nel prevedere futuri eventi CV: Multi-Ethnic Study of Atherosclerosis (MESA),[102] iniziato nel 2000, e Progression of Early Subclinical Atherosclerosis Study (PESA),[103] iniziato nel 2010.
Terapia e riduzione del rischio cardiovascolare[modifica | modifica wikitesto]
I trattamenti sono mirati al contenimento dei fattori di rischio (es. fumo) e dei danni correlati alle patologie (es. diabete) che possono indurre aterosclerosi, alla riduzione dei sintomi (es. dolore anginoso) e alla prevenzione degli eventi trombotici (aspirina e farmaci antiaggreganti piastrinici).
Generalmente il primo approccio è legato alla correzione degli stili di vita come viene illustrato nel «Progetto Cuore», uno studio epidemiologico e di prevenzione delle malattie cerebro e cardiovascolari promosso dall'Istituto superiore di sanità, in cui sono indicate una serie di misure igienico-dietetiche atte a ridurre il rischio cardiovascolare:[104]
- Abolizione del fumo: rispetto ai non fumatori, i fumatori hanno un'aspettativa di vita inferiore di 8 anni, un rischio doppio di infarto miocardico acuto e un rischio 10 volte superiore di carcinoma del polmone. Il rischio CV dopo un anno dall'eliminazione del fumo si riduce di circa il 50% e dopo alcuni anni diviene simile a quello dei non fumatori;[104]
- Corretta alimentazione: regolare consumo di pesce (almeno due volte a settimana), frutta, verdura e legumi; limitato consumo di dolci, alcol e grassi, sostituendo i grassi saturi (carne, insaccati, latte intero, burro, formaggio, uova) con quelli polinsaturi (pesce, oli vegetali non tropicali) e monoinsaturi (olio di oliva); basso consumo di sale da cucina (≤ 5 g/die);[104]
- Regolare attività fisica: almeno 30 minuti di cammino a passo veloce al giorno; salire le scale a piedi.
- Controllo del peso: dimagrire in caso di obesità (indice di massa corporea o IMC ≥30 kg/m2) o sovrappeso (IMC ≥25,0-29,9 kg/m2).[104]
Qualora i tentativi non farmacologici non dessero i risultati attesi, la terapia medica è protesa alla correzione delle patologie che sottendono all'insorgenza, mantenimento e peggioramento dell'aterosclerosi.
Note[modifica | modifica wikitesto]
- ^ Aterosclerosi, su Treccani.it. URL consultato il 29 ottobre 2017.
- ^ a b c d e f g h (EN) Lee Goldman e Andrew Shafer, cap.70, in Glodman's Cecil Medicine, 24ª ed., Philadelphia, Elsevier, 2012.
- ^ a b c (EN) Valentin Fuster, cap.52, in Hurst's The Heart, 13ª ed., McGraw-Hill Companies, 2011.
- ^ (EN) B. Field Bale, High-risk periodontal pathogens contribute to the pathogenesis of atherosclerosis, in Postgrad. Med. J., 29 novembre 2016, pp. 1-7, DOI:10.1136/postgradmedj-2016-134279.
- ^ (EN) F. Montecucco e F. Mach, Common inflammatory mediators orchestrate pathophysiological processes in rheumatoid arthritis and atherosclerosis, in Rheumatology, vol. 48, 2009, pp. 11–22.
- ^ (EN) Z. Wang, Protein carbamylation links inflammation, smoking, uremia and atherogenesis., in Nat Med., vol. 13, 2007, pp. 1176–1184.
- ^ (EN) Y. Soto e E. Acosta, Antiatherosclerotic Effect of an Antibody That Binds to Extracellular Matrix Glycosaminoglycans, in Arterioscl., Thromb., Vasc. Biol., vol. 32, 2012, pp. 595-604.
- ^ (EN) P.Y. Ng, Carotid endarterectomy or stenting?, in Heart Asia, vol. 1, 2009, pp. 39–40.
- ^ (EN) C. Grundtman, The autoimmune concept of atherosclerosis, in Curr. Opin. Lipidol., vol. 22, 2011, pp. 327–334.
- ^ (EN) K.Y. Chyu, Vaccine against arteriosclerosis: an update, in Ther. Adv. Vaccines, vol. 5, 2017, pp. 39–47.
- ^ (EN) I. Tabas, Making Things Stick in the Fight Against Atherosclerosis, in Circ. Res., vol. 112, 2013, pp. 1094-1096.
- ^ (EN) P. Libby, Novel Anti-Atherosclerotic Therapies, in Arterioscler. Thromb. Vasc. Biol., vol. 39, 2019, pp. 538-545.
- ^ (EN) AM. Gotto, Jr., Some reflections on arteriosclerosis: past, present, and future, in Circulation, vol. 72, 1985, pp. 8-17.
- ^ Meliceride, su treccani.it. URL consultato il 17 settembre 2017.
- ^ a b c (EN) A.S. Fauci, cap.235, in Harrison's principles of internal medicine, 17ª ed., McGraw-Hill Companies, 2008.
- ^ a b c (EN) J.T. Willerson, cap.30, in Cardiovascular medicine, 3ª ed., London, Springer-Verlag, 2007.
- ^ a b c (EN) V. Kumar, cap.11, in Robbins and Cotran Pathologic Basis of Disease, 9 ed, Philadelphia, Elsevier, 2015.
- ^ (EN) A.E. Moran, 1990-2010 global cardiovascular disease atlas, in Glob. Heart, vol. 9, 2014, pp. 3-16.
- ^ (EN) Global burden of disease, su healthdata.org. URL consultato il 27 febbraio 2016.
- ^ Il nuovo Global Burden of Disease study: cosa c'è di nuovo?, su saluteinternazionale.info. URL consultato il 27 febbraio 2016.
- ^ (EN) D.L. Mann, cap.1, su Braunwald's Heart Disease: a textbook of cardiovascular medicine, books.google.it, 10ª ed., Philadelphia, Elsevier-Saunders, 2015, pp. 1-10. URL consultato il 27 febbraio 2016.
- ^ (EN) American Heart Association, Heart Disease and Stroke Statistics—2016 Update (PDF), in Circulation, 2016, DOI:10.1161/CIR.0000000000000350.
- ^ a b c d e (EN) M. Nichols, Cardiovascular disease in Europe 2014: epidemiological update, in Eur. Heart J, vol. 35, 2014, pp. 2950-2959.
- ^ (EN) M.H. Criqui, Epidemiology of Peripheral Artery Disease, in Circ. Res., vol. 116, 2015, pp. 1509-1526.
- ^ L’evoluzione della mortalità per causa: le prime 25 cause di morte (PDF), ISTAT, 2017.
- ^ (EN) P.N. Nemetz, Recent Trends in the Prevalence of Coronary Disease, in Arch. Intern. Med., vol. 168, 2008, pp. 264-270.
- ^ (EN) C.Y. Smith et al., Contributions of Increasing Obesity and Diabetes to Slowing Decline in Subclinical Coronary Artery Disease, in J. Am. Heart. Assoc., vol. 4, 2015, p. e001524.
- ^ Progetto Cuore, su cuore.iss.it.
- ^ a b c d e f g h i j k l m n o p (EN) Mitchell et al., Robbins Basic Pathology: With STUDENT CONSULT Online Access, 8ª ed., Philadelphia, Saunders, 2007, pp. 345, ISBN 1-4160-2973-7.
- ^ (EN) Narain VS et al., Clinical correlation of multiple biomarkers for risk assessment in patients with acute coronary syndrome, in Indian Heart J, vol. 60, n. 6, 2008, pp. 536–42, PMID 19276492.
- ^ (EN) Rinehart JF, Greenberg LD, Arteriosclerotic Lesions in Pyridoxine-Deficient Monkeys, in Am. J. Pathol., vol. 25, n. 3, maggio 1949, pp. 481–91, PMC 1942913, PMID 18127137.
- ^ (EN) Rinehart JF e Greenberg LD, Vitamin B6 deficiency in the rhesus monkey; with particular reference to the occurrence of atherosclerosis, dental caries, and hepatic cirrhosis, in Am. J. Clin. Nutr., vol. 4, n. 4, 1956, pp. 318–25; discussion, 325–8, PMID 13339702.
- ^ (EN) Gruber, E.R. e Raymond, S.A., Beyond Cholesterol: Vitamin B6, Arteriosclerosis, and Your Heart, 1st, New York, St. Martin's Press, 1981.
- ^ a b (DE) Kocher T, Uber Kropf exstirpation und ihre Folgen, in Arch Klin Chir, vol. 29, 1883, pp. 254–337.
- ^ a b (EN) Turner KB, Studies on the prevention of cholesterol atherosclerosis in rabbits, in J Exp Med, vol. 58, 1933, pp. 115–125.
- ^ a b (EN) Katamine S et al., Effects of the longterm feeding of high-iodine eggs on lipid metabolism and thyroid function in rats, in J Nutr Sci Vitaminol, vol. 31, 1985, pp. 339–345.
- ^ a b (EN) Cann SA, Hypothesis: dietary iodine intake in the etiology of cardiovascular disease, in J Am Coll Nutr-volume=25, 2006, pp. 1–11.
- ^ a b c (EN) Venturi, Sebastiano, Evolutionary Significance of Iodine, in Current Chemical Biology-, vol. 5, n. 3, 2011, pp. 155–162, DOI:10.2174/187231311796765012, ISSN 1872-3136.
- ^ Borissoff JI et al., Is thrombin a key player in the 'coagulation-atherogenesis' maze?, in Cardiovasc. Res., vol. 82, n. 3, giugno 2009, pp. 392–403, DOI:10.1093/cvr/cvp066, PMID 19228706.
- ^ (EN) Borissoff JI et al., Early atherosclerosis exhibits an enhanced procoagulant state, in Circulation, vol. 122, n. 8, agosto 2010, pp. 821–30, DOI:10.1161/CIRCULATIONAHA.109.907121, PMID 20697022.
- ^ (EN) Borissoff JI, Spronk HM, ten Cate H, The hemostatic system as a modulator of atherosclerosis, in N. Engl. J. Med., vol. 364, n. 18, maggio 2011, pp. 1746–60, DOI:10.1056/NEJMra1011670, PMID 21542745.
- ^ (EN) Food and nutrition board, institute of medicine of the national academies, Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients), National Academies Press, 2005, pp. 481–484.
- ^ (EN) Food and nutrition board, institute of medicine of the national academies, Dietary Reference Intakes for Energy, Carbohydrate, Fiber, Fat, Fatty Acids, Cholesterol, Protein, and Amino Acids (Macronutrients), National Academies Press, 2005, pp. 494–505.
- ^ (EN) Bhatt DL, Topol EJ, Need to test the arterial inflammation hypothesis, in Circulation, vol. 106, n. 1, luglio 2002, pp. 136–40, DOI:10.1161/01.CIR.0000021112.29409.A2, PMID 12093783. URL consultato l'11 febbraio 2012 (archiviato dall'url originale l'11 marzo 2007).
- ^ (EN) Griffin M et al., Cellular cholesterol synthesis—the relationship to post-prandial glucose and insulin following weight loss, in Atherosclerosis., vol. 138, n. 2, 1998, pp. 313–8, DOI:10.1016/S0021-9150(98)00036-7, PMID 9690914.
- ^ (EN) King, Cr et al., Short sleep duration and incident coronary artery calcification, in JAMA : the journal of the American Medical Association, vol. 300, n. 24, dicembre 2008, pp. 2859–66, DOI:10.1001/jama.2008.867, PMC 2661105, PMID 19109114.
- ^ (EN) Food Pyramids: Nutrition Source, Harvard School of Public Health, su hsph.harvard.edu. URL consultato il 25 novembre 2007 (archiviato dall'url originale il 28 agosto 2008).
- ^ (EN) Taubes G, Nutrition. The soft science of dietary fat, in Science, vol. 291, n. 5513, marzo 2001, pp. 2536–45, DOI:10.1126/science.291.5513.2536, PMID 11286266.
- ^ (EN) Venturi S, Venturi M., Evolution of Dietary Antioxidant Defences, in European Epi-Marker, 11, 3, 2007, pp. 1–7.
- ^ (FR) Pellerin P, La tecnique d'autoradiographie anatomique a la temperature de l'azote liquide., in Path Biol, vol. 232, n. 9, 1961, pp. 233–252.
- ^ (EN) Ullberg S, Ewaldsson B, Distribution of radio-iodine studied by whole-body autoradiography., in Acta Radiologica Therapy Physics Biology, vol. 41, 1964, pp. 24–32.
- ^ (EN) Brown-Grant K, Extrathyroidal iodide concentrating mechanisms, in Physiol Rev-, vol. 41, 1961, pp. 189–213.
- ^ (EN) Farrell, A.P. et al., Arteriosclerosis in Atlantic salmon: effects of dietary cholesterol and maturation., in Arteriosclerosis, vol. 6, 1986, pp. 453–461, PMID 3729801.
- ^ (EN) Eaton R.P. et al., Coronary myointimal hyperplasia in freshwater Lake Michigan salmon (genus Oncorhynchus): Evidence for lipoprotein-related atherosclerosis., in American Journal of Pathology, vol. 116, n. 8, 1984, pp. 311–318, PMID 6431821.
- ^ (EN) ESC/EAS Guidelines for the management of dyslipidaemias, in Eur. Heart J., vol. 32, 2011, pp. 1769–1818.
- ^ carta di rischio Progetto Cuore e SCORE, su ausl.fe.it.
- ^ (EN) J. Pekkanen et al., Does the predictive value of baseline coronary risk factors change over a 30-year follow-up?, in Cardiology, vol. 82, 1993, pp. 181–190.
- ^ (EN) K. Fox et al., Heart Rate Working Group. Resting heart rate in cardiovascular disease, in J. Am. Coll. Cardiol., vol. 50, 2007, pp. 823-830.
- ^ (EN) I. Janssen et al., The Cooper Clinic mortality risk index clinical score sheet for men, in Am. J. Prev. Med., vol. 29, 2005, pp. 194–203.
- ^ (EN) D.M. Lloyd-Jones, Prediction of lifetime risk of cardiovascular disease by risk factor burden at 50 years of age, in Circulation, vol. 113, 2006, pp. 791–798.
- ^ V. Peiffer, S.J. Sherwin e P.D. Weinberg, Does low and oscillatory wall shear stress correlate spatially with early atherosclerosis? A systematic review, in Cardiovasc. Res., vol. 99, 2013, pp. 242-250.
- ^ (EN) P.A. Vander Laan, C.A. Reardon e G.S. Getz, Site specificity of atherosclerosis: site-selective responses to atherosclerotic modulators, in Arterioscl. Thromb. Vasc. Biol., vol. 24, 2004, pp. 12–22.
- ^ (EN) C.K. Zarins, S. Glagov e et al., Carotid bifurcation atherosclerosis. Quantitative correlation of plaque localization with flow velocity profiles and wall shear stress, in Circ. Res., vol. 53, 1983, pp. 502–514.
- ^ (EN) V. Kumar, A.K. Abbas e J.C. Aster, cap.11, in Robbins and Cotran Pathologic Basis of Disease, 9 ed, Philadelphia, Elsevier, 2015.
- ^ (EN) G. London et al., Arterial aging and arterial disease: interplay between central hemodynamics, cardiac work, and organ flow-implications for CKD and cardiovascular disease (PDF), in Kidney Int., Suppl. 1, 2001, pp. 10–12. URL consultato il 1º marzo 2016 (archiviato dall'url originale il 9 marzo 2016).
- ^ G. Hodgson, Trattato Delle Malattie Delle Arterie E Delle Vene, su G.B.Caimi (a cura di), books.google.it, 1823. URL consultato il 2 giugno 2017.
- ^ (FR) Michel Eugène Chevreul, Oeuvres scientifiques de Michel-Eugène Chevreul : doyen des étudiants de France 1806-1886, su archive.org, 1886. URL consultato il 2 giugno 2017.
- ^ (EN) George Gulliver, Notes of some of the researches in anatomy, physiology, pathology, and botany, of George Gulliver, su archive.org. URL consultato il 2 giugno 2017.
- ^ (EN) A. Zernecke e C. Weber, Chemokines in the vascular inflammatory response of atherosclerosis, in Cardiovasc. Res., vol. 86, 2010, pp. 192–201.
- ^ (EN) A.C. Doran, N. Meller e C.A. McNamara, Role of Smooth Muscle Cells in the Initiation and Early Progression of Atherosclerosis, in Arterioscl. Thromb. Vasc. Biol., vol. 28, 2008, pp. 812-819.
- ^ (EN) Q. Cai e L. Lanting, Interaction of monocytes with vascular smooth muscle cells regulates monocyte survival and differentiation through distinct pathways, in Arterioscl. Thromb. Vasc. Biol., vol. 24, 2004, pp. 2263–2270.
- ^ (EN) B.G. Nordestgaard, Triglyceride-Rich Lipoproteins and Atherosclerotic Cardiovascular Disease, in Circ. Res., vol. 118, 2016, pp. 547-563.
- ^ (EN) P. Libby e J.H. Qiao, Role of macrophage colony-stimulating factor in atherosclerosis: studies of osteopetrotic mice, in Am. J. Pathol., vol. 150, 1997, pp. 1687–1699.
- ^ (EN) Dennis Wolf e Klaus Ley, Immunity and Inflammation in atherosclerosis, in Circ. Res., vol. 124, n. 2, 2019, pp. 315-327.
- ^ (EN) R.A. Baylis, The CANTOS Trial, in Artherioscl. Thromb. Vasc. Biol., vol. 37, 2017, pp. e174–e177, PMID 28970294.
- ^ a b (EN) E. Falk et al., Update on acute coronary syndromes: the pathologists' view, in Eur. Heart J., vol. 34, 2014, pp. 719-728.
- ^ (EN) MJ. Mulligan-Keohe, The vasa vasorum in diseased and nondiseased arteries, in Am. J. Physiol., vol. 298, 2010, pp. H295–H305.
- ^ MJ. Mulligan-Keohe, The vasa vasorum in diseased and nondiseased arteries, in Am. J. Physiol., vol. 298, 2010, pp. H295–H305.
- ^ (DE) Rudolf Virchow, Die Cellularpathologie in ihrer Begründung auf physiologische und pathologische Gewebelehre, su archive.org, 1859. URL consultato il 2 giugno 2017.
- ^ (DE) Karl Aschoff, Sunao Tawara, Die heutige Lehre von den pathologisch-anatomischen Grundlagen der Herzschwäche : kritische Bemerkungen auf Grund eigener Untersuchungen, su archive.org, 1906. URL consultato il 2 giugno 2017.
- ^ (EN) M.E. DeBakey, G.M. Lawrie e D.H. Glaeser, Patterns of atherosclerosis and they surgical significance (PDF), in Ann. Surg., vol. 201, 1985, pp. 115-131.
- ^ Jeng-Jiann Chiu e Shu Chien, Effects of Disturbed Flow on Vascular Endothelium: Pathophysiological Basis and Clinical Perspectives, in Phys. Rev., vol. 91, 2011, pp. 327-387. URL consultato il 1º marzo 2016 (archiviato dall'url originale il 23 marzo 2017).
- ^ H.C. Stary et al., A definition of the intima of human arteries and of its atherosclerosis-prone regions: a report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association. Special report, in Circ., vol. 85, 1992, pp. 391-405.
- ^ a b (EN) H.C. Stary et al., A definition of initial, fatty streak, and intermediate lesions of atherosclerosis: a report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association. Special report, in Arterioscler. Thromb. Vasc. Biol., vol. 14, 1994, pp. 840-856.
- ^ (EN) H.C. Stary et al., A Definition of Advanced Types of Atherosclerotic Lesions and a Histological Classification of Atherosclerosis: a Report From the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association, in Arterioscler. Thromb. Vasc. Biol., vol. 15, 1995, pp. 1512-1531.
- ^ J.R. Guyton e K.F. Klemp, The lipid-rich core region of human atherosclerotic fibrous plaques: prevalence of small lipid droplets and vesicles by electron microscopy, in Am. J. Pathol., vol. 134, 1989, pp. 705-717.
- ^ (EN) J.R. Guyton e K.F. Klemp, Development of the lipid-rich core in human atherosclerosis, in Arterioscler. Thromb. Vasc. Biol., vol. 16, 1996, pp. 4-11.
- ^ (EN) G. Kellner-Weibel et al., Crystallization of Free Cholesterol in Model Macrophage Foam Cells, in Arterioscl. Thromb. Vasc. Biol., vol. 19, 1999, pp. 1891-1898.
- ^ a b (EN) G.S. Abela, Cholesterol crystals piercing the arterial plaque and intima trigger local and systemic inflammation, in J. Clin. Lipidol., vol. 4, 2010, pp. 156-164.
- ^ (EN) S.M. Nidorf, J.W. Eikelboom e P.L. Thompson, Targeting Cholesterol Crystal-Induced Inflammation for the Secondary Prevention of Cardiovascular Disease, in J Cardiovasc. Pharmacol. Ther., vol. 19, 2014, pp. 45-52. URL consultato il 17 dicembre 2020 (archiviato dall'url originale il 17 marzo 2016).
- ^ (EN) G.S. Abela e K. Aziz, Cholesterol crystals rupture biological membranes and human plaques during acute cardiovascular events--a novel insight into plaque rupture by scanning electron microscopy, in Scanning, vol. 28, 2006, pp. 1-10.
- ^ (EN) D.A. Towler e L. Demer, Thematic Series on the Pathobiology of Vascular Calcification, in Circ. Res., vol. 108, 2011, pp. 1378-1380.
- ^ (EN) H.C. Stary, Macrophages, macrophage foam cells, and eccentric intimal thickening in the coronary arteries of young children, in Atherosclerosis, vol. 64, 1987, pp. 91-108.
- ^ (EN) W.F. Enos, R.H. Holmes e J. Beyer, Coronary disease among United States soldiers killed in action in Korea, in JAMA, vol. 152, 1953, pp. 1090-1093.
- ^ (EN) R.L. Holman, H.C. Jr. McGill e J.P. Strong, The natural history of atherosclerosis (PDF), in Am. J. Pathol., vol. 34, 1958, pp. 209-235.
- ^ a b c d (EN) J.P. Strong e HC. Jr. McGill, The geographic pathology of atherosclerosis, in Ann. New York Acad. Sci., vol. 149, 1968, pp. 923-927, DOI:10.1111/j.1749-6632.1968.tb53846.x/abstract.
- ^ (EN) P. Greenland, 2010 ACCF/AHA guideline for assessment of cardiovascular risk in asymptomatic adults (PDF), in Circulation, vol. 122, 2010, pp. e584–e636.
- ^ (EN) S.A. Peters, Improvements in risk stratification for the occurrence of cardiovascular disease by imaging subclinical atherosclerosis: a systematic review (PDF), in Heart, vol. 98, 2012, pp. 177-184, PMID 22095617.
- ^ (EN) K. Gee-Hee, Is Carotid Artery Ultrasound Still Useful Method for Evaluation of Atherosclerosis?, in Korean Circ J., vol. 47, 2017, pp. 1–8, PMID 28154582.
- ^ (EN) M. Laclaustra, Femoral and Carotid Subclinical Atherosclerosis Association With Risk Factors and Coronary Calcium: The AWHS Study, in J. Am. Coll. Cardiol., vol. 67, 2016, pp. 1263-1274, PMID 26988945.
- ^ (EN) R. Forés, Contribution of the ankle-brachial index to improve the prediction of coronary risk: The ARTPER cohort, in PLoS One, vol. 13, 2018, p. e0191283, PMID 29338049.
- ^ (EN) A.E. Zavodni, Carotid artery plaque morphology and composition in relation to incident cardiovascular events: the Multi-Ethnic Study of Atherosclerosis (MESA), in Radiology, vol. 271, 2014.
- ^ (EN) L. Fernández-Friera, Prevalence, Vascular Distribution, and Multiterritorial Extent of Subclinical Atherosclerosis in a Middle-Aged Cohort, in Circulation, vol. 131, 2015, pp. 2104-2113.
- ^ a b c d Progetto Cuore - Prevenzione, su cuore.iss.it.
Bibliografia[modifica | modifica wikitesto]
- Guyton, Fisiologia Medica, Napoli, EdiSES, 2007, ISBN 88-7959-210-6.
- (EN) Eugene Braunwald, Peter Libby, Robert O. Bonow, Douglas P. Zipes, Douglas L. Mann, Braunwald's Heart Disease. A textbook of cardiovascular medicine, 8ª ed., Saunders Elsevier, 2008, ISBN 978-1-4160-4105-4.
- (EN) Frances Fischbach, Dunning III, Marshall B., A Manual of Laboratory and Diagnostic test, ed 8, Filadelfia, Lippincott Williams & Wilkins, maggio 2009, pp. 1344.
- John Willis Hurst, Il cuore, a cura di Alberto Zanchetti, 12ª ed., Milano, McGraw-Hill, 2009 [2008], pp. 2064-2078, ISBN 978-88-386-3943-2.
- Brian P. Griffin, Eric J. Topol, Malattie del Cuore, Filadelfia, Lippincott Williams & Wilkins, 2010.
- Bruno Trimarco et al., Cardiologia, Napoli, Idelson Gnocchi, 2013, ISBN 978-88-7947-568-6.
- Lionel H. Opie, Gersh Bernard J., Farmaci per il cuore, 8ª ed., Milano, Edra, 2014, ISBN 978-88-214-3768-7.
- Longo DL et al., Harrison Manuale di Medicina - 18ª edizione), a cura di Vanoli M, Milano, Casa Editrice Ambrosiana, 2014 [2013], ISBN 978-88-08-18603-4.
- (EN) Paramjit S. Tappia et al., Biochemistry of cardiovascular dysfunction in obesity, Springer Nature, 2020, ISBN 978-3-030-47335-8.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «aterosclerosi»
Wikizionario contiene il lemma di dizionario «aterosclerosi» Wikimedia Commons contiene immagini o altri file su aterosclerosi
Wikimedia Commons contiene immagini o altri file su aterosclerosi
Collegamenti esterni[modifica | modifica wikitesto]
- aterosclerosi, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) atherosclerosis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Aterosclerosi, su inran.it. URL consultato il 27 luglio 2009 (archiviato dall'url originale il 1º maggio 2017). - Pagina sul Sito dell'Istituto Nazionale di Ricerca per gli Alimenti e la Nutrizione
- Il progetto cuore, su cuore.iss.it, Istituto Superiore di Sanità. URL consultato il 27 luglio 2009 (archiviato dall'url originale il 16 febbraio 2007). - Sito dedicato alla prevenzione delle malattie cerebro e cardiovascolari
- Calcolo del rischio individuale, su cuore.iss.it, Istituto Superiore di Sanità. URL consultato il 27 luglio 2009.
| Controllo di autorità | Thesaurus BNCF 22402 · LCCN (EN) sh85009129 · J9U (EN, HE) 987007294940005171 |
|---|


