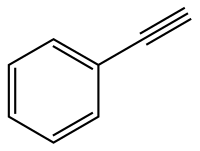
Fenilacetilene
| Fenilacetilene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Feniletino | |
| Abbreviazioni | |
| Ph-C≡CH | |
| Nomi alternativi | |
| fenilacetilene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8H6 |
| Massa molecolare (u) | 102,133 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 208-645-1 |
| PubChem | 10821 |
| SMILES | C#CC1=CC=CC=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,93 |
| Indice di rifrazione | 1,547 |
| Costante di dissociazione acida (pKa) a K | 28,7 (DMSO) 23,2 (aq, estrapolato) |
| Solubilità in acqua | 456 mg/L a 25 °C |
| Coefficiente di ripartizione 1-ottanolo/acqua | 2,53 |
| Temperatura di fusione | −44,8 °C |
| Temperatura di ebollizione | 143 °C |
| Tensione di vapore (Pa) a K | 17,6 mm Hg (37 °C) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 100 mg/Kg, topo, i.v. |
| Indicazioni di sicurezza | |
| Punto di fiamma | 27 °C |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 226 - 304 - 315 - 319 |
| Consigli P | 301+310 - 305+351+338 - 331 [1] |
Il fenilacetilene, o etinilbenzene, è un alchino aromatico di formula C6H5-C≡CH o anche Ph-C≡CH. Deriva formalmente dal benzene per sostituzione di un atomo di idrogeno con un gruppo etinile. Può altresì essere considerato come una molecola di acetilene in cui un H è sostituito con un gruppo fenile; in ogni caso, il triplo legame (C ibrido sp) è coniugato con l'anello benzenico.
A temperatura ambiente appare come un liquido incolore, viscoso e praticamente insolubile in acqua. È miscibile con alcool ed etere, è solubile in acetone, ma poco in cloroformio.[2]
Sintesi[modifica | modifica wikitesto]
Il fenilacetilene può essere sintetizzato facendo reagire il β-bromostirene con l'idrossido di potassio in ambiente riscaldato a 200 °C[3]:
- Ph-CH=CH-Br + KOH → Ph-C≡CH + KBr
Un secondo metodo per ottenere il fenilacetilene è per trattamento dell'1,2-dibromo-1-feniletano (ottenibile per bromurazione dello stirene) con sodio metallico in ammoniaca liquida; l'ammoniuro di sodio che così si forma è una base più forte degli idrossidi alcalini ed è capace di effettuare una doppia β-eliminazione (meccanismo E2) di HBr per dare il fenilacetilene[4]:
- Ph-CH(Br)-CH2-Br + 2 Na → Ph-C≡CH + 2 NaBr
Un altro metodo di sintesi parte dall'acido fenilpropiolico che, riscaldato in ambiente basico, subisce decarbossilazione:[3][5]
- Ph-C≡C-COOH → Ph-C≡CH + CO2↑
Reattività[modifica | modifica wikitesto]
Il fenilacetilene è un alchino terminale e, come tale, ha un idrogeno acido; il pKa estrapolato del Ph-C≡CH è 23,2[6] e quindi è anche più forte come acido dell'acetilene stesso (pKa = 25[7]). L'anione fenilacetiluro può quindi, come l'acetiluro, essere ottenuto facilmente in ambiente basico e formare fenilacetiluri metallici;[5] può anche addizionarsi facilmente al carbonio carbonilico (Addizione nucleofila al carbonile). In particolare, il fenilacetilene può dare la reazione di Mannich con la formaldeide e la dimetilammina:[8]
- Ph-C≡CH + H2C=O + HN(CH3)2 → Ph-C≡C-CH2-N(CH3)2 + H2O
Trattato con acido solforico diluito somma una molecola di acqua per dare l'acetofenone:[5]
- Ph-C≡CH + H2O → Ph-CO-CH3
Il fenilacetilene reagisce con ammine secondarie H-NR2 in soluzione di benzene con l'ossigeno molecolare, in presenza di acetato di rame(II) come catalizzatore, per dare inammine:[9]
- Ph-C≡CH + H-NR2 + ½ O2 → Ph-C≡C-NR2 + H2O
La bromurazione del fenilacetilene non segue un meccanismo stereospecifico e porta a una miscela di cis- e trans-dibromostirene:[10]
- Ph-C≡CH + Br2 → Ph-CBr=CHBr (cis + trans)
Il fenilacetilene può essere ridotto per idrogenazione del triplo legame carbonio-carbonio. La reazione può dare come prodotti lo stirene o l'etilbenzene per reazione completa di una mole di fenilacetilene con rispettivamente una mole e due moli di idrogeno molecolare[11]:
- Ph-C≡CH + H2 → Ph-CH=CH2
- Ph-C≡CH + 2 H2 → Ph-CH2-CH3
ll fenilacetilene inoltre, in opportune condizioni, può dimerizzare formando un idrocarburo complesso con nome IUPAC 1,4-difenilbut-1-en-3-ino. Il fenilacetilene deve essere riscaldato a 145 °C in ambiente anidro ad atmosfera di argon ed in presenza di FeCl3, toluene, KOtBu e DMEDA:
- 2 Ph-C≡CH → Ph-CH=CH-C≡C-Ph
Il dimero presenta nella struttura un doppio legame carbonio-carbonio, ciò conferisce alla molecola la proprietà di esistere in due distinti isomeri: una forma cis ed una trans[12].
Note[modifica | modifica wikitesto]
- ^ Fenilacetilene (PDF), su Sigma-Aldrich. URL consultato il 9 settembre 2015.
- ^ phenylacetylene, su chemister.ru. URL consultato il 15 aprile 2023.
- ^ a b (EN) John C. Hessler, Phenylacetylene, in Organic Syntheses, vol. 2, n. 67, Organic Syntheses, Inc., 1922, DOI:10.15227/orgsyn.002.0067, ISSN 0078-6209. URL consultato il 9 settembre 2015.
- ^ (EN) Kenneth N. Campbell e Barbara K. Campbell, Phenylacetylene, in Organic Syntheses, vol. 30, n. 72, Organic Syntheses, Inc., 1950, DOI:10.15227/orgsyn.030.0072, ISSN 0078-6209. URL consultato il 9 settembre 2015.
- ^ a b c I. L. Finar, ORGANIC CHEMISTRY The fundamental principles, Fourth Edition, Longmans, 1963, p. 538.
- ^ (EN) Andrew Streitwieser e David M. E. Reuben, Acidity of hydrocarbons. XXXV. Equilibrium acidities of phenylacetylene and tert-butylacetylene in cyclohexylamine, in Journal of the American Chemical Society, vol. 93, n. 7, 1971-04, pp. 1794–1795, DOI:10.1021/ja00736a045. URL consultato il 15 aprile 2023.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 303-307.
- ^ R.O.C. Norman, CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, pp. 271-273.
- ^ (EN) Laurence I. Peterson e Edgar C. Britton, A novel synthesis of ynamines. Copper catalyzed oxidation of phenylacetylene in the presence of secondary amines, in Tetrahedron Letters, vol. 9, n. 51, 1º gennaio 1968, pp. 5357–5360, DOI:10.1016/S0040-4039(00)75383-4. URL consultato il 15 aprile 2023.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., 2007, pp. 999-1004, ISBN 978-0-471-72091-1.
- ^ (EN) Phenylethyne, su webbook.nist.gov, NIST. URL consultato il 9 settembre 2015.
- ^ (EN) Ganesh Chandra Midya, Sushovan Paladhi, Kalyan Dhara e Jyotirmayee Dash, Iron Catalyzed Regioselective Dimerization of Terminal Aryl Alkynes (PDF), in Chemical Communications, Royal Society of Chemistry, ISSN 1364-548X. URL consultato il 9 settembre 2015.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su fenilacetilene
Wikimedia Commons contiene immagini o altri file su fenilacetilene