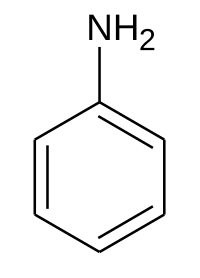
Anilina
| Anilina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| anilina | |
| Abbreviazioni | |
| Ph-NH2 | |
| Nomi alternativi | |
| fenilammina amminobenzene benzenammina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H7N |
| Massa molecolare (u) | 93,13 |
| Aspetto | liquido incolore (da giallo a bruno se impura) |
| Numero CAS | |
| Numero EINECS | 200-539-3 |
| PubChem | 6115 |
| DrugBank | DB06728 |
| SMILES | C1=CC=C(C=C1)N |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,03 |
| Costante di dissociazione basica a 293 K | 3,81×10−10 |
| Solubilità in acqua | 36 g/l a 293 K |
| Temperatura di fusione | −6,2 °C (266,9 K) |
| Temperatura di ebollizione | 184 °C (457 K) |
| ΔebH0 (kJ·mol−1) | 47,3 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 31,6 |
| C0p,m(J·K−1mol−1) | 191,9 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 76 °C (349 K) |
| Limiti di esplosione | 1,2 - 11% vol. |
| Temperatura di autoignizione | 540 °C (813 K) |
| Simboli di rischio chimico | |
    
| |
| pericolo | |
| Frasi H | 351 - 341 - 331 - 311 - 301 - 372 - 318 - 317 - 400 |
| Consigli P | 273 - 280 - 308+313 - 302+352 - 305+351+338 - 309+310 [1] |
L'anilina, nota anche come fenilammina o amminobenzene, è un composto aromatico avente formula bruta C6H7N. È un'ammina primaria la cui struttura è quella di un benzene, in cui un atomo di idrogeno è stato sostituito da un gruppo NH2. A temperatura ambiente si presenta come un liquido incolore quando è molto pura. Data la facilità con cui si ossida all'aria, l'anilina tende col tempo a scurirsi fino ad annerire.
Storia[modifica | modifica wikitesto]
L'anilina fu isolata per la prima volta nel 1826 da Otto Unverdorben per distillazione dei prodotti di decomposizione dell'indaco. Fu inizialmente chiamata cristallina.
Nel 1834 F. Runge isolò dal catrame una sostanza capace di produrre un'intensa colorazione blu per trattamento con la calce e la battezzò cianolo.
Nel 1841 C. J. Fritzsche diede il nome di anilina all'olio ottenuto per trattamento dell'indaco con potassa caustica. Prese il nome dalla pianta di Indigofera anil, da cui l'indaco viene ricavato. A sua volta anil deriva dal sanscrito nīla, blu scuro, e nīlā, la pianta dell'indaco. Più o meno nello stesso periodo il chimico russo Nikolaj Nikolaevič Zinin scoprì che per riduzione del nitrobenzene si ottiene un composto basico che chiamò benzidam.
Fu infine August Wilhelm von Hofmann nel 1855 a dimostrare l'identità di questi preparati, tutti riconducibili ad un'unica sostanza, chiamata quindi anilina o fenilammina.
La prima produzione su scala industriale dell'anilina fu impiegata come intermedio della sintesi della mauveina, un colorante viola scoperto nel 1856 da William Henry Perkin. Viene utilizzato anche per il "nero inferno", un colorante per le pelli usato dai calzolai.
Sintesi[modifica | modifica wikitesto]
L'anilina può essere prodotta dal benzene in due passaggi. Dapprima il benzene viene nitrato, cioè fatto reagire con una miscela di acido nitrico e acido solforico concentrati per dare il nitrobenzene tramite una reazione di sostituzione elettrofila. Quindi il nitrobenzene viene ridotto ad anilina per reazione con diversi reagenti riducenti; tra essi l'idrogeno in presenza di un catalizzatore o un metallo (ferro, zinco o stagno) in presenza di acidi.
Molti derivati dell'anilina possono essere sintetizzati in modo simile.
Proprietà e reattività chimica[modifica | modifica wikitesto]
L'anilina è una sostanza velenosa con possibili effetti cancerogeni (frase di rischio R40). È un liquido oleoso dall'odore caratteristico e dall'aspetto incolore, tuttavia nel tempo si ossida e produce impurezze resinose di colore rosso-bruno. Brucia facilmente con fiamma grande e fumosa. Dal punto di vista chimico è una base debole. Le ammine aromatiche come l'anilina sono in genere meno basiche delle ammine alifatiche, questo perché il doppietto elettronico dell'atomo di azoto è parzialmente condiviso con l'anello aromatico per risonanza ed è pertanto meno disponibile per essere ceduto a specie chimiche acide.
- L'anilina reagisce con gli acidi forti a dare sali di anilinio C6H5-NH3+ che generalmente per riscaldamento si decompongono liberando ammoniaca; reagisce inoltre con gli alogenuri acilici, come il cloruro di acetile CH3COCl, o con gli acidi carbossilici in ambiente disidratante a dare le ammidi. Le ammidi dell'anilina sono spesso chiamate anilidi; CH3-CO-NH-C6H5, ad esempio, è l'acetanilide.[2]
- Per reazione con ioduri alchilici l'anilina forma ammine secondarie e terziarie; per bollitura con solfuro di carbonio dà la solfocarbanilide (difeniltiourea, CS(NHC6H5)2) che può essere decomposta in tiocianato di fenile C6H5CNS e trifenilguanidina C6H5N=C(NHC6H5)2.
- Come il fenolo anche l'anilina subisce facilmente reazioni di sostituzione elettrofila sull'anello aromatico in posizione para e orto. Per reazione con l'acido solforico a 180 °C dà l'acido solfanilico p-NH2-C6H4-SO3H le cui ammidi costituiscono la classe dei farmaci sulfamidici, antibatterici comunemente usati all'inizio del XX secolo.
- L'anilina ed i suoi derivati sostituiti sull'anello aromatico reagiscono facilmente con l'acido nitroso per dare i corrispondenti sali di diazonio; attraverso essi il gruppo -NH2 dell'anilina può essere convertito in altri gruppi funzionali quali -OH, -CN o un alogeno oppure possono venire sintetizzati composti coloranti, detti coloranti diazoici.
- Con l'acroleina l'anilina reagisce secondo la sintesi di Skraup come seguito:
- L'anilina viene facilmente ossidata sia sul gruppo -NH2 sia sull'anello aromatico; in ambiente alcalino l'ossidazione dell'anilina produce l'azobenzene; con l'acido arsenico si ottiene il colorante viola di anilina, con l'acido cromico viene convertita nel corrispondente chinone, mentre per ossidazione con clorati in presenza di sali metallici, specialmente di vanadio, si ottiene il colorante nero di anilina.
- L'ossidazione con acido cloridrico e clorato di potassio dà il cloranile; l'ossidazione con permanganato di potassio in soluzione neutra la trasforma in nitrobenzene, in soluzione alcalina la ossida a azobenzene, ammoniaca ed acido ossalico, in soluzione acida la trasforma in nero di anilina.
- La reazione con acido ipocloroso dà 4-amminofenolo e 4-ammino-difenilammina.
Saggi[modifica | modifica wikitesto]
L'anilina ed i suoi sali possono essere identificati in una soluzione acquosa per aggiunta di poche gocce di soluzione satura di ipoclorito di calcio; si ottiene colorazione.
Utilizzi[modifica | modifica wikitesto]
Il valore commerciale dell'anilina è legato alla sua versatilità come intermedio nelle sintesi chimiche industriali di prodotti quali farmaci, ausiliari e coloranti.
A partire dal 1858 l'anilina è stata la materia prima impiegata nella produzione di centinaia di sostanze coloranti tra cui la fucsina, la safranina, l'indaco e molte altre.
Industrialmente l'anilina è prodotta per riduzione del nitrobenzene con ferro e acido cloridrico, purificandola successivamente per distillazione in corrente di vapore.
L'anilina fu inizialmente considerata come propellente per razzi, ma fu abbandonata a causa dell'alta temperatura di fusione.
Effetti per la salute[modifica | modifica wikitesto]
L'anilina è uno dei primi cancerogeni riconosciuti per l'uomo.[3] Ludwig Rehn, nel 1895, associò l'incidenza del tumore alla vescica all'esposizione dei lavoratori dell'industria tedesca dei coloranti artificiali.[3] Provoca soprattutto tumori della vescica e anche tumori renali, cutanei, epatici e del sangue. La molecola non è cancerogena in quanto tale, ma lo diventa a seguito della sua metabolizzazione nel fegato attraverso processi di idrossilazione ad opera di enzimi dipendenti dal citocromo P450 (catena ossidativa dei microsomi). I principali derivati dell'anilina sono il para-ammino-fenolo e la 2,4-diossi-anilina; a loro volta questi intermedi devono andare incontro a reazioni di ossido-riduzione per potersi trasformare nei loro rispettivi chinoni: para-iminochinone e 2-idrossi-para-iminochinone.
Sono queste ultime molecole, assai reattive (elettrofili), che reagiscono prontamente con specifici residui di proteine e con gli acidi nucleici instaurando un legame di tipo covalente. Nel caso delle proteine se si tratta di enzimi questi possono essere permanentemente inattivati e devono essere degradati. Nel caso degli acidi nucleici, soprattutto del DNA, si verificano interazioni covalenti con le basi guanina ed adenina, reazioni che portano sia a legami crociati tra le eliche del DNA sia a rotture delle stesse. A seconda dei geni interessati e della sede al loro interno si potranno avere variabili alterazioni del fenotipo cellulare, per esempio alterazioni in geni oncosoppressori possono rendere la cellula più soggetta a trasformazioni neoplastiche. Un triste esempio della carcinogenicità dell'anilina è la fabbrica IPCA di Ciriè, comune della città metropolitana di Torino.
Note[modifica | modifica wikitesto]
- ^ scheda dell'anilina su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (EN) IUPAC Gold Book, "anilides"
- ^ a b (EN) The Epidemiological Imagination: A Reader - 1994, Page 77 | Online Research Library: Questia, su www.questia.com. URL consultato il 15 agosto 2017.
Bibliografia[modifica | modifica wikitesto]
- (EN) Klaus Weissermel, Hans-Jürgen Arpe, Charlet R. Lindley, Industrial organic chemistry, 4ª ed., Wiley-VCH, 2003, pp. 376-379, ISBN 3-527-30578-5.
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «anilina»
Wikizionario contiene il lemma di dizionario «anilina» Wikimedia Commons contiene immagini o altri file su anilina
Wikimedia Commons contiene immagini o altri file su anilina
Collegamenti esterni[modifica | modifica wikitesto]
- Anilina, ulla Matrice di esposizione a cancerogeni - MATline, su dors.it.
- (EN) aniline / aniline dye, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 30854 · LCCN (EN) sh85005157 · GND (DE) 4142482-7 · BNF (FR) cb12359525w (data) · J9U (EN, HE) 987007294056505171 |
|---|
