Ipoclorito di calcio
| Ipoclorito di calcio | |
|---|---|
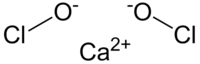 | |
| Nome IUPAC | |
| Monossoclorato di calcio | |
| Nomi alternativi | |
| Cloruro di calce | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Ca(ClO)2 |
| Peso formula (u) | 143.0 |
| Aspetto | solido di colore bianco |
| Numero CAS | |
| Numero EINECS | 231-908-7 |
| PubChem | 24504 |
| DrugBank | DB15912 |
| SMILES | [O-]Cl.[O-]Cl.[Ca+2] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2.35 |
| Solubilità in acqua | 210 g/l a 25 °C |
| Temperatura di fusione | 100 °C (373 K) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 272 - 302 - 314 - 335 - 400 - EUH031 |
| Consigli P | 273 - 280 - 301+330+331 - 304+340 - 305+351+338 - 309+310 [1] |
L'ipoclorito di calcio, altrimenti noto come cloruro di calce, dalla formula chimica Ca(ClO)2, è una polvere bianca, igroscopica ed alterabile all'aria dal caratteristico odore di cloro. Il prodotto industriale cloruro di calce è una miscela di cloruro ed ipoclorito di calcio a contenuto variabile.
Storia[modifica | modifica wikitesto]
Charles Tennant e Charles Macintosh svilupparono un processo industriale per la produzione di cloruro di calce alla fine del XVIII secolo[2]. È stato brevettato nel 1799 e utilizzato pesantemente durante la prima guerra mondiale per disinfettare le trincee e le ferite.
Proprietà[modifica | modifica wikitesto]
Esposto all'aria fissa facilmente l'anidride carbonica eliminando cloro gassoso e formando carbonato di calcio. Con gli acidi reagisce sviluppando cloro. Questa reattività con gli acidi è alla base della misura del suo valore in relazione alla quantità di cloro sviluppato e che viene detto grado o titolo del cloruro; il titolo si calcola in gradi francesi di Gay-Lussac che corrispondono ai litri di cloro gassoso sviluppati da 1 kg di prodotto. Prodotti di buona qualità contengono il 35% di cloro attivo[3].
Sintesi[modifica | modifica wikitesto]
A livello industriale l'ipoclorito di calcio si ricava trattando la calce spenta (Ca(OH)2) con cloro gassoso (Cl2). La reazione può essere condotta in diverse fasi per dare varie composizioni, ciascuna con diversa concentrazione di ipoclorito di calcio, insieme a calce non convertita e cloruro di calcio. Viene qui di seguito mostrata la conversione completa[4]:
- .
La polvere decolorante è realizzata con calce spenta leggermente umida. Non è una semplice miscela di ipoclorito di calcio, cloruro di calcio e idrossido di calcio, si tratta invece di una miscela costituita principalmente da ipoclorito di calcio (Ca(OCl)2), ipoclorito di calcio dibasico (Ca3(OCl)2(OH)4 o scritto anche come Ca(OCl)2 · 2Ca(OH)2), e dibasico cloruro di calcio (Ca3Cl2(OH)4 (chiamato anche idrossicloruro di calcio e scritto come CaCl2 · 2Ca(OH)2)[5].
In laboratorio può essere prodotto in piccole quantità anche per reazione di scambio ionico fra una soluzione di altri sali solubili dell'ipoclorito e una soluzione satura di cloruro di calcio.
Il cloruro di calce si prepara impastando omogeneamente 1 parte di ipoclorito di calcio con 3 parti d'acqua a cui si aggiungono altre 3 parti d'acqua. Si lascia decantare il miscuglio e infine si diluisce la soluzione limpida fino a volume e concentrazione richiesta.
Usi[modifica | modifica wikitesto]
Igienico-sanitari[modifica | modifica wikitesto]
L'ipoclorito di calcio è comunemente usato per sanificare le piscine pubbliche e disinfettare l'acqua potabile. Generalmente le sostanze commerciali sono vendute con una purezza dal 65% al 73% con altri prodotti chimici presenti, come cloruro di calcio e carbonato di calcio, derivanti dal processo di fabbricazione. Come sostanza chimica per piscine, viene miscelata con altre sostanze chimiche meno spesso rispetto ad altre forme di cloro, a causa di reazioni pericolose con alcune comuni sostanze chimiche per piscine. In soluzione, l'ipoclorito di calcio potrebbe essere usato come disinfettante per uso generale[6], ma a causa dei residui di calcio, di solito si preferisce l'ipoclorito di sodio.
Chimica organica[modifica | modifica wikitesto]
L'ipoclorito di calcio è un agente ossidante generale e quindi trova un certo impiego nella chimica organica[7]. Ad esempio, il composto viene utilizzato per scindere glicoli, acidi α-idrossi carbossilici e chetoacidi per produrre aldeidi o acidi carbossilici frammentati[8]. L'ipoclorito di calcio può essere utilizzato anche nella reazione dell'aloformio per produrre cloroformio[9]. L'ipoclorito di calcio può essere utilizzato per ossidare i sottoprodotti del tiolo e dei solfuri nella sintesi organica e quindi ridurre il loro odore e renderli sicuri da smaltire[10].
Industria[modifica | modifica wikitesto]
Il cloruro di calce nell'industria tessile s'impiega nel candeggio delle fibre vegetali e nel processo di cloraggio della lana.
Note[modifica | modifica wikitesto]
- ^ scheda dell'ipoclorito di calcio su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (EN) Calcium hypochlorite, su chemistryworld.com, Chemistry World. URL consultato il 6 settembre 2021.
- ^ Naftolo ACNA norme per l'applicazione. Vol4 2ª ed. , ACNA Milano
- ^ (EN) H. Vogt, J Balej, J. E. Bennett, P. Wintzer, S. A. Sheikh, P. Gallone, S. Vasudevan e K. Pelin, Chlorine Oxides and Chlorine Oxygen Acids, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2010, ISBN 978-35-27-30673-2.
- ^ (EN) W.L Smith, Inorganic bleaches, Production of Hypochlorite, in Handbook of Detergents,Part F, CRC Press, 2009, ISBN 978-08-24-70349-3.
- ^ (EN) Mannsvile Chemical Products, "Chemical Products Synopsis: Calcium Hypochlorite", 1987, Asbuiy Park, NJ
- ^ (EN) Stephen Nwaukwa e Philip Keehn, The oxidation of aldehydes to acids with calcium hypochlorite [Ca(OCl)2], in Tetrahedron Letters, vol. 23, n. 31, 1982, p. 3131–3134, DOI:10.1016/S0040-4039(00)88577-9.
- ^ (EN) Stephen Nwaukwa e Philip Keehn, Oxidative cleavage of α-diols, α-diones, α-hydroxy-ketones and α-hydroxy- and α-keto acids with calcium hypochlorite [Ca(OCl)2], in Tetrahedron Letters, vol. 23, n. 31, 1982, p. 3135–3138, DOI:10.1016/S0040-4039(00)88578-0.
- ^ (EN) Julius Cohen, Practical Organic Chemistry for Advanced Students, New York, Macmillan & Co., 1900, p. 63.
- ^ (EN) National Research Council, Prudent Practices in the Laboratory: Handling and Disposal of Chemicals, Washington, DC, The National Academies Press, 1995, p. 161, DOI:10.17226/4911, ISBN 978-03-09-05229-0.
Collegamenti esterni[modifica | modifica wikitesto]
- Scheda dell'ipoclorito su Center for Disease Control and Prevention
