Acido nitroso
| Acido nitroso | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido diossonitrico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | HNO2 |
| Massa molecolare (u) | 47,018 u |
| Aspetto | soluzione acquosa azzurro pallido |
| Numero CAS | |
| Numero EINECS | 231-963-7 |
| PubChem | 24529 |
| DrugBank | DB09112 |
| SMILES | N(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,142 g/ml |
| Costante di dissociazione acida a 298 K K | 7,10×10−4 |
| Solubilità in acqua | completa |
| Temperatura di fusione | esiste solo in soluzione acquosa o in fase gassosa |
| Temperatura di ebollizione | si decompone |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 8-35 |
| Frasi S | 23-26-36-45 |
L'acido nitroso, nome sistematico acido diossonitrico(III), è l'ossiacido dell'azoto trivalente, di formula HNO2 (H-O–N=O). A differenza dell'acido nitrico (HNO3), dove N è pentavalente, in soluzione acquosa è un acido solo parziamente dissociato e pertanto è classificato come acido debole. Da esso si ottengono sali che prendono il nome di nitriti.[1]
Struttura molecolare e proprietà[modifica | modifica wikitesto]
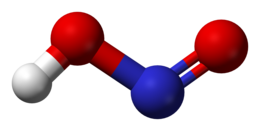
L'acido nitroso è un composto cineticamente molto instabile, come pure la sua anidride formale N2O3,[2] pur essendo termodinamicamente stabile: ΔHƒ° = -76,73 kJ/mol.[3] È noto allo stato puro solo in fase gassosa.[4][5] La sua molecola può esistere in due forme geometriche isomere, entrambe planari: la forma sin, con l'atomo H dell'ossidrile rivolto verso l'O del nitrosile (–N=O) e la forma anti, in cui esso è rivolto in direzione opposta. La forma anti è più stabile della sin di 2,3 kJ/mol,[1] ma le due si interconvertono tra loro tramite una rotazione dell'ossidrile attono al legame O–N superando una barriera energetica di 45,2 kJ/mol.[6] Per entrambe la simmetria molecolare è Cs.[7]
Nella forma anti (quella raffigurata) la lunghezza del legame H–O è di 95,9 pm, quella di O–N è di 144,2 pm e quella di N=O è di 116,9 pm.[8] Si può notare che il legame O–N è leggermente più lungo del normale (140 pm[9]) e che quello N=O è invece leggermente più corto del valore normale (121 pm[9]). L'angolo HON è di 102,1°, più piccolo dei 109,5° attesi per un'ibridazione sp3 di O, il che però è spiegabile in vista della presenza su O di 2 coppie solitarie che occupano più spazio angolare delle coppie di legame (VSEPR). L'angolo ONO è di 110,6°.[8] Questo è più stretto dei 120° attesi per un'ibridazione sp2 dell'atomo di azoto, anche in confronto allo ione nitrito NO2– (115°), ma anche qui la coppia solitaria su N fa stringere un po' l'angolo.
La molecola HNO2 è decisamente polare: il suo momento dipolare ammonta a 1,85 D,[10] praticamente uguale a quello dell'acqua (1,86 D).
Nelle sue soluzioni acquose, alle quali HNO2 conferisce lieve colore azzurro-verdino pallido (simile a quello di N2O3), e un odore un po' pungente, esso è presente in larga parte come molecole indissociate, ma già a freddo manifesta la sua instabilità disproporzionandosi parzialmente a N(V) e N(II) e questo più estesamente al crescere della concentrazione della soluzione e della temperatura:[6][11]
3 HNO2 (aq) ⇄ H3O+ (aq) + NO3– (aq) + 2 NO↑
Il monossido di azoto gassoso che si libera dalla soluzione, reagendo con l'ossigeno dell'aria, si converte rapidamente in biossido di azoto (NO2) di colore arancione-bruno.
Le sue soluzioni si possono ottenere libere virtualmente da sali trattando soluzioni di nitrito di argento, o nitrito di bario con quantità stechiometriche di acido cloridrico o, rispettivamente, acido solforico, preferibilmente a 0 °C, secondo le reazioni:[1]
AgNO2 + HCl → HNO2 + AgCl↓
Ba(NO2)2 + H2SO4 → 2 HNO2 + BaSO4↓
La seconda reazione è preferibile in quanto AgNO2 è un sale poco solubile di suo. Si può anche preparare facendo assorbire in acqua N2O3 (gas instabile) oppure una miscela equimolecolare di NO e NO2 (che sono i prodotti di dissociazione di N2O3):
N2O3 + H2O ⇄ 2 HNO2
In soluzione acquosa l'acido nitroso si comporta da acido debole:
HNO2 + H2O ⇄ H3O+ + NO2–
il suo pKa a 25 °C è pari a 3,16,[12] e quindi è un acido più forte dei comuni acidi carbossilici (pKa ≈ 4,7) e anche un po' più forte dell'acido formico (pKa a 25 °C = 3,745[13]).

Con i metalli forma sali chiamati nitriti, stabili a temperatura ambiente. I nitriti dei metalli alcalini e alcalino terrosi sono solubili in acqua, cristallini incolori, mentre quelli dei metalli di transizione sono in genere colorati e poco solubili.
Usi[modifica | modifica wikitesto]
L'acido nitroso è un acido debole, viene utilizzato in chimica come agente nitrosante e nella preparazione dei diazocomposti, soprattutto nell'industria delle sostanze coloranti.
Inoltre viene utilizzato nelle reazioni con le ammine primarie, liberando N2, H2O e l'alcool corrispondente; nelle reazioni con le ammine secondarie con la formazione di nitrosammine ed acqua.
Preparazione[modifica | modifica wikitesto]
Viene preparato per essere utilizzato immediatamente, o addirittura in seno alla reazione, facendo reagire una soluzione fredda di un nitrito alcalino con un acido minerale diluito come l'acido cloridrico, e i nitriti alcalini si possono preparare facendo assorbire biossido di azoto da una soluzione fredda di idrossido corrispondente, oppure per decomposizione termica del corrispondente nitrato alcalino.
Precauzioni[modifica | modifica wikitesto]
L'acido nitroso è anche un agente mutageno poiché può modificare i legami chimici fra le varie basi del DNA secondo un processo chiamato deaminazione ossidativa. L'alterazione consiste nella trasformazione dell'adenina in ipoxantina e la citosina in uracile; l'ipoxantina, a differenza dell'adenina, non può più legarsi con la timina, ma solo con la citosina, mentre l'uracile, anziché appaiarsi con la guanina, si unisce con l'adenina comportando dunque una evidente mutazione del codice genetico.
Note[modifica | modifica wikitesto]
- ^ a b c N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, pp. 461-462, ISBN 0-7506-3365-4.
- ^ James E. House e Kathleen A. House, Descriptive Inorganic Chemistry, 3ª ed., Elsevier, 2016, p. 209, ISBN 978-0-12-804697-5.
- ^ M. W. Chase, NIST-JANAF Themochemical Tables, Fourth Edition, 1998, pp. 1–1951. URL consultato il 15 settembre 2022.
- ^ A. F. Holleman, E. Wiberg e N. Wiberg, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103ª ed., De Gruyter, 2016, pp. 822-823, ISBN 978-3-11-026932-1.
- ^ (EN) Antonio. Febo, Cinzia. Perrino e Monica. Gherardi, Evaluation of a High-Purity and High-Stability Continuous Generation System for Nitrous Acid, in Environmental Science & Technology, vol. 29, n. 9, 1º settembre 1995, pp. 2390–2395, DOI:10.1021/es00009a035. URL consultato il 15 settembre 2022.
- ^ a b A. F. Holleman, E. Wiberg e N. Wiberg, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103ª ed., De Gruyter, 2016, p. 824, ISBN 978-3-11-026932-1.
- ^ CCCBDB list all species by point group, su cccbdb.nist.gov. URL consultato il 15 settembre 2022.
- ^ a b CCCBDB listing of experimental data page 2, su cccbdb.nist.gov. URL consultato il 15 settembre 2022.
- ^ a b J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, p. A-25 - A-37, ISBN 88-299-1470-3.
- ^ nitrous acid, su www.stenutz.eu. URL consultato il 15 settembre 2022.
- ^ Gary L. Miessler, Paul J. Fischer e Donald A. Tarr, Inorganic Chemistry, 5ª ed., Pearson Education, 2014, p. 289, ISBN 978-0-321-81105-9.
- ^ (EN) Gabriel da Silva, Eric M. Kennedy e Bogdan Z. Dlugogorski, Ab Initio Procedure for Aqueous-Phase p K a Calculation: The Acidity of Nitrous Acid, in The Journal of Physical Chemistry A, vol. 110, n. 39, 1º ottobre 2006, pp. 11371–11376, DOI:10.1021/jp0639243. URL consultato il 15 settembre 2022.
- ^ Arthur E. Martell, Critical stability constants, Plenum, ISBN 978-1-4615-6764-6, OCLC 761375941. URL consultato il 16 settembre 2022.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «acido nitroso»
Wikizionario contiene il lemma di dizionario «acido nitroso» Wikimedia Commons contiene immagini o altri file su acido nitroso
Wikimedia Commons contiene immagini o altri file su acido nitroso
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) nitrous acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 37367 · LCCN (EN) sh85092096 · GND (DE) 4178975-1 · J9U (EN, HE) 987007531400605171 |
|---|