Butadiene
| Butadiene | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| 1,3-butadiene | |
| Nomi alternativi | |
| butadiene bietilene divinile viniletilene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H6 |
| Massa molecolare (u) | 54,09 |
| Aspetto | gas incolore di odore caratteristico |
| Numero CAS | |
| Numero EINECS | 203-450-8 |
| PubChem | 7845 |
| SMILES | C=CC=C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,62 (liquefatto in c.n.) |
| Solubilità in acqua | 735 ppm w (20 °C) |
| Temperatura di fusione | −108,9 °C (164,25 K) |
| Temperatura di ebollizione | −4,4 °C (268,75 K) |
| Tensione di vapore (Pa) a 293,15 K | 245 kPa |
| Indicazioni di sicurezza | |
| Punto di fiamma | −76 °C (197,15 K) |
| Limiti di esplosione | 1,1 - 16,3 % |
| Temperatura di autoignizione | 414 °C (687,15 K) |
| TLV (ppm) | 2 |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 220 - 350 - 340 - 280 |
| Consigli P | 210 - 202 - 308+313 - 377 - 381 - 405 - 403 [1] |
Il butadiene è un poliene composto da quattro atomi di carbonio ("buta" da butano) che presenta due doppi legami ("diene" da di- che indica due ed -ene che indica un doppio legame).
Struttura[modifica | modifica wikitesto]
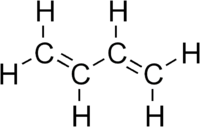
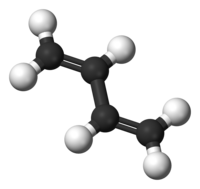
L'1,3-butadiene è una molecola organica composta da 4 atomi di carbonio e un doppio legame tra il carbonio 1 e il carbonio 2 e un altro doppio legame tra il carbonio 3 e il carbonio 4: CH2=CH-CH=CH2. È un diene coniugato.
L'1,2-butadiene rappresenta il composto isomero di struttura.
Reattività[modifica | modifica wikitesto]
L'1,3-butadiene è un diene coniugato, e in quanto tale molto reattivo grazie alle diverse forme di risonanza che distribuiscono gli elettroni sugli orbitali; l'1,3-butadiene può subire addizione elettrofila 1,2 (cosiddetta vinilica) e 1,4, per cui si ottiene del polibutadiene nel quale a bassa temperatura predomina l'addotto 1,2 (cineticamente favorito, caratterizzato dalla formazione di un gruppo vinilico per ogni molecola reagita), mentre a temperature maggiore prevale l'addotto 1,4 (termodinamicamente più stabile).
La reazione del butadiene è esotermica, con forte sviluppo di calore, circa 340 kcal/kg nel caso della polimerizzazione del polibutadiene. La forte esotermicità va tenuta in conto al fine di evitare eccessivi incrementi di pressione; si tenga anche conto che all'incremento di temperatura corrisponde un aumento della velocità di reazione, che in alcuni casi può essere così rapida da configurarsi come vera e propria reazione fuggitiva (run-away).
La forte reattività del butadiene porta alla formazione di "pop-corn", un polimero vetroso caratterizzato da peso molecolare medio, consistenza molto dura e un aspetto fiorito, simile al pop-corn, da cui prende il nome. Industrialmente il fenomeno è tenuto sotto controllo mediante l'adozione di alcune accortezze tecniche: assenza di ossigeno anche in modeste quantità, evitare punti di ristagno (zone morte), uso di sostanze antipolimerizzanti, ecc.
Il butadiene inoltre tende a dimerizzare, per reazione di cicloaddizione di Diels-Alder, formando il vinilcicloesene. La reazione è attivata per via termica, l'aumento di temperatura accelera la reazione di dimerizzazione; per lo stoccaggio per lunghi periodi di tempo è opportuno utilizzare uno stoccaggio refrigerato.
Fonti industriali[modifica | modifica wikitesto]
Industrialmente si ottiene principalmente in due modi:
- isolandolo dalla frazione C4 ottenuta dallo steamcracking della virgin nafta; la separazione del butadiene dalle altre molecole C4 può essere fatta mediante distillazione estrattiva con solventi selettivi (acetonitrile, azotometilpirrolidone, furfurolo); in laboratorio si può fare la separazione mediante formazione di un complesso con acetato di cuproammonio;
- deidrogenazione da n-butano: catalizzatore miscela Al2O3/CrO3 in rapporto 4:1, pressione 0,2 atm, temperatura 650 °C. In alternativa si possono usare miscele C4 ricche in 1-butene.
- Altri metodi, che non hanno applicazioni industriali:
- sintesi da etanolo, a temperatura 400-450 °C in presenza di ossidi metallici catalizzatori: 2 CH3CH2OH → CH2=CHCH=CH2 + 2 H2O + H2.
- sintesi da butandiolo.
Utilizzo industriale[modifica | modifica wikitesto]
Il butadiene viene utilizzato per preparare elastomeri quali il polibutadiene, il neoprene o copolimeri con stirene (gomma SBR) o con acrilonitrile (gomma nitrilica).
Piccole quantità sono utilizzate nella sintesi del nylon via adiponitrile. È usato anche per preparare industrialmente il ciclododecatriene tramite trimerizzazione.
Note tossicologiche[modifica | modifica wikitesto]
Esposizioni acute al butadiene causano sintomi vegetativi quali disturbi visivi, vertigini, stanchezza generale, abbassamento della pressione sanguigna, mal di testa, nausea, diminuzione del battito cardiaco e svenimento.
Diversi studi tossicologici indicano che un'esposizione cronica al butadiene può causare malattie cardiovascolari e cancro (categoria 1 delle liste IARC). Recenti studi stanno valutando l'effetto sulla sfera riproduttiva.
Note[modifica | modifica wikitesto]
- ^ scheda del butadiene su IFA-GESTIS
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su butadiene
Wikimedia Commons contiene immagini o altri file su butadiene
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) butadiene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.