Distrofia miotonica
| Distrofia miotonica | |
|---|---|
 | |
| Malattia rara | |
| Cod. esenz. SSN | RFG090 |
| Specialità | neurologia |
| Eziologia | mutazione |
| Classificazione e risorse esterne (EN) | |
| OMIM | 160900 |
| MeSH | D009223 |
| GeneReviews | Panoramica e Panoramica |
| Sinonimi | |
| Miotonia distrofica Distrofia di Steinert (tipo 1) Distrofia di Ricker (tipo 2) Miopatia miotonica prossimale (tipo 2) | |
| Eponimi | |
| Hans Gustav Wilhelm Steinert Kenneth Ricker | |
La distrofia miotonica (DM) è una malattia genetica neuromuscolare degenerativa a carattere autosomico dominante, caratterizzata da un quadro clinico ampiamente variabile e da un decorso lentamente progressivo, il cui esordio può avvenire a qualunque età. Rappresenta la seconda forma di distrofia muscolare più diffusa dopo la distrofia muscolare di Duchenne. Il quadro clinico è caratterizzato da perdita di massa muscolare (miopatia con ipotrofia), miotonia (rilassamento ritardato o contrazione prolungata dei muscoli scheletrici, dopo contrazione volontaria o stimolazione), cataratta (circa metà dei casi di DM1), disturbi cardiaci (aritmia/disturbi di conduzione, cardiomiopatia), alterazioni endocrine e deficit cognitivi, più evidenti nei casi congeniti e infantili di DM1.
I pazienti con distrofia miotonica di tipo 1 (DM1) o malattia di Steinert, tranne che nella forma tardiva e dell'adulto (più favorevole), e quella congenita (più grave) hanno un'aspettativa di vita più bassa, ridotta in media di 10-20 anni[1], essendo soggetti ad aritmia grave per difetti nel sistema di conduzione cardiaco, e cardiomiopatia (che possono esitare in morte cardiaca improvvisa), e a disturbi respiratori seri. Nella distrofia miotonica di tipo 2, detta anche miopatia miotonica prossimale (DM2 o PROMM) o di malattia di Ricker (esordio adulto) - da non confondere con un'omonima atassia cerebellare - l'aspettativa di vita del paziente può anche essere normale.
È presente nella DM1 un fenomeno di anticipazione per cui l'esordio tende a presentarsi ad un'età sempre più giovane di generazione in generazione nella stessa famiglia.
Epidemiologia
[modifica | modifica wikitesto]La prevalenza è stata calcolata intorno ad 1 su 8.000 persone.[2][3]
Classificazione
[modifica | modifica wikitesto]
Esistono varie forme di distrofia miotonica riconoscibili mediante l'esame del DNA:
- Distrofia miotonica di tipo 1 (DM1), detta anche malattia di Steinert, individuata nel 1909,[4] che può avere un esordio precoce nei lattanti e bambini. Il gene responsabile è stato identificato solo nel 1993 nel cromosoma 19
- Distrofia miotonica di tipo 2 (DM2) o PROMM (proximal myotonic myopathy), raramente detta anche malattia di Ricker, ovvero la forma più benigna, scoperta e descritta nel 1994 da Ricker e Moxley e nel 1996 in Italia da Meola e altri. Il gene responsabile è stato identificato nel 1996 nel cromosoma 3
Il 98% circa di tutti i casi di distrofia miotonica rientrano nel tipo 1, ad ogni modo il tipo 2 è caratterizzato da presentazione atipica e fenotipi insoliti, con sintomi diversi dalla forma classica, e a volte sintomatologia ibrida, e a volte compresenza di patologie nell'età matura (deterioramento cognitivo lieve non progressivo, parkinsonismo[5]), pertanto verosimilmente la diagnosi è sottostimata. È risultata molto diffusa in Germania, Europa dell'Est (specie Repubblica Ceca e Polonia) e Québec (paesi dove i casi eguagliano o superano la DM1, corrispondendo al circa 50 % o più delle distrofie miotoniche) e tra le persone con origini tedesche.[6]
Gli specialisti stanno attualmente indagando sull'esistenza di altri tipi di distrofia miotonica, ad esempio si ipotizzava una forma grave dell'età matura collegata alla demenza frontotemporale, ma poi essa è stata collegata geneticamente alla malattia ossea di Paget. [7][8][9] Ulteriori forme di distrofia miotonica ipotizzate sono definite come DM3 (distrofia miotonica congenita infantile non di tipo 1), DM4, DMX, ma non sono stati identificati i geni. I ricercatori sospettano che queste forme abbiano possibili difetti nel cromosoma 16 e nel cromosoma 21.
Fenotipi per esordio e sintomi
[modifica | modifica wikitesto]La DM1 esordisce a diverse età[10]:
- congenita, dalla nascita
- infantile, prima o intorno ai 10 anni
- classica (giovanile-preadolescenziale), tra 10 e i 30 anni, solitamente intorno agli 11 anni
- adulto, tipicamente intorno o dopo i 40 anni, ma è possibile dai 20 ai 50-60[11]
- tardiva
La forma giovanile è spesso difficilmente riconosciuta a causa dei sintomi poco caratteristici per una distrofia muscolare. I pazienti infatti sono spesso caratterizzati esclusivamente da difficoltà nell’apprendimento e nella socializzazione, mentre i sintomi distrofici e miotonici compaiono più tardi. La forma tardiva è spesso silente e viene diagnosticata con test genetico effettuato quando la DM1 compare negli adulti o nei giovani della stessa famiglia, per effetto dell'anticipazione genetica.[12]
La DM2 esordisce tipicamente tra i 40 e i 50 anni, spesso intorno ai 48, tuttavia sono stati osservati casi dai 20 ai 70 anni.[13]
Un'altra classificazione dei fenotipi si basa sulla dimensione delle ripetizioni e l'insorgenza dei sintomi[14]:
- congenita: più grave, solitamente più di 1000 ripetizioni
- infantile e giovanile: esordio precoce e tipicamente più di 800 ripetizioni (range tra 50 e 1000)
- adulto classico (sopra 20 o 30 anni): ampia gamma di sintomi da lievi a gravi, con espansioni da 50 a 1000 ripetizioni
- lieve tardiva (dopo 50/60 anni): tra 50 e 100/150 ripetizioni, oligosintomatica o asintomatica
Nella DM2 sono stati identificati due fenotipi[14]:
- miotonia prossimale (classica, PROMM)
- distrofia miotonica prossimale (fenotipo PDM): atrofia muscolare più severa, assenza di cataratta e di miotonia clinica
Eziologia genetica
[modifica | modifica wikitesto]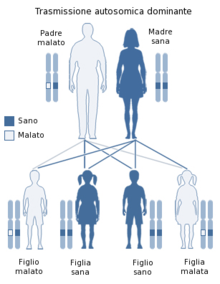
La distrofia miotonica è una malattia genetica a trasmissione autosomica dominante, pertanto si sviluppa in seguito all'acquisizione del gene affetto da un genitore. La probabilità di ereditare il gene affetto è del 50%. Come tutte le distrofie muscolari esiste anche una rara probabilità di sviluppare il gene (come portatore sano o malato) tramite mutazione de novo.
La DM è caratterizzata dalla presenza di triplette nucleotidi che ripetute (malattie da espansione di triplette) ripetizioni di coppie o triplette nucleotidiche sono frequenti nel DNA, ma in questa patologia le ripetizioni sono in numero esagerato rispetto alle ripetizioni presenti nel DNA normale; questo fenomeno prende il nome di "amplificazione". Negli ultimi anni sono state identificate numerose malattie a trasmissione genetica in cui il meccanismo di danno è legato alla presenza di ripetizione di triplette (malattie da espansione di triplette), la prima ad essere studiata e la più nota fu la Corea di Huntington che condivide con la distrofia miotonica la caratteristica di esordire più precocemente ad ogni generazione successiva.
DM1
[modifica | modifica wikitesto]Nella forma DM1 (malattia di Steinert) il gene mutato è chiamato DMPK (myotonic dystrophy protein kinase) e codifica per una miosin chinasi espressa nei muscoli scheletrici. Questo gene è localizzato nel braccio lungo del cromosoma 19 (in posizione 19q13.3). In questo locus vi è un difetto molecolare specifico, costituito da una sequenza trinucleotidica instabile C-T-G (Citosina-Timina-Guanina) nel 3'UTR che viene ripetuta 50-4000 volte quando nella popolazione normale il range varia da 5 a 37 volte.
DM2
[modifica | modifica wikitesto]
Nella forma DM2 (detta anche miopatia miotonica prossimale/PROMM o malattia di Ricker) analogamente c'è un difetto nel gene ZNF9 sul cromosoma 3 in posizione 3q21. Il numero di ripetizioni va da 75 ad oltre 11000, ma in questo caso non sembra esserci differenza nella gravità della patologia o nella precocità di esordio. Il fenomeno dell'anticipazione in questa forma sembra essere meno significativo e in letteratura è riferita solo una lieve anticipazione. In questo caso la ripetizione coinvolge quattro nucleotidi, C-C-T-G (Citosina-Citosina-Timina-Guanina).[15]
Coinvolgimento del canale ionico
[modifica | modifica wikitesto]È un esempio di eterogeneità genetica: nella DM sono interessati altri geni, responsabili della merosina, e non la distrofina (come ad esempio nella DMD e nella BMD), ma hanno lo stesso quadro fenotipico di espressione simili. Oltre all'alterazione dei geni che causano la distrofia muscolare, ovvero la perdita di fibra muscolare sostituita da tessuto adiposo, vi è la miotonia chr è correlata con l'alterazione deldel gene CLCN1, che codifica un canale del cloro attivo a livello muscolare, in maniera somigliante alle altre canalopatie del cloro (come nella miotonia congenita di Becker). Questa alterazione porta alla formazione di una forma tronca del canale che viene quindi eliminato.
Recenti studi hanno ipotizzato anche una disfunzione mitocondriale nella DM2.[16]
Classificazione delle distrofie miotoniche congenite
[modifica | modifica wikitesto]Sono presenti 4 fenotipi che uniscono alla miopatia, alla miotonia e al coinvolgimento cardiaco-endocrino diversi sintomi:
1. Classico: 60% in paesi occidentali, con ipodensità della sostanza bianca e dilatazione dei ventricoli, e uno sviluppo intellettivo nella norma.
Distrofie da alterata glicosilazione dell’alfa-distroglicano:
2. Fukuyama: maggiore nei paesi asiatici con presenza di attivazione strutturale nel cervello, ritardo mentale lieve ed epilessia.
3. Cerebro-muscolo-oculare (Muscle-Eye-Brain Disease): con presenza di disturbi neurologici e oculari gravi, epilessia e grave ritardo mentale.
4. Walker-Warburg: versione più severa della terza dal punto di vista neurologico: ritardo mentale grave, epilessia, encefalopatia, ecc.
Diagnosi
[modifica | modifica wikitesto]La diagnosi di distrofia miotonica può essere difficile poiché comporta la diagnosi differenziale con le patologie neuromuscolari che condividono alcuni aspetti del quadro clinico, tramite clinica, elettromiografia, biopsia muscolare ed esami genetici. Le patologie neuromuscolari sono perlopiù rare ed attualmente se ne conoscono oltre 40 che diventano 100 se si prendono in considerazione i sottotipi. Perciò un paziente con un quadro clinico complesso che potrebbe essere affetto da DM dovrà essere indirizzato ad uno specialista, ma a seconda del sintomo d'esordio il paziente potrebbe essere indirizzato ad un neurologo, ad un cardiologo, ad un pneumologo, ad un oculista, ad un endocrinologo, ad un gastroenterologo o ad un reumatologo. Poiché la presentazione è frequentemente atipica è possibile che se non viene interpellato un neurologo esperto di patologie neuromuscolari la diagnosi non venga eseguita, specie se non si è a conoscenza di casi famigliari. Le normali analisi del sangue possono infatti apparire regolari per CPK e LDH.
Il fenomeno miotonico elettrico, di solito clinicamente visibile, è evidenziato dall'esame elettromiografico, ma non sempre se i sintomi sono lievi; nella DM2 può sfuggire all'esame strumentale in quasi metà dei casi.[5] La miotonia può essere evocata sia dal paziente che dal medico tramite movimenti di contrazione o con martello per controllo di riflesso patellare. Essa può manifestarsi come miotonia da presa (incapacità di rilasciare rapidamente un pugno stretto), miotonia da percussione (contrazione sostenuta dopo aver toccato un muscolo con un martello riflesso), miotonia alle gambe, in particolare quando si sale una scala o si cerca di correre velocemente, o miotonia elettrica (scariche spontanee ripetitive osservate all'EMG). La miotonia negli individui con DM2 non è sempre rilevabile dall'EMG e può richiedere un esame EMG approfondito di diversi gruppi muscolari, inclusi i muscoli prossimali e paraspinali.[17]
Sono considerati affetti da DM1 i soggetti portatori di un numero di triplette CTG superiore a 50 nel gene DMPK. Un numero di triplette compreso tra 35 e 49 è considerato premutazione: il soggetto è sano, ma esiste un rischio significativo di sviluppo di DM1 tra la prole. Maggiori sono le mutazioni (fino a 4000) e più gravi i sintomi.
Nel caso si tratti della ricerca dei due geni già identificati, il sequenziamento del DNA (ricerca di mutazione genetica e polimorfismi con test di pannello genico o gene singolo) su globuli bianchi da campione di sangue può dare diagnosi pressoché certa di DM, senza dovere eseguire un esame più invasivo come la biopsia. I test positivi sono precisi al 100 % come sensibilità e specificità delle analisi PCR (polymerase chain reaction), valida fino a 180 triplette, e Southern blot, per espansioni maggiori.[12]
La DM1 è più semplice da diagnosticare rispetto alla DM2 o PROMM, pur essendo simile a una normale malattia da espansione di triplette, sono in realtà quadriplette ad espandersi. L'anomalia genetica presente nel gene ZNF9 (zinc finger 9, detto ora CNBP) sul cromosoma 3 presente nella DM2 è più difficile a volte da individuare con assoluta certezza; in individui sani la sequenza di quattro nucleotidi CCTG (tetrapletta) che si ripete fino a 75 volte. Nella PROMM c'è un aumento del numero di ripetizioni che vanno da 75 a 11.000. Pare che però non ci sia una correlazione tra il numero di tetraplette e la severità della malattia. La diagnosi molecolare su campione ematico pone maggiori difficoltà tecniche. I test, pur essendo precisi al 99 % non forniscono la quantificazione esatta dell'amplificazione, ma piuttosto una sua stima o un range di variabilità, per cui può essere necessario analizzare il tessuto muscolare. Il soggetto è considerato affetto quando presenta un numero di tetraplette CCTG superiore a 75 nel gene CNBP, ma comunemente tale numero si ritrova in ordine di migliaia tra i positivi (fino a 11.000).
Un valore inferiore a 26 tetraplette CCTG è considerato un risultato negativo; un'espansione tra 26 e 75 triplette CCTG ("premutazioni") è rarissima e non esistono ad oggi dati clinici sufficienti per interpretare questo risultato. In una tale evenienza può essere necessario un secondo test molecolare su un nuovo prelievo ematico o su tessuto muscolare e con ibridazione fluorescente in situ.[18] Il range 36-55 è stato ritenuto una zona grigia rara, mentre tra 56 e 75 è più frequente. In uno studio italiano su persone con "sospetta DM2" la diagnosi genetica positiva è stata ritrovata solo nel 32,8%, confliggendo con l’analisi clinica che evidenzia la presenza di disturbi, anche molto lievi, che vengono considerati solo in centri specializzati; tra la comparsa dei primi sintomi e la diagnosi genetica, possono passare in media 14 anni.[19] Il rilevamento della premutazione non esclude la DM2 conclamata; l'espansione delle tetraplette non è stabile e può avere valori diversi nei diversi tessuti ed aumenta con l'età (rendendo difficile interpretare i risultati).[20]
Screening
[modifica | modifica wikitesto]Lo screening può essere effettuato in chi ha parenti affetti o portatori del gene mutato. La diagnosi di DM1, a differenza della DM2, dovrebbe essere sospettata in chiunque presenti almeno tre dei seguenti sintomi: ptosi palpebrale; debolezza distale, principalmente delle dita e dei flessori lunghi del polso, senza contratture con tipica distribuzione; miotonia o "rigidità" dei muscoli; cataratta presenile, specie quella policromatica.[12]
La diagnosi di DM1 deve essere sospettata anche in chiunque presenti uno dei precedenti sintomi o una storia familiare in cui sono stati riscontrati uno e più di questi aspetti: difetti di conduzione atrio-ventricolari (80% dei casi); sindrome dell'intestino irritabile (IBS) o enzimi epatici elevati; calcoli biliari in giovane età; recupero prolungato o arresto respiratorio dopo un anestetico, somministrato per via generale; insulinoresistenza o diabete mellito; ipogonadismo ipogonadotropo; eccessiva sonnolenza diurna (EDS); lieve difficoltà di apprendimento; sindrome frontale (danni al lobo frontale con abulia, agnosia, anosognosia, amnesia e disorganizzazione); disturbi della personalità; ritardo mentale nei bambini; iper-catabolismo IgG; calvizie frontale.[12]
Lo screening per il gene DMPK per DM1 è mirato al cromosoma 19 mentre il gene ZNF9 per DM2 si trova sul cromosoma 3. Per entrambe le forme confermate sono disponibili test genetici, compresi i test prenatali. I test molecolari sono considerati il gold standard della diagnosi
Nonostante non esistano ad oggi cure specifiche per la DM e la terapia sia basata su interventi sintomatici (si affrontano i problemi mano a mano che si presentano), è importante che la diagnosi venga formulata correttamente, sia per monitorare il paziente e poter riconoscere precocemente le manifestazioni più gravi e potenzialmente fatali (ad esempio i problemi cardiaci), sia per fornire una consulenza genetica rispetto all'elevato rischio di trasmissione alla prole.
Di fronte a una diagnosi di DM2, l'entourage familiare del soggetto affetto dovrebbe essere informato della possibilità di altri casi al suo interno,in quanto vi è un rischio del 50% di trasmissione della mutazione da un soggetto affetto alla prole. La penetranza della patologia è da considerasi completa nei range abituali di espansione CCTG ma recenti evidenze suggeriscono la possibilità di una penetranza incompleta nei rari casi di espansioni al limite inferiore di positività.[18]
Il rischio anestesiologico è tale per cui la presenza di DM conclamata in famiglia deve essere riferita ad ogni visita medica, anche per problemi non correlati alla patologia.
Il test per la resistenza all'insulina per valutare la possibile presenza del diabete deve durare almeno 3 ore e includere il monitoraggio seriale del profilo lipidico e la valutazione intermittente dei test di tolleranza orale al glucosio come da rapporto del 140° Workshop internazionale ENMC: Distrofia Miotonica DM2/PROMM e altre distrofie miotoniche con linee guida sulla gestione (2006) Si sospetta che il diabete di tipo 2 sia più comune nella DM2 che nella DM1.
Quadro clinico
[modifica | modifica wikitesto]
Il quadro clinico è variabile, con la costante della miotonia (abnorme aumento del tono e mancato rilascio muscolare, o contrazione prolungata), nella DM2 di solito solo nei muscoli coinvolti, e del coinvolgimento distrofico di muscolatura striata (tessuto muscolare striato, tessuto muscolare cardiaco), e a volte anche muscolatura liscia, a causa del danno al sarcolemma. Nella DM1 le principali caratteristiche sono inoltre la debolezza muscolare progressiva, l'esordio distale e l'aritmia, mentre nella DM2 il dolore muscolare, una debolezza minore, l'esordio prossimale, un coinvolgimento cardiaco minore e la facile stanchezza con intolleranza allo sforzo.

Frequente nella DM1 il riscontro di miopatia, disartria, atrofia muscolare, ritardo mentale (solo se esordio infantile), molto grave può essere il coinvolgimento del miocardio[21] portando a forme di cardiomiopatia diffusa.[22] La forma congenita e quella infantile sono gravi, mentre lo è meno la forma giovanile o preadolescenziale. La forma meno grave è la tardiva ma anche quella dell'adulto. Molti sintomi sono comuni tra le forme. I sintomi della DM1 considerati meno gravi o comuni per la DM2 sono l'ipersonnia (sonnolenza diurna), l'atrofia muscolare, la disfagia e i problemi respiratori.
I pazienti con DM1 possono manifestare una gamma più diversificata di problemi cognitivi rispetto a quelli con DM2. A seconda della forma e del grado di gravità, i problemi cognitivi nella DM1 possono variare da ritardi di sviluppo, problemi di apprendimento, linguaggio, discorso, comportamento, apatia o ipersonnia. Le manifestazioni cognitive della DM2 includono problemi con le funzioni esecutive (ad esempio di organizzazione e di concentrazione mentale, o difficoltà nella ricerca delle parole, ecc.) e ipersonnia in grado minore. A volte si presentano disturbi psichiatrici (ansia, depressione, insonnia), più nella DM1, o in comorbilità nel tipo 2. Nella DM1 si osservano più comunemente disturbi dello spettro autistico e la sindrome di Tourette (i disturbi da tic sono presenti a volte anche nella DM2).[23] Secondo uno studio su 40 soggetti il 35 % dei pazienti con DM è risultato avere disturbi psichici (il 17,5 % la depressione).[24]
Nella DM2 si osserva frequentemente nistagmo,[25] e in entrambe disfagia, dispepsia, nausea, dolore addominale, a volte gastroparesi[26]. La DM presenta spesso (più acuti nel tipo 1) anche problemi endocrini (ipotiroidismo e ipertiroidismo, diabete mellito, ipogonadismo, ipergammaglobulinemia, ipercolesterolemia), disturbi visivi (cataratta precoce, dopo i 40/50 anni, ma anche fotofobia, prurito, secchezza oculare), ipoacusia[27], problemi intestinali[26] quali dissenteria o stipsi, in un quadro simile al colon irritabile[28], o a coprostasi/dischezia; in alcuni casi degenerazione in fenomeni di pseudo-ostruzione intestinale cronica acquisita, prolasso rettale o megacolon.[29] I problemi alla muscolatura liscia (compresi i sintomi gastrointestinali) sono meno forti nella DM2 che nella DM1 rispetto ai problemi dell'alto apparato digerente: nella DM2 si possono più avere problemi derivanti dalla rigidità scheletrica e alla sedentarietà come in altre distrofie. Il dolore addominale essere scambiato per appendicite, ostruzione intestinale, o infiammazione della vescica. Esso è causato probabilmente da contrazione muscolare scoordinata dalla miotonia. Molti pazienti avvertono i disturbi gastrointestinali come più debilitanti della debolezza muscolare e della miotonia, e diversi studi hanno evidenziato che le alterazioni del tratto digerente possono essere uno dei primi sintomi; fino al 28% dei pazienti presenta disturbi gastrointestinali comparsi anche 10 anni prima rispetto alle più comuni alterazioni muscolari, compresa la miotonia, che a sua volta può precedere la debolezza e la malattia vera e propria di molti anni. Il meccanismo molecolare esatto che porta a questo fenotipo non è stato chiaramente identificato; sono state ipotizzate alterazioni della motilità causate dal danno alla muscolatura scheletrica e liscia, anche se non si possono escludere come origine le alterazioni neurologiche e ormonali sistemiche. Studi recenti si focalizzano su un possibile coinvolgimento della sovracrescita batterica a causa di ridotta peristalsi come causa dei disturbi intestinali dei pazienti affetti da distrofia miotonica.[30]
Sono presenti ipersonnia, insonnia, problemi respiratori, calvizie genetica frontale e tutti i disturbi del sonno; l'apnea centrale del sonno o l'apnea ostruttiva del sonno possono causare eccessiva sonnolenza diurna e questi individui dovrebbero sottoporsi a uno studio del sonno. Alcuni studi indicano anche un aumento del rischio di alcuni tipi di cancro, come il basalioma.[31] Nella DM si verificano inoltre vertigini e disturbi dell'equilibrio, non solo per la debolezza o altri motivi, ma soprattutto a causa del coinvolgimento dei fusi neuromuscolari del collo.[6] Il tremore (non da debolezza, presente in entrambe le forme) è un sintomo presente nel tipo 2 (tremore cinetico nel 20-30 % dei casi).[32]
Nella DM1, il fenomeno miotonico è tipicamente presente a livello delle mani, della muscolatura mandibolare e linguale, non a livello orbicolare o palpebrale, nella DM2 la miotonia è più variabile; può riscontrarsi anche negli arti inferiori dove i pazienti lamentano spesso anche mialgie, non necessariamente legate. In alcuni pazienti può essere presente a livello palpebrale un fenomeno noto come lid-lag (la palpebra superiore è più alta del normale se l'occhio guarda in basso).[5] Presente la ptosi palpebrale.
Le anomalie della conduzione sono più comuni nella DM1 che nella DM2, ma a tutti i pazienti si consiglia di sottoporsi a un ECG annuale.
I pazienti con DM2 si presentano riferendo un quadro miopatico di dolori muscolari (a volte con crampi, spasmi, contratture, strappi), affaticabilità, miopatia, astenia, rigidità, debolezza ai muscoli prossimali.[33] Si possono verificare specie nella DM2 sintomi affini a quelli di sciatica, radicolite, osteoartrite, lombalgia, e fibromialgia.[34] È importante non confondere i sintomi della DM2 (evitando erroneamente il test del DNA) con quelli di altre patologie, come la sindrome fibromialgica, ponendo una diagnosi errata.[35] Si stima che il 10 % delle diagnosi di fibromialgia siano in realtà riferibili a DM2.[6] In alcuni casi è stata osservata anche una miosite da sovraccarico o infiammatoria, come in tutte le distrofie[36], e in certe famiglie la compresenza di una neuropatia motorio-sensitiva ereditaria.[37] Mentre la miotonia della DM2 è stata segnalata durante la prima decade, l'esordio avviene in genere nel terzo o quarto decennio, più comunemente con dolore muscolare fluttuante o episodico che può essere debilitante, e debolezza prossimale e assiale dei flessori del collo (sternocleidomastoideo e trapezio) e dei flessori dell'anca (ileopsoas, il retto femorale e il sartorio), con difficoltà a salire le scale o alzarsi dalla sedia senza l'uso delle braccia.[17]
Successivamente, si verifica debolezza negli estensori del gomito (es. estensore ulnare del carpo) e nei flessori delle dita (come flessore profondo). Debolezza facciale (es. massetere) e debolezza dei dorsiflessori della caviglia (soleo, peroneo lungo, tibiale anteriore...) sono meno comuni che nella DM1.[17] La miotonia raramente causa sintomi gravi. In un sottoinsieme di individui, è notevole o visibile l'ipertrofia del polpaccio in combinazione con riflessi vivaci agli arti inferiori, mentre in entrambe le forme i riflessi osteo-tendinei possono essere aboliti o deboli (iporeflessia o areflessia) nelle zone più colpite (tipico reperto miopatico).[17] La distribuzione della debolezza muscolare nella distrofia miotonica è diversa per le due forme: nella DM1 sono affette le masse muscolari del volto e della mandibola, con ptosi palpebrale, debolezza dei muscoli di collo, mani e parte distale della gamba (piede). Nella DM2 la debolezza è più evidente (ma non esclusiva) ai muscoli prossimali, quindi vicino al tronco: nuca, spalle, schiena, flessori dell'anca e parte superiore delle gambe, ma anche alle mani. La ptosi può essere presente in modo meno evidente. Nella DM1 il paziente presenta gambe sottili a causa dell'atrofia-ipotrofia distale, mentre nella DM2 l'atrofia si nota a livello della coscia e dell'anca (quadricipite femorale, gluteo, bicipite femorale, piriforme, muscoli ischiocrurali...), e in parte agli arti superiori (specie deltoide, tricipite brachiale e trapezio), e si vede invece la detta ipertrofia dei polpacci, o ipotrofia asimmetrica.[6]
Altre zone come l'addome, le scapole e i muscoli toracici (muscoli intercostali, diaframma) sono colpiti egualmente, in diversa scala di gravità.
Frequenti sono la debolezza del diaframma e l'ipoventilazione alveolare con bronchite cronica.

L'atrofia dei masseteri e la debolezza facciale porta ad un assottigliamento della metà inferiore della faccia e alla malposizione e lussazione della mandibola e malocclusione dentale, e ipomimia. Gli sternocleidomastoidei sono quasi sempre assottigliati e indeboliti con conseguente curvatura inferiore del collo (cervicale a collo a cigno, particolare forma di cifosi a genesi muscolare-vertebrale, testa cadente).[37] La debolezza agli arti porta a mano cadente (con disturbo dei muscoli dell'avambraccio), piede cadente (disfunzione muscolo tibiale anteriore), deambulazione anserina, piede piatto. La debolezza dei muscoli della faringe e della laringe determina una voce debole (disfonia) e monotona, e/o la disartria (difficoltà nell'articolazione delle parole)
I sintomi della miotonia, uniti ai crampi e sporadiche miochimie possono essere confusi con il mioclono e la fascicolazione (in questo caso si tratta della cosiddetta scarica miotonica, il rilascio del muscolo, con apparente pseudo-mioclono e pseudo-fascicolazione), e quindi con le sindromi da ipereccitabilità dei nervi periferici.
La miotonia con la rigidità in entrambe le forme solitamente è peggiore col freddo e migliora con il movimento, per poi ritornare a riposo (fenomeno del riscaldamento). L'intolleranza al calore e all'umidità, e l'ipersudorazione, sono più frequenti nella DM2, meno nella DM1.[38]
Anomalie cutanee sono zone di iperpigmentazione e dermatite seborroica. Uno studio ha evidenziato che il 26 % del pazienti DM2 presenta malattie autoimmuni, tra cui tiroidite di Hashimoto, artrite reumatoide, diabete mellito di tipo 1, lupus eritematoso sistemico, sindrome di Sjögren, sclerodermia localizzata, psoriasi, celiachia, neuromielite ottica, miastenia gravis, sindrome di Guillain-Barré (neuropatia acuta), vitiligine (perdita della pigmentazione) e presenza di autoanticorpi generici.[39][40] Riguardo al diabete mellito presente in alcuni pazienti: la resistenza all’insulina è un fattore di rischio significativo in entrambe le forme della malattia per diabete e colesterolo, con impatto ulteriore sulla cardiopatia, e su tutti gli effetti del diabete: la neuropatia diabetica, la retinopatia diabetica, l'ictus, il metabolismo dei lipidi e del glucosio, la steatosi epatica, ecc. Comunque, il diabete di tipo 2 (non completamente insulinodeficiente, acquisito), più frequente, anche se presenta nei pazienti con DM con una percentuale leggermente più alta che nella popolazione senza distrofia miotonica, spesso appare avere una sintomatologia leggera.[41]
Terapia
[modifica | modifica wikitesto]Non esistono trattamenti efficaci contro tale forma di distrofia muscolare, per combattere in parte la miotonia si somministra la mexiletina (dosi 75 mg - 150 mg). Essa è un antiaritmico e può quindi aiutare nei disturbi del sistema di conduzione cardiaco. In alternativa si usa la lamotrigina (per chi ha già problemi cardiaci la mexiletina è controindicata).[42] Alcuni utilizzano anche vecchi farmaci come fenitoina, il chinino, la procainamide.[43]
L'attenzione si concentra sulla gestione delle complicanze della malattia, in particolare quelle relative al sistema cardiopolmonare in quanto rappresentano il 70% dei decessi dovuti a DM1.[44] L'inserimento di pacemaker può essere richiesto per soggetti con anomalie evidenti della conduzione cardiaca. Il miglioramento della qualità della vita che può essere misurato utilizzando questionari specifici[45] è anche un obiettivo principale delle cure mediche.
Alcuni piccoli studi hanno suggerito che l'imipramina, la clomipramina e la taurina possono essere utili nel trattamento della miotonia.[44] Tuttavia, a causa della debole evidenza e dei potenziali effetti collaterali come aritmie cardiache, questi trattamenti sono usati raramente. Un recente studio del dicembre 2015 ha dimostrato che un comune antibiotico approvato dalla FDA, l'eritromicina, ha ridotto la miotonia nei topi.[46] Sono previsti studi sull'uomo per l'eritromicina. L'eritromicina è stata utilizzata con successo in pazienti con problemi gastrici.[47] Utilizzati come supporto sono anche integratori, come coenzima Q10[48][49] (il quale è risultato incrementare lievemente la forza e la resistenza alla fatica in tutte le distrofie e in diverse miopatie, oltre a rallentare l'atrofia del tessuto e a migliorare le condizioni cardiache), spermidina[50] (che interferisce con l'autofagia cellulare e l'invecchiamento del tessuto del miocardio), ed altri quali magnesio, potassio), e specialmente vitamina D[17][18].
Nella DM2 dove il dolore muscolare è uno dei sintomi principali, si usano antinfiammatori non steroidei (es. ibuprofene), miorilassanti e anticonvulsivanti[27] (gabapentin, pregabalin, utili anche contro il fenomeno miotonico) unitamente a spasmolitici, terapie sintomatiche (diete e farmaci antispastici per i sintomi gastrointestinali) e antidepressivi che agiscono sulla soglia del dolore (es. duloxetina, amitriptilina, nortriptilina) e migliorano l'ansia e l'umore. È stato ipotizzato l'uso medico della cannabis, ma mancano studi controllati a livello internazionale, con l'eccezione della Germania per quanto riguarda la DM2.[51]
Gestione dei sintomi
[modifica | modifica wikitesto]Attualmente non esiste una cura o un trattamento specifico approvato per la distrofia miotonica. I problemi cardiaci, la cataratta e altre anomalie associate alla condizione possono essere trattati ma non curati. Tuttavia ci sono interventi medici (es. chirurgia oculare) e farmaci che possono alleviare alcuni dei sintomi come miotonia, dolore e sonnolenza eccessiva.
La ventilazione assistita non invasiva può essere offerta in caso di anomalie respiratorie. L'eventuale diabete va curato con le relative linee guida (farmaci o insulina).
Come le altre miopatie e distrofie, è importante la gestione diretta dei sintomi come il dolore e la fatica, il mantenimento delle funzioni di movimento, il controllo e l'alleviamento di problemi neurologici, sistemici, psicologici, e quelli muscolo-scheletrici derivati dalla debolezza, con trattamenti di supporto, farmacologici, la riabilitazione e la fisioterapia. Alcuni trattamenti sono stati soggetti a revisione sistematica per quanto riguarda la sicurezza e l'efficacia attraverso le revisioni su Cochrane per sintomi quali ipersonnia (eccessiva sonnolenza diurna), miotonia, e i vari disturbi sistemici correlati; approvati sono la ginnastica "dolce" o un esercizio fisico leggero per non perdere la forza muscolare, l'allenamento aerobico e l'uso di tutori oppure ortesi, agli arti superiori, al collo, al tronco, o per il piede cadente, o dispositivi per disabili motori; generalmente i pazienti con DM2 necessitano molto meno dei dispositivi di assistenza (bastoni, stampelle, deambulatori, sedie a rotelle e carrozzelle, scooter per la mobilità ecc.) rispetto ai pazienti con DM1, sebbene entrambi incontrino difficoltà crescenti a camminare a lungo, stare in piedi, salire le scale o alzare le braccia, man mano che la malattia progredisce, e i supporti possono alleviare la fatica e prevenire cadute o inciampi, quindi il rischio di fratture e traumi; i pazienti che camminano possono quindi sentirsi più sicuri e a loro agio con l'aiuto di alcuni di essi.[44]
Stato della ricerca
[modifica | modifica wikitesto]Ricerche recenti hanno fornito maggiori informazioni sui meccanismi patogenetici molecolari sottostanti coinvolti nella distrofia miotonica e hanno alimentato l’interesse e la ricerca su nuovi approcci per un trattamento più specifico ed efficace per migliorare i sintomi, bloccare la progessione e allungare la vita del paziente curando o tenendo sotto controllo i disturbi cardiaci. La ricerca in settori quali lo screening ad alta produttività e la terapia antisenso fa sperare in trattamenti mirati più efficaci per il futuro. Diversi studi si concentrano sulla terapia genica in particolare centrata sull'RNA. È stato dimostrato che lo splicing alterato del canale 1 specifico per il muscolo (ClC-1) causa il fenotipo miotonico di DM1 ed è reversibile nei modelli murini che utilizzano l'antisenso morpholino per modificare lo splicing dell'mRNA di ClC-1.[52]di ClC-1 mRNA.[53] I progressi clinici vengono monitorati annualmente dalla International Myotonic Dystrophy Consortium.[54]
Prognosi
[modifica | modifica wikitesto]Distrofia miotonica di Steinert (DM1)
[modifica | modifica wikitesto]La prognosi della DM1 non è considerata buona (tranne nella forma DM1 tardiva e nella forma adulta se lieve con poche mutazioni), con aspettativa di vita ridotta di 10-20 anni in media; tra le distrofie muscolari l'aspettativa di vita della distrofia miotonica di Steinert è superiore a quella della distrofia di Duchenne e di Becker ma inferiore rispetto alla distrofia facio-scapolo-omerale o dei cingoli. La sopravvivenza è più ridotta nella DM1 congenita[1]; il rischio di morte è più elevato nella tipologia 1 dato che è più soggetta ad aritmie fatali che causano morte improvvisa per torsione di punta, tachicardia, bradicardia o scompenso cardiaco acuto. Come detto, installazioni di pacemaker ma anche di defibrillatore impiantabile possono essere fondamentali per salvare la vita del paziente. L'incidenza di morte cardiaca improvvisa a causa di disturbi del sistema di conduzione del cuore è del 2-30%, secondo i dati della letteratura, ed è stata osservata anche nei portatori di pacemaker, la cui prevalenza nella DM1 è del 3-22%.[55]
Altre cause di decesso sono la polmonite (anche ab ingestis) e l'insufficienza respiratoria acuta correlata, le infezioni, le malattie correlate all'aspetto sistemico della DM, o le complicanze di interventi chirurgici, ma non direttamente la debolezza dei muscoli respiratori (come nelle distrofinopatie).[56]
La forma tardiva di DM1 è a volte asintomatica. La malattia progredisce lentamente, con interessamento graduale dei muscoli prossimali degli arti e del tronco. La maggior parte dei pazienti perde la deambulazione entro 15-20 anni dall'esordio.[44]
Attualmente l'aspettativa di vita media con distrofia miotonica di tipo 1 è generalmente più bassa, può essere però normale nelle due forme più lievi, DM1 tardiva e DM1 adulta.[57] Nella DM1 ad esordio infantile e giovanile (classica), è stata osservata una mediana di sopravvivenza di 55-60 anni per gli uomini e 55-59 anni per le donne[58]. Con installazione di pacemaker per l'aritmia, la ventilazione e trattamenti per la cardiomiopatia, la sopravvivenza media si alza (54-67, con una media di 64[59]). La sopravvivenza è massimo 45-50 anni nella forma congenita in coloro che raggiungono l'età adulta (il 40% dei neonati non sopravvive per difficoltà respiratorie e cardiomiopatia; il 60% sopravvive ma con un deficit intellettivo e un'aspettativa di vita minore). Alcuni studi indicano invece una vita media nello standard (o leggermente ridotta) per i pazienti con la forma lieve adulta, e normale nella tardiva.[44] Uno studio ha infatti registrato il 4 % di persone poco sintomatiche o paucisintomatiche affette da DM1 tardiva che hanno raggiunto i 70-75 anni di età.[60] Anche alcuni pazienti con DM1 giovanile classica con esordio nella seconda decade ma con poche mutazioni e sintomatologia a lenta progressione possono, con adeguato supporto e assistenza nelle faccende quotidiane, superare i 70 anni di età, e i 40 anni dalla diagnosi.[60]
Posto che i sintomi possono precedere la diagnosi di anni, specie se non si è al corrente di famigliari malati e non si esegue il test genetico, sono stati realizzati studi statistici sulla sopravvivenza. Uno studio realizzato in Francia e pubblicato su JAMA Neurology, è basato su otto segni predittivi - ossia la presenza di sintomi sistemici in forma grave - dell'aspettativa di vita o fattori di rischio; questo può dare indicazioni di azione al medico.[61] Sono stati analizzati 1.296 pazienti (studio longitudinale di coorte) di età media 39,8 anni, 51,7% donne e 48,3% uomini tra gennaio 2000 e novembre 2014 con diagnosi genetica di DM1 in quattro diversi centri per la cura dei disturbi neuromuscolari. Utilizzando una statistica multivariata di Cox, gli autori hanno analizzato i fattori associati alla sopravvivenza: età, presenza di diabete, necessità di un supporto per la deambulazione, frequenza cardiaca, pressione sistolica, blocco atrioventricolare di primo grado, blocco di branca e capacità vitale polmonare, associando dei punteggi di gravità a ciascuna problematica.
Il tasso di sopravvivenza a 10 anni (età media 49,8 anni) è risultato:
- 96,6% nel gruppo con punteggio da 0 a 4, con meno sintomi
- 92,2% nel gruppo con punteggio da 5 a 7, con più sintomi
- 80,7% nel gruppo con punteggio da 8 a 10, con presenza media di sintomi
- 57,9% nel gruppo con punteggio tra 11 e 13 con molti sintomi tra cui sintomi gravi
- 19,4% nel gruppo con 14 punti o più, con molti sintomi gravi, tra cui blocco di conduzione manifesto, uso di ventilazione artificiale, utilizzo di sedia a rotelle, impossibilità a deglutire e diabete avanzato
Tra i 230 pazienti compresi nella coorte di validazione, invece, i tassi di sopravvivenza a 10 anni nei quattro gruppi sono stati lievemente diversi, più alti nel primo, più basso nel secondo e nel quarto, leggermente più basso nel terzo, e leggermente più alto nel quinto: rispettivamente 99,3%, 80,6%, 79,3%, 43,2% e 21,6%.
Miopatia miotonica prossimale (DM2)
[modifica | modifica wikitesto]La prognosi della PROMM è considerata buona se il coinvolgimento cardiaco è minimo o assente. Nella DM2/PROMM, più benigna, non vi sono comunque sufficienti studi sulla sopravvivenza media, ma dai dati disponibili è ritenuta essere più o meno nella norma della popolazione generale, se in assenza di disturbi cardiaci gravi[62], questo indipendentemente dall'età di esordio.[13] Solitamente la miopatia miotonica prossimale ha comunque coinvolgimento cardiaco raro o più tardivo[63], e quindi meno soggetta all'arresto cardiaco improvviso della DM1 e alla cardiomiopatia cronica.[18]
Note
[modifica | modifica wikitesto]- ^ a b "Distrofia miotonica di Steinert" su Orphanet. Articoli citati:
*Harper PS, van Engelen B, Eymard B, Wilcox DE: Myotonic Dystrophy: present management, future therapy. Oxford: Oxford University Press 2004.
*Lazarus A, Varin J, Ounnoughene Z, Radvanyi H, Junien C, Coste J, Laforet P, Eymard B, Becane HM, Weber S, Duboc D: Relationships among electrophysiological findings and clinical status, heart function, and extent of DNA mutation in myotonic dystrophy. Circulation 1999, 99:1041-1046.
*Groh WJ, Groh MR, Saha MSC, Kincaid JC, Simmons Z, Ciafaloni E, Pourmand R, Otten RF, Bhakta D, Nair GV, Marashdeh MM, Zipes DP, Pascuzzi RM: Electrocardiographic abnormalities and sudden death in myotonic dystrophy Type 1. N Engl J Med 2008, 358:2688-97. - ^ Antonio Cao, Malattie genetiche. Molecole e geni. Diagnosi, prevenzione e terapia, Padova, Piccin, febbraio 2004 [2004].
- ^ (EN) Genetics Home Reference, Myotonic dystrophy, su Genetics Home Reference. URL consultato il 10 dicembre 2018.
- ^ Steinberg H, Wagner A., Hans Steinert: 100 years of myotonic dystrophy, in Cardiol Prat., vol. 79, agosto 2008, pp. 961-70.
- ^ a b c Valeria A. Sansone, Distrofie miotoniche, su UILDM.
- ^ a b c d Debolezza Muscolare e Dolore nella Distrofia Miotonica
- ^ Le Ber I, Martinez M, Campion D, et al., A non-DM1, non-DM2 multisystem myotonic disorder with frontotemporal dementia: phenotype and suggestive mapping of the DM3 locus to chromosome 15q21-24, in Brain, vol. 127, Pt 9, 2004, pp. 1979–92, DOI:10.1093/brain/awh216, PMID 15215218.
- ^ Myotonic Dystrophy Type 2, su ncbi.nlm.nih.gov. URL consultato il 24 febbraio 2008.
- ^ Udd B, Meola G, Krahe R, et al., 140th ENMC International Workshop: Myotonic Dystrophy DM2/PROMM and other myotonic dystrophies with guidelines on management, in Neuromuscul. Disord., vol. 16, n. 6, 2006, pp. 403–13, DOI:10.1016/j.nmd.2006.03.010, PMID 16684600.
- ^ Myotonic Dystrophy
- ^ Turner, C. & Hilton-Jones, D. Myotonic dystrophy: Diagnosis, management and new therapies. Current Opinion in Neurology (2014). doi:10.1097/WCO.0000000000000128
- ^ a b c d Distrofia miotonica di tipo 1 su fondazionemalattiemiotoniche
- ^ a b Day, J. W. et al. Myotonic dystrophy type 2: Molecular, diagnostic and clinical spectrum. Neurology (2003). doi:10.1212/01.WNL.0000054481.84978.F9
- ^ a b Giovanni Meola, Fondazione Malattie Miotoniche, Aspetti diagnostici della DM1 e della DM2, su YouTube.
- ^ Liquori CL, Ricker K, Moseley ML, et al., Myotonic dystrophy type 2 caused by a CCTG expansion in intron 1 of ZNF9, in Science (journal), vol. 293, n. 5531, agosto 2001, pp. 864–7, DOI:10.1126/science.1062125, PMID 11486088.
- ^ Disfunzione funzionale e strutturale mitocondriale nella DM2. Nuovi Progressi Nella Ricerca Sulla DM2. Un'anomalia Mitocondriale Potrebbe Essere Coinvolta Nella Manifestazione Clinica Della DM2. - fondazionemalattiemiotoniche
- ^ a b c d e Benedikt Schoser, Myotonic Dystrophy Type 2. Synonym: Proximal Myotonic Myopathy (PROMM)
- ^ a b c d Distrofia miotonica di tipo 2 su fondazionemalattiemiotoniche
- ^ Studio genetico sulla DM2
- ^ Il test genetico
- ^ Sá MI, Cabral S, Costa PD, Coelho T, Freitas M, Torres S, Gomes JL., Cardiac involveent in type 1 myotonic dystrophy, in Rev Port Cardiol., vol. 27, 2007, pp. 829-840.
- ^ McDonnell M, Alcantar J, Wachsner RY, Meymandi SK., Cardiomyopathy and multiple pulmonary emboli in a patient with myotonic dystrophy, in Congest Heart Fail., vol. 14, 2008, pp. 106-110.
- ^ Ekström AB, Hakenäs-Plate L, Samuelsson L, Tulinius M, Wentz E.., Autism spectrum conditions in myotonic dystrophy type 1: a study on 57 individuals with congenital and childhood forms., in Am J Med Genet B Neuropsychiatr Genet., 147B, 2008, pp. 918-926.
- ^ Colombo G., Perini G I, Miotti M V, Armani M & Angelini C., Cognitive and psychiatric evaluation of 40 patients with myotonic dystrophy, February 1992, The Italian Journal of Neurological Sciences Volume 13, pages 53–58, (1992)
- ^ Ajroud-Driss S, Sufit R, Siddique T, Hain TC., Oculomotor involvement in myotonic dystrophy type 2., in Muscle Nerve., 2008.
- ^ a b Tieleman AA, van Vliet J, Jansen JB, van der Kooi AJ, Borm GF, van Engelen BG., Gastrointestinal involvement is frequent in Myotonic Dystrophy type 2., in Neuromuscul Disord., vol. 18, agosto 2008, pp. 646-649.
- ^ a b Myotonic Dystrophy Type 2
- ^ Dolore addominale e problemi intestinali
- ^ LINDA NGUYEN, MD CLINICAL ASSOCIATE PROFESSOR DIRECTOR, MYOTONIC DYSTROPHY & THE GI TRACT OVERVIEW & SYMPTOM MANAGEMENT NEUROGASTROENTEROLOGY AND MOTILITY September 17, 2016
- ^ I disturbi dell'apparato gastrointestinale nelle malattie miotoniche
- ^ Gadalla, S. M. et al. Cancer risk among patients with myotonic muscular dystrophy. JAMA - J. Am. Med. Assoc. (2011). doi:10.1001/jama.2011.1796
- ^ Miopatia miotonica prossimale - Orphanet
- ^ (Day & al, 2003).
- ^ Myotonic dystrophy type 2: the 2020 update
- ^ La fibromialgia va distinta dalla distrofia miotonica di tipo 2
- ^ Tarnopolsky MA, Hatcher E, Shupak R (May 2016). "Genetic Myopathies Initially Diagnosed and Treated as Inflammatory Myopathy". The Canadian Journal of Neurological Sciences. Le Journal Canadien des Sciences Neurologiques. 43 (3): 381–384. doi:10.1017/cjn.2015.386. PMID 26911292. S2CID 25515951.
- ^ a b Distrofia miotonica - Malattie rare
- ^ Myotonic Dystrophy - Anesthesiology
- ^ Strong association between myotonic dystrophy type 2 and autoimmune diseases - November 2009Journal of Neurology, Neurosurgery, and Psychiatry 80(11):1293-
- ^ Malattie autoimmuni nei pazienti con DM2
- ^ Peter S. Harper, La distrofia miotonica. I fatti, traduzione di Giovanni Meola, 2012, p. 21
- ^ Research Laboratories Merck, The Merck Manual quinta edizione Pag 2600, Milano, Springer-Verlag, 2008, ISBN 978-88-470-0707-9.
- ^ Peter S. Harper, La distrofia miotonica. I fatti, traduzione di Giovanni Meola, 2012, p. 61.
- ^ a b c d e (EN) Chris Turner e David Hilton-Jones, The myotonic dystrophies: diagnosis and management, in Journal of Neurology, Neurosurgery & Psychiatry, vol. 81, n. 4, 1º aprile 2010, pp. 358–367, DOI:10.1136/jnnp.2008.158261. URL consultato l'11 giugno 2020.
- ^ (EN) Antoine Dany, Coralie Barbe e Amandine Rapin, Construction of a Quality of Life Questionnaire for slowly progressive neuromuscular disease, in Quality of Life Research, vol. 24, n. 11, 1º novembre 2015, pp. 2615–2623, DOI:10.1007/s11136-015-1013-8. URL consultato l'11 giugno 2020.
- ^ Masayuki Nakamori, Katarzyna Taylor e Hideki Mochizuki, Oral administration of erythromycin decreases RNA toxicity in myotonic dystrophy, in Annals of Clinical and Translational Neurology, vol. 3, n. 1, 10 dicembre 2015, pp. 42–54, DOI:10.1002/acn3.271. URL consultato l'11 giugno 2020.
- ^ (EN) A. Rönnblom, S. Andersson e P. M. Hellström, Gastric emptying in myotonic dystrophy, in European Journal of Clinical Investigation, vol. 32, n. 8, 2002, pp. 570–574, DOI:10.1046/j.1365-2362.2002.01028.x. URL consultato l'11 giugno 2020.
- ^ K. Folkers, R. Simonsen, Two successful double-blind trials with coenzyme Q10 (vitamin Q10) on muscular dystrophies and neurogenic atrophies., in Biochim Biophys Acta, vol. 1271, n. 1, maggio 1995, pp. 281-6, PMID 7599221.
- ^ CF. Spurney, CT. Rocha; E. Henricson; J. Florence; J. Mayhew; K. Gorni; L. Pasquali; A. Pestronk; GR. Martin; F. Hu; L. Nie, CINRG pilot trial of coenzyme Q10 in steroid-treated Duchenne muscular dystrophy., in Muscle Nerve, vol. 44, n. 2, Aug 2011, pp. 174-8, DOI:10.1002/mus.22047, PMID 21698649.
- ^ Un integratore per la distrofia miotonica
- ^ Montagnese F., Current treatment options for patients with myotonic dystrophy type 2. Curr Treat Options Neurol 2021;23:31
- ^ Thurman M. Wheeler, John D. Lueck e Maurice S. Swanson, Correction of ClC-1 splicing eliminates chloride channelopathy and myotonia in mouse models of myotonic dystrophy, in The Journal of Clinical Investigation, vol. 117, n. 12, 3 dicembre 2007, pp. 3952–3957, DOI:10.1172/JCI33355. URL consultato l'11 giugno 2020.
- ^ Wheeler TM, Lueck JD, Swanson MS, Dirksen RT, Thornton CA, Correction of ClC-1 splicing eliminates chloride channelopathy and myotonia in mouse models of myotonic dystrophy, in J. Clin. Invest., vol. 117, n. 12, 2007, pp. 3952–7, DOI:10.1172/JCI33355, PMC 2075481, PMID 18008009.
- ^ Progress in this area is being fueled by the sharing of research by scientists and clinicians at biannual meetings by the International Myotonic Dystrophy Consortium (IDMC). The 7th biannual meeting IDMC-7 will take place in Wurtzburg, Germany September 9-12 2009.
- ^ VALUTAZIONE DEL RISCHIO ARITMICO NELLA DISTROFIA MIOTONICA TIPO 1 (DM1) - Fondazione Telethon
- ^ Consensus-based care recommendations for adults with myotonic dystrophy type 1". Neurology. Clinical Practice. 8 (6): 507–520. doi:10.1212/CPJ.0000000000000531. PMC 6294540. PMID 30588381.
- ^ Groh WJ, Groh MR, Saha C, Kincaid JC, Simmons Z, Ciafaloni E, Pourmand R, Otten RF, Bhakta D, Nair GV, Marashdeh MM, Zipes DP, Pascuzzi RM., Electrocardiographic abnormalities and sudden death in myotonic dystrophy type 1., in N Engl J Med., vol. 358, giugno 2008, pp. 2688-2697.
- ^ Age and causes of death in adult-onset myotonic dystrophy
- ^ Predictors of prognosis in type 1 myotonic dystrophy (DM1): longitudinal 18-years experience from a single center
- ^ a b Age and causes of death in adult-onset myotonic dystrophy - Sep 1998
- ^ Un punteggio prognostico dell’aspettativa di vita per la DM1, su neurologiaitaliana.
- ^ In memory of Gilbert Gottfried - Myotonic Dystrophy Foundation
- ^ Proximal myotonic myopathy
Bibliografia
[modifica | modifica wikitesto]- Joseph C. Segen, Concise Dictionary of Modern Medicine, New York, McGraw-Hill, 2006, ISBN 978-88-386-3917-3.
- Douglas M. Anderson, A. Elliot Michelle, Mosby’s medical, nursing, & Allied Health Dictionary sesta edizione, New York, Piccin, 2004, ISBN 88-299-1716-8.
- Peter S. Harper, Myotonic Dystrophy: The Facts : A Book for Patients and Families (Oxford Medical Publications) - prima e seconda edizione, Oxford [Oxfordshire], Oxford University Press, 2002-2009, ISBN 0-19-852586-9.
- Peter S. Harper, La distrofia miotonica. I fatti, traduzione di Giovanni Meola, con Alice Zanolini, 2012. - guida in scaricabile in pdf ad es. qui
- Peter S. Harper... [et al.], Myotonic dystrophy: present management, future therapy, Oxford [Oxfordshire], Oxford University Press, 2004, ISBN 0-19-852782-9.
- Robert D. Wells (Editor), Tetsuo Ashizawa (Editor), Genetic Instabilities and Neurological Diseases, Second Edition, with chapters on multiple disorders including both Steinert's (DM1) and PROMM (DM2), Boston, Academic Press, 2006, ISBN 0-12-369462-0.
Voci correlate
[modifica | modifica wikitesto]- Miotonia
- Distrofia muscolare
- Miopatia
- Malattie da espansione di triplette
- Sindrome di Andersen-Tawil
- Sistema di conduzione del cuore
- Aritmia
- Cardiomiopatia
- Miotonia congenita di Thomsen
- Atrofia muscolare spinale e bulbare
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su distrofia miotonica
Wikimedia Commons contiene immagini o altri file su distrofia miotonica
Collegamenti esterni
[modifica | modifica wikitesto]- Distrofie miotoniche, su UILDM.
- Distrofia miotonica di tipo 1, su fondazionemalattiemiotoniche.
- Distrofia miotonica di tipo 2, su fondazionemalattiemiotoniche.
- Distrofia miotonica, su Telethon.
- Distrofia miotonica, su Centro Dino Ferrari.
- Distrofia miotonica di Steinert, su orphanet.
- Miopatia miotonica prossimale o distrofia miotonica di Ricker, su orphanet.
- Myotonic Dystrophy Foundation, su myotonic.org.
- Searchable database Archiviato il 17 ottobre 2008 in Internet Archive. at Dutch Neuromuscular Research
- 140th ENMC International Workshop 2006 - Myotonic Dystrophy DM2/PROMM and other Myotonic dystrophies]
- Disease Information from the Myotonic Dystrophy Foundation
- Information from the International Myotonic Dystrophy Organization
- MDSG Information, su mdsguk.org. URL consultato il 26 agosto 2009 (archiviato dall'url originale il 29 dicembre 2008).
Information from the Neuromuscular Disease Center
- DM Toolbox Research tools for Myotonic Dystrophy from the Marigold Foundation
| Controllo di autorità | Thesaurus BNCF 43723 · LCCN (EN) sh85089286 · BNE (ES) XX4435101 (data) · BNF (FR) cb12268952p (data) · J9U (EN, HE) 987007555749205171 |
|---|
