Delta-9-tetraidrocannabinolo: differenze tra le versioni
| Riga 102: | Riga 102: | ||
Vi sono inoltre alcuni [[Studio clinico|studi clinici]] che dimostrano la [[Correlazione (statistica)|correlazione]] tra la presenza di significativi danni cerebrali e cognitivi e l'assunzione di THC, senza però potere, in via definitiva, postulare una [[Causa (filosofia)|causalità]], data la presenza di numerosi [[Interazione|effetti di interazione]] con altri fattori, che sovrastano l'effetto semplice del solo THC.<ref name=brain /><ref>{{Cita pubblicazione|autore=Heishman SJ|coautori=Arasteh K, Stitzer ML|titolo=Comparative effects of alcohol and marijuana on mood, memory, and performance|rivista=Pharmacol Biochem Behav|anno=1997|mese=settembre|volume=58|numero=1|pagine|93-101|pmid=9264076|doi=10.1016/S0091-3057(96)00456-X}}</ref><ref>{{Cita pubblicazione|autore=Fletcher JM|coautori= Page JB, Francis DJ, Copeland K, Naus MJ, Davis CM, Morris R, Krauskopf D, Satz P|titolo= Cognitive correlates of long-term cannabis use in Costa Rican men|rivista= Arch Gen Psychiatry|anno= 1996|mese=novembre|volume=53|numero=11|pp=1051-7|pmid=8911228|doi=10.1001/archpsyc.1996.01830110089011}}</ref><ref>{{Cita pubblicazione|autore=Block RI|coautori= Ghoneim MM|titolo= Effects of chronic marijuana use on human cognition|rivista= Psychopharmacology (Berl)|anno=1993|volume=110|numero=1-2|pp=219-28|pmid=7870889|doi=10.1007/BF02246977}}</ref><ref>{{Cita pubblicazione|autore=Patrick G|coautori= Straumanis JJ, Struve FA, Fitz-Gerald MJ, Leavitt J, Manno JE|titolo=Reduced P50 auditory gating response in psychiatrically normal chronic marihuana users: a pilot study|rivista= Biol Psychiatry|anno= 1999|mese=maggio|volume 45|numero=10|pp=1307-12|pmid=10349037|doi=10.1016/S0006-3223(98)00155-3}}</ref><ref>{{cita pubblicazione|autore=Patrick G|coautori=Struve FA|titolo= Reduction of auditory P50 gating response in marihuana users: further supporting data|rivista= Clin Electroencephalogr|anno= 2000|mese= aprile|volume= 31|numero=2|pp=88-93|pmid=10840631}}</ref> |
Vi sono inoltre alcuni [[Studio clinico|studi clinici]] che dimostrano la [[Correlazione (statistica)|correlazione]] tra la presenza di significativi danni cerebrali e cognitivi e l'assunzione di THC, senza però potere, in via definitiva, postulare una [[Causa (filosofia)|causalità]], data la presenza di numerosi [[Interazione|effetti di interazione]] con altri fattori, che sovrastano l'effetto semplice del solo THC.<ref name=brain /><ref>{{Cita pubblicazione|autore=Heishman SJ|coautori=Arasteh K, Stitzer ML|titolo=Comparative effects of alcohol and marijuana on mood, memory, and performance|rivista=Pharmacol Biochem Behav|anno=1997|mese=settembre|volume=58|numero=1|pagine|93-101|pmid=9264076|doi=10.1016/S0091-3057(96)00456-X}}</ref><ref>{{Cita pubblicazione|autore=Fletcher JM|coautori= Page JB, Francis DJ, Copeland K, Naus MJ, Davis CM, Morris R, Krauskopf D, Satz P|titolo= Cognitive correlates of long-term cannabis use in Costa Rican men|rivista= Arch Gen Psychiatry|anno= 1996|mese=novembre|volume=53|numero=11|pp=1051-7|pmid=8911228|doi=10.1001/archpsyc.1996.01830110089011}}</ref><ref>{{Cita pubblicazione|autore=Block RI|coautori= Ghoneim MM|titolo= Effects of chronic marijuana use on human cognition|rivista= Psychopharmacology (Berl)|anno=1993|volume=110|numero=1-2|pp=219-28|pmid=7870889|doi=10.1007/BF02246977}}</ref><ref>{{Cita pubblicazione|autore=Patrick G|coautori= Straumanis JJ, Struve FA, Fitz-Gerald MJ, Leavitt J, Manno JE|titolo=Reduced P50 auditory gating response in psychiatrically normal chronic marihuana users: a pilot study|rivista= Biol Psychiatry|anno= 1999|mese=maggio|volume 45|numero=10|pp=1307-12|pmid=10349037|doi=10.1016/S0006-3223(98)00155-3}}</ref><ref>{{cita pubblicazione|autore=Patrick G|coautori=Struve FA|titolo= Reduction of auditory P50 gating response in marihuana users: further supporting data|rivista= Clin Electroencephalogr|anno= 2000|mese= aprile|volume= 31|numero=2|pp=88-93|pmid=10840631}}</ref> |
||
A favore della seconda tesi uno studio [[in vitro]], effettuato su neuroni di ratto, ha mostrato che il cannabinoide HU210 è immunoreattivo col recettore CB1 per i cannabinoidi, portando gli autori ad ipotizzare che possa avere un ruolo nella proliferazione neuronale. Tale ipotesi è supportata dall'osservazione che il cannabinoide HU210 stimola la proliferazione (ma non la differenziazione) di cellule neuronali embrionali di ratto in vitro.<ref>{{Cita pubblicazione |url=http://www.jci.org/articles/view/25509 |titolo=Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects |autore=Wen Jiang|coautori=Yun Zhang; Lan Xiao; Jamie Van Cleemput; Shao-Ping Ji; Guang Bai; Xia Zhang|rivista=[[Journal of Clinical Investigation]] |volume=115 |numero=11 |data=1º novembre 2005 |doi=10.1172/JCI25509 |accesso=7 marzo 2011 }}</ref> Un altro studio ha dimostrato in maniera precisa come il CBD e il THC abbiano effetti neuroprotettivi su cellule neuronale corticali<ref>{{Cita pubblicazione|nome=A. J.|cognome=Hampson|data=1998-07-07|titolo=Cannabidiol and (−)Δ9-tetrahydrocannabinol are neuroprotective antioxidants|rivista=Proceedings of the National Academy of Sciences of the United States of America|volume=95|numero=14|pp=8268–8273|accesso=2017-01-25|url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC20965/|nome2=M.|cognome2=Grimaldi|nome3=J.|cognome3=Axelrod}}</ref>. |
A favore della seconda tesi uno studio [[in vitro]], effettuato su neuroni di ratto, ha mostrato che il cannabinoide HU210 è immunoreattivo col recettore CB1 per i cannabinoidi, portando gli autori ad ipotizzare che possa avere un ruolo nella proliferazione neuronale. Tale ipotesi è supportata dall'osservazione che il cannabinoide HU210 stimola la proliferazione (ma non la differenziazione) di cellule neuronali embrionali di ratto in vitro.<ref>{{Cita pubblicazione |url=http://www.jci.org/articles/view/25509 |titolo=Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects |autore=Wen Jiang|coautori=Yun Zhang; Lan Xiao; Jamie Van Cleemput; Shao-Ping Ji; Guang Bai; Xia Zhang|rivista=[[Journal of Clinical Investigation]] |volume=115 |numero=11 |data=1º novembre 2005 |doi=10.1172/JCI25509 |accesso=7 marzo 2011 }}</ref> Un altro studio ha dimostrato in maniera precisa come il CBD e il THC abbiano effetti neuroprotettivi su cellule neuronale corticali<ref>{{Cita pubblicazione|nome=A. J.|cognome=Hampson|data=1998-07-07|titolo=Cannabidiol and (−)Δ9-tetrahydrocannabinol are neuroprotective antioxidants|rivista=Proceedings of the National Academy of Sciences of the United States of America|volume=95|numero=14|pp=8268–8273|accesso=2017-01-25|url=http://www.ncbi.nlm.nih.gov/pmc/articles/PMC20965/|nome2=M.|cognome2=Grimaldi|nome3=J.|cognome3=Axelrod}}</ref>. Ulteriori studi hanno portato all'attenzione degli ambienti scientifici l'effetto del THC su umani, in realzione a malattie neurodegenerative come [[Malattia di Alzheimer|Alzheimer]] e [[Malattia di Parkinson|Parkinson]]<ref>{{Cita pubblicazione|nome=C. B.|cognome=Carroll|data=2004-10-12|titolo=Cannabis for dyskinesia in Parkinson disease A randomized double-blind crossover study|rivista=Neurology|volume=63|numero=7|pp=1245–1250|lingua=en|accesso=2017-01-25|doi=10.1212/01.WNL.0000140288.48796.8E|url=http://www.neurology.org/content/63/7/1245|nome2=P. G.|cognome2=Bain|nome3=L.|cognome3=Teare}}</ref><ref>{{Cita pubblicazione|nome=Lisa M.|cognome=Eubanks|data=2006-12-01|titolo=A Molecular Link between the Active Component of Marijuana and Alzheimer's Disease Pathology|rivista=Molecular Pharmaceutics|volume=3|numero=6|pp=773–777|accesso=2017-01-25|doi=10.1021/mp060066m|url=http://dx.doi.org/10.1021/mp060066m|nome2=Claude J.|cognome2=Rogers|cognome3=Beuscher}}</ref>, come illustrato nella sezione successiva. |
||
== Utilizzo terapeutico == |
== Utilizzo terapeutico == |
||
Versione delle 17:01, 25 gen 2017
| Delta-9-tetraidrocannabinolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Tetraidro-6,6,9-trimetil-3-pentil-6H-dibenzo[b,d]piran-1-olo | |
| Abbreviazioni | |
| THC | |
| Nomi alternativi | |
| Tetraidrocannabinolo delta-9-THC | |
| Caratteristiche generali | |
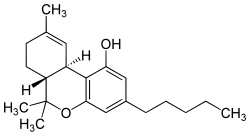
| Formula bruta o molecolare | C21H30O2 |
| Massa molecolare (u) | 314.47 |
| Aspetto | olio viscoso marroncino |
| Numero CAS | |
| Numero EINECS | 625-153-6 |
| PubChem | 16078 |
| DrugBank | DB00470 |
| SMILES | CCCCCC1=CC2=C(C3C=C(CCC3C(O2)(C)C)C)C(=C1)O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 2,8 g/l a 23 °C |
| Temperatura di fusione | 180 °C (453,15 K) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1270 |
| Indicazioni di sicurezza | |
Il delta-9-tetraidrocannabinolo (detto comunemente THC, delta-9-THC o tetraidrocannabinolo) è uno dei maggiori e più noti principi attivi della cannabis, e può essere considerato il capostipite della famiglia dei fitocannabinoidi.
È una sostanza psicotropa prodotta dai fiori di cannabis, può essere ingerito, comunemente fumato o inalato grazie ad un vaporizzatore, con proprietà antidolorifiche (Es: farmaci contenenti THC come il Sativex o il Bedrocan sono usati per il trattamento del dolore), euforizzante, antinausea, antiemetiche, anticinetosico, stimolante l'appetito, che abbassa la pressione endooculare, ed è capace di abbassare l'aggressività.[1]
È stato isolato da Raphael Mechoulam, Yechiel Gaoni, e Habib Edery dall'istituto Weizmann, Israele, nel 1964. In forma pura, a temperature più fredde, è un solido vetroso, di color viola, diventa più viscoso e appiccicoso se riscaldato. Il THC ha una bassissima solubilità in acqua, ma buona solubilità nella maggior parte dei solventi organici.
Biosintesi nella cannabis
Nella cannabis il THC si verifica principalmente come acido tetraidrocannabinolico (delta-9-THCA). La condensazione enzimatica del geranil pirofosfato e dell'acido olivetolico genera tetraidrocannabivarina, il quale è ciclizzato dall'enzima acido sintasi THC per dare THC-COOH. Il calore decarbossila l'acido in THC.
La modificazione principale è l'ossidazione dell'anello cicloesanico, che trasforma il THC in cannabidiolo (CBD). Gli acidi cannabinoidici subiscono decarbossilazione in seguito a riscaldamento e quindi quando la Cannabis viene fumata i livelli di cannabinoidi attivi aumentano, per esempio l'acido tetraidrocannabinolico viene convertito in tetraidrocannabinolo.
Farmacologia
Le azioni farmacologiche del THC risultano dal suo legame con i recettori cannabinoidi CB1, e CB2, che si trovano principalmente nel sistema nervoso centrale, e nel sistema immunitario. Esso agisce come un parziale ligando agonista su entrambi i recettori, cioè, li attiva ma non per intero. La presenza di questi recettori specializzati nel cervello fece presupporre agli scienziati che cannabinoidi endogeni vengono prodotti naturalmente dal corpo umano, si scoprirono infatti numerosi endocannabinoidi tra cui l'Anandamide, l'Arachidonoilglicerolo(2-AG) la Virodamina e molti altri.

Meccanismo d'azione
Il THC stimola il rilascio di dopamina dal nucleus accumbens, può provocare nella persona sensazioni di euforia, rilassamento, percezione spazio-temporale alterata; alterazioni uditive, olfattive e visive, ansia, disorientamento, stanchezza, e stimolazione dell'appetito. Il legame dei cannabinoidi ai recettori CB1 causa una inibizione presinaptica del rilascio di vari neurotrasmettitori (in particolare dopamina e glutammato), e una stimolazione delle aree della sostanza grigia periacqueduttale (PAG) e del midollo rostrale ventromediale (RVM), che a loro volta inibiscono le vie nervose ascendenti del dolore. A livello del midollo spinale il legame dei cannabinoidi ai recettori CB1 causa una inibizione delle fibre afferenti a livello del corno dorsale, e a livello periferico il legame dei cannabinoidi con i recettori CB1 e CB2 causa una riduzione della secrezione di vari prostanoidi e citochine proinfiammatorie, l'inibizione della sostanza P e pertanto del segnale doloroso. Il meccanismo per la stimolazione dell'appetito si crede sia il risultato di attività del THC nell'asse ipotalamico-gastroenterico. L'attività del CB1 nei centri della fame dell'ipotalamo aumenta l'appetibilità del cibo quando i livelli dell'ormone della fame grelina aumentano in seguito all'entrata di cibo nello stomaco.
Aspetti tossicologici
Fino ad oggi, non vi è mai stata una fatalità umana documentata da overdose di tetraidrocannabinolo, o cannabis.[2] La valutazione della pericolosità del THC nei confronti dell'uomo è largo oggetto di dispute non solo scientifiche, ma anche politiche e ideologiche. Secondo il Merck[3], la LD50 del tetraidrocannabinolo è di 1270 mg/Kg di peso vivo se somministrata per via orale (veicolato in olio di sesamo) nei ratti maschi e di 730 mg/Kg nei ratti femmine; la dose scende a 482 mg/Kg di peso vivo se somministrato per inalazione[4]. Tale valore è ritenuto molto alto, secondo le opinioni, tale da considerare la tossicità acuta del THC relativamente bassa rispetto ad altre sostanze psicotrope o farmaci, se non altro anche solo per la impraticabilità di una tale somministrazione attraverso cannabis (si pensi che la media della concentrazione di principio attivo nelle sostanze di consumo diffuse oggi è di 15%, con picchi attorno ai 30%: 10 grammi di prodotto contengono quindi in media 1,5 g di THC, ovvero 1500 mg. Considerando un umano di 70 kg, servirebbero 482x70=54'740 mg di principio attivo, dunque più o meno 365 grammi di prodotto. Uno "spinello" si prepara normalmente con 0,5 grammi di sostanza: servirebbero 730 spinelli per raggiungere l'assunzione della Dose Letale, ma il tempo necessario all'assunzione di una tale spropositata quantità comporterebbe una metabolizzazione del principio attivo assunto in precedenza, rendendo in fine impossibile la overdose). Per questo motivo le legislazioni dei diversi Paesi valutano i fitocannabinoidi con approcci differenti, con conseguenti divergenze in sede normativa. Alcuni studi condotti, relativi all'assimilazione del THC, convergono sulla conferma che la sostanza induca la perdita di neuroni nell'ippocampo, area del cervello responsabile della fissazione della memoria da breve a lungo termine[5]; numerosi altri studi hanno dimostrato invece le capacità neuroprotettive e antifiammatorie del THC[6][7][8][9][10]
A favore della prima tesi (cioè quella che sostiene provochi danni all'ippocampo), in uno studio in vivo[11] ratti esposti a THC ogni giorno per 8 mesi (approssimativamente 30% della loro aspettativa di vita), esaminati a 11 o 12 mesi di età, dimostravano una perdita di cellule nervose equivalente ad animali con il doppio della loro età.[12]
Vi sono inoltre alcuni studi clinici che dimostrano la correlazione tra la presenza di significativi danni cerebrali e cognitivi e l'assunzione di THC, senza però potere, in via definitiva, postulare una causalità, data la presenza di numerosi effetti di interazione con altri fattori, che sovrastano l'effetto semplice del solo THC.[5][13][14][15][16][17]
A favore della seconda tesi uno studio in vitro, effettuato su neuroni di ratto, ha mostrato che il cannabinoide HU210 è immunoreattivo col recettore CB1 per i cannabinoidi, portando gli autori ad ipotizzare che possa avere un ruolo nella proliferazione neuronale. Tale ipotesi è supportata dall'osservazione che il cannabinoide HU210 stimola la proliferazione (ma non la differenziazione) di cellule neuronali embrionali di ratto in vitro.[18] Un altro studio ha dimostrato in maniera precisa come il CBD e il THC abbiano effetti neuroprotettivi su cellule neuronale corticali[19]. Ulteriori studi hanno portato all'attenzione degli ambienti scientifici l'effetto del THC su umani, in realzione a malattie neurodegenerative come Alzheimer e Parkinson[20][21], come illustrato nella sezione successiva.
Utilizzo terapeutico


Al di là delle accese discussioni e controversie sociali e politiche sull'uso della canapa come stupefacente, va considerato che essa è stata per migliaia di anni un'importante pianta medicinale, fino all'arrivo del proibizionismo.[22] Sono oggi in commercio in diversi paesi farmaci a base di THC, di altri fitocannabinoidi o di cannabinoidi sintetici.
Potenziali campi di utilizzo terapeutico dei derivati della cannabis:
- nausea e vomito in chemioterapia
- stimolazione appetito nell'AIDS
- sclerosi multipla
- terapia del dolore
- traumi cerebrali / ictus
- sindrome di Tourette
- cancro al cervello, alla prostata, al seno, ai polmoni
- leucemia
- artrite reumatoide
- malattie infiammatorie croniche intestinali (malattia di Crohn, colite ulcerosa)
- glaucoma
- epilessia
Altre indicazioni potenziali:
- allergie
- anti-tumorale
- asma bronchiale
- malattie autoimmuni (lupus eritematoso, ...)
- malattie neurodegenerative (malattia di Alzheimer, corea di Huntington, malattia di Parkinson)
- patologie cardiovascolari (aterosclerosi, ipertensione arteriosa)
- sindromi ansioso-depressive
- sindromi da astinenza nelle dipendenze da sostanze
- spasticità nelle lesioni midollari (tetraplegia, paraplegia)
Al contrario di quanto si pensava finora, una ricerca del Center for Translational Psychiatry del Feinstein Institute for Medical Research e del Zucker Hillside Hospital di New York, rivela che in realtà l'assunzione di cannabis ha effetti positivi sulle funzioni cognitive dei pazienti affetti da schizofrenia.[23] Inoltre, se prima era diffusa nell'ambiente medico l'opinione che la cannabis potesse portare alla schizofrenia, vi sono evidenze statistiche che difficilmente possono essere contraddette: l'uso della cannabis, negli ultimi decenni, è aumentato considerevolmente, mentre l'incidenza della schizofrenia non ha subito sostanziali variazioni.[24] È opportuno puntualizzare, inoltre, che le percentuali di individui schizofrenici sono rimaste quasi le stesse nonostante la cannabis sia consumata principalmente da individui di giovani età.
Si stanno testando nel mondo farmaci che contengono una versione sintetica di alcuni dei principi attivi della cannabis (dronabinol, HU-210, levonantradolo, nabilone, SR 141716 A, Win 55212-2), ma questi per ora hanno mostrato molti più effetti collaterali e svantaggi rispetto alla pianta naturale. Il Canada, il 20 giugno 2005, è stato il primo paese ad autorizzare la messa in commercio di un estratto totale di Cannabis sotto forma di spray sublinguale Sativex standardizzato per THC e CBD, per il trattamento del dolore neuropatico dei malati di sclerosi multipla e cancro. Nel 2006 il Sativex è stato approvato negli Stati Uniti per essere sottoposto a studi clinici di Fase III per dolore intrattabile in pazienti con tumore.
Il Dronabinol è il termine registrato INN della variante stereochimica del THC. È un prodotto della Unimed Pharmaceuticals, Inc. ed è commercializzato negli USA come Marinol, ma è disponibile anche nell'Unione europea come farmaco generico (Dronabinol). Il farmaco è registrato, a partire dal 1985, per il trattamento della nausea e del vomito nei pazienti in chemioterapia antitumorale e per la stimolazione dell'appetito nei pazienti con sindrome da deperimento da AIDS. Negli ultimi anni l'uso terapeutico dei derivati della cannabis sta vivendo un globale processo di rivalutazione. Lo sviluppo delle conoscenze sul sistema dei cannabinoidi endogeni progredisce di pari passo all'individuazione di nuovi potenziali campi di utilizzo terapeutico.
Nel 2010 il Senato italiano ha concesso l'autorizzazione per una produzione di farmaci a base di cannabinoidi. Fino ad allora tutti i farmaci a base di cannabis venivano comprati da stati esteri. L'Italia su questo terreno è molto indietro rispetto agli USA e alla gran parte dei paesi europei.[25][26][27]
Nel 2014, l'azienda Farmalabor è stata autorizzata dal Ministero della Salute al commercio all'ingrosso di preparazioni vegetali a base di cannabis. I prodotti sono venduti a farmacie private e ospedaliere per l'allestimento di preparazioni magistrali su prescrizione del medico[28].
Farmaci cannabinoidi
- Dronabinol, cannabinoide sintetico, variante stereochimica del THC
- CP 47,497, cannabinoide sintetico
- JWH-018, cannabinoide sintetico
- Levonantradolo, cannabinoide sintetico
- Nabilone, cannabinoide sintetico, variante del THC
- Sativex, Spray orale a base alcolica contenente THC e CBD
- Cannabidiolo, (CBD), prodotto naturalmente nel fiore di cannabis
- Tetraidrocannabinolo, (THC), prodotto naturalmente nel fiore di cannabis
Presenza del THC
Il contenuto di THC nella marijuana (Cannabis sativa) è nell'ordine di 0,5-1% nelle foglie grandi, 1-3% nelle foglie piccole, variabile nei fiori dal 10 al 27%, 5-10% nelle brattee, 10-60% nell'hash, oltre il 60% fino a 99% nell'olio. Quantità superiori di THC, fino al 30%, si possono ottenere, nei fiori, da specie selezionate appositamente.
Il contenuto di THC di hashish e marijuana tende a diminuire con il tempo, un processo accelerato dal calore e dalla luce. Le foglie e la resina di canapa conservate in condizioni normali perdono rapidamente la loro attività e possono diventare completamente inattive dopo 2 anni.
-
Struttura stereochimica del THC
-
Animazione tridimensionale del THC
Note
- ^ Cannabis: Proprietà chimico-farmacologiche
- ^ Galileo - Giornale di Scienza | La cannabis? Un'erba benefica
- ^ (EN) ISBN 0-911910-12-3 S. Budavari, et al., The Merck Index. An Encyclopedia of Chemicals, Drugs, and Biologicals, Merck & Co., 1996.
- ^ (EN) Cannabis Chemistry, su The Vaults of Erowid. URL consultato il 28 novembre 2007.
- ^ a b Ameri A, The effects of cannabinoids on the brain, in Prog Neurobiol, vol. 58, n. 4, luglio 1999, pp. 315-48, DOI:10.1016/S0301-0082(98)00087-2, PMID 10368032.
- ^ (EN) A. J. Hampson, M. Grimaldi e J. Axelrod, Cannabidiol and (−)Δ9-tetrahydrocannabinol are neuroprotective antioxidants, in Proceedings of the National Academy of Sciences, vol. 95, n. 14, 7 luglio 1998, pp. 8268–8273. URL consultato il 25 gennaio 2017.
- ^ (EN) M. van der Stelt, W. B. Veldhuis e P. R. Bär, Neuroprotection by Δ9-Tetrahydrocannabinol, the Main Active Compound in Marijuana, against Ouabain-Induced In Vivo Excitotoxicity, in Journal of Neuroscience, vol. 21, n. 17, 1º settembre 2001, pp. 6475–6479. URL consultato il 25 gennaio 2017.
- ^ Stephen Yazulla, Endocannabinoids in the retina: From marijuana to neuroprotection, in Progress in Retinal and Eye Research, vol. 27, n. 5, 1º settembre 2008, pp. 501–526, DOI:10.1016/j.preteyeres.2008.07.002. URL consultato il 25 gennaio 2017.
- ^ (EN) Tetsuya Nagayama, Amy D. Sinor e Roger P. Simon, Cannabinoids and Neuroprotection in Global and Focal Cerebral Ischemia and in Neuronal Cultures, in Journal of Neuroscience, vol. 19, n. 8, 15 aprile 1999, pp. 2987–2995. URL consultato il 25 gennaio 2017.
- ^ (EN) C. B. Carroll, M.-L. Zeissler e C. O. Hanemann, Δ9-tetrahydrocannabinol (Δ9-THC) exerts a direct neuroprotective effect in a human cell culture model of Parkinson's disease, in Neuropathology and Applied Neurobiology, vol. 38, n. 6, 1º ottobre 2012, pp. 535–547, DOI:10.1111/j.1365-2990.2011.01248.x. URL consultato il 25 gennaio 2017.
- ^ Chen JP, Paredes W, Li J, Smith D, Lowinson J, Gardner EL, Delta 9-tetrahydrocannabinol produces naloxone-blockable enhancement of presynaptic basal dopamine efflux in nucleus accumbens of conscious, freely-moving rats as measured by intracerebral microdialysis., in Psychopharmacology, vol. 102, n. 2, 1990, pp. 156-62, PMID 2177204.
- ^ Dronet :: Approfondimenti Per Operatori
- ^ Heishman SJ, Arasteh K, Stitzer ML, Comparative effects of alcohol and marijuana on mood, memory, and performance, in Pharmacol Biochem Behav, vol. 58, n. 1, settembre 1997, DOI:10.1016/S0091-3057(96)00456-X, PMID 9264076.
- ^ Fletcher JM, Page JB, Francis DJ, Copeland K, Naus MJ, Davis CM, Morris R, Krauskopf D, Satz P, Cognitive correlates of long-term cannabis use in Costa Rican men, in Arch Gen Psychiatry, vol. 53, n. 11, novembre 1996, pp. 1051-7, DOI:10.1001/archpsyc.1996.01830110089011, PMID 8911228.
- ^ Block RI, Ghoneim MM, Effects of chronic marijuana use on human cognition, in Psychopharmacology (Berl), vol. 110, n. 1-2, 1993, pp. 219-28, DOI:10.1007/BF02246977, PMID 7870889.
- ^ Patrick G, Straumanis JJ, Struve FA, Fitz-Gerald MJ, Leavitt J, Manno JE, Reduced P50 auditory gating response in psychiatrically normal chronic marihuana users: a pilot study, in Biol Psychiatry, n. 10, maggio 1999, pp. 1307-12, DOI:10.1016/S0006-3223(98)00155-3, PMID 10349037.
- ^ Patrick G, Struve FA, Reduction of auditory P50 gating response in marihuana users: further supporting data, in Clin Electroencephalogr, vol. 31, n. 2, aprile 2000, pp. 88-93, PMID 10840631.
- ^ Wen Jiang, Yun Zhang; Lan Xiao; Jamie Van Cleemput; Shao-Ping Ji; Guang Bai; Xia Zhang, Cannabinoids promote embryonic and adult hippocampus neurogenesis and produce anxiolytic- and antidepressant-like effects, in Journal of Clinical Investigation, vol. 115, n. 11, 1º novembre 2005, DOI:10.1172/JCI25509. URL consultato il 7 marzo 2011.
- ^ A. J. Hampson, M. Grimaldi e J. Axelrod, Cannabidiol and (−)Δ9-tetrahydrocannabinol are neuroprotective antioxidants, in Proceedings of the National Academy of Sciences of the United States of America, vol. 95, n. 14, 7 luglio 1998, pp. 8268–8273. URL consultato il 25 gennaio 2017.
- ^ (EN) C. B. Carroll, P. G. Bain e L. Teare, Cannabis for dyskinesia in Parkinson disease A randomized double-blind crossover study, in Neurology, vol. 63, n. 7, 12 ottobre 2004, pp. 1245–1250, DOI:10.1212/01.WNL.0000140288.48796.8E. URL consultato il 25 gennaio 2017.
- ^ Lisa M. Eubanks, Claude J. Rogers e Beuscher, A Molecular Link between the Active Component of Marijuana and Alzheimer's Disease Pathology, in Molecular Pharmaceutics, vol. 3, n. 6, 1º dicembre 2006, pp. 773–777, DOI:10.1021/mp060066m. URL consultato il 25 gennaio 2017.
- ^ ACT
- ^ ADUC - Droghe - Notizia - USA - Schizofrenia. Studio: la cannabis migliora 'in modo significativo' le funzioni cognitive dei pazienti
- ^ Domande frequenti
- ^ ADUC - Articolo - Cure palliative. Italia garantisca diritto dei malati a non soffrire
- ^ ADUC - Droghe - Articolo - Cannabis terapeutica. Da Rovigo e Firenze parte la produzione italiana? Approvato ordine del giorno in Senato
- ^ ADUC - Articolo - Cure palliative. Si ha paura della responsabilità del medico e della parola cannabis. Intervento al Senato
- ^ Cannabis in farmacia, Farmalabor riceve l'autorizzazione del Ministero della Salute, su farmalabor.it.
Bibliografia
- Grotenhermen F., Russo E., Cannabis and cannabinoids. Pharmacology, Toxicology and Therapeutic potential. Binghamton, NY: Haworth Press 2002
- Dewick M., Chimica, biosintesi e bioattività delle sostanze naturali, Ed. Piccin
- Ethan B Russo, Cannabis and Cannabinoids: Pharmacology, Toxicology, and Therapeutic Potential, Routledge, 3 aprile 2013, ISBN 978-1-136-61493-4.
- Leslie L. Iversen Professor of Pharmacology University of Oxford, The Science of Marijuana, Oxford University Press, 6 novembre 2007, ISBN 978-0-19-979598-7.
Voci correlate
- Droga leggera
- Cannabis
- Cannabis indica
- Cannabis sativa
- Marijuana
- Hashish
- Teoria del 16 percento
- Teoria del passaggio
- Effetti della cannabis sulla salute
- Canapa (tessile)
- Skunk (cannabis)
- White widow (cannabis)
- Haze (cannabis)
- Antiproibizionismo
- Legalità della cannabis
- Endocannabinoidi
- Recettori cannabinoidi
- Cannabidiolo
- Cannabinoidi
- Anandamide
- Dronabinol
- Nabilone
- Sativex
Altri progetti
 Wikimedia Commons contiene immagini o altri file su Δ-9-tetraidrocannabinolo
Wikimedia Commons contiene immagini o altri file su Δ-9-tetraidrocannabinolo



