Triclorofluorometano
| Triclorofluorometano | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| Freon 11, F11, CFC-11, R-11 | |
| Caratteristiche generali | |
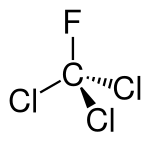
| Formula bruta o molecolare | CCl3F |
| Massa molecolare (u) | 137,37 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-892-3 |
| PubChem | 6389 |
| SMILES | C(F)(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,494 |
| Indice di rifrazione | 1,3821 |
| Solubilità in acqua | 1,5 g/L a 20 °C |
| Temperatura di fusione | –111 °C |
| Temperatura di ebollizione | 23,6 °C |
| Tensione di vapore (Pa) a 293 (20 °C) K | 88 600 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1900 orale, ratto |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
| Frasi R | 59 |
| Consigli P | 273, 280, 501 |
Il triclorofluorometano, noto anche come freon-11, CFC-11 o R-11, è un clorofluorocarburo di formula CCl3F, dove il carbonio è presente nel suo massimo stato di ossidazione (+4). È stato comunemente impiegato come fluido refrigerante.
È un composto stabile: ΔHƒ° = -288,70 kJ/mol.[1] In condizioni normali è un liquido incolore, non infiammabile, denso (d ≈ 1,5 g/mL), mobile (viscosità 0,42 cP[2]), estremamente volatile, con un leggero odore etereo dolciastro;[3] è pochissimo solubile in acqua (1,5 g/L),[4] ma è solubile in alcool, etere e in altri comuni solventi organici.[3] La sua temperatura di ebollizione di 23,7 °C (296,9 K)[5] è prossima alla temperatura ambiente, mentre la sua temperatura critica è 198 °C.[6]
Il triclorofluorometano è stato scelto come sostanza di riferimento per studi di spettroscopia RMN del 19F: al suo spostamento chimico si assegna quindi il valore 0,00 ppm.[7]
Da non confondere con il clorotrifluorometano, CF3Cl, un altro clorofluorocarburo con struttura molecolare molto simile (ruoli di F e Cl scambiati), che però bolle a -81,5 °C.
Struttura molecolare e proprietà[modifica | modifica wikitesto]
La molecola CCl3F, con l'atomo di carbonio centrale ibridato sp3, è di tipo tetraedrico, ma con simmetria C3v, come per CClF3.[8] L'analisi dei dati di esperimenti di diffrazione elettronica e di spettroscopia rotazionale nella regione delle microonde ha permesso di quantificare lunghezze ed angoli di legame.[9][10]
Il legame C–F (134,5 pm) ha lunghezza praticamente normale (135 pm[11]) ed è leggermente più lungo che in CClF3 (132,5 pm[12]); il legame C–Cl (176,4 pm) ha lunghezza appena minore del normale (177 pm[11]) ed è leggermente più lungo che in CClF3 (175,2 pm[12]). Le reciproche distanze tra gli atomi di cloro sono di 289,81 pm, mentre la distanza attesa per interazioni di non legame tra due atomi cloro sarebbe 2 rvdW, cioè l'intervallo 340-380 pm;[13] qualitativamente questo fenomeno si riscontra anche negli altri clorofluorometani, CClF3 CCl2F2, ed anche in CCl4.
L'angolo ClCCl (110,5°) è un po' più ampio dell'angolo tetraedrico (109,5°), mentre l'angolo FCCl (108,42°) ne è leggermente più stretto ed è un po' più stretto dell'angolo FCCl in CClF3 (110,3°[12]).
La presenza nei vertici del tetraedro di un atomo (F) diverso dagli altri tre (Cl) fa sì che la somma vettoriale dei quattro momenti di dipolo elettrico non sia nulla, come accade in CCl4 e in CF4, ma ammonti a 0,45 D[14] o 0,48 D;[15] di conseguenza, CCl3F è una molecola dotata di una certa polarità.
Chimica ionica in fase gassosa[modifica | modifica wikitesto]
L'energia di ionizzazione della molecola CCl3F è di 11,68 eV, maggiore di quella di CCl4 (11,47 eV), ma minore sia di quella di CCl2F2 (12,0 eV), che di quella di CClF3 (12,6 eV) e quella di CF4 (≤ 14,7 eV).[16] Nella serie dei clorofluorometani l'energia di ionizzazione cresce al crescere del numero di atomi di fluoro, l'elemento più elettronegativo.
Nonostante CCl3F sia una molecola in cui tutti gli atomi hanno ottetti completi, la cattura di un elettrone per formare l'anione molecolare radicalico [CCl3F]•– è favorita, come dimostra il valore dell'affinità elettronica pari a 1,10±0,30 eV.[17] Questo comportamento, comune anche ad altri alogenometani,[18] ha conseguenze, per esempio, sulla sua inattesa reattività quando in contatto con superficie di metalli[19][20] e sulla sua tossicità.[21]
Reattività[modifica | modifica wikitesto]
Il triclorofluorometano è un composto stabile, ma può decomporsi a contatto con scintille, fiamme o oggetti molto caldi, formando vapori altamente tossici e corrosivi, contenenti cloro, acido cloridrico e acido fluoridrico. Per contatto con metalli reattivi come alluminio in polvere, bario, calcio, magnesio e sodio si decompone violentemente.[22]
Uso[modifica | modifica wikitesto]
R-11 è stato il primo fluido refrigerante di largo impiego. Ha un punto di ebollizione elevato (rispetto alla maggioranza dei fluidi refrigeranti) e quindi può essere utilizzato in sistemi che funzionano a bassa pressione, rendendo la progettazione meccanica di tali sistemi meno impegnativa rispetto a fluidi refrigeranti come R-12 o R-22 che richiedono una pressione maggiore.
R-11 ha un alto contenuto di cloro, che può facilmente essere rilasciato dalla molecola se esposta a radiazione ultravioletta. Per questo motivo R-11 è il fluido refrigerante col più alto potenziale di distruzione dell'ozono (Ozone Depletion Potential, ODP), e per definizione gli viene assegnato il valore 1,0. La produzione negli Stati Uniti è stata interrotta il 1º gennaio 1996. Trova applicazione inoltre come solvente solido in studi di ionizzazione con raggi gamma.[23]
Galleria d'immagini[modifica | modifica wikitesto]
-
Concentrazione atmosferica di R-11 nel tempo
-
Concentrazione di R-11 sulla superficie del mare negli anni novanta
Note[modifica | modifica wikitesto]
- ^ (EN) Trichloromonofluoromethane, su webbook.nist.gov. URL consultato il 21 luglio 2022.
- ^ Liquids - Dynamic Viscosities, su www.engineeringtoolbox.com. URL consultato il 29 giugno 2022.
- ^ a b (EN) PubChem, Trichlorofluoromethane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 25 giugno 2022.
- ^ GESTIS-Stoffdatenbank, su gestis.dguv.de. URL consultato il 25 giugno 2022.
- ^ Fluorotrichloromethane | CCl3F | ChemSpider, su www.chemspider.com. URL consultato il 25 giugno 2022.
- ^ (EN) Trichloromonofluoromethane, su webbook.nist.gov. URL consultato il 29 giugno 2022.
- ^ 19F NMR Reference Standards (PDF), su colorado.edu.
- ^ CCCBDB listing of experimental data page 2, su cccbdb.nist.gov. URL consultato il 25 giugno 2022.
- ^ CCCBDB listing of experimental data page 2, su cccbdb.nist.gov. URL consultato il 20 luglio 2022.
- ^ (EN) Shigehiro Konaka, Munetaka Takeuchi e Mabao Kimura, The average structure and force constants of gaseous trichlorofluoromethane determined by electron diffraction and spectroscopy, in Journal of Molecular Structure, vol. 131, n. 3, 1º novembre 1985, pp. 317–325, DOI:10.1016/0022-2860(85)87033-2. URL consultato il 20 luglio 2022.
- ^ a b J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. A-25 - A-37, ISBN 88-299-1470-3.
- ^ a b c CCCBDB listing of experimental data page 2, su cccbdb.nist.gov. URL consultato il 20 luglio 2022.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chemical Forces, in Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, p. 300, ISBN 88-299-1470-3.
- ^ (EN) Harley P. Martins Fo, Joao Bosco L. de Oliveira e Paulo H. Guadagnini, Infrared Vibrational Intensities and Polar Tensors of the Fluorochloromethanes, in The Journal of Physical Chemistry, vol. 99, n. 29, 1995-07, pp. 11357–11364, DOI:10.1021/j100029a010. URL consultato il 25 giugno 2022.
- ^ trichlorofluoromethane, su www.stenutz.eu. URL consultato il 25 giugno 2022.
- ^ Chemical Formula Search, su webbook.nist.gov. URL consultato il 25 giugno 2022.
- ^ (EN) Trichloromonofluoromethane, su webbook.nist.gov. URL consultato il 25 giugno 2022.
- ^ (EN) P. O. Staneke, G. Groothuis e S. Ingemann, Formation, stability and structure of radical anions of chloroform, tetrachloromethane and fluorotrichloromethane in the gas phase, in International Journal of Mass Spectrometry and Ion Processes, vol. 142, n. 1, 31 marzo 1995, pp. 83–93, DOI:10.1016/0168-1176(94)04127-S. URL consultato il 25 giugno 2022.
- ^ A. Sreekumaran Nair e T. Pradeep, Halocarbon mineralization and catalytic destruction by metal nanoparticles, in Current Science, vol. 84, n. 12, 2003, pp. 1560–1564. URL consultato il 25 giugno 2022.
- ^ (EN) V.S. Smentkowski e J.T. Yates, The role of surface defects in chemisorptive molecular dissociation — Enhancement of halocarbon reactions on Fe(110), in Surface Science, vol. 232, n. 1-2, 1990-06, pp. 102–112, DOI:10.1016/0039-6028(90)90591-U. URL consultato il 25 giugno 2022.
- ^ S. Roszak, W. S. Koski e J. J. Kaufman, Structures and Electron Attachment Properties of Halomethanes (CX n Y m , X = H, F; Y = Cl, Br, I; n = 0,4; m = 4n), in SAR and QSAR in Environmental Research, vol. 11, n. 5-6, 1º febbraio 2001, pp. 383–396, DOI:10.1080/10629360108035360. URL consultato il 25 giugno 2022.
- ^ ICSC 0047 - TRICHLOROFLUOROMETHANE, su inchem.org. URL consultato il 25 giugno 2022.
- ^ Almond e Jenkins 2006
Bibliografia[modifica | modifica wikitesto]
- (EN) M. J. Almond e S. L. Jenkins, Short-Lived Intermediates, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia218, ISBN 978-0-470-86210-0.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su triclorofluorometano
Wikimedia Commons contiene immagini o altri file su triclorofluorometano
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) trichlorofluoromethane, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.

