Clorometano
| Clorometano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| clorometano | |
| Nomi alternativi | |
| cloruro di metile metilcloruro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH3Cl |
| Massa molecolare (u) | 50,49 g/mol |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 200-817-4 |
| PubChem | 6327 |
| SMILES | CCl |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 0,915 |
| Solubilità in acqua | 0,5325 g/100 ml (20 °C) |
| Coefficiente di ripartizione 1-ottanolo/acqua | 1,113 |
| Temperatura di fusione | −97 °C (176 K) |
| Temperatura di ebollizione | −24 °C (249 K) (1013 hPa) |
| Indicazioni di sicurezza | |
| Limiti di esplosione | 19% |
| Temperatura di autoignizione | 632 °C (905 K) |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 220 - 280 - 351 - 373 |
| Consigli P | 210 - 281 - 410+403 [1] |
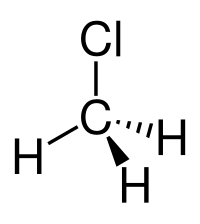
Il clorometano, noto anche con il nome di cloruro di metile o metil cloruro, o anche per mezzo delle sigle commerciali R-40 o HCC 40, è un composto chimico di formula CH3Cl. È un alometano e in particolare un alogenuro alchilico. A temperatura ambiente si presenta in forma gassosa o gas liquefatto sotto pressione; è incolore, di odore leggermente etereo[2] ed è riportato avere sapore dolce;[3] è molto infiammabile e può formare miscele esplosive in aria.[2]
In passato è stato utilizzato largamente come refrigerante, tuttavia i rischi connessi alla sua tossicità ne hanno ridotto l'impiego ed oggigiorno non è più utilizzato nei prodotti di largo consumo.
Il clorometano fu sintetizzato per la prima volta dai chimici francesi Jean Baptiste Dumas e Eugène-Melchior Péligot nel 1835, facendo bollire una miscela di metanolo, acido solforico e cloruro di sodio. Questa sintesi è tuttora alla base del metodo di preparazione odierno.
Proprietà e struttura molecolare[modifica | modifica wikitesto]
A temperatura ambiente il cloruro di metile è tecnicamente un vapore, la sua temperatura critica è infatti 144 °C; è più pesante dell'aria e moderatamente solubile in acqua (1% in massa a 25 °C)[4] ma è solubile nei comuni solventi organici (es. acetone, alcool, etere) e negli oli minerali.
Il cloruro di metile è un composto stabile: ΔHƒ° = -83,68 kJ/mol.[5] La molecola CH3Cl è di tipo tetraedrico con simmetria C3v,[6] con l'atomo di carbonio centrale ibridato sp3. Il suo momento dipolare è notevole e risulta pari a 1,8974 D,[7] praticamente uguale a quello di H2O (1,86 D), ed è leggermente minore che nel fluoruro di metile (1,8584 D),[8] molecola analoga ed isoelettronica di valenza.
Da indagini spettroscopiche vibrazionali (infrarosso) è stato possibile ricavare, tra l'altro, distanze ed angoli di legame:[9]
- r(C–H)) = 109,0 pm; r(C–Cl) = 178,5 pm;
- ∠(HCH) = 110,75°; ∠(HCF) = 108,16°.
Similmente a quanto accade per il fluoruro di metile, mentre i legami C–H hanno lunghezze praticamente normali (109 pm[10]), il legame del carbonio con l'alogeno, qui C–Cl, è lievemente più lungo del normale (177 pm[10]).
Gli angoli HCH sono lievemente maggiori di quello tetraedrico (109,5°) e quello HCCl con il cloro è lievemente minore. Lo stesso andamento qualitativo si osserva per il fluoruro di metile. Queste differenze rispetto ai valori attesi per un'ibridazione sp3 del carbonio centrale, seppur lievi, si inquadrano nell'ambito della regola di Bent.[11][12]
Questa prevede un minor carattere s per gli orbitali ibridi con cui il carbonio si lega ad atomi più elettronegativi di altri, qui Cl rispetto ad H e, viceversa, un maggior carattere s per gli orbitali ibridi con cui il carbonio si lega ad atomi meno elettronegativi di altri, qui H rispetto a Cl; ovviamente, a minor carattere s corrisponde un maggior carattere p, perché l'ibridazione complessiva dell'atomo di carbonio resta sp3.[13] Un aumento del carattere s comporta un'apertura dell'angolo di legame rispetto all'angolo tetraedrico,[13] come si evidenzia qui per l'angolo HCH, e viceversa per quello HCCl.
Chimica ionica in fase gassosa[modifica | modifica wikitesto]
La molecola CH3Cl ha un'energia di ionizzazione pari a 11,26 eV,[14] significativamente minore di quella del CH3F (12,50 eV).[15]
L'affinità protonica del cloruro di metile, che è una misura della sua basicità intrinseca, è pari a 647,3 kJ/mol.[16]
- H3C–Cl (g) + H+ (g) → [H3C–Cl-H]+ (g)
Questa affinità protonica è un ben maggiore di quella del fluoruro di metile (598,9 kJ/mol),[17] ma minore di quella dell'acqua (691 kJ/mol),[18] e molto maggiore rispetto al metano (543,5 kJ/mol), che quindi è molto meno basico.[19] Sperimentalmente l'affinità protonica degli alogenuri di alchile aumenta all'aumentare del numero atomico dell'alogeno e quindi, rispetto a CH3Cl, è ancora maggiore in CH3Br e in CH3I.[20]
Per quanto riguarda l'acidità in fase gassosa, tuttavia, pur essendo il cloruro di metile più basico del fluoruro di metile, risulta essere contemporaneamente più acido: si liberano 1672±10 kJ/mol per l'assunzione di un H+ da parte dell'anione CH2Cl−[21] contro 1756 ±19 kJ/mol per l'anione CH2F−.[22]
Note[modifica | modifica wikitesto]
- ^ scheda del clorometano su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ a b GESTIS-Stoffdatenbank, su gestis.dguv.de. URL consultato il 9 febbraio 2023.
- ^ (EN) PubChem, Chloromethane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 9 febbraio 2023.
- ^ chloromethane, su www.stenutz.eu. URL consultato il 9 febbraio 2023.
- ^ (EN) Chloromethane, su webbook.nist.gov. URL consultato il 9 febbraio 2023.
- ^ CCCBDB Experimental Data page 1, su cccbdb.nist.gov. URL consultato il 9 febbraio 2023.
- ^ (EN) G. Wlodarczak, F. Herlemont e J. Demaison, Combined subdoppler laser-Stark and millimeter-wave spectroscopies: Analysis of the ν6 band of CH335Cl, in Journal of Molecular Spectroscopy, vol. 112, n. 2, 1º agosto 1985, pp. 401–412, DOI:10.1016/0022-2852(85)90171-7. URL consultato il 2 agosto 2022.
- ^ (EN) Mark D. Marshall e J. S. Muenter, The electric dipole moment of methyl fluoride, in Journal of Molecular Spectroscopy, vol. 83, n. 2, 1º ottobre 1980, pp. 279–282, DOI:10.1016/0022-2852(80)90051-X. URL consultato il 2 agosto 2022.
- ^ (EN) J. L Duncan, D. C McKean e P. D Mallinson, Infrared spectra of CHD2Cl and CHD2CCH and the geometries of methyl chloride and propyne, in Journal of Molecular Spectroscopy, vol. 46, n. 2, 1º maggio 1973, pp. 232–239, DOI:10.1016/0022-2852(73)90039-8. URL consultato il 9 febbraio 2023.
- ^ a b J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 231-236, ISBN 88-299-1470-3.
- ^ A. F. Holleman, E. Wiberg e N. Wiberg, Anorganische Chemie, 103ª ed., De Gruyter, 2016, pp. 398-399, ISBN 978-3-11-026932-1.
- ^ a b J.B. Hendrickson, D.J. Cram e G.S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 57-61.
- ^ (EN) Chloromethane, su webbook.nist.gov. URL consultato il 2 agosto 2022.
- ^ (EN) Methyl fluoride, su webbook.nist.gov. URL consultato il 2 agosto 2022.
- ^ (EN) Chloromethane, su webbook.nist.gov. URL consultato il 2 agosto 2022.
- ^ (EN) Methyl fluoride, su webbook.nist.gov. URL consultato il 2 agosto 2022.
- ^ (EN) Water, su webbook.nist.gov. URL consultato il 30 giugno 2022.
- ^ (EN) Methane, su webbook.nist.gov. URL consultato il 30 giugno 2022.
- ^ (EN) Mikhail N. Glukhovtsev, Jan E. Szulejko e T. B. McMahon, New Theoretical and Experimental Proton Affinities for Methyl Halides and Diazomethane: A Revision of the Methyl Cation Affinity Scale, in The Journal of Physical Chemistry, vol. 98, n. 50, 1994-12, pp. 13099–13101, DOI:10.1021/j100101a001. URL consultato il 10 febbraio 2023.
- ^ (EN) P. M. Hierl, M. J. Henchman e J. F. Paulson, Threshold energies for the reactions OH− + CH3X → CH3OH + X− (X = Cl, Br) measured by tandem mass spectrometry: deprotonation energies (acidities) of CH3Cl and CH3Br, in International Journal of Mass Spectrometry and Ion Processes, vol. 117, 1º settembre 1992, pp. 475–485, DOI:10.1016/0168-1176(92)80109-E. URL consultato il 2 agosto 2022.
- ^ (EN) Nicola J. Rogers, Matthew J. Simpson e Richard P. Tuckett, Vacuum-UV negative photoion spectroscopy of CH3F, CH3Cl and CH3Br, in Physical Chemistry Chemical Physics, vol. 12, n. 36, 1º settembre 2010, pp. 10971–10980, DOI:10.1039/C0CP00234H. URL consultato il 2 agosto 2022.
Voci correlate[modifica | modifica wikitesto]
- Fluorometano
- Bromometano
- Iodometano
- Clorosilano
- Flotta del Mar Rosso
- Macallè (sommergibile)
- Elettrotreno FS ETR.200 (condizionamento a Cloruro di Metile - anno 1936)
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su clorometano
Wikimedia Commons contiene immagini o altri file su clorometano
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) Francis A. Carey, methyl chloride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh93000117 · GND (DE) 4133969-1 · J9U (EN, HE) 987007544230205171 |
|---|