AIDS: differenze tra le versioni
→Prevenzione: Amplio (da en.wiki) |
Nessun oggetto della modifica |
||
| Riga 512: | Riga 512: | ||
La [[circoncisione]] nell'Africa sub-sahariana "riduce l'acquisizione del virus HIV da uomini eterosessuali in un valore compreso tra il 38% e il 66% per più di 24 mesi".<ref>{{cite journal|last=Siegfried|first=N|coauthors=Muller, M; Deeks, JJ; Volmink, J|title=Male circumcision for prevention of heterosexual acquisition of HIV in men|journal=Cochrane database of systematic reviews (Online)|date=2009-04-15|issue=2|pages=CD003362|pmid=19370585|doi=10.1002/14651858.CD003362.pub2|editor1-last=Siegfried|editor1-first=Nandi}}</ref> Sulla base di questi studi, l'Organizzazione Mondiale della Sanità e l'[[UNAIDS]] hanno consigliato, nel 2007, tale pratica per prevenire la trasmissione da donna a maschio.<ref>{{cite web |title=WHO and UNAIDS announce recommendations from expert consultation on male circumcision for HIV prevention |publisher=World Health Organization |date=Mar 28, 2007|url=http://www.who.int/mediacentre/news/releases/2007/pr10/en/index.html}}</ref><ref>{{cite journal|last=Larke|first=N|title=Male circumcision, HIV and sexually transmitted infections: a review|journal=British journal of nursing (Mark Allen Publishing)|date=2010 May 27 – Jun 9|volume=19|issue=10|pages=629–34|pmid=20622758}}</ref> Non è però dimostrato che la circoncisione maschile possa portare beneficio nei paesi sviluppati e tra gli uomini che hanno rapporti sessuali omosessuali.<ref>{{cite journal|last=Kim|first=HH|coauthors=Li, PS, Goldstein, M|title=Male circumcision: Africa and beyond?|journal=Current opinion in urology|date=2010 Nov|volume=20|issue=6|pages=515–9|pmid=20844437|doi=10.1097/MOU.0b013e32833f1b21}}</ref><ref>{{cite journal|last=Templeton|first=DJ|coauthors=Millett, GA, Grulich, AE|title=Male circumcision to reduce the risk of HIV and sexually transmitted infections among men who have sex with men|journal=Current opinion in infectious diseases|date=2010 Feb|volume=23|issue=1|pages=45–52|pmid=19935420|doi=10.1097/QCO.0b013e328334e54d}}</ref><ref>{{Cite journal | last1 = Wiysonge | first1 = CS. | last2 = Kongnyuy | first2 = EJ. | last3 = Shey | first3 = M. | last4 = Muula | first4 = AS.|last5 = Navti | first5 = OB. | last6 = Akl | first6 = EA. | last7 = Lo | first7 = YR. | title = Male circumcision for prevention of homosexual acquisition of HIV in men | journal = Cochrane Database Syst Rev | volume = | issue = 6 | pages = CD007496 | month = | year = 2011 | doi = 10.1002/14651858.CD007496.pub2 | pmid = 21678366 | editor1-last = Wiysonge |editor1-first = Charles Shey }}</ref> Alcuni esperti temono che una minore percezione di vulnerabilità tra gli uomini circoncisi possa comportare una maggiore propensione a comportamenti sessuali a rischio, vanificando in tal modo gli effetti della prevenzione.<ref>{{Cite journal|author=Eaton LA, Kalichman S |title=Risk compensation in HIV prevention: implications for vaccines, microbicides, and other biomedical HIV prevention technologies |journal=Curr HIV/AIDS Rep |volume=4 |issue=4 |pages=165–72 |year=2007|month=December|pmid=18366947|pmc=2937204 |doi=10.1007/s11904-007-0024-7}}</ref> Le donne che hanno subito [[mutilazioni genitali femminili]] vedono un aumentato di rischio di HIV.<ref>{{Cite journal|author=Utz-Billing I, Kentenich H|title=Female genital mutilation: an injury, physical and mental harm |journal=J Psychosom Obstet Gynaecol |volume=29|issue=4 |pages=225–9|year=2008 |month=December |pmid=19065392 |doi=10.1080/01674820802547087 |url=}}</ref> |
La [[circoncisione]] nell'Africa sub-sahariana "riduce l'acquisizione del virus HIV da uomini eterosessuali in un valore compreso tra il 38% e il 66% per più di 24 mesi".<ref>{{cite journal|last=Siegfried|first=N|coauthors=Muller, M; Deeks, JJ; Volmink, J|title=Male circumcision for prevention of heterosexual acquisition of HIV in men|journal=Cochrane database of systematic reviews (Online)|date=2009-04-15|issue=2|pages=CD003362|pmid=19370585|doi=10.1002/14651858.CD003362.pub2|editor1-last=Siegfried|editor1-first=Nandi}}</ref> Sulla base di questi studi, l'Organizzazione Mondiale della Sanità e l'[[UNAIDS]] hanno consigliato, nel 2007, tale pratica per prevenire la trasmissione da donna a maschio.<ref>{{cite web |title=WHO and UNAIDS announce recommendations from expert consultation on male circumcision for HIV prevention |publisher=World Health Organization |date=Mar 28, 2007|url=http://www.who.int/mediacentre/news/releases/2007/pr10/en/index.html}}</ref><ref>{{cite journal|last=Larke|first=N|title=Male circumcision, HIV and sexually transmitted infections: a review|journal=British journal of nursing (Mark Allen Publishing)|date=2010 May 27 – Jun 9|volume=19|issue=10|pages=629–34|pmid=20622758}}</ref> Non è però dimostrato che la circoncisione maschile possa portare beneficio nei paesi sviluppati e tra gli uomini che hanno rapporti sessuali omosessuali.<ref>{{cite journal|last=Kim|first=HH|coauthors=Li, PS, Goldstein, M|title=Male circumcision: Africa and beyond?|journal=Current opinion in urology|date=2010 Nov|volume=20|issue=6|pages=515–9|pmid=20844437|doi=10.1097/MOU.0b013e32833f1b21}}</ref><ref>{{cite journal|last=Templeton|first=DJ|coauthors=Millett, GA, Grulich, AE|title=Male circumcision to reduce the risk of HIV and sexually transmitted infections among men who have sex with men|journal=Current opinion in infectious diseases|date=2010 Feb|volume=23|issue=1|pages=45–52|pmid=19935420|doi=10.1097/QCO.0b013e328334e54d}}</ref><ref>{{Cite journal | last1 = Wiysonge | first1 = CS. | last2 = Kongnyuy | first2 = EJ. | last3 = Shey | first3 = M. | last4 = Muula | first4 = AS.|last5 = Navti | first5 = OB. | last6 = Akl | first6 = EA. | last7 = Lo | first7 = YR. | title = Male circumcision for prevention of homosexual acquisition of HIV in men | journal = Cochrane Database Syst Rev | volume = | issue = 6 | pages = CD007496 | month = | year = 2011 | doi = 10.1002/14651858.CD007496.pub2 | pmid = 21678366 | editor1-last = Wiysonge |editor1-first = Charles Shey }}</ref> Alcuni esperti temono che una minore percezione di vulnerabilità tra gli uomini circoncisi possa comportare una maggiore propensione a comportamenti sessuali a rischio, vanificando in tal modo gli effetti della prevenzione.<ref>{{Cite journal|author=Eaton LA, Kalichman S |title=Risk compensation in HIV prevention: implications for vaccines, microbicides, and other biomedical HIV prevention technologies |journal=Curr HIV/AIDS Rep |volume=4 |issue=4 |pages=165–72 |year=2007|month=December|pmid=18366947|pmc=2937204 |doi=10.1007/s11904-007-0024-7}}</ref> Le donne che hanno subito [[mutilazioni genitali femminili]] vedono un aumentato di rischio di HIV.<ref>{{Cite journal|author=Utz-Billing I, Kentenich H|title=Female genital mutilation: an injury, physical and mental harm |journal=J Psychosom Obstet Gynaecol |volume=29|issue=4 |pages=225–9|year=2008 |month=December |pmid=19065392 |doi=10.1080/01674820802547087 |url=}}</ref> |
||
Programmi volti a promuovere l'[[astinenza sessuale]] non sembrano influenzare positivamente il rischio di contrarre HIV.<ref>{{cite journal |author= Underhill K, Operario D, Montgomery P |title= Abstinence-only programs for HIV infection prevention in high-income countries |journal=Cochrane Database of Systematic Reviews |issue=4 |pages= CD005421|year=2008|pmid= 17943855|doi=10.1002/14651858.CD005421.pub2|url=http://onlinelibrary.wiley.com/o/cochrane/clsysrev/articles/CD005421/frame.html|editor1-last= Operario|editor1-first= Don}}</ref> Una efficace [[educazione sessuale]] scolastica può diminuire i comportamenti ad alto rischio.<ref>{{cite journal|last=Tolli|first=MV|title=Effectiveness of peer education interventions for HIV prevention, adolescent pregnancy prevention and sexual health promotion for young people: a systematic review of European studies|journal=Health education research|date=2012-05-28|pmid=22641791|doi=10.1093/her/cys055}}</ref> Una minoranza consistente di giovani continua, tuttavia, sottovaluta il rischio.<ref name="Patel2008">{{Cite journal| author=Patel VL, Yoskowitz NA, Kaufman DR, Shortliffe EH | title=Discerning patterns of human immunodeficiency virus risk in healthy young adults | journal=Am J Med | year=2008 | pages=758–764 | volume=121|issue=4 | pmid=18724961 |doi=10.1016/j.amjmed.2008.04.022 | pmc=2597652 }}</ref> Non è noto se il trattamento di altre infezioni a trasmissione sessuale sia efficace nel prevenire l'HIV.<ref name=CochraneSTI2012/> |
Programmi volti a promuovere l'[[astinenza sessuale]] non sembrano influenzare positivamente il rischio di contrarre HIV.<ref>{{cite journal |author= Underhill K, Operario D, Montgomery P |title= Abstinence-only programs for HIV infection prevention in high-income countries |journal=Cochrane Database of Systematic Reviews |issue=4 |pages= CD005421|year=2008|pmid= 17943855|doi=10.1002/14651858.CD005421.pub2|url=http://onlinelibrary.wiley.com/o/cochrane/clsysrev/articles/CD005421/frame.html|editor1-last= Operario|editor1-first= Don}}</ref> Una efficace [[educazione sessuale]] scolastica può diminuire i comportamenti ad alto rischio.<ref>{{cite journal|last=Tolli|first=MV|title=Effectiveness of peer education interventions for HIV prevention, adolescent pregnancy prevention and sexual health promotion for young people: a systematic review of European studies|journal=Health education research|date=2012-05-28|pmid=22641791|doi=10.1093/her/cys055}}</ref> Una minoranza consistente di giovani continua, tuttavia, sottovaluta il rischio.<ref name="Patel2008">{{Cite journal| author=Patel VL, Yoskowitz NA, Kaufman DR, Shortliffe EH | title=Discerning patterns of human immunodeficiency virus risk in healthy young adults | journal=Am J Med | year=2008 | pages=758–764 | volume=121|issue=4 | pmid=18724961 |doi=10.1016/j.amjmed.2008.04.022 | pmc=2597652 }}</ref> Non è noto se il trattamento di altre infezioni a trasmissione sessuale sia efficace nel prevenire l'HIV.<ref name=CochraneSTI2012>{{cite journal|last=Ng|first=BE|coauthors=Butler, LM; Horvath, T; Rutherford, GW|title=Population-based biomedical sexually transmitted infection control interventions for reducing HIV infection|journal=Cochrane database of systematic reviews (Online)|date=2011-03-16|issue=3|pages=CD001220|pmid=21412869|doi=10.1002/14651858.CD001220.pub3|editor1-last=Butler|editor1-first=Lisa M}}</ref> |
||
=== Profilassi post-esposizione === |
=== Profilassi post-esposizione === |
||
{{Vedi anche|Profilassi post-esposizione ad HIV}} |
{{Vedi anche|Profilassi post-esposizione ad HIV}} |
||
un ciclo di farmaci antiretrovirali somministrati entro un tempo tra le 48 e le 72 ore dopo l'esposizione a sangue sieropositivo o secrezioni genitali, viene indicato come [[profilassi]] post-esposizione.<ref name=Prevention2012>{{cite journal |author= |title=HIV exposure through contact with body fluids |journal=Prescrire Int |volume=21 |issue=126 |pages=100–1, 103–5 |year=2012 |month=April |pmid=22515138 |doi= |url= }}</ref> L'uso della [[zidovudina]] in monoterapia riduce il rischio di una successiva infezione da HIV a seguito di una puntura di ago.<ref name=Prevention2012/> Il trattamento è consigliato anche dopo una [[violenza sessuale]] quando l'autore è noto per essere sieropositivo, ma non il suo utilizzo è dubbio quando lo stato di sieropositività è sconosciuto.<ref name=NEJM2011Sex>{{cite journal|last=Linden|first=JA|title=Clinical practice. Care of the adult patient after sexual assault|journal=The New England Journal of Medicine|date=2011-09-01|volume=365|issue=9|pages=834–41|pmid=21879901|doi=10.1056/NEJMcp1102869}}</ref> L'attuale trattamento di profilassi utilizza in genere [[lopinavir]]/[[ritonavir]] e [[lamivudina]]/[[zidovudina]] o [[emtricitabina]]/[[tenofovir]].<ref name=Prevention2012/> La durata del trattamento è di quattro settimane<ref name=CochranePEP2007>{{cite journal|last=Young|first=TN|coauthors=Arens, FJ; Kennedy, GE; Laurie, JW; Rutherford, G|title=Antiretroviral post-exposure prophylaxis (PEP) for occupational HIV exposure|journal=Cochrane database of systematic reviews (Online)|date=2007-01-24|issue=1|pages=CD002835|pmid=17253483|doi=10.1002/14651858.CD002835.pub3|editor1-last=Young|editor1-first=Taryn}}</ref> ed è spesso associato ad effetti avversi (con zidovudina in circa il 70% dei casi, tra cui [[nausea]] nel 24%, nel 22% affaticamento, sofferenza emotiva nel 13%, e [[cefalea]] nel 9%).<ref name=AFP2007/> |
un ciclo di farmaci antiretrovirali somministrati entro un tempo tra le 48 e le 72 ore dopo l'esposizione a sangue sieropositivo o secrezioni genitali, viene indicato come [[profilassi]] post-esposizione.<ref name=Prevention2012>{{cite journal |author= |title=HIV exposure through contact with body fluids |journal=Prescrire Int |volume=21 |issue=126 |pages=100–1, 103–5 |year=2012 |month=April |pmid=22515138 |doi= |url= }}</ref> L'uso della [[zidovudina]] in monoterapia riduce il rischio di una successiva infezione da HIV a seguito di una puntura di ago.<ref name=Prevention2012/> Il trattamento è consigliato anche dopo una [[violenza sessuale]] quando l'autore è noto per essere sieropositivo, ma non il suo utilizzo è dubbio quando lo stato di sieropositività è sconosciuto.<ref name=NEJM2011Sex>{{cite journal|last=Linden|first=JA|title=Clinical practice. Care of the adult patient after sexual assault|journal=The New England Journal of Medicine|date=2011-09-01|volume=365|issue=9|pages=834–41|pmid=21879901|doi=10.1056/NEJMcp1102869}}</ref> L'attuale trattamento di profilassi utilizza in genere [[lopinavir]]/[[ritonavir]] e [[lamivudina]]/[[zidovudina]] o [[emtricitabina]]/[[tenofovir]].<ref name=Prevention2012/> La durata del trattamento è di quattro settimane<ref name=CochranePEP2007>{{cite journal|last=Young|first=TN|coauthors=Arens, FJ; Kennedy, GE; Laurie, JW; Rutherford, G|title=Antiretroviral post-exposure prophylaxis (PEP) for occupational HIV exposure|journal=Cochrane database of systematic reviews (Online)|date=2007-01-24|issue=1|pages=CD002835|pmid=17253483|doi=10.1002/14651858.CD002835.pub3|editor1-last=Young|editor1-first=Taryn}}</ref> ed è spesso associato ad effetti avversi (con zidovudina in circa il 70% dei casi, tra cui [[nausea]] nel 24%, nel 22% affaticamento, sofferenza emotiva nel 13%, e [[cefalea]] nel 9%).<ref name=AFP2007>{{cite journal|last=Kripke|first=C|title=Antiretroviral prophylaxis for occupational exposure to HIV|journal=American family physician|date=2007-08-01|volume=76|issue=3|pages=375–6|pmid=17708137}}</ref> |
||
=== Madre-bambino === |
=== Madre-bambino === |
||
Programmi per prevenire la trasmissione del virus HIV da madre a figlio possono ridurre i tassi di trasmissione dal 92 al 99%.<ref name=Mother2010>{{cite journal|last=Coutsoudis|first=A|coauthors=Kwaan, L; Thomson, M|title=Prevention of vertical transmission of HIV-1 in resource-limited settings|journal=Expert review of anti-infective therapy|date=2010 Oct|volume=8|issue=10|pages=1163–75|pmid=20954881|doi=10.1586/eri.10.94}}</ref><ref name=Kurth2011/> Si tratta in primo luogo dell'uso di una combinazione di farmaci antivirali durante la [[gravidanza]] e dopo la nascita del bambino, ma comprende anche l'utilizzo del biberon piuttosto che l'[[allattamento al seno]].<ref name=Mother2010/><ref>{{cite journal|last=Siegfried|first=N|coauthors=van der Merwe, L; Brocklehurst, P; Sint, TT|title=Antiretrovirals for reducing the risk of mother-to-child transmission of HIV infection|journal=Cochrane database of systematic reviews (Online)|date=2011-07-06|issue=7|pages=CD003510|pmid=21735394|doi=10.1002/14651858.CD003510.pub3|editor1-last=Siegfried|editor1-first=Nandi}}</ref> Se l'alimentazione sostitutiva è accettabile, fattibile, abbordabile, sostenibile e sicura, le madri dovrebbero evitare l'allattamento al seno per i loro bambini. La somministrazione di estesa profilassi antiretrovirale al neonato diminuisce il rischio di trasmissione.<ref>{{cite journal|last=Horvath|first=T|coauthors=Madi, BC; Iuppa, IM; Kennedy, GE; Rutherford, G; Read, JS|title=Interventions for preventing late postnatal mother-to-child transmission of HIV|journal=Cochrane database of systematic reviews (Online)|date=2009-01-21|issue=1|pages=CD006734|pmid=19160297|doi=10.1002/14651858.CD006734.pub2|editor1-last=Horvath|editor1-first=Tara}}</ref> |
Programmi per prevenire la trasmissione del virus HIV da madre a figlio possono ridurre i tassi di trasmissione dal 92 al 99%.<ref name=Mother2010>{{cite journal|last=Coutsoudis|first=A|coauthors=Kwaan, L; Thomson, M|title=Prevention of vertical transmission of HIV-1 in resource-limited settings|journal=Expert review of anti-infective therapy|date=2010 Oct|volume=8|issue=10|pages=1163–75|pmid=20954881|doi=10.1586/eri.10.94}}</ref><ref name=Kurth2011>{{cite journal|last=Kurth|first=AE|coauthors=Celum, C; Baeten, JM; Vermund, SH; Wasserheit, JN|title=Combination HIV prevention: significance, challenges, and opportunities|journal=Current HIV/AIDS reports|date=2011 Mar|volume=8|issue=1|pages=62–72|pmid=20941553|doi=10.1007/s11904-010-0063-3|pmc=3036787}}</ref> Si tratta in primo luogo dell'uso di una combinazione di farmaci antivirali durante la [[gravidanza]] e dopo la nascita del bambino, ma comprende anche l'utilizzo del biberon piuttosto che l'[[allattamento al seno]].<ref name=Mother2010/><ref>{{cite journal|last=Siegfried|first=N|coauthors=van der Merwe, L; Brocklehurst, P; Sint, TT|title=Antiretrovirals for reducing the risk of mother-to-child transmission of HIV infection|journal=Cochrane database of systematic reviews (Online)|date=2011-07-06|issue=7|pages=CD003510|pmid=21735394|doi=10.1002/14651858.CD003510.pub3|editor1-last=Siegfried|editor1-first=Nandi}}</ref> Se l'alimentazione sostitutiva è accettabile, fattibile, abbordabile, sostenibile e sicura, le madri dovrebbero evitare l'allattamento al seno per i loro bambini. La somministrazione di estesa profilassi antiretrovirale al neonato diminuisce il rischio di trasmissione.<ref>{{cite journal|last=Horvath|first=T|coauthors=Madi, BC; Iuppa, IM; Kennedy, GE; Rutherford, G; Read, JS|title=Interventions for preventing late postnatal mother-to-child transmission of HIV|journal=Cochrane database of systematic reviews (Online)|date=2009-01-21|issue=1|pages=CD006734|pmid=19160297|doi=10.1002/14651858.CD006734.pub2|editor1-last=Horvath|editor1-first=Tara}}</ref> |
||
== Stato della ricerca == |
== Stato della ricerca == |
||
Versione delle 14:25, 6 set 2012
| AIDS | |
|---|---|
 | |
| Specialità | infettivologia |
| Eziologia | HIV |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 042 |
| ICD-10 | B24 |
| OMIM | 609423 |
| MeSH | D000163 |
| MedlinePlus | 000594 |
| eMedicine | 211316 |
| Sinonimi | |
| Sindrome da immunodeficienza acquisita | |
La Sindrome da Immunodeficienza Acquisita (da cui l'acronimo SIDA in italiano, francese e spagnolo), o Acquired Immune Deficiency Syndrome (AIDS in inglese, utilizzato anche all'estero) è una malattia del sistema immunitario umano causata dal virus dell'immunodeficienza umana (HIV).[1][2][3] La malattia interferisce con il sistema immunitario, rendendo le persone colpite più vulnerabili alle infezioni, incluse le infezioni opportunistiche e tumori che generalmente non colpiscono le persone con un sistema immunitario normale. Questa vulnerabilità aumenta con il progredire della malattia.
L'HIV si trasmette in molti modi, ad esempio tramite i rapporti sessuali, trasfusioni di sangue contaminato e aghi ipodermici e tramite trasmissione verticale tra madre e bambino durante la gravidanza, il parto e l'allattamento al seno[4][5].
Il virus e la malattia sono spesso indicati insieme come HIV/AIDS. La malattia è un importante problema sanitario in molte parti del mondo ed è considerato una pandemia.[6] Nel 2009, l'Organizzazione Mondiale della Sanità (OMS) stima che vi siano 33,4 milioni di persone nel mondo vivono con l'HIV/AIDS, con 2,7 milioni di nuove infezioni HIV all'anno e 2,0 milioni di decessi annuali a causa di AIDS.[7] Secondo il rapporto UNAIDS 2009, in tutto il mondo vi sono state circa 60 milioni di persone contagiate sin dall'inizio della pandemia, con circa 25 milioni di morti e 14 milioni di bambini orfani nel sud Africa.[8]
La ricerca genetica indica che l'HIV abbia avuto origine in Africa centro-occidentale nel corso del ventesimo secolo[9][10]. L'AIDS è stato individuato dal Centers for Disease Control and Prevention (CDC) nel 1981 e la sua causa, l'HIV, è stata identificata nel 1983.[11]
Anche se i trattamenti per l'HIV/AIDS possono rallentare il decorso della malattia, non vi è cura conosciuta o vaccino contro l'HIV. Il trattamento antiretrovirale riduce sia i morti che le nuove infezioni, ma questi farmaci sono costosi e non sono disponibili in tutti i paesi[12]. A causa della difficoltà nel trattamento delle infezioni da HIV, la prevenzione è un obiettivo chiave per il controllo dell'AIDS.
Storia

L'AIDS è stato riconosciuto per la prima volta il 5 giugno 1981, quando il CDC ha registrato un cluster di polmonite da Pneumocystis carinii in cinque uomini omosessuali a Los Angeles.[13] In principio, il CDC non aveva dato un nome ufficiale alla malattia e spesso faceva riferimento ad essa per mezzo delle malattie che sono state associate ad essa, ad esempio, linfoadenopatia.[14][15]
In generale la stampa coniò il termine GRID che stava per Gay-related immune deficiency.[16] Il CDC, in cerca di un nome, osservò che le comunità infette apparentemente fossero limitate a quelle degli haitiani, degli omosessuali, degli emofiliaci e dei consumatori di eroina, coniò i termine di "malattia 4H".[17] Tuttavia, dopo aver stabilito che l'AIDS non era limitato a quelle sole comunità, il termine AIDS venne introdotto nel luglio 1982.[18] Nel settembre 1982, il CDC iniziò ad usare i nomi di AIDS per la corretta definizione della malattia.[19]
La identificazione positiva del virus HIV-1 viene dal Congo nel 1959 e gli studi genetici del 1960 indicano che il virus è passato nella popolazione umana dagli scimpanzé circa cinquant'anni prima.[10] Uno studio del 2007 afferma che un ceppo di HIV- 1, probabilmente spostato dall'Africa ad Haiti, è entrato negli Stati Uniti intorno al 1969.[20]
L'HIV deriva dal relativo virus di immunodeficienza delle scimmie (SIV), che infetta le scimmie in Africa. Vi sono prove che gli esseri umani che partecipano ad attività di caccia e di vendita di pelli di scimmia, abbiano contratto il SIV.[21] Tuttavia, solo alcune di queste infezioni è stata in grado di causare epidemie nell'uomo e tutte si sono verificate tra la fine del XIX secolo e l'inizio del XX secolo. Per spiegare la nascita di epidemie di HIV negli umani solo da quel momento, vi sono diverse teorie: cambiamenti sociali dopo il colonialismo[22] trasmissione tramite vaccinazioni contro il vaiolo con aghi non sterili[23][24] e la prostituzione con la concomitante alta frequenza di malattie ulcerative dei genitali (come la sifilide) nelle nascenti città coloniali.[25][26]
Una delle prime vittime famose di AIDS fu l'americano Rock Hudson, un attore gay morto il 2 ottobre 1985 dopo aver annunciato che aveva contratto il virus. La malattia gli era stata diagnosticata nel 1984. Un'altra vittima degna di nota fu Nicholas Eden, membro gay del Parlamento inglese e figlio del defunto primo ministro Anthony Eden.[27][28] Il virus ha provocato forse la sua più celebre vittima il 24 novembre 1991, quando la rockstar Freddie Mercury, cantante de frontman dei Queen, morì per una malattia correlata all'AIDS dopo aver annunciato la malattia soltanto il giorno precedente.[29] Tuttavia la diagnosi gli era stata fatta già nel 1987.[30] Una delle prime vittime eterosessuali fu Arthur Ashe, tennista americano. Diagnosticato come positivo all'HIV, il 31 agosto 1988, dopo aver contratto il virus da trasfusioni di sangue durante un intervento chirurgico al cuore. Morì all'età di 49 anni, il 6 febbraio 1993.[31]
Una teoria controversa nota come teoria del vaccino orale antipolio sull'origine dell'AIDS suggerisce che l'epidemia di AIDS sia stata involontariamente avviata alla fine del 1950 nel Congo Belga dal ricercatore Hilary Koprowski che stava sperimentando un vaccino contro la poliomielite.[32][33] La comunità scientifica ha dichiarato che le prove disponibili non supportano questa teoria.[34][35][36]
Epidemiologia

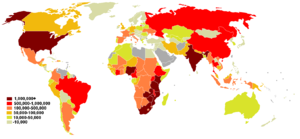
La pandemia di AIDS può anche essere vista come diverse epidemie di sottotipi distinti. I fattori principali della sua diffusione sono la trasmissione sessuale e la trasmissione verticale da madre a figlio alla nascita e attraverso il latte materno.[6] Nonostante il recente miglioramento all'accesso al trattamento antiretrovirale, in molte regioni del mondo, la pandemia di AIDS ha coinvolto circa 2,1 milioni (range tra gli 1.900.000 e i 2.400.000) di persone nel 2007, di cui circa 330.000 erano bambini sotto i 15 anni.[37] A livello globale, si stima che 33,2 milioni di persone vivevano con l'HIV nel 2007, di cui 2,5 milioni di bambini. Si stima che circa 2,5 milioni (range tra gli 1.800.000 e i 4.100.000) persone siano state contagiate nel 2007, tra cui 420.000 bambini.[37]
L'Africa subsahariana rimane di gran lunga la regione più colpita. Nel 2007 si stimava che li ci fossero il 68% di tutte le persone che vivono con l'AIDS e il 76% di tutte le morti per AIDS, con 1,7 milioni di nuove infezioni. A differenza di altre regioni, la maggior parte delle persone che vivevano con l'HIV nell'Africa sub-sahariana nel 2007 erano donne (61%). La prevalenza sugli adulti nel 2007 era stata stimata al 5,0% e l'AIDS continua ad essere la principale causa di mortalità in questa regione.[37]
Il Sud Africa ha la più grande popolazione di pazienti affetti da HIV nel mondo, seguito da Nigeria e India.[38] Il Sud e Sud-Est asiatico sono le seconde regioni più colpite.[37] L'India ha circa 2,5 milioni di infetti e la prevalenza negli adulti è stimata nello 0,36%.[37] L'aspettativa di vita è diminuita drammaticamente nei paesi più colpiti, per esempio, nel 2006 è stato stimato che era scesa da 65 a 35 anni in Botswana.[6]
Negli Stati Uniti, le giovani donne afro-americane sono a rischio particolarmente elevato per l'infezione da HIV.[39] Gli afro-americani rappresentano il 10% della popolazione, ma possiedono circa la metà dei casi di HIV/AIDS a livello nazionale.[40] Questo è dovuto in parte alla mancanza di informazioni sull'AIDS, nonché di un accesso limitato alle risorse sanitarie e una maggiore probabilità di rapporti sessuali con partner a rischio.[41]
Ci sono anche differenze geografiche nella prevalenza AIDS negli Stati Uniti, è infatti più comune nelle grandi aree metropolitane della costa orientale e nella California e nelle aree urbane del profondo sud.[41] Circa 1,1 milioni di persone vivono con l'HIV/AIDS negli Stati Uniti e più di 56.000 nuove infezioni si verificano ogni anno.[42]
Nei paesi dell'Europa dell'Est e dell'Asia Centrale si stima che vi siano, nel 2010, 1,5 milioni di persone sieropositive e che nello stesso anno 160.000 siano stati i nuovi casi di infezione e 90.000 i decessi a causa dell'AIDS. Dal 2001, la prevalenza dell'HIV in questi paesi è aumentata del 250%, rendendo la regione quella con l'epidemia a più rapida espansione al mondo.[43]
Patogenesi

HIV è un retrovirus del genere lentivirus, caratterizzato cioè dal dare origine a infezioni croniche, che sono scarsamente sensibili alla risposta immunitaria ed evolvono lentamente ma progressivamente e che, se non trattate, possono avere un esito fatale[44]. In base alle conoscenze attuali, HIV è suddiviso in due ceppi: HIV-1 e HIV-2. Il primo dei due è prevalentemente localizzato in Europa, America e Africa centrale. HIV-2, invece, si trova per lo più in Africa occidentale[44].
Una volta entrato nel circolo sanguigno dell'ospite non infetto HIV ricerca alcune particolari cellule in cui può riprodursi. Per farlo utilizza una glicoproteina che sporge sulla superficie della sua membrana esterna, la gp120, la quale è un recettore per le cellule bersaglio, mentre un'altra proteina, la gp41, serve per fondere la membrana del bersaglio e permettere al virus di penetrare al suo interno[44].

Le cellule bersaglio di HIV sono quelle che ricche di recettori CD4, in particolare alcuni linfociti chiamati CD4+, che hanno un ruolo particolarmente cruciale nel sistema immunitario: sono infatti del veri e propri "direttori d'orchestra" che attivano di volta in volta settori diversi delle difese a seconda del tipo ospite indesiderato con cui vengono in contatto (batteri, virus, protozoi, funghi, vermi, cellule tumorali, ecc.)[44].
Una volta entrato nella cellula HIV, tramite alcuni enzimi contenuti nella sua struttura, integra il proprio codice genetico (RNA) con quello della cellula ospite trascrivendolo in DNA. Gli enzimi coinvolti in questa fase si chiamano trascrittasi inversa e integrasi. Si tratta di un processo molto importante per il virus, poiché "mascherandosi" all'interno del DNA diventa di fatto inattaccabile dalle difese immunitarie e dalle terapie farmacologiche: è questa la caratteristica principale del processo biologico dei retrovirus[44].
A questo punto HIV può avviare subito la replicazione virale o può restare inattivo dentro la cellula, costituendo un serbatoio ineliminabile, che garantisce al virus la sopravvivenza nell'organismo ospitante a tempo indeterminato, per l'intera durata della vita del soggetto[44]. Quando il virus si attiva (per ragioni non completamente chiarite, ma legate comunque all'entrata in attività della cellula ospite e quindi sistema immunitario) il virus obbliga la cellula ospitante a produrre al suo interno le proteine e l’acido nucleico virale (RNA) che, come un puzzle, si assemblano all'interno della stessa cellula fino a creare virioni completi. L'enzima che modella le macroproteine in una forma idonea a dare vita a nuovo virus è chiamato proteasi[44].
I nuovi virioni vengono quindi espulsi dalla cellula per gemmazione e immessi nel sistema circolatorio. Nell'uscire essi formano le proprie membrane esterne (pericapside)m col materiale della cellula che li ha prodotti e creano una sorta di lacerazioni nella membrana cellulare ospitante che provocano la morte della cellula. È quindi il processo replicativo, non l'ingresso o la permanenza del virus nella cellula, che è dannoso. Le terapie farmacologiche odierne mirano infatti a inibire la replicazione e l'aggancio di nuovi bersagli agendo sulle proteine e sugli enzimi del virus, non eliminando il virus[44].
Trasmissione

Dagli inizi dell'epidemia, sono state individuate principalmente tre vie di trasmissioni dell'HIV, tutte riguardanti la penetrazione diretta di sangue o altre secrezioni infette nel circolo ematico di un soggetto sano. HIV inoltre è un virus a bassa contagiosità, che per trasmettersi ha bisogno di un'elevata concentrazione di particelle virali vitali. tale condizione si realizza pressoché esclusivamente nel sangue e nelle secrezioni genitali, in particolare lo sperma; in misura minore, ma comunque sufficiente, nelle secrezioni vaginali[44]. Altre secrezioni contengono HIV a bassa cancentrazione, ma l'esperienza e numerosi studi sperimentali escludono la trasmissibilità tramite queste secrezioni, salvo situazioni del tutto eccezionali, come la presenza abbondante di sangue nella saliva[44].
Sangue e derivati
L'immissione di sangue infetto nel circolo di un soggetto sano genera un'infezione pressoché certa. Questo tipo di contagio è stato molto frequente prima della messa a punto del test HIV, tramite trasfusioni di sangue infetto (ad esempio per pazienti emofiliaci), trapianti di organi di donatori infetti e accidentali casi di ferimento con strumenti quali rasoi, aghi (anche da tatuaggio) o bisturi appena venuti in contatto con materiale infetto, soprattutto in ambito professionale (incidenti di laboratorio)[44]. L'esclusione sistematica dalle donazioni dei soggetti infetti e la sterilizzazione di tutti gli strumenti che entrano in contatto col sangue ha reso questo tipo di contagio prettamente episodico[44].
Lo scambio di sangue fu responsabile dell'esplosione dell'epidemia tra tossicodipendenti da eroina, tramite lo scambio di siringhe usate[45]. Tale contagio, legato a pratiche molto diffuse di condivisione della droga e della siringa tra gruppi di giovani in momenti di aggregazione, rappresentò negli anni '80 la principale forma di contagio in paesi mediterranei quali la Spagna, l'Italia, la Yugoslavia. Il crollo dell'uso dell'eroina nei paesi occidentali ha drasticamente ridotto l'incidenza di questa forma di contagio in tali zone, sebbene restino a rischio ampie fasce di consumatori concentrati soprattutto nell'Europa dell'est e nei paesi emergenti dell'Asia[44].
Rapporti sessuali

La maggior parte delle infezioni del virus dell'HIV avviene attraverso rapporti sessuali penetrativi non protetti, sia etero che omosessuali[44].
La secrezioni genitali possono infatti raggiungere livelli elevanti di cariche virale e la dinamica della penetrazione favorisce la microfessurazione delle mucose genitali, di per sé già congeste durante l'atto, attraverso le quali il virus può entrare nel circolo dell'individuo sano[44]. Lo sperma è mediamente più infettante delle secrezioni vaginali, perché oltre al virus libero può contenere linfociti infetti; inoltre esso può rimanese anche a lungo a contatto con le mucose vaginali o rettali. La donna diventa più infettante in presenza di sangue mestruale, infezioni o infiammazioni vaginali[44].
I rapporti anali rappresentano un maggior rischio di contagio, per la maggiore facilità con cui crea microtraumi e per la natura della mucosa rettale, strutturalmente meno ideonea e contrastare l'impianto dell'infezione[44].
Lo stesso pene è dotato di mucose che possono lacerarsi durante i rapporti sessuali entrando in contatto con sangue e secrezioni infette, rendendo rischioso quindi anche il ruolo attivo. L'ispessimento della pelle in seguito alla circoncisione abbassa notevolmente (ma non esclude) i rischi di tale tipo contagio[46].
Il preservativo, impedendo il contatto tra mucose genitali e secrezioni potenzialmente infette, è un presidio sanitario di provata efficacia: il suo uso corretto rende il sesso sicuro e impedisce il contagio da tutte le malattie sessualmente trasmissibili[44].
Rapporti non penetrativi
Le pratiche sessuali non penetrative non possono essere definite prive di rischi in assoluto, sebbene le segnalazioni di contagio sicuramente attribuibili a tali pratiche abbiano un valore del tutto anedottico e di eccezionale rarità[44].
Non esistono dimostrazioni della contagiosità fellatio: esiste sicuramente una plausibilità biologica del contagio, ma l'esperienza medica parla di un rischio ridotto. In ogni caso la pratica può essere rischiosa solo se sperma infetto entra a contatto con ferite, mucose lacerate (anche microlacerate) o ulcerate della bocca. Il rischio è oggettivamente nullo in assenza di contatto con lo sperma e per chi riceve la fellatio, anche se chi la pratica è un sieropositivo contagioso. L'uso del preservativo annulla qualsiasi possibilità di contagio[47].
Stesse considerazioni valgono per il cunnilingus, anche se non esistono casi accertati di contagio attraverso questa pratica sessuale[47]. La minore concentrazione di virus nelle secrezioni vaginali rendono le possibilità di contagio estremamente basse, mentre la presenza di sangue mestruale è invece rischiosa. Barriere di lattice (come la superficie di un profilattico aperto con un taglio longitudinale) o di pellicola plastica eliminano qualsiasi rischio[47].
Rimming, fist fucking e golden shower possono essere teoricamente foriere di contagio HIV solo se tracce di sangue o di sperma infetto entrano in contatto con ferite, ulcerazioni o piaghe della pelle o delle mucose di una persona sana. Si tratta di una considerazione generale che vale per qualsiasi tipo di contatto, anche accidentale[47]. I tessuti permeabili e particolarmente irrorati da vasi sanguigni delle congiuntive della cornea pare invece che siano permeabili anche in assenza di ferite[48]. La pelle è una barriera efficace al virus e nemmeno graffi superficiali o pellicine alzate permettono al virus di entrare nella circolazione sanguigna[49].
Contagio verticale madre-figlio

La trasmissione del virus da madre a figlio può essere una derivazione del contagio sanguigno, in utero attraverso il cordone ombelicale, oppure duarnte il parto o l'allattamento. Sia il liquido amniotico che il latte materno hanno infatti un'alta concentrazione di virus[50]. In assenza di trattamento, il tasso di trasmissione tra madre e figlio è del 25%.
Tuttavia, dove un trattamento venga effettuato combinandolo con la possibilità di un parto cesareo e con alcune di settimane di terapia farmacologica per il neonato, il rischio è stato ridotto all'1%[50].
Un sieropositivo che vuole diventare padre con una compagna sieronegativa rischia di infettare la compagna, ma se essa non viene contagiata non c'è pericolo per il nascituro: l'infezione si trasmette infatti solo da madre a figlio e non dal padre. Esistono dei procedimenti per escludere la contagiosità dello sperma (il cosiddetto "lavaggio dello sperma") e permettere una fecondazione in tutta sicurezza per la madre[50].
Casi non contagiosi
L'HIV è stato trovato nella saliva, lacrime e urina di individui infetti, ma vista la bassa concentrazione del virus in questi liquidi biologici, il rischio di trasmissione è considerato trascurabile. Lo stesso vale per tosse, sudore, muco e feci[51].
Il virus non si trasmette tramite contatti come strette di mano, abbracci, baci, morsi, graffi[51] né tramite l'uso di rasoi o spazzolini da denti di persone sieropositive (se privi di tracce ematiche), anche se è comunque sempre consigliabile l'uso di strumenti di igiene personale individuali[52]. Nulla è la possibilità di contagio tramite vestiti, asciugamani, lenzuola, né tramite bicchieri, piatti o posate e in generale in tutti quei rapporti legati al vivere sotto uno stesso tetto[51].
Le zanzare, da sempre sospettate di essere un possibile veicolo di infezione, in realtà sono sostanzialmente innocue, sia perché il virus non si può replicare all'interno delle ghiandole salivari dell'insetto (trasmissione biologica)[53] sia per via della bassissima probabilità di infezione. La zanzara femmina (il maschio non punge) dopo aver nutrito le uova nel proprio addome con il sangue aspirato, riposa per circa 24 ore, tempo sufficiente alla scomparsa del virus dall'insetto madre. Anche qualora la zanzara punga due individui in successione di cui il primo sieropositivo, anche se altamente infetto e anche se con ripeture punture, la possibilità di contagio (trasmissione meccanica) è nulla perché il canale attraverso cui viene iniettata la saliva e quello attraverso il quale viene prelevato il sangue sono due condotti differenti, non in comunicazione tra di loro. Un discorso analogo può essere fatto anche per altri artropodi ematofagi come pulci, zecche e cimici[44]. La credenza che le zanzare siano veicolo di contagio è diffusa nei paesi meno sviluppati[54]. Le zanzare sono in effetti responsabili della trasmissione di altre patologie a eziologia virale come per esempio dengue e febbre gialla.
Stadi dell'infezione

In assenza di terapie l'infezione da HIV evolve inesorabilmente verso uno stato di malattia e la morte: in questo l'AIDS ha rappresentato un'epidemia molto più temibile di altre epidemie dell'era moderna, pari in termini di incidenza di persone colpite a quella della tubercolosi, della lue o del vaiolo, ma caratterizzata da un'inesorabile mortalità del 100%[55].
Per fini pratici l'infezione venne suddivisa in tre stadi, di facile applicazione ma estremamente grossolani: infezione acuta, stadio di latenza clinica e stadio sintomatico. Solo con l'ultimo stadio, in cui la sindrome inizia a manifestarsi con infezioni opportunistiche, si parla di immunodeficienza e quindi di AIDS. Con le moderne terapie, anche in caso di AIDS conclamato, è diventata possibile una regressione tra le fasi, rendendo di fatto obsoleta tale distinzione, che comunque viene ancora oggi tenuta in conto per ragioni storiche[44].
I linfociti perduti per via della replicazione dell'HIV vengono ricostruiti dall'organismo ma, a lungo andare, le quantità sempre maggiori di virus immessi nel sistema circolatorio ne infettano un numero sempre maggiore, portando la loro quantità inesorabilmente al di sotto di una soglia critica (>200 per millilitro di sangue, a fronte di 1200-600/ml in un individuo sano), che rende di fatto l'organismo attaccabile con successo da qualsiasi di agente patogeno[44].
Oggi l'avanzamento dell'infezione viene calcolato misurando la quantità media di copie di virus presente per millilitro di sangue ("carica virale") e la quantità di danno provocato dalla replicazione in termini di scomparsa dei linfociti CD4+. La misurazione di questi parametri si è rivelata particolarmente utile, anche perché indipendente dalle manifestazioni cliniche: non è infatti eccezionale riscontrare gravi quadri di immunocompromissione in assenza di sintomi clinici rilevanti[44].
Un'alta carica virale indica un'intensa attività replicativa dell'HIV e quindi un'elevata distruzione di linfociti CD4+; tale dato esprime la velocità con cui l’infezione corre verso l’AIDS. La conta dei linfociti CD4+ presenti nel sangue indica invece il grado di compromissione del sistema immunitario e, combinata col dato precedente, può permettere una stima dei tempi entro i quali si raggiungerà una soglia critica e quindi uno sviluppo della sindrome di immunodeficienza[44].
Il tasso di progressione clinica della malattia varia notevolmente tra persone e ha dimostrato di essere influenzato da molti fattori, come la suscettibilità dell'ospite, la funzionalità immunitaria,[56][57][58] l'assistenza sanitaria e le possibili co-infezioni e quale particolare ceppo del virus è coinvolto[59][60][61].
Infezione acuta
Il primo stadio, di infezione acuta, è caratterizzato da una rapida e imponente replicazione del virus che non trova alcun ostacolo. In tale fase la carica virale può raggiungere valori pari a milioni di copie di RNA/ml[44].
Se l'infezione è stata contratta per inoculazione di sangue infetto nel torrente circolatorio (trasfusione di sangue infetto, trapianto di organi, uso promiscuo di siringhe, punture accidentali con materiale infetto quali aghi o bisturi, trasmissione materno-fetale) il virus si dirige direttamente verso i centri linfatici e qui infetta le cellule CD4+, avviando la moltiplicazione[44].
Diverso è il caso della trasmissione per via sessuale, quando il virus è probabile che infetti inizialmente le cellule linfatiche delle mucose interessate, vaginali o rettali. Qui HIV compie i primi cicli replicativi finché raggiunge la carica virale sufficienti per abbandonare le mucose e raggiungere i linfonodi corrispondenti[44].
Non tutte le cellule infettate nella fase acuta avviano la replicazione virale: HIV costituisce infatti un serbatoio di cellule latentemente infette in cui integra i proprio codice biologico in quello dell'ospitante, "mascherando" il proprio RNA in DNA e diventando di fatto invisibile per il sistema immunitario e per le terapie. Si tratta questa di una caratteristica peculiare dei retrovirus, che ne garantisce la sopravvivenza nel corpo dell'individuo infetto in tutto l'arco della sua vita[44].
L'infezione acuta è quindi caratterizzata da tre caratteristiche: elevanta replicazione virale e conseguente distruzione di cellule CD4+, costituzione del serbatoio di cellule latentemente infette[44].
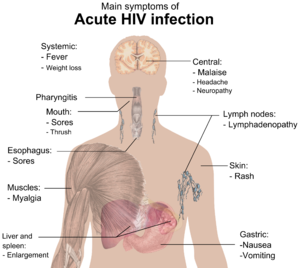
In circa la metà dei casi l'infezione acuta è asintomatica e, anche quando è caratterizzata da sintomi, il quadro clinico è poco specifico, facilmente confondibile con una sindrome influenzale protratta. Un 20-30% di casi mostra un quadro clinico più complesso e sospetto, con febbre protratta e non altrimenti interpretabile, manifestazioni esantematiche simil-morbillose, linfonodi ingrossati, quadri meningei che indicano la presenza di HIV nel sistema nervoso centrale[44].
Stadio di latenza clinica
La fase acuta viene interrotta dalla comparsa della risposta immunitaria, che richiede circa 2-8 settimane e interessa sia umorale che quella cellulo-mediata, attraverso la produzione di anticorpi anti-HIV e linfociti citotossici. I primi in particolare inattivano un'alta quantità di virus libero immesso nel sistema circolatorio[44].
La fine della fase acuta quindi mostra un'importante riduzione della carica virale, la ripresa del numero dei linfociti CD4+ e la scomparsa dei segni clinici, se presenti. La rilevazione di anticorpi anti-HIV è riscontrabile con uno specifico test ELISA (Enzyme-Linked ImmunoSorbent Assay), il test HIV. I soggetti positivi al test sono definiti sieropositivi. La sieropositività è una condizione che, stanti le conoscenze mediche odierne, perdura per tutta la vita di chi ha contratto l’infezione, indipendentemente dallo stadio e dal grado di immunodeficienza, ed esprime l'avvenuto contagio e il perdurare dell'infezione[44].
La fase di latenza clinica (o cronica), in assenza di terapie può durare da qualche anno a oltre 15. Dal punto di vista clinico le condizioni del soggetto sono per lo più stabili, ma dal punto di vista virologico la replicazione persiste, in particolare nei tessuti linfatici, sebbene tenuta sotto controllo dalla risposta immunitaria. Il tessuto linfatico che ospita la replicazione va però incontro a un progressivo deterioramento, che nel tempo compromette la capacità di reintegrare i linfociti distrutti dal virus. Inoltre, le frequenti mutazioni del virus, portano alla comparsa di nuove popolazioni virali diverse da quella originale, alle quali il sistema immunitario è continuamente sollecitato ad adeguarsi[44].
Stadio sintomatico

Gradualmente la carica virale riacquista forza, mentre resta progressivo e costante l'assottigliamento dei livelli di linfociti CD4+ presenti nel sangue. Quando il numero di linfociti scende al di sotto di una soglia critica (tra 400/ml e 200/ml, a fronte di un valore di 1200-600/ml in un individuo sano), l'organismo non riesce più a difendersi da una serie di microrganismi scarsamente patogeni in condizioni normali, detti opportunisti, tra cui tutta una serie di ospiti abituali e del tutto innocui dell'organismo (virus, batteri, funghi e protozoi), più raramente acquisiti con metodi occasionali. L'opprtunità che questi organismi hanno di sviluppare una malattia, e trasformarsi quindi in patogeni, è fornita dal basso numero di linfociti CD4+[44].
Per alcuni microrganismi è sufficiente un grado molto limitato di immunodeficienza e le infezioni che portano sono le prime a manifestarsi, altri richiedono una compromissione più severa. Sintomi comuni sono febbre, sudorazione specie notturna, ingrossamento ghiandolare, tremore, debolezza e perdita di peso[62]. Alcune infezioni opportunistiche e alcuni tumori, come il sarcoma di Kaposi sono ormai sintomi ben noti della possibile infezione da AIDS. Senza terapie il numero dei linfociti CD4+ si erode inesorabilmente e le infezioni opportunistiche si susseguono una dopo l'altra, magari con pause di benessere tra l'una e l'altra grazie a cure farmacologiche. È comunque solo questione di tempo, e lo scarto tra la prima infezione e il decesso variava entro sei mesi e tre anni, in cui l'individuo andava incontro a infezioni sempre più severe e ravvicinate, che portavano a un progressivo e inarrestabile decadimento generale, letale al 100%[44]. Le principali patologie polmonari sono: la polmonite da Pneumocystis jiroveci, la tubercolosi (che può evolvere in extrapolmonare) e la parotite. Le infezioni del tratto gastro-intestinale comportano esofagiti e diarrea cronica. Tra le principali patologie neurologiche vi sono la toxoplasmosi, la leucoencefalite multifocale progressiva e l'AIDS Dementia Complex. Aumenta inoltre il rischio di sviluppare varie forme di tumore come il Sarcoma di Kaposi, i tumori del cervello e i linfomi.
Oggi i farmaci, sebbene incapaci di eliminare il virus, ne impediscono la replicazione, cambiando completamente la prognosi degli ammalati. Persone sieropositive che avevano già sperimentato un’infezione opportunistica e gravi stadi di immunodeficienza sono riusciti a recuperare un buon numero di linfociti CD4+ e godono di buona salute, nonostante figurino statisticamente tra i casi di AIDS conclamato. Per queste ragione la suddivisione in stadi tradizionale oggi non corrisponde all’attuale contesto clinico e terapeutico dell’infezione, basandosi piuttosto su dati oggettivi quali il numero dei linfociti CD4+ e l’entità della carica virale[44].
Si ritiene che il trattamento terapeutico denominato HAART consenta un incremento dell'aspettativa di vita medio attorno ai 30 anni[63] o, secondo alcuni studi, anche oltre[64].
Diagnosi
La diagnosi di AIDS in una persona infetta da HIV si basa sulla presenza di alcuni segni o sintomi. Dal 5 giugno 1981 sono state coniate varie definizioni per il monitoraggio epidemiologico dell'infezione: tra queste la definizione Bangui e quella dell'Organizzazione Mondiale della Sanità datata 1994. Tuttavia, non sono da intendersi come utili per la classificazione clinica dei pazienti, in quanto non sono appropriate e specifiche. Il sistema di classificazione usato dall'Organizzazione Mondiale della Sanità e quello del CDC (Centers for Disease Control) può essere utilizzato solo nei paesi sviluppati.
Classificazione secondo l'OMS
Nel 1990, l'Organizzazione Mondiale della Sanità (OMS) ha raggruppato i diversi tipi di casi definendo una scala per i pazienti affetti da HIV-1.[65] Questa è stata aggiornata nel settembre del 2005. La maggior parte di queste infezioni opportunistiche può essere facilmente curata in soggetti altrimenti sani.
- Stadio I: l'infezione da HIV è asintomatica e non categorizzata come AIDS
- Stadio II: include minori manifestazioni mucocutanee e ricorrenti infezioni del tratto respiratorio superiore
- Stadio III: include diarrea cronica prolungata per oltre un mese, gravi infezioni batteriche e tubercolosi
- Stadio IV: include toxoplasmosi del cervello, candidosi di esofago, trachea, bronchi o polmoni e sarcoma di Kaposi; queste patologie sono usate come indicatori dell'AIDS.
Classificazione secondo il CDC
Nel 1993, il Center for Disease Controlo and Prevention statunitense ha ampliato la sua definizione di AIDS includendo tutte le persone sieropositive con il conteggio delle cellule CD4+ T inferiore a 200 per millilitro di sangue o al 14% di tutti i linfociti.[66] La maggior parte dei nuovi casi di AIDS nei paesi sviluppati seguono questa definizione. La diagnosi di AIDS si ferma anche se, dopo il trattamento, le cellule CD4+ T sale al di sopra di 200/ml di sangue o se le altre patologie che definiscono l'AIDS malattie vengono guarite.
Test HIV

Molte persone non sanno di essere infette da HIV.[67] Meno dell'1% della popolazione sessualmente attiva urbana in Africa è stata testato e questa proporzione è ancora più bassa nelle popolazioni rurali. Inoltre, solo lo 0,5% delle donne in gravidanza che frequentano le strutture sanitarie urbane sono sottoposte al test. Ancora una volta, questa percentuale è più bassa nelle strutture sanitarie rurali.[67] Per tale motivo il sangue e gli emoderivati utilizzati vengono sottoposti al test HIV.
Il test HIV viene solitamente effettuato su sangue venoso. Molti laboratori utilizzano la quarta generazione di test di screening che rilevano anticorpi anti-HIV (IgG e IgM) e l'antigene p24 dell'HIV. Il rilevamento di anticorpi per HIV in un paziente precedentemente noto come negativo è evidenza di infezione da HIV. Gli individui a cui il primo test ha evidenziato una positività verranno sottoposti ad un nuovo esame su un secondo campione di sangue per confermare i risultati.
Il periodo di finestra (il tempo tra l'infezione iniziale e lo sviluppo di anticorpi rilevabili) può variare richiedendo fino a da 3 a 6 mesi per la sieroconversione. Il rilevamento del virus mediante reazione a catena della polimerasi (PCR) durante il periodo finestra è possibile e consente una diagnosi più precoce.
Gli eventuali risultati positivi ottenuti con la PCR vengono confermati da test anticorpali.[68] I test di routine per l'infezione da HIV se utilizzati nei neonati e nei bambini, nati da madri sieropositive, non hanno alcun valore, in quanto vi è la presenza di anticorpi materni nel sangue del bambino.[69] Per una corretta diagnosi in questi soggetti è necessario ricorrere alla PCR.[70]
Trattamento
Nella storia della medicina resterà una pietra miliare la straordinaria rapidità e la dimensione di ricercatori coinvolti nell'individuare una cura per la sindrome da HIV[44]. In tempi da record si comprese che il danno provocato da HIV sul sistema immunitario non era tanto correlato alla presenza del virus nell'organismo, ma al suo processo di replicazione, e che tale processo si realizza tramite specifici enzimi e proteine e quali possono essere un ottimo bersaglio della terapia farmacologica[44]. Oggi la scoperta tempestiva della sieropositività affidandosi a un'équipe di medici esperta può garantire un'aspettativa e una qualità di vita pari a quella di chi è affetto da altre patologie croniche, come ipertensione o diabete[44].
Si è finora dimostrata invece una chimera la realizzazione di un vaccino che eradichi l'HIV dall'organismo, sia per il ciclo biologico particolare dei retrovirus, sia l'altissima variabilità del virus stesso[44].
Le strategie di prevenzione sono esclusivamente basate sui metodi per evitare l'esposizione al virus o sul'impiego di farmaci antiretrovirali come profilassi post-esposizione (PEP)[71] La PEP ha un calendario molto impegnativo con quattro settimane di somministrazione. Presenta anche effetti collaterali molto spiacevoli tra cui diarrea, malessere diffuso, nausea e stanchezza.[72].
La terapia antivirale
Il primo farmaco in grado di arginare gli effetti della sindrome fu la zidovudina (o AZT), un inibitore della trascrittasi inversa, disponibile dal 1987. La tendenza del virus a sviluppare mutazioni resistenti e l'alta tossicità del farmaco portarono all'abbandono della monoterapia nel 1991 in seguito alla messa in commercio di una nuova terapia a due farmaci (biterapia ). Dal 1996 infine la scoperta di inibitori della proteasi[12] ha permesso un nuovo protocollo farmacologico altamente efficace, basato su tre inibitori virali (triterapia), attuale terapia standard, detta HAART (Highly Active Antiretroviral Therapy)[44].
Oggi esistono varie famiglie di farmaci, capaci di bloccare o rallentare la replicazione virale (e quindi la progressione clinica della sindrome): essi agiscono sulla trascrittasi inversa, sulle integrasi e sulle proteasi; una quarta famiglia impedisce l'ingresso del virus nelle cellule interferendo sul recettore CD4 o sulla gp41, la glicoproteina di fusione.
La terapia tipica consiste nella somministrazione di due inibitori nucleosidici della trascrittasi inversa (NRTI) più un inibitore della proteasi o un inibitore non nucleosidico della trascrittasi inversa (NNRTI). Poiché la progressione della malattia da HIV nei bambini è più rapida che negli adulti, per i primi i protocolli prevedono un trattamento più aggressivo.[73] Nei paesi sviluppati, dove la terapia HAART è disponibile, i medici valutano la carica virale, la conta dei CD4, la velocità di decadimento di quest'ultima e le condizioni cliniche del paziente prima di decidere quando iniziare il trattamento.[74] Tradizionalmente, il trattamento è stato consigliato ai pazienti asintomatici quando la conta delle cellule CD4 scende a 200-250 unità per millilitro di sangue. Tuttavia, iniziare il trattamento prima (ad un livello di CD4 di 350 cellule/ml) può ridurre significativamente il rischio di morte.[75]
Gli obiettivi standard della HAART includono il miglioramento della qualità del paziente della vita, la riduzione delle complicanze e la riduzione della viremia sotto al limite di rivelazione. La terapia non comporta però né la cura della malattia né impedisce il ritorno, una volta che il trattamento viene interrotto, di alti livelli ematici di HIV, spesso resistente ad ulteriori cicli di terapia.[76][77][78]
Nonostante questo, molti individui infetti da HIV hanno beneficiato di notevoli miglioramenti nel loro stato di salute generale e nella qualità della vita, con una forte diminuzione della morbilità e mortalità associata al virus HIV.[79][80][81] In assenza della terapia HAART, la progressione da infezione da HIV all'AIDS si verifica in una mediana compresa tra i 9 e i 10 anni e la sopravvivenza mediana dopo aver sviluppato l'AIDS è di solamente 9,2 mesi[82].
Fallimenti terapeutici
In alcuni casi la terapia HAART porta a risultati non ottimali, a causa dell'intolleranza ai farmaci o degli effetti collaterali dei farmaci stessi, così come per l'eventualità di infezione dovuta ad un ceppo di HIV farmaco-resistente. La non aderenza alla terapia è indubbiamente fra i motivi principali per cui alcune soggetti non ne traggono i benefici desiderati.[83] Le cause possono facilmente essere ricondotte a molteplici fattori. Fra le principali tematiche psicosociali spiccano il difficoltoso accesso alle strutture mediche e il contemporaneo mantenimento della segretezza dei dati personali, ciò che rende anche più difficile l'implementazione dei supporti sociali, la presenza in non sporadici casi di una patologia psichiatrica e l'abuso di droghe. I regimi disponibili per la terapia HAART possono anche essere complessi e quindi difficili da seguire, a causa del gran numero di principi attivi da assumere frequentemente; tuttavia l'introduzione di preparazioni farmacologiche combinate di differenti principi attivi ha reso disponibili trattamenti che riducono l'assunzione di medicinali anche ad una singola somministrazione giornaliera.[84][85][86][87][88]
Trattandosi di una terapia complessa e portatrice di numerosi effetti collaterali, a fronte di progressi non riscontrabili, i principali rischio di fallimento sono legati a errori nell'assunzione dei farmaci e alla sospensione volontaria. Tra gli effetti collaterali si registrano infatti lipodistrofia, dislipidemia, diarrea, insulino-resistenza, aumento dei rischi cardiovascolari, danni a carico dell'apparato scheletrico (osteopenia/osteoporosi vuoi dovuta all'azione diretta del materiale virale, vuoi derivanti da carenza indotta di vitamina D), e una diminuzione dell'energia dell'individuo per effetti negativi sui mitocondri[89].
L'abbandono o anche la mancata assunzione di alcune dosi della terapia porta inevitabilmente allo scarseggiare degli inibitori nel plasma a livelli inferiori, facendo sì che i virus possa riprendere la replicazione virale la quale, in presenza delle dosi sub-inibenti del farmaco, porta inevitabilmente all'emergere di mutamenti resistenti: in qualsiasi momento potrebbe essere tardi per riprendere la vecchia terapia, e non è infrequente che essa debba essere sostituita. La ripresa dell'attività virale comporta le normali conseguenze nel crollo del livello dei linfociti CD4+ e nell'aumento della carica virale nel sangue, e quindi della contagiosità dell'individuo[44].
I farmaci anti-retrovirali sono costosi e la maggior parte degli individui infetti non hanno la possibilità di averne accesso, tuttavia, i costi nei paesi a basso reddito sono recentemente scesi. Inoltre, il successo del trattamento è correlato con la qualità dei servizi sanitari presenti[90].
Terapia complementare e medicina alternativa
Negli Stati Uniti, circa il 60% dei pazienti affetti da HIV, utilizza varie forme di medicina complementare o alternativa.[91] Nonostante l'uso diffuso di tali terapie, l'efficacia di esse non è stata stabilita,[92] anzi uno studio del 2005 ha concluso come siano "insufficienti" le prove "per sostenere l'uso di erbe medicinali in individui infetti da HIV e malati di AIDS".[93] L'agopuntura è stata proposta solo per il sollievo sintomatico, ma non per il trattamento o la cura per l'HIV o l'AIDS.[94]
La somministrazione supplementare di vitamine o minerali ha dimostrato benefici in alcuni studi. Dosi giornaliere di selenio sono in grado diportare benefici e essere usate come terapia aggiuntiva ai normali trattamenti antivirali,[95][96] ma non può curare l'infezione.
Vi sono alcune prove che la vitamina A nei bambini riduca la mortalità e migliori la crescita.[97] Un ampio studio effettuato in Tanzania su donne malnutrite e immunologicamente compromesse in gravidanza e in allattamento, che hanno mostrato una serie di vantaggi dall'integrazione multivitaminica quotidiana.[97] L'assunzione di micronutrienti a livelli RDA per gli adulti infettati da HIV è raccomandata dall'Organizzazione Mondiale della Sanità (OMS).[98] L'OMS precisa inoltre che numerosi studi indicano che la supplementazione di vitamina A, zinco e ferro è in grado di produrre effetti negativi sugli adulti l'HIV positivi.[98]
Prognosi

nessun dato
≤ 10
10–25
25–50
50–100
100–500
500–1000
1000–2500
2500–5000
5000–7500
7500-10000
10000-50000
≥ 50000
In molte aree del mondo, dove vi è accesso alle cure, l'AIDS è diventata una malattia cronica piuttosto che una malattia acuta mortale.[99] La prognosi varia tra le persone e sia la conta dei CD4 che la carica virale sono utili per prevedere l'esito.[100] In assenza di trattamento, la sopravvivenza media tempo dopo l'infezione da HIV è stimato a 9 a 11 anni, a seconda del sottotipo HIV.[37] Dopo la diagnosi di AIDS, se il trattamento non è disponibile, la sopravvivenza varia tra i 6 e 19 mesi.[82][101] La disponibilità di farmaci antiretrovirali e l'adeguata prevenzione dalle infezioni opportunistiche riduce il tasso di mortalità dell'80% e aumenta la speranza di vita a 20-50 anni.[99][102][103] Questo valore è di circa i due terzi[102] della popolazione generale.[104] [105] Se il trattamento viene iniziato in ritardo, la prognosi può non essere così buona, [14] per esempio, se il trattamento inizia in seguito alla diagnosi di AIDS l'aspettativa di vita sarà tra i 10 e i 40 anni.[104][99] La metà dei bambini nati con l'HIV muoiono prima dei due anni di età, se non ricevono un trattamento.[106]
Le cause principali di morte da HIV/AIDS sono le infezioni opportunistiche e i tumori, entrambi i quali sono spesso il risultato del fallimento del sistema immunitario.[107][108] Il rischio di cancro sembrano aumentare una volta che il numero dei CD4 scende al di sotto 500/uL.[104] Il tasso di progressione della malattia clinica varia notevolmente tra gli individui e ha dimostrato che possa essere influenzato da una serie di fattori, come la suscettibilità di una persona e la funzionalità immunitaria,[58] la possibilità di accesso alle cure sanitarie e la presenza di coinfezioni,[82][109] e il particolare ceppo (o ceppi) del virus coinvolti.[59][60]
La co-infezione di tubercolosi è una delle principali cause di malattia e di morte nei pazienti con HIV/AIDS ed è presente in un terzo di tutte le persone con infezione da HIV. Questa condizione ha causato il 25% delle morti correlate all'HIV.[110] L'epatite C è un altra co-infezione molto comune.[111] I due tumori più comuni associati con l'HIV/AIDS sono il sarcoma di Kaposi e il linfoma non Hodgkin.[108]
Nei pazienti sottoposti a terapia anti-retrovirale per lunghi periodi, sono stati osservati dei disturbi neurocognitivi,[112] osteoporosi,[113] neuropatie,[114] tumori,[115][116] nefropatia[114] e malattie cardiovascolari.[89] Non è chiaro se queste condizioni derivano da dall'infezione da HIV o siano effetti avversi del trattamento.
Prevenzione
Il contatto sessuale
L'uso costante del condom riduce il rischio di trasmissione dell'HIV di circa l'80% nel lungo termine.[117] Quando uno dei partner di una coppia è sieropositivo, grazie all'utilizzo del preservativo i tassi di infezione da HIV per la persona non infetta sono inferiori all'1% annuo.[118] Vi sono alcune prove che suggeriscono che il preservativo femminile possa fornire un livello di protezione equivalente.[119] L'applicazione di un gel vaginale contenente tenofovir (un inibitore della trascrittasi inversa) immediatamente prima del rapporto sessuale sembra ridurre i tassi di infezione di circa il 40%, dato rilevato in uno studio in un gruppo di donne africane.[120] Al contrario, l'uso dello spermicida nonoxynol-9 può aumentare il rischio di trasmissione a causa della sua tendenza a causare irritazione vaginale e rettale.[121]
La circoncisione nell'Africa sub-sahariana "riduce l'acquisizione del virus HIV da uomini eterosessuali in un valore compreso tra il 38% e il 66% per più di 24 mesi".[122] Sulla base di questi studi, l'Organizzazione Mondiale della Sanità e l'UNAIDS hanno consigliato, nel 2007, tale pratica per prevenire la trasmissione da donna a maschio.[123][124] Non è però dimostrato che la circoncisione maschile possa portare beneficio nei paesi sviluppati e tra gli uomini che hanno rapporti sessuali omosessuali.[125][126][127] Alcuni esperti temono che una minore percezione di vulnerabilità tra gli uomini circoncisi possa comportare una maggiore propensione a comportamenti sessuali a rischio, vanificando in tal modo gli effetti della prevenzione.[128] Le donne che hanno subito mutilazioni genitali femminili vedono un aumentato di rischio di HIV.[129]
Programmi volti a promuovere l'astinenza sessuale non sembrano influenzare positivamente il rischio di contrarre HIV.[130] Una efficace educazione sessuale scolastica può diminuire i comportamenti ad alto rischio.[131] Una minoranza consistente di giovani continua, tuttavia, sottovaluta il rischio.[132] Non è noto se il trattamento di altre infezioni a trasmissione sessuale sia efficace nel prevenire l'HIV.[133]
Profilassi post-esposizione
un ciclo di farmaci antiretrovirali somministrati entro un tempo tra le 48 e le 72 ore dopo l'esposizione a sangue sieropositivo o secrezioni genitali, viene indicato come profilassi post-esposizione.[134] L'uso della zidovudina in monoterapia riduce il rischio di una successiva infezione da HIV a seguito di una puntura di ago.[134] Il trattamento è consigliato anche dopo una violenza sessuale quando l'autore è noto per essere sieropositivo, ma non il suo utilizzo è dubbio quando lo stato di sieropositività è sconosciuto.[135] L'attuale trattamento di profilassi utilizza in genere lopinavir/ritonavir e lamivudina/zidovudina o emtricitabina/tenofovir.[134] La durata del trattamento è di quattro settimane[136] ed è spesso associato ad effetti avversi (con zidovudina in circa il 70% dei casi, tra cui nausea nel 24%, nel 22% affaticamento, sofferenza emotiva nel 13%, e cefalea nel 9%).[137]
Madre-bambino
Programmi per prevenire la trasmissione del virus HIV da madre a figlio possono ridurre i tassi di trasmissione dal 92 al 99%.[138][139] Si tratta in primo luogo dell'uso di una combinazione di farmaci antivirali durante la gravidanza e dopo la nascita del bambino, ma comprende anche l'utilizzo del biberon piuttosto che l'allattamento al seno.[138][140] Se l'alimentazione sostitutiva è accettabile, fattibile, abbordabile, sostenibile e sicura, le madri dovrebbero evitare l'allattamento al seno per i loro bambini. La somministrazione di estesa profilassi antiretrovirale al neonato diminuisce il rischio di trasmissione.[141]
Stato della ricerca
Viene generalmente ritenuto che solo un vaccino può arrestare la pandemia, poiché il suo utilizzo non richiederebbe trattamenti giornalieri e sarebbe quindi economicamente accessibile anche nei paesi in via di sviluppo. Tuttavia, anche dopo quasi 30 anni di ricerche, il vaccino per l'HIV-1 rimane un obiettivo ancora lontano.[142]
La ricerca per il miglioramento dei trattamenti consiste nel tentativo di ridurre gli effetti collaterali dei farmaci, nell'ulteriore semplificazione delle terapie farmacologiche e determinare le migliori strategie per gestire la resistenza alla terapia. Alcuni studi hanno anche suggerito di operare strategie atte a prevenire le infezioni opportunistiche. La vaccinazione contro l'epatite A e B è consigliata per i pazienti che non sono infettati con questi virus e che sono a rischio di contrarre l'infezione.[143] Ai pazienti con immunosoppressione sostanziale viene inoltre consigliata una terapia di profilassi per la polmonite da Pneumocystis carinii (PCP) e molti pazienti possono trarre beneficio da una terapia profilattica per la toxoplasmosi e per la meningite da Cryptococcus.[72]
I ricercatori della Hebrew University di Gerusalemme hanno scoperto che una combinazione di peptidi stimolano l'integrazione con l'inibitore della proteasi Ro 31-8959 che causa la morte apoptotica delle cellule infettate da HIV con lo sterminio totale del virus, ma senza danneggiare le cellule sane.[144][145] Potrebbero però passare molti anni prima che diventi disponibile un trattamento commerciale basato su questa scoperta.[146]
Le piante transgeniche che esprimono uno o più geni dei virus dell'AIDS possono rappresentare un'efficace strategia per produrre un vaccino contro questa malattia, di fatto sono state già prodotte piante che esprimono antigeni che si sono rivelate efficaci nell'indurre la sintesi di anticorpi specifici. Le piante transgeniche sono superiori rispetto ad altri metodi per produrre vaccini perché nel tempo sono più economiche e producono più antigeni[147][148]
A Berlino, in Germania, un paziente di 42 anni affetto da leucemia, Timothy Ray Brown (noto anche come il "paziente di Berlino"),[149] infettato da HIV da più di un decennio, è stato sottoposto ad un trapianto sperimentale di midollo osseo con cellule che contenevano un'insolita variante naturale della superficie cellulare del recettore CCR5. Quasi due anni dopo il trapianto, e anche dopo che il paziente ha interrotto l'assunzione di farmaci antiretrovirali, l'HIV non è stato più rilevato nel suo sangue.[150] A partire da dicembre 2010, tre anni dopo il trapianto, Brown era ancora privo di qualsiasi traccia rilevabile di HIV nel suo sangue[149]. Il suo caso resta però anedottico, per i rischi e l'alta mortalità connessi ai trapianti di cellule transplantali e per la difficoltà di trovare donatori disponibili[151].
Aspetti sociali

Fin dalla sua comparsa, l'Aids ha sollevato uno serie di problemi, tra cui anche quello sociale. Il contagio stato legato fin dalle origini con comportamenti etichettati come trasgressivi, come la promiscuità sessuale, l'omosessualità, il consumo di droghe. Nella società civile la persona che ha contratto l'infezione da HIV, prima di essere accettata come cittadino con un problema di salute, è vista innanzitutto come portatrice di una malattia ‘giudicata’. Passato l'allarme legato al dilagare dell'epidemia, le informazioni sulla malattia circolano molto meno e sono essenzialmente legate all'iniziativa delle singole persone: molti non sanno come rapportarsi con persone sieropositive, quali siano i rischi e i non-rischi, prevalendo un diffuso senso di paura verso "il diverso"[44].
Tale atteggiamento viene percepito appieno dai contagiati che sono costretti a vivere in una stretta clandestinità: le centinaia di migliaia di persone sieropositive in paesi come l'Italia di fatto non esistono. La difficoltà nel condividere con altri il proprio stato, i problemi che ne derivano, sono tra le cause di maggior sofferenza di chi è portatore del virus: tali problematiche si sono in un certo senso acuite con la cronicizzazione farmacologica della malattia, quando la scomparsa dei sintomi fisici ha messo in evidenza tutte le tematiche della malattia legate al normale vivere nella società[44].
Ipotesi alternative sull'Aids
Una piccola minoranza di autori ha messo in discussione, con argomentazioni che sono però state ripetutamente dimostrate essere prive di fondamento scientifico, biologico o clinico, la connessione tra HIV e AIDS, l'esistenza del virus, o la validità delle attuali metodologie diagnostiche. I cosiddetti "dissidenti" criticano l'attuale approccio all'AIDS basato su HIV, affermando che, a loro parere, avrebbe causato diagnosi inaccurate, trattamenti inadeguate e dispendio di fondi pubblici.
Queste considerazioni hanno ricevuto forti smentite dalla comunità medica internazionale e dall'evidenza scientifica oggettiva, dalla quale emerge come i cosiddetti "dissidenti" ignorino del tutto le chiare evidenze scientifiche sul ruolo causale dell'HIV nell'etiopatogenesi dell'AIDS, e di essere anzi loro a rappresentare, con le loro tesi indimostrate e palesemente incoerenti, una seria minaccia per la salute pubblica.
L'emergere di tali idee "negazioniste" ha portato quindi, da parte di oltre 5.000 tra medici e scienziati (tra cui 11 vincitori di Premio Nobel), alla sottoscrizione dell'importante documento noto come Dichiarazione di Durban, nel quale si afferma che il legame causale tra HIV e AIDS è chiaramente definito, esaustivo e univoco.
Le conseguenze pericolose del "negazionismo" si sono infatti manifestate in maniera lampante in Sudafrica, dove politiche sanitarie relative all'AIDS basate su un approccio negazionista, e sull'uso di inefficaci rimedi tradizionali, hanno portato a un'enorme diffusione del virus HIV: si stima che il 20% della popolazione adulta sia sieropositivo, contro il 6,1% medio dell'Africa subsahariana[152].
Note
- ^ Sepkowitz KA, AIDS—the first 20 years, in N. Engl. J. Med., vol. 344, n. 23, giugno 2001, pp. 1764–72, DOI:10.1056/NEJM200106073442306, PMID 11396444.
- ^ Weiss RA, How does HIV cause AIDS?, in Science, vol. 260, n. 5112, maggio 1993, pp. 1273–9, Bibcode:1993Sci...260.1273W, DOI:10.1126/science.8493571, PMID 8493571.
- ^ Russell Cecil, Textbook of Medicine, Philadelphia, Saunders, 1988, pp. 1523, 1799, ISBN 0721618480.
- ^ HIV and Its Transmission, su cdc.gov, Centers for Disease Control and Prevention, 2003. URL consultato il 23 maggio 2006 (archiviato dall'url originale il 4 febbraio 2005).
- ^ How HIV is spread, su sfaf.org, San Francisco AIDS Foundation, 14 aprile 2006. URL consultato il 23 maggio 2006.
- ^ a b c Kallings LO, The first postmodern pandemic: 25 years of HIV/AIDS, in J Intern Med, vol. 263, n. 3, 2008, pp. 218–43, DOI:10.1111/j.1365-2796.2007.01910.x, PMID 18205765.
- ^ AIDS epidemic update (PDF), su unaids.org, World Health Organization. URL consultato il 29 luglio 2011.
- ^ http://data.unaids.org/pub/FactSheet/2009/20091124_FS_global_en.pdf
- ^ Gao F, Origin of HIV-1 in the Chimpanzee Pan troglodytes troglodytes, in Nature, vol. 397, n. 6718, 1999, pp. 436–441, Bibcode:1999Natur.397..436G, DOI:10.1038/17130, PMID 9989410.
- ^ a b Worobey M, Direct evidence of extensive diversity of HIV-1 in Kinshasa by 1960, in Nature, vol. 455, n. 7213, ottobre 2008, pp. 661–4, Bibcode:2008Natur.455..661W, DOI:10.1038/nature07390, PMID 18833279. URL consultato il 31 marzo 2009.
- ^ Gallo RC, A reflection on HIV/AIDS research after 25 years, in Retrovirology, vol. 3, 2006, DOI:10.1186/1742-4690-3-72, PMC 1629027, PMID 17054781.
- ^ a b Palella FJ Jr, Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection. HIV Outpatient Study Investigators, in N. Engl. J. Med., vol. 338, n. 13, 1998, pp. 853–860, DOI:10.1056/NEJM199803263381301, PMID 9516219.
- ^ Gottlieb MS, Pneumocystis pneumonia—Los Angeles. 1981, in Am J Public Health, vol. 96, n. 6, 2006, pp. 980–1; discussion 982–3, PMC 1470612, PMID 16714472. URL consultato il 31 marzo 2009.
- ^ Centers for Disease Control (CDC), Persistent, generalized lymphadenopathy among homosexual males, in MMWR Morb Mortal Wkly Rep., vol. 31, n. 19, 1982, pp. 249–251, PMID 6808340. URL consultato il 31 agosto 2011.
- ^ Barré-Sinoussi F, Isolation of a T-lymphotropic retrovirus from a patient at risk for acquired immune deficiency syndrome (AIDS), in Science, vol. 220, n. 4599, 1983, pp. 868–871, Bibcode:1983Sci...220..868B, DOI:10.1126/science.6189183, PMID 6189183.
- ^ Altman LK, New homosexual disorder worries health officials, in The New York Times, 11 maggio 1982. URL consultato il 31 agosto 2011.
- ^ Making Headway Under Hellacious Circumstances (PDF), su scienceonline.org, American Association for the Advancement of Science, 28 luglio 2006. URL consultato il 23 giugno 2008.
- ^ Kher U, A Name for the Plague, in Time, 27 luglio 1982. URL consultato il 10 marzo 2008.
- ^ Centers for Disease Control (CDC), Update on acquired immune deficiency syndrome (AIDS)—United States, in MMWR Morb Mortal Wkly Rep., vol. 31, n. 37, 1982, pp. 507–508; 513–514, PMID 6815471.
- ^ Gilbert MT, Rambaut A, Wlasiuk G, Spira TJ, Pitchenik AE, Worobey M, The emergence of HIV/AIDS in the Americas and beyond, in Proc. Natl. Acad. Sci. U.S. A., vol. 104, n. 47, 2007, pp. 18566–70, Bibcode:2007PNAS..10418566G, DOI:10.1073/pnas.0705329104, PMC 2141817, PMID 17978186.
- ^ Kalish ML, Central African hunters exposed to simian immunodeficiency virus, in Emerg Infect Dis, vol. 11, n. 12, 2005, pp. 1928–30, DOI:10.3201/eid1112.050394, PMID 16485481.
- ^ P. M. Sharp, The origins of acquired immune deficiency syndrome viruses: where and when?, in Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 356, n. 1410, 2001, pp. 867–76, DOI:10.1098/rstb.2001.0863, PMC 1088480, PMID 11405934.
- ^ Marx PA, Alcabes PG, Drucker E, Serial human passage of simian immunodeficiency virus by unsterile injections and the emergence of epidemic human immunodeficiency virus in Africa, in Philos Trans R Soc Lond B Biol Sci, vol. 356, n. 1410, 2001, pp. 911–20, DOI:10.1098/rstb.2001.0867, PMC 1088484, PMID 11405938.
- ^ Amit Chitnis, Origin of HIV Type 1 in Colonial French Equatorial Africa?, in AIDS Research and Human Retroviruses, vol. 16, n. 1, 2000, pp. 5–8, DOI:10.1089/088922200309548, PMID 10628811.
- ^ João Dinis de Sousa, High GUD Incidence in the Early 20th Century Created a Particularly Permissive Time Window for the Origin and Initial Spread of Epidemic HIV Strains, in PLoS ONE, vol. 5, n. 4, 2010, pp. e9936, DOI:10.1371/journal.pone.0009936, PMC 2848574, PMID 20376191.
- ^ Donald G. McNeil, Jr., Precursor to H. I. V. Was in Monkeys for Millennia, in New York Times, 16 settembre 2010. URL consultato il 17 settembre 2010.
- ^ Anthony Eden, su nndb.com. URL consultato il 1º novembre 2011.
- ^ Brian Coleman, Thatcher the gay icon, in New Statesman, 25 giugno 2007. URL consultato il 1º novembre 2011.
- ^ BBC ON THIS DAY | 24 | 1991: Giant of rock dies, BBC News, 24 novembre 1963. URL consultato il 1º novembre 2011.
- ^ Freddie Mercury, su nndb.com. URL consultato il 1º novembre 2011.
- ^ The Independent, London, 8 febbraio 1993, http://www.independent.co.uk/news/tributes-to-arthur-ashe-1471622.html.
- ^ Curtis T, The origin of AIDS, in Rolling Stone, 1992, 54–59, 61, 106, 108. URL consultato il 10 marzo 2008.
- ^ Hooper E, The River: A Journey to the Source of HIV and AIDS, 1st, Boston, Massachusetts, Little Brown & Co, 1999, pp. 1–1070, ISBN 0-316-37261-7.
- ^ Worobey M, Origin of AIDS: contaminated polio vaccine theory refuted, in Nature, vol. 428, n. 6985, 2004, Bibcode:2004Natur.428..820W, DOI:10.1038/428820a, PMID 15103367.
- ^ Berry N, Mitochondrial DNA and retroviral RNA analyses of archival oral polio vaccine (OPV CHAT) materials: evidence of macaque nuclear sequences confirms substrate identity, in Vaccine, vol. 23, n. 14, 2005, pp. 1639–1648, DOI:10.1016/j.vaccine.2004.10.038, PMID 15705467.
- ^ Oral Polio Vaccine and HIV / AIDS: Questions and Answers, su cdc.gov, Centers for Disease Control and Prevention, 23 marzo 2004. URL consultato il 20 novembre 2006.
- ^ a b c d e f UNAIDS, WHO, 2007 AIDS epidemic update (PDF), su data.unaids.org, dicembre 2007. URL consultato il 12 marzo 2008. Errore nelle note: Tag
<ref>non valido; il nome "UNAIDS2007" è stato definito più volte con contenuti diversi - ^ McNeil DG Jr, U. N. agency to say it overstated extent of H. I. V. cases by millions, in New York Times, 20 novembre 2007. URL consultato il 18 marzo 2008.
- ^ Report: Black U.S. AIDS rates rival some African nations
- ^ "DTL&feed=rss. news_politics White House summit on AIDS' impact on black men[collegamento interrotto]". San Francisco Chronicle. June 3, 2010.
- ^ a b Annual Report 2005 - Revised Edition June 2007.fm
- ^ "Obama Ends U.S. Travel Ban On Visitors, Immigrants With HIV-AIDS". ABC News. October 30, 2009.
- ^ (EN) HIV and AIDS in Russia, Eastern Europe & Central Asia, su avert.org. URL consultato il 20 maggio 2012.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar AIDS nel "Libro dell'anno (2007)" su Treccani.it
- ^ Ministero della Salute, Hiv e Aids - Come si trasmette il virus, su salute.gov.it. URL consultato il 1º dicembre 2011.
- ^ Hiv: la circoncisione riduce il rischio
- ^ a b c d Come si può contrarre HIV Forum LILA.
- ^ Universo del corpo (1999)] su Treccani.it.
- ^ Trasmissione dell'HIV LILA Piacenza.
- ^ a b c Forum LILA
- ^ a b c Ministero della Salute, Hiv e Aids - Come non si trasmette il virus, su salute.gov.it. URL consultato il 1º dicembre 2011.
- ^ Ministero della Salute, Prevenzione e controlli - Promozione della salute - AIDS - Faq, su salute.gov.it. URL consultato il 1º dicembre 2011.
- ^ Iqbal MM., Can we get AIDS from mosquito bites?, in J La State Med Soc., vol. 151, agosto 1999.
- ^ Mazloomy SS, Baghianimoghadam MH., Knowledge and attitude about HIV/ AIDS of schoolteachers in Yazd, Islamic Republic of Iran., in East Mediterr Health J., vol. 14, marzo-aprile 2008, pp. 292-297..
- ^ [http://www.treccani.it/enciclopedia/aids_%28Universo-del-Corpo%29/ Universo del corpo (1999), su Treccani.it.
- ^ Clerici M, Type 1 cytokine production and low prevalence of viral isolation correlate with long-term non progression in HIV infection, in AIDS Res. Hum. Retroviruses., vol. 12, n. 11, 1996, pp. 1053–1061, DOI:10.1089/aid.1996.12.1053, PMID 8827221.
- ^ Morgan D, Mahe C, Mayanja B, Whitworth JA, Progression to symptomatic disease in people infected with HIV-1 in rural Uganda: prospective cohort study, in BMJ, vol. 324, n. 7331, 2002, pp. 193–196, DOI:10.1136/bmj.324.7331.193, PMC 64788, PMID 11809639.
- ^ a b Tang J, Kaslow RA, The impact of host genetics on HIV infection and disease progression in the era of highly active antiretroviral therapy, in AIDS, vol. 17, Suppl 4, 2003, pp. S51–S60, DOI:10.1097/00002030-200317004-00006, PMID 15080180. Errore nelle note: Tag
<ref>non valido; il nome "Tang" è stato definito più volte con contenuti diversi - ^ a b Campbell GR, The glutamine-rich region of the HIV-1 Tat protein is involved in T-cell apoptosis, in J. Biol. Chem., vol. 279, n. 46, 2004, pp. 48197–48204, DOI:10.1074/jbc.M406195200, PMID 15331610. Errore nelle note: Tag
<ref>non valido; il nome "Campbell" è stato definito più volte con contenuti diversi - ^ a b Campbell GR, Watkins JD, Esquieu D, Pasquier E, Loret EP, Spector SA, The C terminus of HIV-1 Tat modulates the extent of CD178-mediated apoptosis of T cells, in J. Biol. Chem., vol. 280, n. 46, 2005, pp. 38376–39382, DOI:10.1074/jbc.M506630200, PMID 16155003. Errore nelle note: Tag
<ref>non valido; il nome "Campbell2" è stato definito più volte con contenuti diversi - ^ Senkaali D, Muwonge R, Morgan D, Yirrell D, Whitworth J, Kaleebu P, The relationship between HIV type 1 disease progression and V3 serotype in a rural Ugandan cohort, in AIDS Res. Hum. Retroviruses., vol. 20, n. 9, 2005, pp. 932–937, DOI:10.1089/aid.2004.20.932, PMID 15585080.
- ^ Guss, 1994a; 1994b
- ^ Nell'era della HAART aspettativa di vita maggiore di 30 anni, 29 gennaio 2010
- ^ (EN) HAART increases HIV-positive people's life expectancy by average of 13 years, 29 luglio 2008. L'articolo stima in 43 anni l'aspettativa di vita.
- ^ World Health Organization, Interim proposal for a WHO staging system for HIV infection and disease, in WHO Wkly Epidem. Rec., vol. 65, n. 29, 1990, pp. 221–228, PMID 1974812.
- ^ 1993 Revised Classification System for HIV Infection and Expanded Surveillance Case Definition for AIDS Among Adolescents and Adults, su cdc.gov, CDC, 1992. URL consultato il 9 febbraio 2006.
- ^ a b Kumaranayake L, Watts C, Resource allocation and priority setting of HIV/AIDS interventions: addressing the generalized epidemic in sub-Saharan Africa, in J. Int. Dev., vol. 13, n. 4, 2001, pp. 451–466, DOI:10.1002/jid.798.
- ^ Weber B, Screening of HIV infection: role of molecular and immunological assays, in Expert Rev. Mol. Diagn., vol. 6, n. 3, 2006, pp. 399–411, DOI:10.1586/14737159.6.3.399, PMID 16706742.
- ^ eMedicine – HIV Infection (Pediatrics: General Medicine), su medscape.com. URL consultato il 1º novembre 2011.
- ^ Tóth FD, Bácsi A, Beck Z, Szabó J, Vertical transmission of human immunodeficiency virus, in Acta Microbiol Immunol Hung, vol. 48, 3–4, 2001, pp. 413–27, DOI:10.1556/AMicr.48.2001.3-4.10, PMID 11791341.
- ^ Hamlyn E, Easterbrook P, Occupational exposure to HIV and the use of post-exposure prophylaxis, in Occup Med (Lond), vol. 57, n. 5, agosto 2007, pp. 329–36, DOI:10.1093/occmed/kqm046, PMID 17656498.
- ^ a b A Pocket Guide to Adult HIV/AIDS Treatment February 2006 edition, su hab.hrsa.gov, Department of Health and Human Services, febbraio 2006. URL consultato il 1º settembre 2006.[collegamento interrotto] Errore nelle note: Tag
<ref>non valido; il nome "PEPpocketguide" è stato definito più volte con contenuti diversi - ^ Guidelines for the Use of Antiretroviral Agents in Pediatric HIV Infection (PDF), su aidsinfo.nih.gov, Department of Health and Human Services Working Group on Antiretroviral Therapy and Medical Management of HIV-Infected Children, 3 novembre 2005. URL consultato il 17 gennaio 2006.
- ^ Guidelines for the Use of Antiretroviral Agents in HIV-1-Infected Adults and Adolescents (PDF), su aidsinfo.nih.gov, Department of Health and Human Services Panel on Clinical Practices for Treatment of HIV Infection, 6 ottobre 2005. URL consultato il 17 gennaio 2006.
- ^ (EN) When is the best time to start antiretroviral therapy in people with HIV infection, who have not received antiretroviral treatment before and who do not have any symptoms of HIV illness?, DOI:10.1002/14651858.CD008272.pub2.
- ^ Martinez-Picado J, Antiretroviral resistance during successful therapy of human immunodeficiency virus type 1 infection, in Proc. Natl. Acad. Sci. U.S. A., vol. 97, n. 20, 2000, pp. 10948–10953, Bibcode:2000PNAS...9710948M, DOI:10.1073/pnas.97.20.10948, PMC 27129, PMID 11005867.
- ^ Dybul M, Fauci AS, Bartlett JG, Kaplan JE, Pau AK; Panel on Clinical Practices for Treatment of HIV., Guidelines for using antiretroviral agents among HIV-infected adults and adolescents, in Ann. Intern. Med., vol. 137, 5 Pt 2, 2002, pp. 381–433, PMID 12617573.
- ^ Blankson JN, Persaud D, Siliciano RF, The challenge of viral reservoirs in HIV-1 infection, in Annu. Rev. Med., vol. 53, 2002, pp. 557–593, DOI:10.1146/annurev.med.53.082901.104024, PMID 11818490.
- ^ Palella FJ, Delaney KM, Moorman AC, Loveless MO, Fuhrer J, Satten GA, Aschman DJ, Holmberg SD, Declining morbidity and mortality among patients with advanced human immunodeficiency virus infection, in N. Engl. J. Med., vol. 338, n. 13, 1998, pp. 853–860, DOI:10.1056/NEJM199803263381301, PMID 9516219.
- ^ Wood E, Hogg RS, Yip B, Harrigan PR, O'Shaughnessy MV, Montaner JS, Is there a baseline CD4 cell count that precludes a survival response to modern antiretroviral therapy?, in AIDS, vol. 17, n. 5, 2003, pp. 711–720, DOI:10.1097/00002030-200303280-00009, PMID 12646794.
- ^ Chene G, Sterne JA, May M, Costagliola D, Ledergerber B, Phillips AN, Dabis F, Lundgren J, D'Arminio Monforte A, de Wolf F, Hogg R, Reiss P, Justice A, Leport C, Staszewski S, Gill J, Fatkenheuer G, Egger ME and the Antiretroviral Therapy Cohort Collaboration, Prognostic importance of initial response in HIV-1 infected patients starting potent antiretroviral therapy: analysis of prospective studies, in Lancet, vol. 362, n. 9385, 2003, pp. 679–686, DOI:10.1016/S0140-6736(03)14229-8, PMID 12957089.
- ^ a b c Morgan D, Mahe C, Mayanja B, Okongo JM, Lubega R, Whitworth JA, HIV-1 infection in rural Africa: is there a difference in median time to AIDS and survival compared with that in industrialized countries?, in AIDS, vol. 16, n. 4, 2002, pp. 597–632, DOI:10.1097/00002030-200203080-00011.
- ^ Becker SL, Dezii CM, Burtcel B, Kawabata H, Hodder S., Young HIV-infected adults are at greater risk for medication nonadherence, in MedGenMed., vol. 4, n. 3, 2002, PMID 12466764.
- ^ M. Crespo, E. Ribera, I. Suarez-Lozano, P. Domingo, E. Pedrol, J. Lopez-Aldeguer, Effectiveness and safety of didanosine, lamivudine and efavirenz versus zidovudine, lamivudine and efavirenz for the initial treatment of HIV-infected patients from the Spanish VACH cohort, in Journal of Antimicrobial Chemotherapy, vol. 63, n. 1, 2008, pp. 189–196, DOI:10.1093/jac/dkn450. URL consultato il 17 luglio 2012.
- ^ Javier Ena, Francisco Pasquau, Once‐a‐Day Highly Active Antiretroviral Therapy: A Systematic Review, in Clinical Infectious Diseases, vol. 36, n. 9, 2003, pp. 1186–1190, DOI:10.1086/374602. URL consultato il 17 luglio 2012.
- ^ Nieuwkerk P, Sprangers M, Burger D, Hoetelmans RM, Hugen PW, Danner SA, van Der Ende ME, Schneider MM, Schrey G, Meenhorst PL, Sprenger HG, Kauffmann RH, Jambroes M, Chesney MA, de Wolf F, Lange JM and the ATHENA Project, Limited Patient Adherence to Highly Active Antiretroviral Therapy for HIV-1 Infection in an Observational Cohort Study, in Arch. Intern. Med., vol. 161, n. 16, 2001, pp. 1962–1968, DOI:10.1001/archinte.161.16.1962, PMID 11525698.
- ^ Kleeberger C, Phair J, Strathdee S, Detels R, Kingsley L, Jacobson LP, Determinants of Heterogeneous Adherence to HIV-Antiretroviral Therapies in the Multicenter AIDS Cohort Study, in J. Acquir. Immune Defic. Syndr., vol. 26, n. 1, 2001, pp. 82–92, PMID 11176272.
- ^ Heath KV, Singer J, O'Shaughnessy MV, Montaner JS, Hogg RS, Intentional Nonadherence Due to Adverse Symptoms Associated With Antiretroviral Therapy, in J. Acquir. Immune Defic. Syndr., vol. 31, n. 2, 2002, pp. 211–217, DOI:10.1097/00126334-200210010-00012, PMID 12394800.
- ^ a b Burgoyne RW, Tan DH, Prolongation and quality of life for HIV-infected adults treated with highly active antiretroviral therapy (HAART): a balancing act, in J. Antimicrob. Chemother., vol. 61, n. 3, marzo 2008, pp. 469–73, DOI:10.1093/jac/dkm499, PMID 18174196.
- ^ PMID 20390475
- ^ Littlewood RA, Vanable PA, Complementary and alternative medicine use among HIV-positive people: research synthesis and implications for HIV care, in AIDS Care, vol. 20, n. 8, settembre 2008, pp. 1002–18, DOI:10.1080/09540120701767216, PMC 2570227, PMID 18608078.
- ^ Mills E, Wu P, Ernst E, Complementary therapies for the treatment of HIV: in search of the evidence, in Int J STD AIDS, vol. 16, n. 6, giugno 2005, pp. 395–403, DOI:10.1258/0956462054093962, PMID 15969772.
- ^ Liu JP, Manheimer E, Yang M, Herbal medicines for treating HIV infection and AIDS, in Cochrane Database Syst Rev, n. 3, 2005, pp. CD003937, DOI:10.1002/14651858.CD003937.pub2, PMID 16034917.
- ^ Nicholas PK, Symptom management and self-care for peripheral neuropathy in HIV/AIDS, in AIDS Care, vol. 19, n. 2, febbraio 2007, pp. 179–89, DOI:10.1080/09540120600971083, PMID 17364396.
- ^ Hurwitz BE, Suppression of human immunodeficiency virus type 1 viral load with selenium supplementation: a randomized controlled trial, in Arch. Intern. Med., vol. 167, n. 2, January 2007, pp. 148–54, DOI:10.1001/archinte.167.2.148, PMID 17242315.
- ^ Gerhard N. Schrauzer, Juliane Sacher, Selenium in the maintenance and therapy of HIV-infected patients, in Chemico-Biological Interactions, vol. 91, 2–3, 1994, pp. 199–205, DOI:10.1016/0009-2797(94)90040-X, PMID 7514960. URL consultato il 20110918.
- ^ a b Irlam JH, Visser ME, Rollins N, Siegfried N, Micronutrient supplementation in children and adults with HIV infection, in Cochrane Database Syst Rev, n. 4, 2005, pp. CD003650, DOI:10.1002/14651858.CD003650.pub2, PMID 16235333.
- ^ a b World Health Organization, Nutrient requirements for people living with HIV/AIDS: Report of a technical consultation (PDF), Geneva, 2003-05, ISBN. URL consultato il 31 marzo 2009.
- ^ a b c Knoll B, Lassmann B, Temesgen Z, Current status of HIV infection: a review for non-HIV-treating physicians, in Int J Dermatol, vol. 46, n. 12, 2007, pp. 1219–28, DOI:10.1111/j.1365-4632.2007.03520.x.
- ^ Mandell, Bennett, and Dolan (2010). Chapter 118.
- ^ Zwahlen M, Egger M, Progression and mortality of untreated HIV-positive individuals living in resource-limited settings: update of literature review and evidence synthesis (PDF), 2006. URL consultato il March 19, 2008.
- ^ a b Antiretroviral Therapy Cohort Collaboration, Life expectancy of individuals on combination antiretroviral therapy in high-income countries: a collaborative analysis of 14 cohort studies, in Lancet, vol. 372, n. 9635, 2008, pp. 293–9, DOI:10.1016/S0140-6736(08)61113-7.
- ^ Schackman BR, Gebo KA, Walensky RP, Losina E, Muccio T, Sax PE, Weinstein MC, Seage GR 3rd, Moore RD, Freedberg KA., The lifetime cost of current HIV care in the United States, in Med Care, vol. 44, n. 11, 2006, pp. 990–997, DOI:10.1097/01.mlr.0000228021.89490.2a.
- ^ a b c M Vogel, Schwarze-Zander, C; Wasmuth, JC; Spengler, U; Sauerbruch, T; Rockstroh, JK, The treatment of patients with HIV, in Deutsches Ärzteblatt international, vol. 107, 28–29, 2010 Jul, pp. 507–15; quiz 516, DOI:10.3238/arztebl.2010.0507.
- ^ AI van Sighem, Gras, LA; Reiss, P; Brinkman, K; de Wolf, F; ATHENA national observational cohort, study, Life expectancy of recently diagnosed asymptomatic HIV-infected patients approaches that of uninfected individuals, in AIDS (London, England), vol. 24, n. 10, 19 giugno 2010, pp. 1527–35, DOI:10.1097/QAD.0b013e32833a3946.
- ^ UNAIDS 2011 pg. 60–70
- ^ [edited by] Blaine T. Smith, Concepts in immunology and immunotherapeutics, 4th, Bethesda, Md., American Society of Health-System Pharmacists, 2008, p. 143, ISBN 978-1-58528-127-5.
- ^ a b MC Cheung, Pantanowitz, L; Dezube, BJ, AIDS-related malignancies: emerging challenges in the era of highly active antiretroviral therapy, in The oncologist, vol. 10, n. 6, 2005 Jun–Jul, pp. 412–26, DOI:10.1634/theoncologist.10-6-412.
- ^ Lawn SD, AIDS in Africa: the impact of co-infections on the pathogenesis of HIV-1 infection, in J. Infect. Dis., vol. 48, n. 1, 2004, pp. 1–12, DOI:10.1016/j.jinf.2003.09.001.
- ^ Tuberculosis, in Fact sheet 104, World Health Organization, March 2012. URL consultato il August 29, 2012.
- ^ Editors, Raphael Rubin, M.D., Professor of Pathology, David S. Strayer, M.D., Ph.D., Professor of Pathology, Department of Pathology and Cell Biology, Jefferson Medical College of Thomas Jefferson University Philadelphia, Pennsylvania ; Founder and Consulting Editor, Emanuel Rubin, M.D., Gonzalo Aponte Distinguished Professor of Pathology, Chairman Emeritus of the Department of Pathology and Cell Biology, Jefferson Medical College of Thomas Jefferson University, Philadelphia, Pennsylvania, Rubin's pathology : clinicopathologic foundations of medicine, Sixth, Philadelphia, Wolters Kluwer Health/Lippincott Williams & Wilkins, 2011, p. 154, ISBN 978-1-60547-968-2.
- ^ PMID 19462243
- ^ PMID 17086056
- ^ a b PMID 19106702
- ^ Boshoff C, Weiss R, AIDS-related malignancies, in Nat. Rev. Cancer, vol. 2, n. 5, 2002, pp. 373–382, DOI:10.1038/nrc797.
- ^ Yarchoan R, Tosato G, Little RF, Therapy insight: AIDS-related malignancies – the influence of antiviral therapy on pathogenesis and management, in Nat. Clin. Pract. Oncol., vol. 2, n. 8, 2005, pp. 406–415, DOI:10.1038/ncponc0253.
- ^ R Crosby, Bounse, S, Condom effectiveness: where are we now?, in Sexual health, vol. 9, n. 1, 2012 Mar, pp. 10–7, DOI:10.1071/SH11036.
- ^ Condom Facts and Figures, su wpro.who.int, WHO, August 2003. URL consultato il January 17, 2006.
- ^ MF Gallo, Kilbourne-Brook, M; Coffey, PS, A review of the effectiveness and acceptability of the female condom for dual protection, in Sexual health, vol. 9, n. 1, 2012 Mar, pp. 18–26, DOI:10.1071/SH11037.
- ^ C Celum, Baeten, JM, Tenofovir-based pre-exposure prophylaxis for HIV prevention: evolving evidence, in Current opinion in infectious diseases, vol. 25, n. 1, 2012 Feb, pp. 51–7, DOI:10.1097/QCO.0b013e32834ef5ef.
- ^ M Baptista, Ramalho-Santos, J, Spermicides, microbicides and antiviral agents: recent advances in the development of novel multi-functional compounds, in Mini reviews in medicinal chemistry, vol. 9, n. 13, 1º novembre 2009, pp. 1556–67, DOI:10.2174/138955709790361548.
- ^ N Siegfried, Muller, M; Deeks, JJ; Volmink, J, Male circumcision for prevention of heterosexual acquisition of HIV in men, in Cochrane database of systematic reviews (Online), n. 2, 15 aprile 2009, pp. CD003362, DOI:10.1002/14651858.CD003362.pub2.
- ^ WHO and UNAIDS announce recommendations from expert consultation on male circumcision for HIV prevention, su who.int, World Health Organization, Mar 28, 2007.
- ^ N Larke, Male circumcision, HIV and sexually transmitted infections: a review, in British journal of nursing (Mark Allen Publishing), vol. 19, n. 10, 2010 May 27 – Jun 9, pp. 629–34.
- ^ HH Kim, Li, PS, Goldstein, M, Male circumcision: Africa and beyond?, in Current opinion in urology, vol. 20, n. 6, 2010 Nov, pp. 515–9, DOI:10.1097/MOU.0b013e32833f1b21.
- ^ DJ Templeton, Millett, GA, Grulich, AE, Male circumcision to reduce the risk of HIV and sexually transmitted infections among men who have sex with men, in Current opinion in infectious diseases, vol. 23, n. 1, 2010 Feb, pp. 45–52, DOI:10.1097/QCO.0b013e328334e54d.
- ^ Male circumcision for prevention of homosexual acquisition of HIV in men, in Cochrane Database Syst Rev, n. 6, 2011, pp. CD007496, DOI:10.1002/14651858.CD007496.pub2.
- ^ Eaton LA, Kalichman S, Risk compensation in HIV prevention: implications for vaccines, microbicides, and other biomedical HIV prevention technologies, in Curr HIV/AIDS Rep, vol. 4, n. 4, December 2007, pp. 165–72, DOI:10.1007/s11904-007-0024-7.
- ^ Utz-Billing I, Kentenich H, Female genital mutilation: an injury, physical and mental harm, in J Psychosom Obstet Gynaecol, vol. 29, n. 4, December 2008, pp. 225–9, DOI:10.1080/01674820802547087.
- ^ Underhill K, Operario D, Montgomery P, Abstinence-only programs for HIV infection prevention in high-income countries, in Cochrane Database of Systematic Reviews, n. 4, 2008, pp. CD005421, DOI:10.1002/14651858.CD005421.pub2.
- ^ MV Tolli, Effectiveness of peer education interventions for HIV prevention, adolescent pregnancy prevention and sexual health promotion for young people: a systematic review of European studies, in Health education research, 28 maggio 2012, DOI:10.1093/her/cys055.
- ^ Patel VL, Yoskowitz NA, Kaufman DR, Shortliffe EH, Discerning patterns of human immunodeficiency virus risk in healthy young adults, in Am J Med, vol. 121, n. 4, 2008, pp. 758–764, DOI:10.1016/j.amjmed.2008.04.022.
- ^ BE Ng, Butler, LM; Horvath, T; Rutherford, GW, Population-based biomedical sexually transmitted infection control interventions for reducing HIV infection, in Cochrane database of systematic reviews (Online), n. 3, 16 marzo 2011, pp. CD001220, DOI:10.1002/14651858.CD001220.pub3.
- ^ a b c HIV exposure through contact with body fluids, in Prescrire Int, vol. 21, n. 126, April 2012, pp. 100–1, 103–5.
- ^ JA Linden, Clinical practice. Care of the adult patient after sexual assault, in The New England Journal of Medicine, vol. 365, n. 9, 1º settembre 2011, pp. 834–41, DOI:10.1056/NEJMcp1102869.
- ^ TN Young, Arens, FJ; Kennedy, GE; Laurie, JW; Rutherford, G, Antiretroviral post-exposure prophylaxis (PEP) for occupational HIV exposure, in Cochrane database of systematic reviews (Online), n. 1, 24 gennaio 2007, pp. CD002835, DOI:10.1002/14651858.CD002835.pub3.
- ^ C Kripke, Antiretroviral prophylaxis for occupational exposure to HIV, in American family physician, vol. 76, n. 3, 1º agosto 2007, pp. 375–6.
- ^ a b A Coutsoudis, Kwaan, L; Thomson, M, Prevention of vertical transmission of HIV-1 in resource-limited settings, in Expert review of anti-infective therapy, vol. 8, n. 10, 2010 Oct, pp. 1163–75, DOI:10.1586/eri.10.94.
- ^ AE Kurth, Celum, C; Baeten, JM; Vermund, SH; Wasserheit, JN, Combination HIV prevention: significance, challenges, and opportunities, in Current HIV/AIDS reports, vol. 8, n. 1, 2011 Mar, pp. 62–72, DOI:10.1007/s11904-010-0063-3.
- ^ N Siegfried, van der Merwe, L; Brocklehurst, P; Sint, TT, Antiretrovirals for reducing the risk of mother-to-child transmission of HIV infection, in Cochrane database of systematic reviews (Online), n. 7, 6 luglio 2011, pp. CD003510, DOI:10.1002/14651858.CD003510.pub3.
- ^ T Horvath, Madi, BC; Iuppa, IM; Kennedy, GE; Rutherford, G; Read, JS, Interventions for preventing late postnatal mother-to-child transmission of HIV, in Cochrane database of systematic reviews (Online), n. 1, 21 gennaio 2009, pp. CD006734, DOI:10.1002/14651858.CD006734.pub2.
- ^ Karlsson Hedestam GB, Fouchier RA, Phogat S, Burton DR, Sodroski J, Wyatt RT, The challenges of eliciting neutralizing antibodies to HIV-1 and to influenza virus, in Nat. Rev. Microbiol., vol. 6, n. 2, febbraio 2008, pp. 143–55, DOI:10.1038/nrmicro1819, PMID 18197170.
- ^ Laurence J, Hepatitis A and B virus immunization in HIV-infected persons, in AIDS Reader, vol. 16, n. 1, 2006, pp. 15–17, PMID 16433468.
- ^ Dan Even, Hebrew U. researchers develop treatment to kill HIV cells, 3 settembre 2010. URL consultato l'11 ottobre 2010.
- ^ Aviad Levin, Hayouka, Zvi; Friedler, Assaf; Loyter; Abraham, Specific eradication of HIV-1 from infected cultured cells, in AIDS Research and Therapy, vol. 7, n. 31, 19 agosto 2010, DOI:10.1186/1742-6405-7-31, PMC 2933580, PMID 20723214. URL consultato l'11 ottobre 2010.
- ^ Abigail Klein Leichman, org/201010038374/health/on-the-hiv-warpath On the HIV warpath, 7 ottobre 2010. URL consultato l'11 ottobre 2010.
- ^ Plant-based anti-HIV-1 strategies: vacci... [Expert Rev Vaccines. 2010] - PubMed - NCBI
- ^ Is there a role for plant-made vaccines in... [Immunol Cell Biol. 2005] - PubMed - NCBI
- ^ a b German HIV patient cured after stem cell transplant, 15 dicembre 2010. URL consultato il 15 dicembre 2010.
- ^ Mark Schoofs, A Doctor, a Mutation and a Potential Cure for AIDS: A Bone Marrow Transplant to Treat a Leukemia Patient Also Gives Him Virus-Resistant Cells; Many Thanks, Sample 61, in Wall Street Journal, novembre 2008. URL consultato il 12 novembre 2008.
- ^ Not an HIV Cure, but Encouraging New Directions
- ^ UNAIDS: 2006 Report on the global AIDS epidemic
Bibliografia
- Schneider, M. F., Gange, S. J., Williams, C. M., Anastos, K., Greenblatt, R. M., Kingsley, L., Detels, R., Munoz, A. (2005) Patterns of the hazard of death after AIDS through the evolution of antiretroviral therapy: 1984-2004. AIDS 19, 2009-2018 PMID 16260908
- Saitoh A, Hull AD, Franklin P, Spector SA. (2005) Myelomeningocele in an infant with intrauterine exposure to efavirenz. J Perinatol. 25, 555-556 PMID 16047034
- Dybul M, Fauci AS, Bartlett JG, Kaplan JE, Pau AK; Panel on Clinical Practices for Treatment of HIV. (2002) Guidelines for using antiretroviral agents among HIV-infected adults and adolescents. Ann Intern Med. 137, 381-433 PMID 12617573
- Guss, D. A. (1994a) The acquired immune deficiency syndrome: an overview for the emergency physician, Part 1. J. Emerg. Med. 12, 375-384 PMID 8040596
- Guss, D. A. (1994b) The acquired immune deficiency syndrome: an overview for the emergency physician, Part 2. J. Emerg. Med. 12, 491-497 PMID 7963396
- Holmes, C. B., Losina, E., Walensky, R. P., Yazdanpanah, Y., Freedberg, K. A. (2003) Review of human immunodeficiency virus type 1-related opportunistic infections in sub-Saharan Africa. Clin Infect Dis. 36 656-662 PMID 12594648
- Morgan, D., Mahe, C., Mayanja, B. and Whitworth, J. A. (2002a) Progression to symptomatic disease in people infected with HIV-1 in rural Uganda: prospective cohort study. BMJ 324, 193-196 PMID 11809639
- Morgan, D., Mahe, C., Mayanja, B., Okongo, J. M., Lubega, R. and Whitworth, J. A. (2002b) HIV-1 infection in rural Africa: is there a difference in median time to AIDS and survival compared with that in industrialized countries? AIDS 16, 597-6032 PMID 11873003
- Lawn, S. D. (2004) AIDS in Africa: the impact of coinfections on the pathogenesis of HIV-1 infection. J. Infect.Dis. 48, 1-12 PMID 14667787
- Montessori, V., Press, N., Harris, M., Akagi, L., Montaner, J. S. (2004) Adverse effects of antiretroviral therapy for HIV infection. CMAJ 170, 229-238 PMID 14734438
- Clerici, M., Balotta, C., Meroni, L., Ferrario, E., Riva, C., Trabattoni, D., Ridolfo, A., Villa, M., Shearer, G.M., Moroni, M. and Galli, M. (1996) Type 1 cytokine production and low prevalence of viral isolation correlate with long-term non progression in HIV infection. AIDS Res. Hum. Retroviruses. 12, 1053-1061 PMID 8827221
Voci correlate
- Storia dell'epidemia di HIV/AIDS
- Diffusione dell'HIV in Africa
- Aids e cinema
- AZT
- FightAIDS@Home
- Giornata mondiale contro l'Aids
- HIV
- NAMES Project AIDS Memorial Quilt
- The Mercury Phoenix Trust
- Nastro rosso
- Sieropositività
- Sindrome
- Test HIV
- Profilassi post-esposizione ad HIV
- Ryan White
- Freddie Mercury
- Rock Hudson
- Keith Haring
- Orfano da AIDS
- HLA-B
Altri progetti
 Wikiquote contiene citazioni sull'AIDS
Wikiquote contiene citazioni sull'AIDS Wikizionario contiene il lemma di dizionario «AIDS»
Wikizionario contiene il lemma di dizionario «AIDS» Wikinotizie contiene notizie di attualità su AIDS
Wikinotizie contiene notizie di attualità su AIDS Wikimedia Commons contiene immagini o altri file sull'AIDS
Wikimedia Commons contiene immagini o altri file sull'AIDS
Collegamenti esterni
- Centro Operativo AIDS (Istituto Superiore di Sanità)
- Dati Aids in Italia 2011
- Aids su Treccani.it
- Domande e risposte relative all'infezione da HIV e all'AIDS: documento sui contenuti scientifici, promosso e finanziato dal Ministero del Lavoro, della Salute e delle Politiche Sociali con responsabilità scientifica e coordinamento dell'Istituto Superiore di Sanità.
- Template:Dmoz
Template:Link AdQ Template:Link AdQ Template:Link AdQ Template:Link AdQ Template:Link AdQ Template:Link AdQ Template:Link VdQ Template:Link AdQ Template:Link VdQ