Tetrossido di diazoto
| Tetrossido di diazoto | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| tetrossido di diazoto anidride nitroso-nitrica ipoazotide DNTO | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2O4 |
| Massa molecolare (u) | 92,01 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 234-126-4 |
| PubChem | 25352 |
| SMILES | [N+](=O)([N+](=O)[O-])[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,443 (liquido, 21 °C) |
| Solubilità in acqua | reagisce |
| Temperatura di fusione | −11,2 °C (11,8 °F) |
| Temperatura di ebollizione | 21,1 °C (70,0 °F) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 270 - 280 - 330 - 314 - EUH071 |
| Consigli P | 220 - 244 - 260 - 280 - 303+361+353+315 - 304+340+315 - 305+351+338+315 - 370+376 - 403 - 405 [1] |
Il tetrossido di diazoto o tetrossido di azoto (NTO), formula chimica N2O4, è un composto chimico dell'azoto. È un dimero del biossido di azoto. Allo stato gassoso è incolore e si decompone a biossido di azoto, che a sua volta si aggrega a tetrossido, formando così una miscela in equilibrio.
Il tetrossido di diazoto si trova allo stato liquido a temperature comprese tra −11 e +21 °C; ha un basso punto di ebollizione (+21,1 °C), pertanto deve essere conservato e trasportato sotto pressione; la sua massa molare è di ed è un forte ossidante. Si ottiene come prodotto intermedio nella produzione di acido nitrico.
Il tetrossido di diazoto è frequentemente utilizzato come sostanza ossidante nei sistemi di propulsione di razzi e veicoli spaziali, solitamente in combinazione con idrazina o suoi derivati.
Struttura e proprietà
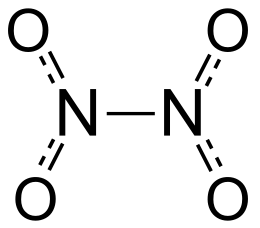
[modifica | modifica wikitesto]Il tetrossido di diazoto potrebbe essere considerato come due gruppi nitro () legati insieme; forma una miscela di equilibrio con il diossido di azoto (NO2).[2] La molecola è piana con una distanza di legame di 1,78 Å (dove Å sta per Ångström) e distanze di 1,19 Å . La distanza corrisponde a un legame debole, poiché è significativamente più lunga della lunghezza media del singolo legame di 1,45 Å.[3] Questo legame σ eccezionalmente debole (che equivale alla sovrapposizione degli orbitali ibridi delle due unità NO2[4]) deriva dalla simultanea delocalizzazione della coppia di elettroni di legame attraverso l'intera molecola di N2O4 e dalla notevole repulsione elettrostatica degli orbitali molecolari doppiamente occupati di ogni unità NO2.[5]
A differenza del diossido di azoto, il tetrossido di azoto è diamagnetico poiché non ha elettroni spaiati.[6] Il liquido è incolore, ma può presentarsi con una colorazione giallo-brunastra per la presenza di NO2 secondo il seguente equilibrio:
Temperature più elevate spingono l'equilibrio verso il biossido di azoto. Inevitabilmente, una certa percentuale di tetrossido di diazoto è un componente dello smog, che contiene biossido di azoto.
Produzione
[modifica | modifica wikitesto]Il tetrossido di azoto si ottiene per ossidazione catalitica dell'ammoniaca (NH3): il vapore viene utilizzato come diluente per ridurre la temperatura di combustione. Nella prima fase, l'ammoniaca viene ossidata in ossido nitrico (NO):
- .
La maggior parte dell'acqua viene condensata e i gas vengono ulteriormente raffreddati; l'ossido nitrico, prodotto nella reazione, viene ossidato in biossido di azoto, che viene poi dimerizzato in tetrossido di azoto:
- ,
e il resto dell'acqua viene rimossa come acido nitrico. Il gas è essenzialmente biossido di azoto puro, che viene condensato in tetrossido di diazoto in un liquefattore raffreddato con acqua salata (salamoia).
Il tetrossido di diazoto può anche essere prodotto attraverso la reazione di acido nitrico concentrato e rame metallico. Questa sintesi è più pratica in un ambiente di laboratorio ed è comunemente usata come dimostrazione o esperimento nei laboratori di chimica universitari. L'ossidazione del rame da parte dell'acido nitrico è una reazione complessa: forma vari ossidi di azoto di varia stabilità che dipende dalla concentrazione dell'acido nitrico, dalla presenza di ossigeno e da altri fattori. Le specie instabili reagiscono ulteriormente per formare biossido di azoto che viene poi purificato e condensato per formare tetrossido di diazoto.
Utilizzo come propellente per razzi
[modifica | modifica wikitesto]Il tetrossido di azoto viene utilizzato come agente ossidante in uno dei più importanti propellenti per razzi, perché può essere conservato in forma liquida a temperatura ambiente. All'inizio del 1944, gli scienziati tedeschi hanno condotto ricerche sulla possibilità di utilizzo del tetrossido di diazoto come agente ossidante per il carburante per missili, sebbene i tedeschi lo usassero solo in misura molto limitata come additivo per S-Stoff (acido nitrico fumante). Divenne l'ossidante conservabile preferito per molti razzi sia negli Stati Uniti che in URSS alla fine degli anni '50. È un propellente ipergolico in combinazione con un carburante per missili a base di idrazina. Uno dei primi usi di questa combinazione è stato sulla famiglia di razzi Titan usati originariamente come missili balistici intercontinentali e poi come vettori di lancio per molti veicoli spaziali. Utilizzato sulla navicella spaziale statunitense Gemini e Apollo, e anche sullo Space Shuttle, continua ad essere utilizzato come propellente per il mantenimento in orbita delle stazioni spaziali, sulla maggior parte dei satelliti geostazionari e su molte sonde di esplorazione dello spazio profondo. È anche il principale ossidante per il razzo russo Proton.
Quando viene utilizzato come propellente, il tetrossido di diazoto viene solitamente indicato semplicemente come tetrossido di azoto ed è ampiamente utilizzata l'abbreviazione NTO. Inoltre, l'NTO viene spesso utilizzato con l'aggiunta di una piccola percentuale di ossido nitrico, che inibisce la rottura per corrosione sotto sforzo delle leghe di titanio e, in questa forma, i gradi di propellenza dell'NTO vengono indicati come ossidi misti di azoto (MON). La maggior parte dei veicoli spaziali ora usa MON invece di NTO; ad esempio, il sistema di controllo di reazione dello Space Shuttle utilizzava MON3 (NTO contenente il 3% di NO in peso).[7]
L'incidente Apollo-Soyuz
[modifica | modifica wikitesto]Il 24 luglio 1975, l'avvelenamento da NTO colpì tre astronauti statunitensi durante la discesa finale sulla Terra dopo il volo del progetto di prova Apollo-Soyuz. Ciò era dovuto a un interruttore lasciato accidentalmente nella posizione sbagliata, che consentiva ai propulsori di controllo dell'assetto di attivarsi dopo l'apertura della presa d'aria fresca della cabina, consentendo ai fumi dell'NTO di entrare nella cabina. Un membro dell'equipaggio ha perso conoscenza durante la discesa. All'atterraggio, l'equipaggio è stato ricoverato in ospedale per cinque giorni per polmonite ed edema indotti da sostanze chimiche.[8][9]
Produzione di energia mediante N2O4
[modifica | modifica wikitesto]La tendenza del tetrossido di diazoto a scindersi in modo reversibile in diossido di azoto ha portato alla ricerca sul suo utilizzo nei sistemi avanzati di produzione di energia come cosiddetto gas dissociante.[10] Il tetrossido di diazoto "freddo" viene compresso e riscaldato, provocandone la dissociazione in biossido di azoto a metà del peso molecolare. Questo biossido di azoto caldo viene espanso attraverso una turbina, raffreddandolo e abbassando la pressione, e poi ulteriormente raffreddato in un dissipatore di calore, facendolo ricombinare in tetrossido di azoto al peso molecolare originale. È quindi ora molto più facile comprimere nuovamente per ricominciare l'intero ciclo. Tali cicli, chiamati cicli di Brayton-Joule con gas dissociativo hanno il potenziale per aumentare considerevolmente l'efficienza delle apparecchiature di conversione di potenza.[11]
Reazioni chimiche
[modifica | modifica wikitesto]Come prodotto intermedio nella produzione di acido nitrico
[modifica | modifica wikitesto]L'acido nitrico è prodotto su larga scala tramite N2O4. Questa specie reagisce con l'acqua per dare sia acido nitroso (HNO2) che acido nitrico (HNO3):
Il coprodotto HNO2 per riscaldamento si trasforma in monossido di azoto (NO) e acido nitrico per dismutazione:
Quando esposto all'ossigeno, il monossido di azoto viene riconvertito in biossido di azoto:
Il diossido di azoto per refrigerazione si trasforma in tetrossido di diazoto che viene reimmesso nel ciclo per dare nuovamente la miscela di acido nitroso e nitrico.
Sintesi di nitrati metallici
[modifica | modifica wikitesto]Il tetrossido di azoto si comporta come il sale , essendo il primo un forte ossidante:
- ,
Se i nitrati metallici vengono preparati dal tetrossido di diazoto in condizioni completamente anidre, si può formare una gamma di nitrati metallici covalenti con molti metalli di transizione. Questo perché c'è una preferenza termodinamica per lo ione nitrato di legarsi covalentemente con tali metalli piuttosto che formare una struttura ionica. Tali composti devono essere preparati in condizioni anidre, poiché lo ione nitrato è un legante molto più debole dell'acqua, e se l'acqua è presente si formerà il semplice nitrato idrato. I nitrati anidri interessati sono essi stessi covalenti e molti, ad esempio il nitrato di rame anidro, sono volatili a temperatura ambiente. Il nitrato di titanio anidro sublima nel vuoto a soli 40 °C. Molti dei nitrati di metalli di transizione anidri hanno colori sorprendenti. Questa branca della chimica è stata sviluppata da Cliff Addison e Norman Logan presso l'Università di Nottingham nel Regno Unito durante gli anni '60 e '70, quando iniziarono a diventare disponibili essiccanti altamente efficienti e scatole a secco.
Note
[modifica | modifica wikitesto]- ^ Scheda IFA-GESTIS, su gestis.dguv.de.
- ^ (EN) Henry A. Bent, Dimers of Nitrogen Dioxide. II. Structure and Bonding, in Inorganic Chemistry, vol. 2, n. 4, 1963, p. 747–752, DOI:10.1021/ic50008a020.
- ^ (EN) Ralph H. Petrucci, William S. Harwood e F. Geoffrey Herring, General chemistry: principles and modern applications, 8ª ed., Upper Saddle River, Prentice Hall, 2002, p. 420, ISBN 978-0-13-014329-7.
- ^ (EN) Geoff Rayner-canham, Descriptive inorganic chemistry, 6ª ed., 2013, p. 400, ISBN 978-1-319-15411-0.
- ^ (EN) Reinhart Ahlrichs e Frerich Keil, Structure and bonding in dinitrogen tetroxide (N2O4), in Journal of the American Chemical Society, vol. 96, n. 25, 1974, p. 7615–7620.
- ^ (EN) A. F Holleman e E. Wiberg, Inorganic Chemistry, San Diego, Academic Press, 2001, ISBN 978-0-12-352651-9.
- ^ (EN) Rocket Propellant Index, su friends-partners.org. URL consultato il 1º marzo 2005 (archiviato dall'url originale l'11 maggio 2008).
- ^ (EN) Brand Takes Blame For Apollo Gas Leak, su news.google.com, 10 agosto 1975.
- ^ (EN) John S. Sotos, Astronaut and Cosmonaut Medical Histories, su doctorzebra.com, 12 maggio 2008. URL consultato il 1º aprile 2011.
- ^ (EN) Robert J. Stochl, Potential performance improvement by using a reacting gas (nitrogen tetroxide) as the working fluid in a closed Brayton cycle (PDF), TM-79322, NASA, 1979.
- ^ (EN) R. Ragheb, Nuclear Reactors Concepts and Thermodynamic Cycles (PDF), su mragheb.com. URL consultato il 1º maggio 2013.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su tetraossido di diazoto
Wikimedia Commons contiene immagini o altri file su tetraossido di diazoto
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) dinitrogen tetroxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh2001002918 · GND (DE) 4150245-0 · J9U (EN, HE) 987007532621205171 · NDL (EN, JA) 00571245 |
|---|











![{\displaystyle {\ce {[NO+][NO3^{-}]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/82c9ca82032f58c7c8f55027f911373eb5ea1672)

