Assone: differenze tra le versioni
Aggiungo wikilink Etichette: Modifica da mobile Modifica da applicazione mobile |
traduzione da inglese |
||
| Riga 1: | Riga 1: | ||
{{S|argomento=anatomia}} |
|||
{{Disclaimer|medico}} |
{{Disclaimer|medico}} |
||
{{Neurone mappa}} |
{{Neurone mappa}} |
||
| Riga 7: | Riga 6: | ||
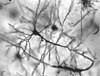
L'assone, solitamente, non presenta diramazioni nella sua porzione prossimale, mentre, nella sua porzione distale, si dirama assumendo l'aspetto della "chioma di un albero". |
L'assone, solitamente, non presenta diramazioni nella sua porzione prossimale, mentre, nella sua porzione distale, si dirama assumendo l'aspetto della "chioma di un albero". |
||
== |
==Anatomia== |
||
Nel regno animale, a seconda dello stato evolutivo, esistono due tipologie di trasmissione dell'impulso nervoso tra due cellule attigue: |
Nel regno animale, a seconda dello stato evolutivo, esistono due tipologie di trasmissione dell'impulso nervoso tra due cellule attigue: |
||
* Una trasmissione puramente elettrica, in cui l'assone è a contatto diretto con le strutture del neurone "bersaglio" e avviene una depolarizzazione "per contatto" (tipica degli invertebrati). |
* Una trasmissione puramente elettrica, in cui l'assone è a contatto diretto con le strutture del neurone "bersaglio" e avviene una depolarizzazione "per contatto" (tipica degli invertebrati). |
||
| Riga 30: | Riga 29: | ||
La demielinizzazione degli assoni causa una serie di sintomi neurologici ed è la base cellulare della [[sclerosi multipla]]. |
La demielinizzazione degli assoni causa una serie di sintomi neurologici ed è la base cellulare della [[sclerosi multipla]]. |
||
==Classificazione== |
|||
==Modelli fisici di descrizione di un assone== |
|||
{{Vedi anche|Velocità di conduzione dell'impulso nervoso}} |
|||
A partire dai lavori pioneristici di Cole, Huxley, Curtis e Hodgkin si è provato a descrivere gli assoni in termini di circuiti elettrici, rappresentando in termini di impedenze le caratteristiche elettriche delle cellule. |
|||
Gli assoni dei neuroni nel [[sistema nervoso periferico]] umano possono essere classificati in base alle loro caratteristiche fisiche e alle proprietà di conduzione del segnale. Gli assoni sono noti per avere spessori diversi (da 0,1 a 20 μm)<ref>{{Cita libro|nome=Squire, Larry|cognome=R.|titolo=Fundamental neuroscience|url=https://www.worldcat.org/oclc/830351091|accesso=2018-07-30|edizione=4th ed|data=2013|editore=Elsevier/Academic Press|OCLC=830351091|ISBN=9780123858719}}</ref> e si pensava che queste differenze fossero correlate alla velocità con cui un [[potenziale d'azione]] può viaggiare lungo l'assone - la sua velocità di conduttanza. [[Joseph Erlanger|Erlanger]] e [[Herbert Spencer Gasser|Gasser]] hanno dimostrato questa ipotesi e identificato diversi tipi di [[Neurofilamento|fibre nervose]], stabilendo una relazione tra il diametro dell'assone e la sua velocità di conduzione nervosa. Pubblicarono le loro scoperte nel 1941 dando la prima classificazione degli assoni. |
|||
Numerosi sono i modelli proposti. Quelli più studiati e conosciuti sono il [[Modello a cavo di un assone|modello a cavo]] e il [[modello a linea di trasmissione]] |
|||
Gli assoni sono classificati in due sistemi. Il primo introdotto da Erlanger e Gasser, raggruppava le fibre in tre gruppi principali usando le lettere A, B e C. Questi gruppi, comprendono sia le fibre sensoriali ([[Fibre afferenti|afferenti]]) che le fibre motorie ([[Fibre efferenti|efferenti]]). Il gruppo A è suddiviso in fibre alfa, beta, gamma e delta (Aα, Aβ, Aγ e Aδ). I [[Motoneurone|motoneuroni]] delle fibre motorie, sono i neuroni motori inferiori - alfa motoneurone, beta motoneurone e motoneurone gamma con le fibre nervose Aα, AC e Aγ rispettivamente. |
|||
<!--== History == |
|||
Some of the first intracellular recordings in a nervous system were made in the late 1930's by K. Cole and H. Curtis. Alan Hodgkin and Andrew Huxley also employed the squid axon (1939) and by 1952 they had obtained a full quantitative description of the ionic basis of the action potential. Hodgkin and Huxley were awarded jointly the Nobel Prize for this work in 1963.--> |
|||
Successive scoperte di altri ricercatori hanno identificato due gruppi di fibre Aa che sono fibre motorie. Poi è stato introdotto in un sistema che includeva solo fibre sensoriali (anche se alcuni di questi sono nervi misti). Questo sistema utilizza i numeri romani, e comprende il Tipo Ia, Tipo Ib, Tipo II, Tipo III e Tipo IV. |
|||
=== Fibre motorie === |
|||
I motoneuroni inferiori hanno due tipi di fibreː |
|||
{| class="wikitable" |
|||
|+ |
|||
!Tipo |
|||
!Classificazione Erlanger-Gasser |
|||
!Diametro |
|||
(μm) |
|||
!'''mielina''' |
|||
!Velocità di conduzione (m/s) |
|||
![[Fibrocellula|Fibre muscolari]] associate |
|||
|- |
|||
|α |
|||
|Aα |
|||
|13-20 |
|||
|si |
|||
|80-120 |
|||
|Fibre muscolari extrafusali |
|||
|- |
|||
|β |
|||
|Aβ |
|||
| |
|||
| |
|||
| |
|||
| |
|||
|- |
|||
|γ |
|||
|Aγ |
|||
|5-8 |
|||
|si |
|||
|4-24<ref>{{Cita pubblicazione|nome=B. L.|cognome=Andrew|data=1972-4|titolo=Properties of fast and slow motor units in hind limb and tail muscles of the rat|rivista=Quarterly Journal of Experimental Physiology and Cognate Medical Sciences|volume=57|numero=2|pp=213–225|accesso=2018-07-30|url=https://www.ncbi.nlm.nih.gov/pubmed/4482075|nome2=N. J.|cognome2=Part}}</ref><ref>{{Cita pubblicazione|nome=N. J.|cognome=Russell|data=1980-1|titolo=Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat|rivista=The Journal of Physiology|volume=298|pp=347–360|accesso=2018-07-30|url=https://www.ncbi.nlm.nih.gov/pubmed/7359413}}</ref> |
|||
|Fibre muscolari intrafusali |
|||
|} |
|||
===Fibre sensoriali=== |
|||
Diversi [[Recettore sensoriale|recettori sensoriali]] innervano diversi tipi di fibre nervose. I [[Propriocettore|propriocettori]] sono innervati dalle fibre sensoriali di tipo Ia, Ib e II, i [[Meccanocettore|meccanocettori]] da fibre sensoriali di tipo II e III e [[Nocicettore|nocicettori]] e [[termocettori]] da fibre sensoriali di tipo III e IV. |
|||
{| class="wikitable" |
|||
|+ |
|||
!Tipo |
|||
!Classificazione Erlanger-Gasser |
|||
!Diametro |
|||
(μm) |
|||
!'''mielina''' |
|||
!Velocità di conduzione (m/s) |
|||
![[Recettore sensoriale|Recettori sensoriali]] associati |
|||
!'''Propriorecettori''' |
|||
!'''Meccanocettori''' |
|||
!Nocicettori e |
|||
termocettori |
|||
|- |
|||
|Ia |
|||
|Aα |
|||
|13-20 |
|||
|si |
|||
|80-120 |
|||
|Recettori primari del [[fuso neuromuscolare]] |
|||
| rowspan="3" |✔ |
|||
| |
|||
| |
|||
|- |
|||
|Ib |
|||
|Aα |
|||
|13-20 |
|||
|si |
|||
|80-120 |
|||
|[[Organo tendineo del Golgi]] |
|||
| |
|||
| |
|||
|- |
|||
|II |
|||
|Ap |
|||
|6-12 |
|||
|si |
|||
|33-75 |
|||
| |
|||
* Recettori secondari del fuso neuromuscolare |
|||
* Tutti i [[Meccanocettore|meccanocettori]] cutanei |
|||
| rowspan="2" |✔ |
|||
| |
|||
|- |
|||
|III |
|||
|Aδ |
|||
|1-5 |
|||
|poca |
|||
|3-30 |
|||
| |
|||
* Terminazioni nervose libere del tatto e pressione |
|||
* [[Nocicettore|Nocicettori]] del [[tratto spinotalamico]] laterale |
|||
* [[Termocettori|Termorecettori]] per il freddo |
|||
| |
|||
| rowspan="2" |✔ |
|||
|- |
|||
|IV |
|||
|C |
|||
|0,2-1,5 |
|||
|no |
|||
|33-75 |
|||
| |
|||
* Nocicettori del tratto spinotalamico anteriore |
|||
* Termocettori per il caldo |
|||
| |
|||
| |
|||
|} |
|||
===Fibre autonomiche=== |
|||
Il [[sistema nervoso autonomo]] ha due tipi di fibre perifericheː |
|||
{| class="wikitable" |
|||
|+ |
|||
!Tipo |
|||
!Classificazione Erlanger-Gasser |
|||
!Diametro |
|||
(μm) |
|||
!'''Mielina'''<ref>{{Cita libro|nome=Pocock,|cognome=Gillian.|titolo=Human physiology : the basis of medicine|url=https://www.worldcat.org/oclc/53192607|accesso=2018-07-30|edizione=2nd ed|data=2004|editore=Oxford University Press|OCLC=53192607|ISBN=0198585268}}</ref> |
|||
!Velocità di conduzione (m/s) |
|||
|- |
|||
|Fibre pregangliari |
|||
|B |
|||
|1-5 |
|||
|si |
|||
|3–15 |
|||
|- |
|||
|Fibre postgangliari |
|||
|C |
|||
|0.2–1.5 |
|||
|no |
|||
|0.5–2.0 |
|||
|} |
|||
===Modelli fisici di descrizione di un assone=== |
|||
A partire dai lavori pioneristici di Cole, Huxley, Curtis e Hodgkin si è provato a descrivere gli assoni in termini di circuiti elettrici, rappresentando in termini di impedenze le caratteristiche elettriche delle cellule. Numerosi sono i modelli proposti. Quelli più studiati e conosciuti sono il [[Modello a cavo di un assone|modello a cavo]] e il modello a linea di trasmissione |
|||
== Patologia == |
|||
In ordine di gravità, la lesione a un nervo può essere descritta come [[neuroaprassia]], assonotmesi o neurotmesi. |
|||
La disfunzione degli assoni del sistema nervoso è una delle cause di molti disturbi neurologici ereditari che colpiscono sia i neuroni periferici che i neuroni centrali.<ref name=":0">{{Cita pubblicazione|nome=Dominique|cognome=Debanne|data=2011-04|titolo=Axon Physiology|rivista=Physiological Reviews|volume=91|numero=2|pp=555–602|accesso=2018-07-30|doi=10.1152/physrev.00048.2009|url=https://doi.org/10.1152/physrev.00048.2009|nome2=Emilie|cognome2=Campanac|nome3=Andrzej|cognome3=Bialowas}}</ref> |
|||
La [[Guaina mielinica|demielinizzazione]] degli assoni provoca la maggior parte dei sintomi neurologici riscontrati nella [[sclerosi multipla]]. |
|||
La dissielinizzazione è la formazione anormale della guaina mielinica, implicata in diverse [[Leucodistrofia|leucodistrofie]] e anche nella [[schizofrenia]].<ref>{{Cita pubblicazione|nome=Eva-Maria|cognome=Krämer-Albers|data=2006-11-08|titolo=Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia|rivista=The Journal of Neuroscience: The Official Journal of the Society for Neuroscience|volume=26|numero=45|pp=11743–11752|accesso=2018-07-30|doi=10.1523/JNEUROSCI.3581-06.2006|url=https://www.ncbi.nlm.nih.gov/pubmed/17093095|nome2=Katja|cognome2=Gehrig-Burger|nome3=Christoph|cognome3=Thiele}}</ref><ref>{{Cita pubblicazione|nome=Reuben|cognome=Matalon|data=2006|titolo=Canavan disease: studies on the knockout mouse|rivista=Advances in Experimental Medicine and Biology|volume=576|pp=77–93; discussion 361–363|accesso=2018-07-30|doi=10.1007/0-387-30172-0_6|url=https://www.ncbi.nlm.nih.gov/pubmed/16802706|nome2=Kimberlee|cognome2=Michals-Matalon|nome3=Sankar|cognome3=Surendran}}</ref><ref>{{Cita pubblicazione|nome=Dmitri|cognome=Tkachev|data=2007-02-12|titolo=Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia|rivista=The International Journal of Neuropsychopharmacology|volume=10|numero=04|pp=557|lingua=en|accesso=2018-07-30|doi=10.1017/s1461145706007334|url=https://doi.org/10.1017/S1461145706007334|nome2=Michael L.|cognome2=Mimmack|nome3=Stephen J.|cognome3=Huffaker}}</ref> |
|||
Una [[Trauma cranico|lesione cerebrale traumatica]] può causare danni alle vie nervose danneggiando gli assoni, e una condizione nota come danno assonale diffuso, che può portare a uno [[stato vegetativo]] persistente.<ref>{{Cita news|url=https://archive.is/20110526162429/http://www.medcyclopaedia.com/library/topics/volume_vi_1/b/BRAIN_INJURY_TRAUMATIC.aspx|titolo=Medcyclopaedia - Brain injury, traumatic|pubblicazione=archive.is|data=2011-05-26|accesso=2018-07-30}}</ref> La [[commozione cerebrale]] è considerata una forma lieve di [[danno assonale diffuso]].<ref>{{Cita pubblicazione|data=2017-08-18|titolo=Traumatic Brain Injury (TBI) - Definition, Epidemiology, Pathophysiology: Overview, Epidemiology, Primary Injury|accesso=2018-07-30|url=https://emedicine.medscape.com/article/326510-overview}}</ref> . |
|||
== Storia == |
|||
L'anatomista tedesco [[Otto Deiters|Otto Friedrich Karl Deiters]] è lo scopritore degli assoni e il primo a distinguerli dai [[Dendrite (biologia)|dendriti]].<ref name=":0" /> Lo svizzero [[Rudolf Albert von Kölliker|Rüdolf Albert von Kölliker]] e il tedesco Robert Remak furono i primi a identificare e caratterizzare il segmento iniziale degli assoni. Kölliker diede il nome all'assone nel 1896.<ref>{{Cita libro|nome=Finger,|cognome=Stanley.|titolo=Origins of neuroscience : a history of explorations into brain function|url=https://www.worldcat.org/oclc/27151391|accesso=2018-07-30|data=1994|editore=Oxford University Press|OCLC=27151391|ISBN=0195065034}}</ref> Alan Hodgkin e [[Andrew Huxley]] studiarono l'[[assone gigante di calamaro]] (1939) e nel 1952 ottennero un'analisi quantitativa completa della base ionica del [[potenziale d'azione]], portando alla formulazione dell [[Modello di Hodgkin-Huxley|modello di Hodgkin - Huxley]], che valse ad entrambi il [[Premio Nobel]] nel 1963. Le formule che descrivono la [[Conduttanza elettrica|conduttanza]] assonale furono estese ai vertebrati grazie alle equazioni di Frankenhaeuser-Huxley. Il primo a descrivere i nodi assonali fu [[Louis-Antoine Ranvier]], che per questo motivo sono comunemente chiamati [[nodi di Ranvier]]. [[Santiago Ramón y Cajal]], un anatomista spagnolo, propose che gli assoni fossero i componenti in uscita dei neuroni, descrivendone la funzionalità.<ref name=":0" /> [[Joseph Erlanger]] e Herbert Gasser svilupparono il sistema di classificazione delle fibre nervose periferiche, basato sulla velocità di conduzione assonale, sulla mielinizzazione , sulla dimensione delle fibre ecc. La comprensione delle basi biochimiche per la propagazione del potenziale d'azione è ulteriormente progredita e include molti dettagli sui singoli [[Canale ionico|canali ionici]]. |
|||
== Altri animali == |
|||
Gli assoni negli [[Invertebrata|invertebrati]] sono stati ampiamente studiati. Il [[Doryteuthis pealeii|calamaro atlantico]], usato come organismo modello, ha l'assone più lungo conosciuto.<ref>{{Cita libro|nome=Jennifer L.|cognome=Hellier|titolo=The Brain, the Nervous System, and Their Diseases [3 volumes]|url=https://books.google.co.uk/books?redir_esc=y&id=SDi2BQAAQBAJ&q=axon#v=snippet&q=axon&f=false|accesso=2018-07-30|data=2014-12-16|editore=ABC-CLIO|lingua=en|ISBN=9781610693387}}</ref> Il [[Architeuthis|calamaro gigante]] ha il più grande assone conosciuto. Le sue dimensioni variano da un millimetro a mezzo millimitro di diametro. La velocità di conduzione più veloce registrata è di 210 m/s e si trova negli assoni di alcuni [[Penaeidae|gamberetti pelagici]],<ref>{{Cita pubblicazione|nome=K.|cognome=Hsu|data=1996-7|titolo=Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction|rivista=Journal of Neurobiology|volume=30|numero=3|pp=397–409|accesso=2018-07-30|doi=10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#|url=https://www.ncbi.nlm.nih.gov/pubmed/8807532|nome2=S.|cognome2=Terakawa}}</ref> con un range usuale compreso tra 90 e 200 m/s <ref>{{Cita pubblicazione|nome=J.L.|cognome=Salzer|data=2016-10|titolo=Myelination|rivista=Current Biology|volume=26|numero=20|pp=R971–R975|accesso=2018-07-30|doi=10.1016/j.cub.2016.07.074|url=https://doi.org/10.1016/j.cub.2016.07.074|nome2=B.|cognome2=Zalc}}</ref> ( cfr. 100-120 m/s per l'assone [[Vertebrata|vertebrato]] mielinizzato più veloce). |
|||
In altri casi, come osservato negli studi sui ratti, un assone può avere origine da un [[Dendrite (biologia)|dendrite]]. Alcuni assoni con origine dendritica hanno un segmento iniziale prossimale che inizia direttamente sull'origine dell'assone, mentre altri hanno un segmento iniziale distale, separato dall'origine dell'assone.<ref name=":1">{{Cita pubblicazione|nome=Felix|cognome=Höfflin|data=2017|titolo=Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex|rivista=Frontiers in Cellular Neuroscience|volume=11|pp=332|accesso=2018-07-30|doi=10.3389/fncel.2017.00332|url=https://www.ncbi.nlm.nih.gov/pubmed/29170630|nome2=Alexander|cognome2=Jack|nome3=Christian|cognome3=Riedel}}</ref> In molte specie alcuni neuroni hanno assoni che partono dal dendite e non dal corpo cellulare.<ref>{{Cita pubblicazione|nome=Lazaros C.|cognome=Triarhou|data=2014|titolo=Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues|rivista=Frontiers in Neuroanatomy|volume=8|pp=133|accesso=2018-07-30|doi=10.3389/fnana.2014.00133|url=https://www.ncbi.nlm.nih.gov/pubmed/25477788}}</ref> In molti casi, l'assone ha origine sul soma. Alcuni assoni con origine somatica hanno un segmento iniziale prossimale adiacente al monticolo assonico, mentre altri hanno un segmento iniziale distale.<ref name=":1" /> |
|||
== Note == |
|||
<references /> |
|||
== Altri progetti == |
== Altri progetti == |
||
Versione delle 19:32, 30 lug 2018
Struttura tipica di un neurone

L'assone o neurite (in generale, anche i dentriti sono classificabili come neuriti) è un conduttore di impulsi in direzione centrifuga rispetto al corpo cellulare. Ogni neurone ha unicamente un assone. Esso si origina a partire dal soma cellulare attraverso una particolare struttura anatomica che prende il nome di "cono di emergenza"; questo nome deriva dal fatto che questa struttura ha forma di tronco di cono con la base rivolta verso il "soma" cellulare e l'apice tronco che continua nell'assone. L'assone, solitamente, non presenta diramazioni nella sua porzione prossimale, mentre, nella sua porzione distale, si dirama assumendo l'aspetto della "chioma di un albero".
Anatomia
Nel regno animale, a seconda dello stato evolutivo, esistono due tipologie di trasmissione dell'impulso nervoso tra due cellule attigue:
- Una trasmissione puramente elettrica, in cui l'assone è a contatto diretto con le strutture del neurone "bersaglio" e avviene una depolarizzazione "per contatto" (tipica degli invertebrati).
- Una trasmissione chimica, in cui due neuroni attigui comunicano attraverso il rilascio di sostanze chimiche, che prendono il nome di "mediatori" (ad esempio acetilcolina o adrenalina); a seconda del mediatore che le fibre utilizzano per "comunicare" esse vengono classificate in modi differenti.
Le diramazioni assoniche terminali finiscono con una struttura dilatata, detta a "bottoncino", che prende il nome di sinapsi. La sinapsi viene divisa in uno spazio presinaptico (la vescicola) e uno postsinaptico (lo spazio compreso tra la vescicola e la membrana nel neurone successivo).
La sinapsi contiene solo i mediatori chimici e i mitocondri necessari alla produzione energetica; la sintesi dei mediatori avviene nel soma cellulare e viene trasportato alla sinapsi attraverso il "flusso assonico".
Le sinapsi possono entrare in contatto sia con il soma sia con i dendriti di altre cellule nervose.
L'assone si comporta come un conduttore elettrico; infatti grazie alla presenza di alcuni ioni come sodio, cloro, calcio e potassio, viene creato un flusso ionico che genera una corrente elettrica. Quando arriva un impulso elettrico, questo percorre l'assone. A livello delle sinapsi la depolarizzazione determinata dalla corrente determina l'apertura di canali per il calcio. Questo determina il rilascio di una sostanza chimica detta neurotrasmettitore (come l'acetilcolina, l'acido aminoglutammico, GABA, o altri) che, legandosi a specifici recettori, permette il passaggio dell'impulso elettrico da un neurone all'altro. L'assone quindi rappresenta l'output del neurone che rilascia un impulso elettrico e allo stesso tempo l'input per i neuroni riceventi.
Il singolo assone ha un diametro microscopico di pochi micrometri, ma la sua lunghezza può raggiungere lunghezze macroscopiche. Gli assoni più lunghi del corpo umano sono quelli che costituiscono il nervo sciatico che dalla base del midollo spinale raggiungono l'alluce dei piedi e possono raggiungere lunghezze superiori al metro.
Nei vertebrati gli assoni possono essere rivestiti da una guaina mielinica, formando una fibra nervosa. La guaina mielinica è costituita da due tipi di cellule gliali: le cellule di Schwann per gli assoni periferici e gli oligodendrociti per il sistema nervoso centrale.
Le fibre nervose possono quindi essere:
- amieliniche, se gli assoni sono solamente contenuti in una nicchia delle cellule di Schwann.
- mieliniche, se le cellule mieliniche si avvolgono più volte attorno all'assone, formando una fila di manicotti, che schermano la fibra dalla corrente ionica. Lungo le fibre mieliniche, la guaina mielinica presenta delle interruzioni, i nodi di Ranvier, che permettono una conduzione del segnale elettrico più rapida, detta "conduzione saltatoria".
La demielinizzazione degli assoni causa una serie di sintomi neurologici ed è la base cellulare della sclerosi multipla.
Classificazione
Gli assoni dei neuroni nel sistema nervoso periferico umano possono essere classificati in base alle loro caratteristiche fisiche e alle proprietà di conduzione del segnale. Gli assoni sono noti per avere spessori diversi (da 0,1 a 20 μm)[1] e si pensava che queste differenze fossero correlate alla velocità con cui un potenziale d'azione può viaggiare lungo l'assone - la sua velocità di conduttanza. Erlanger e Gasser hanno dimostrato questa ipotesi e identificato diversi tipi di fibre nervose, stabilendo una relazione tra il diametro dell'assone e la sua velocità di conduzione nervosa. Pubblicarono le loro scoperte nel 1941 dando la prima classificazione degli assoni.
Gli assoni sono classificati in due sistemi. Il primo introdotto da Erlanger e Gasser, raggruppava le fibre in tre gruppi principali usando le lettere A, B e C. Questi gruppi, comprendono sia le fibre sensoriali (afferenti) che le fibre motorie (efferenti). Il gruppo A è suddiviso in fibre alfa, beta, gamma e delta (Aα, Aβ, Aγ e Aδ). I motoneuroni delle fibre motorie, sono i neuroni motori inferiori - alfa motoneurone, beta motoneurone e motoneurone gamma con le fibre nervose Aα, AC e Aγ rispettivamente.
Successive scoperte di altri ricercatori hanno identificato due gruppi di fibre Aa che sono fibre motorie. Poi è stato introdotto in un sistema che includeva solo fibre sensoriali (anche se alcuni di questi sono nervi misti). Questo sistema utilizza i numeri romani, e comprende il Tipo Ia, Tipo Ib, Tipo II, Tipo III e Tipo IV.
Fibre motorie
I motoneuroni inferiori hanno due tipi di fibreː
| Tipo | Classificazione Erlanger-Gasser | Diametro
(μm) |
mielina | Velocità di conduzione (m/s) | Fibre muscolari associate |
|---|---|---|---|---|---|
| α | Aα | 13-20 | si | 80-120 | Fibre muscolari extrafusali |
| β | Aβ | ||||
| γ | Aγ | 5-8 | si | 4-24[2][3] | Fibre muscolari intrafusali |
Fibre sensoriali
Diversi recettori sensoriali innervano diversi tipi di fibre nervose. I propriocettori sono innervati dalle fibre sensoriali di tipo Ia, Ib e II, i meccanocettori da fibre sensoriali di tipo II e III e nocicettori e termocettori da fibre sensoriali di tipo III e IV.
| Tipo | Classificazione Erlanger-Gasser | Diametro
(μm) |
mielina | Velocità di conduzione (m/s) | Recettori sensoriali associati | Propriorecettori | Meccanocettori | Nocicettori e
termocettori |
|---|---|---|---|---|---|---|---|---|
| Ia | Aα | 13-20 | si | 80-120 | Recettori primari del fuso neuromuscolare | ✔ | ||
| Ib | Aα | 13-20 | si | 80-120 | Organo tendineo del Golgi | |||
| II | Ap | 6-12 | si | 33-75 |
|
✔ | ||
| III | Aδ | 1-5 | poca | 3-30 |
|
✔ | ||
| IV | C | 0,2-1,5 | no | 33-75 |
|
Fibre autonomiche
Il sistema nervoso autonomo ha due tipi di fibre perifericheː
| Tipo | Classificazione Erlanger-Gasser | Diametro
(μm) |
Mielina[4] | Velocità di conduzione (m/s) |
|---|---|---|---|---|
| Fibre pregangliari | B | 1-5 | si | 3–15 |
| Fibre postgangliari | C | 0.2–1.5 | no | 0.5–2.0 |
Modelli fisici di descrizione di un assone
A partire dai lavori pioneristici di Cole, Huxley, Curtis e Hodgkin si è provato a descrivere gli assoni in termini di circuiti elettrici, rappresentando in termini di impedenze le caratteristiche elettriche delle cellule. Numerosi sono i modelli proposti. Quelli più studiati e conosciuti sono il modello a cavo e il modello a linea di trasmissione
Patologia
In ordine di gravità, la lesione a un nervo può essere descritta come neuroaprassia, assonotmesi o neurotmesi.
La disfunzione degli assoni del sistema nervoso è una delle cause di molti disturbi neurologici ereditari che colpiscono sia i neuroni periferici che i neuroni centrali.[5]
La demielinizzazione degli assoni provoca la maggior parte dei sintomi neurologici riscontrati nella sclerosi multipla.
La dissielinizzazione è la formazione anormale della guaina mielinica, implicata in diverse leucodistrofie e anche nella schizofrenia.[6][7][8]
Una lesione cerebrale traumatica può causare danni alle vie nervose danneggiando gli assoni, e una condizione nota come danno assonale diffuso, che può portare a uno stato vegetativo persistente.[9] La commozione cerebrale è considerata una forma lieve di danno assonale diffuso.[10] .
Storia
L'anatomista tedesco Otto Friedrich Karl Deiters è lo scopritore degli assoni e il primo a distinguerli dai dendriti.[5] Lo svizzero Rüdolf Albert von Kölliker e il tedesco Robert Remak furono i primi a identificare e caratterizzare il segmento iniziale degli assoni. Kölliker diede il nome all'assone nel 1896.[11] Alan Hodgkin e Andrew Huxley studiarono l'assone gigante di calamaro (1939) e nel 1952 ottennero un'analisi quantitativa completa della base ionica del potenziale d'azione, portando alla formulazione dell modello di Hodgkin - Huxley, che valse ad entrambi il Premio Nobel nel 1963. Le formule che descrivono la conduttanza assonale furono estese ai vertebrati grazie alle equazioni di Frankenhaeuser-Huxley. Il primo a descrivere i nodi assonali fu Louis-Antoine Ranvier, che per questo motivo sono comunemente chiamati nodi di Ranvier. Santiago Ramón y Cajal, un anatomista spagnolo, propose che gli assoni fossero i componenti in uscita dei neuroni, descrivendone la funzionalità.[5] Joseph Erlanger e Herbert Gasser svilupparono il sistema di classificazione delle fibre nervose periferiche, basato sulla velocità di conduzione assonale, sulla mielinizzazione , sulla dimensione delle fibre ecc. La comprensione delle basi biochimiche per la propagazione del potenziale d'azione è ulteriormente progredita e include molti dettagli sui singoli canali ionici.
Altri animali
Gli assoni negli invertebrati sono stati ampiamente studiati. Il calamaro atlantico, usato come organismo modello, ha l'assone più lungo conosciuto.[12] Il calamaro gigante ha il più grande assone conosciuto. Le sue dimensioni variano da un millimetro a mezzo millimitro di diametro. La velocità di conduzione più veloce registrata è di 210 m/s e si trova negli assoni di alcuni gamberetti pelagici,[13] con un range usuale compreso tra 90 e 200 m/s [14] ( cfr. 100-120 m/s per l'assone vertebrato mielinizzato più veloce).
In altri casi, come osservato negli studi sui ratti, un assone può avere origine da un dendrite. Alcuni assoni con origine dendritica hanno un segmento iniziale prossimale che inizia direttamente sull'origine dell'assone, mentre altri hanno un segmento iniziale distale, separato dall'origine dell'assone.[15] In molte specie alcuni neuroni hanno assoni che partono dal dendite e non dal corpo cellulare.[16] In molti casi, l'assone ha origine sul soma. Alcuni assoni con origine somatica hanno un segmento iniziale prossimale adiacente al monticolo assonico, mentre altri hanno un segmento iniziale distale.[15]
Note
- ^ Squire, Larry R., Fundamental neuroscience, 4th ed, Elsevier/Academic Press, 2013, ISBN 9780123858719, OCLC 830351091. URL consultato il 30 luglio 2018.
- ^ B. L. Andrew e N. J. Part, Properties of fast and slow motor units in hind limb and tail muscles of the rat, in Quarterly Journal of Experimental Physiology and Cognate Medical Sciences, vol. 57, n. 2, 1972-4, pp. 213–225. URL consultato il 30 luglio 2018.
- ^ N. J. Russell, Axonal conduction velocity changes following muscle tenotomy or deafferentation during development in the rat, in The Journal of Physiology, vol. 298, 1980-1, pp. 347–360. URL consultato il 30 luglio 2018.
- ^ Pocock, Gillian., Human physiology : the basis of medicine, 2nd ed, Oxford University Press, 2004, ISBN 0198585268, OCLC 53192607. URL consultato il 30 luglio 2018.
- ^ a b c Dominique Debanne, Emilie Campanac e Andrzej Bialowas, Axon Physiology, in Physiological Reviews, vol. 91, n. 2, 2011-04, pp. 555–602, DOI:10.1152/physrev.00048.2009. URL consultato il 30 luglio 2018.
- ^ Eva-Maria Krämer-Albers, Katja Gehrig-Burger e Christoph Thiele, Perturbed interactions of mutant proteolipid protein/DM20 with cholesterol and lipid rafts in oligodendroglia: implications for dysmyelination in spastic paraplegia, in The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, vol. 26, n. 45, 8 novembre 2006, pp. 11743–11752, DOI:10.1523/JNEUROSCI.3581-06.2006. URL consultato il 30 luglio 2018.
- ^ Reuben Matalon, Kimberlee Michals-Matalon e Sankar Surendran, Canavan disease: studies on the knockout mouse, in Advances in Experimental Medicine and Biology, vol. 576, 2006, pp. 77–93; discussion 361–363, DOI:10.1007/0-387-30172-0_6. URL consultato il 30 luglio 2018.
- ^ (EN) Dmitri Tkachev, Michael L. Mimmack e Stephen J. Huffaker, Further evidence for altered myelin biosynthesis and glutamatergic dysfunction in schizophrenia, in The International Journal of Neuropsychopharmacology, vol. 10, n. 04, 12 febbraio 2007, pp. 557, DOI:10.1017/s1461145706007334. URL consultato il 30 luglio 2018.
- ^ Medcyclopaedia - Brain injury, traumatic, in archive.is, 26 maggio 2011. URL consultato il 30 luglio 2018.
- ^ Traumatic Brain Injury (TBI) - Definition, Epidemiology, Pathophysiology: Overview, Epidemiology, Primary Injury, 18 agosto 2017. URL consultato il 30 luglio 2018.
- ^ Finger, Stanley., Origins of neuroscience : a history of explorations into brain function, Oxford University Press, 1994, ISBN 0195065034, OCLC 27151391. URL consultato il 30 luglio 2018.
- ^ (EN) Jennifer L. Hellier, The Brain, the Nervous System, and Their Diseases [3 volumes], ABC-CLIO, 16 dicembre 2014, ISBN 9781610693387. URL consultato il 30 luglio 2018.
- ^ K. Hsu e S. Terakawa, Fenestration in the myelin sheath of nerve fibers of the shrimp: a novel node of excitation for saltatory conduction, in Journal of Neurobiology, vol. 30, n. 3, 1996-7, pp. 397–409, DOI:10.1002/(SICI)1097-4695(199607)30:3<397::AID-NEU8>3.0.CO;2-#. URL consultato il 30 luglio 2018.
- ^ J.L. Salzer e B. Zalc, Myelination, in Current Biology, vol. 26, n. 20, 2016-10, pp. R971–R975, DOI:10.1016/j.cub.2016.07.074. URL consultato il 30 luglio 2018.
- ^ a b Felix Höfflin, Alexander Jack e Christian Riedel, Heterogeneity of the Axon Initial Segment in Interneurons and Pyramidal Cells of Rodent Visual Cortex, in Frontiers in Cellular Neuroscience, vol. 11, 2017, pp. 332, DOI:10.3389/fncel.2017.00332. URL consultato il 30 luglio 2018.
- ^ Lazaros C. Triarhou, Axons emanating from dendrites: phylogenetic repercussions with Cajalian hues, in Frontiers in Neuroanatomy, vol. 8, 2014, pp. 133, DOI:10.3389/fnana.2014.00133. URL consultato il 30 luglio 2018.
Altri progetti
 Wikizionario contiene il lemma di dizionario «assone»
Wikizionario contiene il lemma di dizionario «assone» Wikimedia Commons contiene immagini o altri file su assone
Wikimedia Commons contiene immagini o altri file su assone
| Controllo di autorità | LCCN (EN) sh85010598 · GND (DE) 4200576-0 · J9U (EN, HE) 987007282443905171 |
|---|