Triossido di diazoto: differenze tra le versioni
freccia --> doppia freccia |
praticamente riscritto |
||
| Riga 2: | Riga 2: | ||
{{Composto chimico |
{{Composto chimico |
||
|immagine1_nome = Dinitrogen-trioxide-2D-canonicals.png |
|immagine1_nome = Dinitrogen-trioxide-2D-canonicals.png |
||
|immagine1_dimensioni = |
|immagine1_dimensioni = |
||
|immagine1_descrizione = |
|immagine1_descrizione = |
||
| |
|immagine2_nome = Dinitrogen-trioxide-3D-vdW.png |
||
| |
|immagine2_descrizione = |
||
| |
|immagine2_dimensioni = |
||
|nome_IUPAC = |
|nome_IUPAC = triossido di diazoto |
||
|nomi_alternativi = |
|nomi_alternativi = anidride nitrosa, ossido di azoto(III)<br>sesquiossido di azoto (arcaico) |
||
|titolo_caratteristiche_generali = --- |
|titolo_caratteristiche_generali = --- |
||
|aspetto = |
|aspetto = solido o liquido blu |
||
|titolo_proprietà_chimico-fisiche = --- |
|titolo_proprietà_chimico-fisiche = --- |
||
|solubilità_acqua = |
|solubilità_acqua = reagisce |
||
|titolo_indicazioni_sicurezza = |
|titolo_indicazioni_sicurezza = |
||
|simbolo1 = tossico |
|simbolo1 = tossico |
||
| Riga 19: | Riga 19: | ||
|frasiS = |
|frasiS = |
||
}} |
}} |
||
Il '''triossido di diazoto''', nome sistematico '''ossido di azoto(III)''' e noto come '''anidride nitrosa''' in nomenclatura tradizionale, è un ossido dell'azoto di [[formula molecolare]] N<sub>2</sub>O<sub>3</sub> in cui N è allo [[stato di ossidazione]] +3 (medio<ref>Al quale numero di ossidazione fa riferimento il nome sistematico.</ref>): in [[Formula di struttura|formula semistrutturale]] è ON−N(O)<sub>2</sub>, dove un atomo di azoto è +2 e l'altro +4. Nonostante questa insolita struttura, formalmente è l'anidride dell'[[acido nitroso]],<ref>{{Cita libro|autore=Ralf Steudel|titolo=Chemie der Nichtmetalle|ed=4|anno=2014|editore=Walter de Gruyter GmbH|lingua=de|p=366}}</ref> ma si mostra esserlo anche di fatto (''vide infra''). Questa forma molecolare vale nella condizione più stabile per questo composto, che si ha a basse temperature, sia allo stato solido che in parte allo stato liquido ([[punto di fusione]] -100,7 °C, [[punto di ebollizione]] ~ 3,5 °C), entrambi di colore azzurro.<ref>{{Cita libro|nome=Norman Neill|cognome=Greenwood|nome2=Alan|cognome2=Earnshaw|titolo=Chemistry of the elements|accesso=2024-02-15|edizione=2nd ed|data=1997|editore=Butterworth-Heinemann|p=444|capitolo=11 - Nitrogen|ISBN=978-0-7506-3365-9}}</ref> |
|||
Il '''triossido di diazoto''' (o anidride nitrosa) a basse temperature è un solido blu, e allo stato liquido o di vapore è largamente dissociato in [[monossido d'azoto|NO]] e [[diossido di azoto|NO<sub>2</sub>]]: |
|||
Già in parte allo stato liquido, infatti, ma specialmente allo stato di vapore si instaura un [[Equilibrio chimico|equilibrio]] di [[Dissociazione (chimica)|dissociazione]] in [[monossido di azoto]] e [[biossido di azoto]] e il [[grado di dissociazione]] aumenta all'aumentare della temperatura: |
|||
:<chem>N2O3 <=> NO + NO2</chem> |
|||
:<chem>N2O3 <=> NO + NO2</chem> [ [[Entalpia standard di reazione|Δ''H<sub>r</sub>''°]] = +40,5 k[[Joule|J]]/[[Mole|mol]]; [[Energia libera di Gibbs standard di reazione|Δ''G<sub>r</sub>''°]] = -1,59 k[[Joule|J]]/[[Mole|mol]]; T = 25 °C; [[Costante di equilibrio|K<sub>eq</sub>]] = 1,91 atm ]<ref>{{Cita libro|nome=Norman Neill|cognome=Greenwood|nome2=Alan|cognome2=Earnshaw|titolo=Chemistry of the elements|accesso=2024-02-15|edizione=2nd ed|data=1997|editore=Butterworth-Heinemann|p=454|capitolo=11 - Nitrogen|ISBN=978-0-7506-3365-9}}</ref> |
|||
| ⚫ | |||
La dissociazione e quindi la formazione dei prodotti inizia ad essere apprezzabile a partire da circa -30 °C.<ref>{{Cita libro|nome=Michael|cognome=Binnewies|nome2=Maik|cognome2=Finze|nome3=Manfred|cognome3=Jäckel|titolo=Allgemeine und anorganische Chemie|accesso=2024-02-15|edizione=3., vollständig überarbeitete Auflage|collana=Lehrbuch|data=2016|editore=Springer Spektrum|p=566|ISBN=978-3-662-45066-6|DOI=10.1007/978-3-662-45067-3}}</ref> |
|||
== Proprietà == |
|||
Il triossido di diazoto è già scarsamente stabile di suo, essendo un composto piuttosto [[Processo endotermico|endotermico]], [[Entalpia standard di formazione|Δ''H<sub>ƒ</sub>''°]] = +84,82 k[[Joule|J]]/[[Mole|mol]] <ref>{{Cita pubblicazione|nome=M. W.|cognome=Chase|data=1998|titolo=NIST-JANAF Themochemical Tables, Fourth Edition|pp=1–1951|accesso=2024-02-15|url=https://webbook.nist.gov/cgi/cbook.cgi?ID=C10544737&Units=SI&Mask=1#Thermo-Gas}}</ref> e l'altro suo possibile [[Isomeria|isomero]] molecolare (O=N−O−N=O, nitrito di nitrosile, la forma attesa per l'anidride nitrosa) è ancora meno stabile ([[Entalpia standard di formazione|Δ''H<sub>ƒ</sub>''°]]<sub>calcolato</sub> = +97,9 k[[Joule|J]]/[[Mole|mol]])<ref>{{Cita pubblicazione|nome=I. I.|cognome=Zakharov|nome2=O. I.|cognome2=Zakharova|data=2009-04-01|titolo=Nitrosonium nitrite isomer of N2O3: Quantum-chemical data|rivista=Journal of Structural Chemistry|volume=50|numero=2|pp=212–218|lingua=en|accesso=2024-02-15|doi=10.1007/s10947-009-0031-1|url=https://doi.org/10.1007/s10947-009-0031-1}}</ref> e di esso si conosce solo qualche dato spettrale.<ref>{{Cita web|url=https://cccbdb.nist.gov/exp2x.asp|titolo=Experimental data for ONONO (Nitrosyl nitrite)|sito=Computational Chemistry Comparison and Benchmark DataBase}}</ref> Un terzo possibile isomero sarebbe quello ionico, [[nitrito]] di [[nitrosonio]] [NO<sup>+</sup> NO<sub>2</sub><sup>−</sup>] che è sconosciuto materialmente, ma [[Chimica computazionale|calcoli teorici]] prevedono per esso un'[[Entalpia standard di formazione|entalpia di formazione standard]] parecchio più alta, almeno 113,8 kJ/mol.<ref>{{Cita pubblicazione|nome=I. I.|cognome=Zakharov|nome2=O. I.|cognome2=Zakharova|data=2009-04-01|titolo=Nitrosonium nitrite isomer of N2O3: Quantum-chemical data|rivista=Journal of Structural Chemistry|volume=50|numero=2|pp=212–218|lingua=en|accesso=2024-02-15|doi=10.1007/s10947-009-0031-1|url=https://doi.org/10.1007/s10947-009-0031-1}}</ref> |
|||
Il triossido di diazoto è solubile in [[tetracloruro di carbonio]], [[cloroformio]], [[benzene]] e [[toluene]], dando in ogni caso soluzioni azzurre.<ref>{{Cita pubblicazione|autore=Georg Brauer|data=1963|titolo=Handbook of Preparative Inorganic Chemistry|volume=1|p=488|accesso=2024-02-15|doi=10.1016/b978-0-12-395590-6.x5001-7|url=https://doi.org/10.1016/B978-0-12-395590-6.X5001-7}}</ref> |
|||
Da indagini [[Spettroscopia rotazionale|spettroscopiche rotazionali]] nella regione delle [[microonde]] su N<sub>2</sub>O<sub>3</sub> si ricava che la molecola è planare con simmetria ''C''<sub>s</sub><ref>{{Cita web|url=https://cccbdb.nist.gov/exp2x.asp|titolo=Experimental data for N2O3 (Dinitrogen trioxide)|sito=Computational Chemistry Comparison and Benchmark DataBase}}</ref> ed alquanto [[Polarità|polare]] ([[Momento dipolare|μ]] = 2,12 [[Debye|D]]).<ref>{{Cita pubblicazione|data=1974|titolo=Molecular Constants from Microwave, Molecular Beam, and Electron Spin Resonance Spectroscopy|rivista=Landolt-Börnstein - Group II Molecules and Radicals|curatore=K.-H. Hellwege, A. M. Hellwege|lingua=en|accesso=2024-02-15|doi=10.1007/b19951|url=http://dx.doi.org/10.1007/b19951}}</ref> Da indagini [[Spettroscopia infrarossa|spettroscopiche infrarosse]], effettuate in alta risoluzione con [[trasformata di Fourier]] sul [[vapore]] di N<sub>2</sub>O<sub>3</sub> a 230 K (-43 °C), risulta, tra l'altro, che il legame N−N è insolitamente lungo, ben 186,4 pm, e quindi presumibilmente molto debole;<ref>{{Cita pubblicazione|nome=Leslie A.|cognome=Chewter|nome2=Ian W.M.|cognome2=Smith|nome3=Gregory|cognome3=Yarwood|data=1988-04-10|titolo=A high resolution FTIR spectroscopic study of the nv 1 ( n = 1–4) bands of N 2 O 3|rivista=Molecular Physics|volume=63|numero=5|pp=843–864|lingua=en|accesso=2024-02-15|doi=10.1080/00268978800100601|url=https://www.tandfonline.com/doi/full/10.1080/00268978800100601}}</ref> per confronto, il valor medio di tale legame ammonta a 147 pm.<ref name=":02">{{Cita libro|autore=J. E. Huheey|autore2=E. A. Keiter|autore3=R. L. Keiter|titolo=Chimica Inorganica, Principi, Strutture, Reattività|edizione=|anno=1999|editore=Piccin|pp=A-25 - A-33|ISBN=88-299-1470-3}}</ref> e nell'[[idrazina]] (H<sub>2</sub>N−NH<sub>2</sub>) è ancora un po' più corto (145 pm).<ref>{{Cita web|url=https://cccbdb.nist.gov/exp2x.asp|titolo=Experimental data for N2H4 (Hydrazine)|sito=Computational Chemistry Comparison and Benchmark DataBase}}</ref> In questo contesto è bene comunque notare che anche il legame N−N nel [[tetrossido di diazoto]] (O<sub>2</sub>N−NO<sub>2</sub>), che è soggetto a dissociazione è anch'esso molto lungo: 178,2 pm.<ref>{{Cita pubblicazione|nome=Bruce W.|cognome=McClelland|nome2=Grete|cognome2=Gundersen|nome3=Kenneth|cognome3=Hedberg|data=1972-05-01|titolo=Reinvestigation of the Structure of Dinitrogen Tetroxide, N2O4, by Gaseous Electron Diffraction|rivista=The Journal of Chemical Physics|volume=56|numero=9|pp=4541–4545|accesso=2024-02-15|doi=10.1063/1.1677901|url=http://dx.doi.org/10.1063/1.1677901}}</ref> |
|||
== Sintesi e reattività == |
|||
La maniera più semplice di ottenere il triossido di diazoto consiste nel far condensare a bassa temperatura (< -20 °C) il monossido e il biossido: |
|||
NO + NO<sub>2</sub> ⇄ N<sub>2</sub>O<sub>3</sub> |
|||
Un'altra via consiste nel far reagire a bassa temperatura il tetrossido di diazoto liquido con [[carbonato di litio]], in presenza di tracce di umidità:<ref>{{Cita libro|autore=Rajni Garg|autore2=Randhir Singh|titolo=Inorganic Chemistry|anno=2015|editore=McGraw Hill Education|capitolo=6. Non-aqueous Solvents}}</ref> |
|||
Li<sub>2</sub>CO<sub>3</sub> <sub>(s)</sub> + N<sub>2</sub>O<sub>4</sub> <sub>(liq)</sub> → 2 LiNO<sub>3</sub> + N<sub>2</sub>O<sub>3</sub> + CO<sub>2</sub> |
|||
| ⚫ | La reattività di N<sub>2</sub>O<sub>3</sub> in condizioni ordinarie è spesso approssimabile a quella di una miscela equimolecolare di [[monossido di azoto]] NO e [[diossido di azoto]] NO<sub>2</sub>. Nonostante che la struttura della molecola non sia quella normale per un'anidride inorganica e nonostante la dissociazione, la reazione di N<sub>2</sub>O<sub>3</sub> con soluzioni acquose fornisce soluzioni di [[acido nitroso]]: |
||
N<sub>2</sub>O<sub>3</sub> + H<sub>2</sub>O → 2 HNO<sub>2</sub> |
|||
Questo, essendo un acido debole, nella soluzione è parzialmente dissociato in ione [[Idronio|idrossonio]] e [[ione nitrito]]: |
|||
HNO<sub>2</sub> + H<sub>2</sub>O ⇄ H<sub>3</sub>O<sup>+</sup> + NO<sub>2</sub><sup>−</sup> [ pK<sub>a</sub> = 3,29 ]<ref>{{Cita libro|nome=Nils|cognome=Wiberg|nome2=Egon|cognome2=Wiberg|nome3=Arnold Frederik|cognome3=Holleman|titolo=Anorganische Chemie|accesso=2024-02-15|edizione=103. Auflage|data=2017|editore=De Gruyter|p=825|capitolo=XIV. Die Stickstoffgruppe (Pentele)|ISBN=978-3-11-026932-1}}</ref> |
|||
Questa trasformazione del triossido di diazoto in acqua è molto più rapida e completa se la soluzione è [[Base (chimica)|alcalina]] e in tal caso si ottengono i corrispondenti [[Nitrito|nitriti]].<ref>{{Cita libro|nome=Nils|cognome=Wiberg|nome2=Egon|cognome2=Wiberg|nome3=Arnold Frederik|cognome3=Holleman|titolo=Anorganische Chemie|accesso=2024-02-15|edizione=103. Auflage|data=2017|editore=De Gruyter|pp=810-811|capitolo=XIV. Die Stickstoffgruppe (Pentele)|ISBN=978-3-11-026932-1}}</ref> |
|||
Il triossido di diazoto reagisce con acidi molto forti, come l'[[acido perclorico]] o [[Acido tetrafluoroborico|tetrafluoroborico]], per generare i corrispondenti [[Sale|sali]] di nitrosonio:<ref>{{Cita libro|nome=James E.|cognome=House|nome2=James Evan|cognome2=House|titolo=Inorganic chemistry|accesso=2024-02-15|data=2008|editore=Elsevier Academic Press|p=491|ISBN=978-0-12-356786-4}}</ref><ref>{{Cita pubblicazione|autore=Georg Brauer|data=1963|titolo=Handbook of Preparative Inorganic Chemistry|volume=1|p=224|accesso=2024-02-15|doi=10.1016/b978-0-12-395590-6.x5001-7|url=https://doi.org/10.1016/B978-0-12-395590-6.X5001-7}}</ref> |
|||
N<sub>2</sub>O<sub>3</sub> + 3 HClO<sub>4</sub> → 2 [N≡O]<sup>+</sup> [ClO<sub>4</sub>]<sup>−</sup> + [H<sub>3</sub>O]<sup>+</sup> [ClO<sub>4</sub>]<sup>−</sup> |
|||
N<sub>2</sub>O<sub>3</sub> + 2 HBF<sub>4</sub> → 2 [N≡O]<sup>+</sup> [BF<sub>4</sub>]<sup>−</sup> + H<sub>2</sub>O |
|||
== Altri progetti == |
== Altri progetti == |
||
| Riga 29: | Riga 62: | ||
== Collegamenti esterni == |
== Collegamenti esterni == |
||
{{Collegamenti esterni}} |
|||
{{Ossidi}} |
{{Ossidi}} |
||
Versione delle 23:40, 15 feb 2024
| Triossido di diazoto | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triossido di diazoto | |
| Nomi alternativi | |
| anidride nitrosa, ossido di azoto(III) sesquiossido di azoto (arcaico) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2O3 |
| Aspetto | solido o liquido blu |
| Numero CAS | |
| Numero EINECS | 234-128-5 |
| PubChem | 61526 |
| SMILES | N(=O)[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | reagisce |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
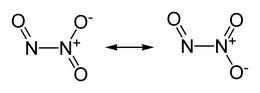
Il triossido di diazoto, nome sistematico ossido di azoto(III) e noto come anidride nitrosa in nomenclatura tradizionale, è un ossido dell'azoto di formula molecolare N2O3 in cui N è allo stato di ossidazione +3 (medio[1]): in formula semistrutturale è ON−N(O)2, dove un atomo di azoto è +2 e l'altro +4. Nonostante questa insolita struttura, formalmente è l'anidride dell'acido nitroso,[2] ma si mostra esserlo anche di fatto (vide infra). Questa forma molecolare vale nella condizione più stabile per questo composto, che si ha a basse temperature, sia allo stato solido che in parte allo stato liquido (punto di fusione -100,7 °C, punto di ebollizione ~ 3,5 °C), entrambi di colore azzurro.[3]
Già in parte allo stato liquido, infatti, ma specialmente allo stato di vapore si instaura un equilibrio di dissociazione in monossido di azoto e biossido di azoto e il grado di dissociazione aumenta all'aumentare della temperatura:
La dissociazione e quindi la formazione dei prodotti inizia ad essere apprezzabile a partire da circa -30 °C.[5]
Proprietà
Il triossido di diazoto è già scarsamente stabile di suo, essendo un composto piuttosto endotermico, ΔHƒ° = +84,82 kJ/mol [6] e l'altro suo possibile isomero molecolare (O=N−O−N=O, nitrito di nitrosile, la forma attesa per l'anidride nitrosa) è ancora meno stabile (ΔHƒ°calcolato = +97,9 kJ/mol)[7] e di esso si conosce solo qualche dato spettrale.[8] Un terzo possibile isomero sarebbe quello ionico, nitrito di nitrosonio [NO+ NO2−] che è sconosciuto materialmente, ma calcoli teorici prevedono per esso un'entalpia di formazione standard parecchio più alta, almeno 113,8 kJ/mol.[9]
Il triossido di diazoto è solubile in tetracloruro di carbonio, cloroformio, benzene e toluene, dando in ogni caso soluzioni azzurre.[10]
Da indagini spettroscopiche rotazionali nella regione delle microonde su N2O3 si ricava che la molecola è planare con simmetria Cs[11] ed alquanto polare (μ = 2,12 D).[12] Da indagini spettroscopiche infrarosse, effettuate in alta risoluzione con trasformata di Fourier sul vapore di N2O3 a 230 K (-43 °C), risulta, tra l'altro, che il legame N−N è insolitamente lungo, ben 186,4 pm, e quindi presumibilmente molto debole;[13] per confronto, il valor medio di tale legame ammonta a 147 pm.[14] e nell'idrazina (H2N−NH2) è ancora un po' più corto (145 pm).[15] In questo contesto è bene comunque notare che anche il legame N−N nel tetrossido di diazoto (O2N−NO2), che è soggetto a dissociazione è anch'esso molto lungo: 178,2 pm.[16]
Sintesi e reattività
La maniera più semplice di ottenere il triossido di diazoto consiste nel far condensare a bassa temperatura (< -20 °C) il monossido e il biossido:
NO + NO2 ⇄ N2O3
Un'altra via consiste nel far reagire a bassa temperatura il tetrossido di diazoto liquido con carbonato di litio, in presenza di tracce di umidità:[17]
Li2CO3 (s) + N2O4 (liq) → 2 LiNO3 + N2O3 + CO2
La reattività di N2O3 in condizioni ordinarie è spesso approssimabile a quella di una miscela equimolecolare di monossido di azoto NO e diossido di azoto NO2. Nonostante che la struttura della molecola non sia quella normale per un'anidride inorganica e nonostante la dissociazione, la reazione di N2O3 con soluzioni acquose fornisce soluzioni di acido nitroso:
N2O3 + H2O → 2 HNO2
Questo, essendo un acido debole, nella soluzione è parzialmente dissociato in ione idrossonio e ione nitrito:
HNO2 + H2O ⇄ H3O+ + NO2− [ pKa = 3,29 ][18]
Questa trasformazione del triossido di diazoto in acqua è molto più rapida e completa se la soluzione è alcalina e in tal caso si ottengono i corrispondenti nitriti.[19]
Il triossido di diazoto reagisce con acidi molto forti, come l'acido perclorico o tetrafluoroborico, per generare i corrispondenti sali di nitrosonio:[20][21]
N2O3 + 3 HClO4 → 2 [N≡O]+ [ClO4]− + [H3O]+ [ClO4]−
N2O3 + 2 HBF4 → 2 [N≡O]+ [BF4]− + H2O
Altri progetti
 Wikimedia Commons contiene immagini o altri file su triossido di diazoto
Wikimedia Commons contiene immagini o altri file su triossido di diazoto
Collegamenti esterni
- (EN) dinitrogen trioxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- ^ Al quale numero di ossidazione fa riferimento il nome sistematico.
- ^ (DE) Ralf Steudel, Chemie der Nichtmetalle, 4ª ed., Walter de Gruyter GmbH, 2014, p. 366.
- ^ Norman Neill Greenwood e Alan Earnshaw, 11 - Nitrogen, in Chemistry of the elements, 2nd ed, Butterworth-Heinemann, 1997, p. 444, ISBN 978-0-7506-3365-9.
- ^ Norman Neill Greenwood e Alan Earnshaw, 11 - Nitrogen, in Chemistry of the elements, 2nd ed, Butterworth-Heinemann, 1997, p. 454, ISBN 978-0-7506-3365-9.
- ^ Michael Binnewies, Maik Finze e Manfred Jäckel, Allgemeine und anorganische Chemie, collana Lehrbuch, 3., vollständig überarbeitete Auflage, Springer Spektrum, 2016, p. 566, DOI:10.1007/978-3-662-45067-3, ISBN 978-3-662-45066-6.
- ^ M. W. Chase, NIST-JANAF Themochemical Tables, Fourth Edition, 1998, pp. 1–1951. URL consultato il 15 febbraio 2024.
- ^ (EN) I. I. Zakharov e O. I. Zakharova, Nitrosonium nitrite isomer of N2O3: Quantum-chemical data, in Journal of Structural Chemistry, vol. 50, n. 2, 1º aprile 2009, pp. 212–218, DOI:10.1007/s10947-009-0031-1. URL consultato il 15 febbraio 2024.
- ^ Experimental data for ONONO (Nitrosyl nitrite), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ (EN) I. I. Zakharov e O. I. Zakharova, Nitrosonium nitrite isomer of N2O3: Quantum-chemical data, in Journal of Structural Chemistry, vol. 50, n. 2, 1º aprile 2009, pp. 212–218, DOI:10.1007/s10947-009-0031-1. URL consultato il 15 febbraio 2024.
- ^ Georg Brauer, Handbook of Preparative Inorganic Chemistry, vol. 1, 1963, p. 488, DOI:10.1016/b978-0-12-395590-6.x5001-7. URL consultato il 15 febbraio 2024.
- ^ Experimental data for N2O3 (Dinitrogen trioxide), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ (EN) K.-H. Hellwege, A. M. Hellwege (a cura di), Molecular Constants from Microwave, Molecular Beam, and Electron Spin Resonance Spectroscopy, in Landolt-Börnstein - Group II Molecules and Radicals, 1974, DOI:10.1007/b19951. URL consultato il 15 febbraio 2024.
- ^ (EN) Leslie A. Chewter, Ian W.M. Smith e Gregory Yarwood, A high resolution FTIR spectroscopic study of the nv 1 ( n = 1–4) bands of N 2 O 3, in Molecular Physics, vol. 63, n. 5, 10 aprile 1988, pp. 843–864, DOI:10.1080/00268978800100601. URL consultato il 15 febbraio 2024.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ Experimental data for N2H4 (Hydrazine), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ Bruce W. McClelland, Grete Gundersen e Kenneth Hedberg, Reinvestigation of the Structure of Dinitrogen Tetroxide, N2O4, by Gaseous Electron Diffraction, in The Journal of Chemical Physics, vol. 56, n. 9, 1º maggio 1972, pp. 4541–4545, DOI:10.1063/1.1677901. URL consultato il 15 febbraio 2024.
- ^ Rajni Garg e Randhir Singh, 6. Non-aqueous Solvents, in Inorganic Chemistry, McGraw Hill Education, 2015.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 825, ISBN 978-3-11-026932-1.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103. Auflage, De Gruyter, 2017, pp. 810-811, ISBN 978-3-11-026932-1.
- ^ James E. House e James Evan House, Inorganic chemistry, Elsevier Academic Press, 2008, p. 491, ISBN 978-0-12-356786-4.
- ^ Georg Brauer, Handbook of Preparative Inorganic Chemistry, vol. 1, 1963, p. 224, DOI:10.1016/b978-0-12-395590-6.x5001-7. URL consultato il 15 febbraio 2024.
