Tetracloruro di carbonio
| Tetracloruro di carbonio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| tetraclorometano | |
| Nomi alternativi | |
| tetracloruro di carbonio
perclorometano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CCl4 |
| Peso formula (u) | 153,8 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-262-8 |
| PubChem | 5943 |
| SMILES | C(Cl)(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,594 |
| Solubilità in acqua | 0,8 g/l a 293 K |
| Temperatura di fusione | −23 °C (250 K) |
| Temperatura di ebollizione | 77 °C (350 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −128,2 |
| S0m(J·K−1mol−1) | 216 |
| C0p,m(J·K−1mol−1) | 130,7 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 301+311+331 - 317 - 351 - 372 - 412 - 420 |
| Consigli P | 261 - 273 - 280 - 301+310+330 - 403+233 - 502 [1] |
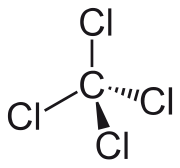
Il tetracloruro di carbonio è un composto binario del carbonio con il cloro, avente formula molecolare CCl4.[2] È noto in chimica organica anche con il nome sistematico tetraclorometano in quanto membro degli alometani tetrasostituiti.[3] In questa molecola l'atomo centrale di carbonio si lega covalentemente a quattro atomi di cloro, raggiungendo così il suo massimo stato di ossidazione (+4), come in CO2, oltre al suo massimo numero di coordinazione (4).
È un composto sintetico e uno dei più tipici solventi apolari,[3] come anche il solfuro di carbonio CS2, rispetto al quale ha il vantaggio di essere chimicamente molto più inerte, ma anche meno volatile. Tuttavia, il suo uso è sempre più in declino a causa della sua pericolosità per la salute e per i suoi effetti dannosi sullo strato di ozono.[4] Il CCl4 è noto anche con le sigle commerciali freon 10, CFC 10, o R-10.
A temperatura ambiente si presenta come un liquido volatile, incolore, non infiammabile, denso (d = 1,594 g/mL), dal caratteristico odore dolciastro, avvertibile anche a basse concentrazioni. In acqua è quasi insolubile (793 mg/L at 25 °C); è completamente miscibile con benzene, cloroformio, etere, solfuro di carbonio, etere di petrolio ed è solubile in alcool e acetone.[5]
È un composto molto tossico perché capace di innescare reazioni a catena radicaliche che degradano le membrane cellulari. Non essendo combustibile, è stato usato in passato negli estintori come liquido di raffreddamento, ma è stato via via sostituito da altri composti per via della sua tossicità.
Struttura molecolare e proprietà[modifica | modifica wikitesto]
Il tetracloruro di carbonio è un composto stabile, ΔHƒ° = -128,1±2,5 kJ/mol.[6] La molecola CCl4 è esattamente tetraedrica e ha perciò simmetria Td,[7] con l'atomo di carbonio centrale ibridato sp3. Il suo momento dipolare è di conseguenza nullo perché si annulla la somma vettoriale dei momenti dipolari e la molecola è quindi apolare.
Da indagini di diffrazione elettronica è stato possibile ricavare la struttura geometrica della molecola:[7][8] la lunghezza del legame C–Cl risulta essere 176,7 pm e questa è appena più corta della lunghezza media dei legami C–Cl (177 pm[9]). Le reciproche distanze tra gli atomi di cloro (Cl…Cl) sono di 288,55 pm, mentre la distanza attesa per interazioni di non legame tra due atomi cloro sarebbe 2 rvdW, cioè un valore nell'intervallo 358 pm - 380 pm.[10]
Il potenziale di ionizzazione del CCl4 è abbastanza alto, pari a 11,47 eV,[11] ma notevolmente minore di quello di CF4,14,7±0,3 eV.[12] Il tetracloruro di carbonio, a differenza del tetrafluoruro, ma analogamente a CBr4 e CI4, può prendere su di sé un elettrone esotermicamente: la sua affinità elettronica, seppur piccola, ammonta a 0,80±0,34 eV.[11]
Produzione[modifica | modifica wikitesto]
La maggior parte del tetracloruro di carbonio è prodotta per reazione tra solfuro di carbonio e cloro alla temperatura di 105-130 °C:
Piccole quantità sono anche ottenibili come sottoprodotto della sintesi del diclorometano e del cloroformio.
Utilizzi[modifica | modifica wikitesto]
All'inizio del XX secolo il tetracloruro di carbonio era ampiamente usato come solvente per il lavaggio a secco, come liquido di raffreddamento e negli estintori. Era presente in flaconi nelle infermerie (ospedali da campo) del Regio Esercito nella prima guerra mondiale.
Dal 1940 il suo impiego comincia a diminuire, per via della sua dimostrata tossicità.Trova a volte uso anche in spettroscopia 1H-RMN e infrarossa per via dell'assenza di atomi di idrogeno nella sua struttura.
Prima della stipula del protocollo di Montréal, grandi quantità di tetracloruro di carbonio erano impiegate per produrre i freon R-11 e R-12, oggi non più usati per via del loro effetto deleterio sullo strato di ozono dell'alta atmosfera. È tuttavia ancora una materia prima per la produzione di freon meno distruttivi.
Il tetracloruro di carbonio è stato impiegato per il rilevamento dei neutrini.
Viene utilizzato come reagente/solvente nella reazione di Zincke-Suhl e, come il cloroformio, funge da sorgente di cloro nella reazione di Appel.
Tossicità[modifica | modifica wikitesto]
L'esposizione ad elevate concentrazioni di tetracloruro di carbonio, anche in forma di vapori, colpisce il sistema nervoso centrale, incluso il cervello. Le vittime avvertono mal di testa, nausea, confusione, sonnolenza e vomito. In casi gravi si può arrivare al coma. Un'intossicazione acuta causa inoltre un'insufficienza epatica fulminante con alta mortalità. La cura consiste nella tempestiva prescrizione di prostaciclina.
L'esposizione cronica e prolungata può danneggiare fegato e reni; l'effetto deleterio a carico del fegato è amplificato dalla presenza di alcol. I danni sono reversibili, se l'esposizione viene fermata in tempo.
L'ingestione cronica è correlata al cancro al fegato negli animali; studi sugli esseri umani non sono disponibili, ma molte autorità considerano questo composto un agente cancerogeno quasi certo. Sarebbe infatti un cancerogeno indiretto, ovvero necessitante di attivazione metabolica, attraverso le reazioni di fase I e II. Il tetracloruro di carbonio viene metabolizzato a livello epatico dal citocromo p450 con produzione di CCl3, un radicale altamente reattivo in grado di innescare danno da specie radicaliche alle componenti cellulari, e specialmente agli acidi nucleici, con azione genotossica. Il radicale CCl3 è inoltre in grado di perossidare i fosfolipidi del reticolo endoplasmatico che perde la propria funzionalità; condizione propedeutica all'insorgenza della steatosi epatica microvescicolare.
La reazione con acqua ad alte temperature (condizione tipica di un incendio) porta all'incompleta decomposizione del composto con formazione di acido cloridrico e di cloruro di carbonile (fosgene) ben più tossico del composto di partenza. La reazione è:
Note[modifica | modifica wikitesto]
- ^ scheda della sostanza su [1]
- ^ F. Albert Cotton, Geoffrey Wilkinson, Carlos A. Murillo e Manfred Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley Interscience, 1999, pp. 222-223, ISBN 0-471-19957-5.
- ^ a b James E. House, Inorganic Chemistry, Elsevier, 2008, p. 456, ISBN 978-0-12-356786-4.
- ^ Wayback Machine (PDF), su web.archive.org, 27 febbraio 2008. URL consultato il 14 marzo 2023 (archiviato dall'url originale il 27 febbraio 2008).
- ^ (EN) PubChem, Carbon Tetrachloride, su pubchem.ncbi.nlm.nih.gov. URL consultato il 14 marzo 2023.
- ^ (EN) Carbon Tetrachloride, su webbook.nist.gov. URL consultato il 14 marzo 2023.
- ^ a b CCCBDB Experimental Data page 1, su cccbdb.nist.gov. URL consultato il 14 marzo 2023.
- ^ (EN) Structure of Free Polyatomic Molecules, DOI:10.1007/978-3-642-45748-7. URL consultato il 14 marzo 2023.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chemical Forces, in Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, p. 300, ISBN 88-299-1470-3.
- ^ a b (EN) Carbon Tetrachloride, su webbook.nist.gov. URL consultato il 14 marzo 2023.
- ^ (EN) Robert W. Kiser e Don L. Hobrock, The Ionization Potential of Carbon Tetrafluoride, in Journal of the American Chemical Society, vol. 87, n. 4, 1965-02, pp. 922–923, DOI:10.1021/ja01082a047. URL consultato l'11 marzo 2023.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su tetracloruro di carbonio
Wikimedia Commons contiene immagini o altri file su tetracloruro di carbonio
Collegamenti esterni[modifica | modifica wikitesto]
- Tetracloruro di carbonio, sulla Matrice di esposizione a cancerogeni - MATline, su dors.it., su dors.it.
- (EN) carbon tetrachloride, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 39013 · LCCN (EN) sh85020127 · GND (DE) 4184864-0 · J9U (EN, HE) 987007283484905171 · NDL (EN, JA) 00576051 |
|---|

