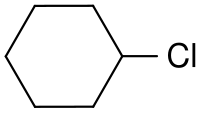
Clorocicloesano
| Clorocicloesano | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Clorocicloesano | |
| Nomi alternativi | |
| Cloruro di cicloesile Cicloesilcloruro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C6H11Cl |
| Massa molecolare (u) | 118,60454 |
| Numero CAS | |
| Numero EINECS | 208-806-6 |
| PubChem | 10952 |
| SMILES | C1CCC(CC1)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,00 a 20 °C |
| Indice di rifrazione | 1,4626 a 20 °C |
| Solubilità in acqua | 500 mg/L a 25 °C |
| Temperatura di fusione | −44 °C |
| Temperatura di ebollizione | 142 °C |
| Indicazioni di sicurezza | |
| Punto di fiamma | 90 F |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 226 - 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 [1] |
Il clorocicloesano, o cloruro di cicloesile, è un alogenuro alchilico derivato dal cicloesano in cui un atomo di idrogeno è stato sostituito con un atomo di cloro. Appare come un liquido incolore e dallo sgradevole odore caratteristico, poco solubile in acqua ma ben miscibile con cloroformio, acetone, benzene, dietiletere ed etanolo[2].
Sintesi[modifica | modifica wikitesto]
Il clorocicloesano può essere ottenuto per alogenazione del cicloesano con pentacloruro di fosforo, eseguita in una soluzione anidra di 1,2-diclorobenzene a circa 80 °C contenente perossido di benzoile con funzione catalitica. Tale metodo di sintesi ha una resa del 70%[3]:
- C6H12 + PCl5 → C6H11Cl
Un secondo metodo per ottenere il clorocicloesano consiste nell'alogenazione del cicloesano da parte del cloruro di solforile in solvente anidro, catalizzato da azobisisobutilonitrile e portato ad elevate temperature[4]:
Reattività[modifica | modifica wikitesto]
Il clorocicloesano è un composto infiammabile, sia allo stato liquido che in quello di vapore. Se opportunamente riscaldato si decompone liberando fumi tossici di acido cloridrico[2].
Note[modifica | modifica wikitesto]
- ^ Clorocicloesano - scheda di dati di sicurezza (PDF), su Sigma-Aldrich. URL consultato il 29 luglio 2015.
- ^ a b (EN) Chlorocyclohexane, su Hazardous Substances Data Bank, National Library of Medicine. URL consultato il 29 luglio 2015.
- ^ Science of Synthesis: Houben-Weyl Methods of Molecular Transformations, p. 28.
- ^ (EN) Preparation and characterisation of Chlorocyclohexane (PDF), su chem.elte.hu, Università Loránd Eötvös. URL consultato il 29 luglio 2015.
Bibliografia[modifica | modifica wikitesto]
- (EN) Daniel Bellus, Manfred Braun, Tonia Freysoldt, Richard Göttlich, Jens Hartung, Monica Härtinger, Stefan Härtinger, Paul Margaretha, Wolf-Diethard Pfeiffer, Kathrin-Maria Roy, Karola Rück-Braun, Ernst Schaumann, Theodor Troll e Henri Ulrich, Science of Synthesis: Houben-Weyl Methods of Molecular Transformations, vol. 35, Georg Thieme Verlag, 2014, ISBN 978-3-13-118871-7. URL consultato il 29 luglio 2015.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su clorocicloesano
Wikimedia Commons contiene immagini o altri file su clorocicloesano