Mieloma multiplo
| Mieloma multiplo | |
|---|---|
 | |
| Specialità | ematologia |
| Classificazione e risorse esterne (EN) | |
| ICD-O | 9732/3 |
| ICD-9-CM | 203.0 |
| OMIM | 254500 |
| MeSH | D009101 |
| MedlinePlus | 000583 |
| eMedicine | 204369 |
| Sinonimi | |
| Mieloma Plasmocitoma maligno Mielomatosi Mieloma plasmacellulare Malattia di Kahler-Bozzolo | |
Il mieloma multiplo (MM), noto anche come malattia di Kahler-Bozzolo, è una neoplasia sostenuta dalla proliferazione di un clone neoplastico di natura plasmacellulare, cellule appartenenti al sistema immunitario presenti soprattutto nel midollo osseo che hanno la funzione di produrre anticorpi. Si tratta di un tumore ematico e linfatico e per lo più di una patologia dell'anziano, dato che solo il 18% dei pazienti in media è più giovane di 50 anni alla diagnosi.
Eziologia[modifica | modifica wikitesto]
Il MM ha base oncogenica ma la sua reale causa non è nota. Di sicuro le radiazioni ionizzanti hanno un ruolo causale, data la sua alta incidenza tra i sopravvissuti delle esplosioni atomiche, gli esposti a scorie nucleari e tra i radiologi esposti per lungo tempo per ragioni professionali. Una incidenza più alta della media è stata riportata anche tra i contadini che hanno maneggiato certe classi di pesticidi o insetticidi, o coloro che hanno vissuto in zone agricole dove tali prodotti sono stati utilizzati; inoltre un'alta incidenza nei lavoratori o in coloro che hanno maneggiato o respirato solventi chimici a base di benzene, toluene, xylene, e derivati del petrolio[1], in rari casi amianto[2][3], in persone esposte all'erbicida agente arancio[3], o in individui che sono stati esposti a particolari infezioni, condizioni e sostanze che hanno stimolato eccessivamente l'attività dei globuli bianchi fagociti mononucleati.[4]
Altri fattori di rischio includono la familiarità genetica, l'obesità e la sindrome metabolica, la presenza di gammopatia monoclonale di significato incerto (MGUS). [5][6][7][8] Raramente, il virus di Epstein-Barr (EBV), agente della mononucleosi, è associato allo sviluppo di mieloma nei pazienti con immunodeficienza acquisita, come gli affetti da AIDS, trapianto con immunosoppressione, o da condizioni infiammatorie croniche autoimmuni in particolare l'artrite reumatoide.[9]
Patogenesi molecolare[modifica | modifica wikitesto]
Dalle analisi citogenetiche convenzionali è emerso che nel 30-59% dei pazienti mielomatosi è possibile che si creino anomalie cariotipiche. L'estensione e la frequenza di queste è correlabile con lo stadio della malattia, con la prognosi e la risposta primaria alla terapia. Per esempio, rientra nella media trovare circa il 20% di anomalie al I stadio della malattia, che diventano il 60% allo stadio III e più dell'80% quando esistono metastasi extra-midollari disseminate.
Caratteristiche anomalie numeriche sono la monosomia 13 e le trisomie dei cromosomi 3, 5, 7, 9, 11, 15 e 19. Anomalie strutturali non casuali più frequentemente coinvolgono il cromosoma 1, con nessuna apparente specificità di locus: il 14q32 (IgH) nel 20-40%; il locus 11q13 (bcl-1) in circa il 20% dei casi ma per lo più è traslocato su 14q32; si registra la delezione interstiziale 13q14 nel 15% dei casi ed il coinvolgimento del locus 8q24 in circa il 10%.
La lesione genetica principale in molti tumori dei linfociti B coinvolge l'attivazione di un oncogene, come conseguenza di una traslocazione a carico del locus IgH (14q32.2), o meno frequentemente traslocazioni variabili su uno dei loci IgL variabili (2p12, kappa o 22q11, lambda). Dalle analisi citogenetiche si rileva molto spesso (circa il 40%) la traslocazione per 14q32; e ben nel 30% di queste il locus cromosomiale partner e 11q13 (geni per ciclina D1 e Bcl-1), mentre un 5% spetta al locus per l'oncogene cMyc (8q24).
Analisi più sofisticate hanno permesso di scoprire che l'oncogene disregolato dalla traslocazione 4;14 è quello per il recettore tipo III del fattore di crescita dei fibroblasti (FGFR3). L'analisi del background immunogenetico del mieloma multiplo si è comunque dimostrata fondamentale per comprendere lo sviluppo della malattia[10]
Mutazioni del gene di Ras avvengono in circa il 39% dei pazienti con mieloma multiplo appena diagnosticato e la loro frequenza aumenta con la progressione della malattia. N-Ras e K-Ras raramente sono mutati in plasmocitomi solitari, ma la loro frequenza può raggiungere il 30% nella forma multipla e circa il 70% nella forma disseminata. Mutazioni attivanti di Ras possono portare all'indipendenza cellulare dai fattori di crescita e alla soppressione della morte cellulare programmata o apoptosi dei linfociti B mielomatosi.
La traslocazione 14q18 coinvolge la proteina anti-apoptotica Bcl-2, la quale conferisce protezione e resistenza all'apoptosi dagli effetti del desametasone, deprivazione di citochine trofiche (IL-6) e farmaci citotossici. Le mutazioni a carico dell'oncogene retinoblastoma (Rb) sono molto frequenti nel MM (fino al 70% dei pazienti) e le cellule tumorali esprimono una proteina Rb iperattiva (a causa di una iper-fosforilazione), che controlla l'entrata della cellula nel ciclo cellulare. All'opposto di quanto avviene nei linfociti B normali, il fattore di crescita trasformante β (TGF-β) non sopprime la fosforilazione di Rb, ma anzi stimola la crescita delle cellule mielomatose nonostante vi sia una elevata presenza di p16INK4, un inibitore di alcune chinasi ciclina-dipendenti.
Infine, la mutazione dell'oncosoppressore p53 è un evento raro nel MM (nel 5% dei mielomi inattivi) e se avviene, si presenta solo nello stadio molto avanzato della malattia.
Le plasmacellule, che derivano dai linfociti B e producono immunoglobulina, sono normalmente in minoranza ma nei pazienti con mieloma aumentano a dismisura riducendo gli altri anticorpi, i globuli rossi e le piastrine nel sangue, che il midollo osseo non riesce più a produrre. Vengono prodotti anticorpi anomali che danneggiano le ossa e i reni. La proteina M (proteina monoclonale delle immunoglobuline) prodotta dalle plasmacellule neoplastiche è di tipo IgG in circa il 55% dei pazienti affetti da mieloma e IgA in circa il 20%.[1] Si sviluppano osteoporosi, lesioni osteolitiche dovute alla sostituzione del tessuto osseo da parte dei plasmocitomi in espansione o alle citochine emesse dalle plasmacellule maligne. Esse attivano gli osteoclasti e sopprimono gli osteoblasti. La perdita della massa ossea può anche portare a ipercalcemia e danno renale. I plasmocitomi solitari extraossei sono molto rari, ma possono comparire ovunque, soprattutto nel tratto respiratorio superiore.[1]
Sintomatologia[modifica | modifica wikitesto]
Poiché diversi organi possono essere affetti da questa patologia i suoi sintomi variano notevolmente da paziente a paziente e spesso vengono confusi con sintomi di altre patologie. Normalmente i sintomi, denominati CRAB (dall'inglese: "increased calcium, renal insufficiency, anaemia, or bone lesions [11]; ipercalcemia, insufficienza renale, anemia, lesioni ossee), sono:
- Dolore osseo, normalmente localizzato lungo la colonna vertebrale, ma può tuttavia presentarsi in qualsiasi altra zona dello scheletro. Non è inusuale che il dolore scaturisca poi in una vera e propria frattura a causa del progressivo indebolimento dell'osso colpito. Il dolore osseo e le possibili fratture sono causate dalla proliferazione delle cellule tumorali nel midollo e dal rilascio di Interleuchina 6 (IL-6), una proteina prodotta dalle cellule del sistema immunitario che induce alla produzione di osteoclasti, cellule che hanno la funzione di riparare i traumi ossei ma che se in sovrapproduzione ne induce invece la frattura. La rottura ossea, se è di una certa estensione, provoca una maggior concentrazione di calcio nel sangue con la conseguente fase di ipercalcemia (eccessiva presenza di calcio nel sangue).
- Insufficienza renale (nefropatia da mieloma multiplo): è una condizione che molto frequentemente si associa a questa patologia ed è spesso asintomatica, ovvero viene scoperta casualmente con le dovute analisi. Essa è spesso frutto dell'ipercalcemia e dell'iperuricemia, ma può essere anche causa del rilascio eccessivo di proteine di Bence Jones nel tubulo renale, che può indurre alla patologia nota come sindrome di Fanconi dell'adulto
- Ipercalcemia
- Astenia e debolezza generale, anche in questo caso prodotte dall'ipercalcemia. Questo stato può portarsi fino alla cefalea, a diverse forme di retinopatia, tutte frutto dell'eccessiva viscosità del sangue causata dalla produzione eccessiva di proteine di Bence Jones.
- Neuropatia
- Amiloidosi
- Anemia, causata dalla mancata produzione di cellule ematiche a favore delle cellule tumorali che si infiltrano nel midollo.
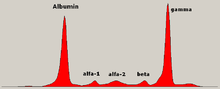
L'esame diagnostico che può far sospettare il mieloma multiplo è l'elettroforesi delle sieroproteine nel quale compare un picco monoclonale delle Gamma-globuline dovuto alla produzione di anticorpi monospecifici che derivano dai cloni della plasmacellula che ha subito la mutazione.
Terapia[modifica | modifica wikitesto]
Chemioterapici classici[modifica | modifica wikitesto]
Prima della comparsa dei moderni farmaci antineoplastici, vi erano pochissime soluzioni per fronteggiare la malattia:
- la radioterapia totale (total body),
- cortisonici come il desametasone col doppio scopo di frenare sia la proliferazione cellulare sia gli eventi febbrili
- e l'uretano etilico, un anestetico generale dotato però di proprietà alchilanti.
Nuova chemioterapia[modifica | modifica wikitesto]
Nuove terapie comprendono:
- l'uso della talidomide e dei suoi derivati (lenalidomide e pomalidomide). Questi composti bloccano la produzione del fattore di necrosi tumorale α (TNF-α) da parte delle plasmacellule tumorali, che lo usano come fattore di crescita e mediatore di molta della sintomatologia (febbre, osteopenia, ecc.). Gli studi preliminari sono stati molto incoraggianti, anche perché questi farmaci sono relativamente poco tossici e la grande maggioranza dei pazienti trattati sembra rispondere bene. Negli Stati Uniti, la lenalinomide è già approvata per sottogruppi di pazienti che sviluppano mieloma multiplo come risultato di una previa mielodisplasia;
- l'inibitore del proteasoma bortezomib, approvato e dato in combinazione col melphalan;
- l'ABT-737, un antagonista della proteina Bcl-2.
Tuttavia la ricerca farmacologica per questa malattia continua: nel giugno 2008 è stato pubblicato, da parte di un gruppo giapponese dell'Università di Kyoto, un articolo che ha riportato come l'alcaloide omo-harringtonina sia molto potente in vitro nell'uccidere le cellule mielomatose. Un altro gruppo del Dana Farber Cancer Institute di Boston, invece, ha scoperto che un composto organico isolato da un organismo marino, l'aplidina, è risultata molto potente nell'uccidere sia cellule mielomatose coltivate, sia trapiantate in topi (xeno-graft). L'effetto per entrambi i composti è quello di stimolare l'apoptosi o morte cellulare programmata.
Infine, per tamponare gli effetti immunosoppressori della chemioterapia (rischio di infezioni), può essere d'aiuto la somministrazione di gamma-globuline e l'uso dei fattori di crescita G-CSF e GM-CSF per aiutare la "ripresa" della componente granulocitaria.
Trapianto delle cellule midollari[modifica | modifica wikitesto]
Alternative non farmacologiche comprendono il trapianto di midollo osseo allogenico e il trapianto autologo di midollo, specialmente trapianto di cellule staminali. Viene utilizzato, in quasi tutti i pazienti con buona sopravvivenza, il trapianto di cellule staminali ematopoietiche autologhe prelevate da striscio di sangue periferico, dopo aver stabilizzato il paziente tramite le altre terapie.[12][13]
Terapia genica e immunoterapia[modifica | modifica wikitesto]
L'immunoterapia con anticorpi monoclonali tramite CAR-T (ricettore chimerico antigene-specifico) può venire utilizzata. In particolare la ciltacabtagene autoleucel (Carvykti), una forma di terapia genica, è stata approvata dalla Food and Drug Administration nel febbraio 2022, per il "trattamento di adulti con mieloma multiplo recidivato o refrattario (RRMM) dopo quattro o più linee precedenti di terapia, compresi un inibitore del proteasoma, un agente immunomodulante e un anticorpo monoclonale anti-CD38". Esso consentirebbe dei lunghi periodi di remissione, diminuendo le recidive improvvise che sono la principale causa di peggioramento, con possibilità di sospendere temporaneamente le cure chemioterapiche.[14]
Terapie palliative, di supporto e per patologie collegate[modifica | modifica wikitesto]
La chemioterapia associata alla radioterapia palliativa e alla terapia del dolore può tamponare molta della fenomenologia decalcificante e dolorosa del paziente. I farmaci classici sono:
- melphalan (agente alchilante)
- gli steroidi prednisone o desametasone,
- le nitrosouree carmustina (BCNU) e bendamustina;
- la vincristina (anti-mitotico)
La loro combinazione può portare il 40% dei pazienti alla risposta completa. Nei casi di refrattarietà al melphalan, la ciclofosfamide si è dimostrata attiva combinata con un altro steroide, il metil-prednisolone. L'uso aggiuntivo di fosfonati come l'alendronato e il clodronato, rallentano di molto la sintomatologia osteoporotica e dolorosa. Il paziente può utilizzare sostegni ortopedici.
Utilizzo dei bifosfonati[modifica | modifica wikitesto]
In circa l'80% dei pazienti affetti da mieloma multiplo ricorre la malattia ossea, con possibili fratture patologiche, compressioni midollari e radicolari con conseguente sintomatologia dolorosa. Tali eventi scheletrici peggiorano la qualità di vita e riducono complessivamente la sopravvivenza dei pazienti. La prevenzione di SRE è pertanto un importante obiettivo della terapia di supporto nel mieloma multiplo.
I bifosfonati (zoledronato e pamidronato) si sono rilevati farmaci attivi ed efficaci nel ridurre tale rischio[15]. Sebbene esistano farmaci di nuova generazione, come il denosumab, al momento questi ultimi non hanno ancora l'indicazione d'utilizzo nel mieloma multiplo, sebbene possano essere assai promettenti[16].
Indicazioni di impiego[modifica | modifica wikitesto]
L'uso di bifosfonati è raccomandato solo nel mieloma sintomatico. In tutti i pazienti con funzionalità renale nella norma, l'inizio della terapia con bifosfonati solitamente coincide con l'avvio della terapia per il mieloma. Pamidronato e zoledronato hanno simile efficacia nella prevenzione delle fratture[17]. La terapia deve essere di durata massima di due anni (24 somministrazioni mensili); oltre i due anni la terapia è da riservare solo a casi selezionati.
Problematiche particolari[modifica | modifica wikitesto]
La terapia con bifosfonati può esporre a rischio di problematiche odontoiatriche come l'osteonecrosi mandibolare o mascellare, per cui un'eventuale bonifica dentaria deve possibilmente essere fatta prima dell'inizio dei bifosfonati. Durante la terapia, è utile un monitoraggio di eventuali problemi odontoiatrici (dolore, disagio mandibolare o mascellare). Il paziente deve eseguire adeguata igiene orale; eventuali interventi odontoiatrici, di qualsiasi natura, sono da effettuare dopo valutazione ematoncologica e odontoiatrica, solo in caso di reale necessità e sotto profilassi antibiotica[18].
La valutazione della funzionalità renale deve essere costante con monitoraggio della creatininemia o, meglio, calcolo della creatinina clearance e, in caso di compromissione renale, il dosaggio del farmaco deve essere adeguato o la terapia sospesa. Per la nefropatia, il paziente in taluni casi ha bisogno di sottoporsi all'emodialisi.
Prognosi[modifica | modifica wikitesto]
Il MM è attualmente ancora una malattia non guaribile ma certamente trattabile, che si può fronteggiare con diversi mezzi, rallentare e cronicizzare come diverse gravi neoplasie. Una guarigione duratura è possibile solo se il tumore è localizzato in un unico punto, come nel raro mieloma solitario (plasmocitoma extramidollare, plasmocitoma solitario) e in pazienti più giovani dopo il trapianto allogeno di midollo osseo. Lunghe remissioni con periodi liberi dalla malattia si possono ottenere grazie ai nuovi farmaci e al trapianto di cellule staminali.[19] Grazie all'introduzione dei nuovi farmaci, nei pazienti giovani (meno del 20 % dei casi) si è assistito negli ultimi anni a un progressivo allungamento della sopravvivenza mediana (che attualmente si attesta intorno ai 6-7 anni), mentre nei pazienti anziani la mediana di sopravvivenza non si è sostanzialmente modificata (attestandosi intorno ai 4 anni)[20]. Negli Stati Uniti il tasso di sopravvivenza a 5 anni dalla diagnosi è del 54 %, attestandosi su più della metà dei pazienti, secondo i dati del 2020. Il 5% delle persone che ricevono la diagnosi in una fase iniziale di malattia, hanno un tasso di sopravvivenza a 5 anni del 71%; se il tumore è già diffuso, è del 48 %.[21]
Negli Stati Uniti si sono verificati anche casi di lunga sopravvivenza e remissione sintomatica in pazienti non anziani e che sono stati sottoposti ai nuovi protocolli di trattamento con i farmaci talidomide, bortezomib, lenalidomide ed altri, seguiti dal trapianto autologo di cellule staminali ematopoietiche, eventualmente dagli anticorpi monoclonali e da terapie geniche, e infine dalla terapia fissa di mantenimento con gli stessi farmaci iniziali a dose bassa; in alcuni di questi pazienti, presi in esame da diversi studi, la sopravvivenza è anche superiore ai 15 anni dalla diagnosi.[22][23]
I principali pericoli per la vita e le cause di decesso del paziente con mieloma sono le complicazioni vascolari della sindrome da iperviscosità (malattia cardiovascolare, ictus, trombosi), la nefropatia da mieloma multiplo (rischio di insufficienza renale acuta o cronica, con possibile necessità di ricorrere a trapianto renale o emodialisi o incorrere in uremia e insufficienza cardiaca) e le infezioni opportuniste seguite all'immunodeficienza temporanea dovuta ai trattamenti (polmonite, sepsi).[24]
Note[modifica | modifica wikitesto]
- ^ a b c Mieloma multiplo (mielomatosi, mieloma plasmacellulare), di James R. Berenson, MD, Institute for Myeloma and Bone Cancer Research
- ^ B cell neoplasms and occupational asbestos exposure
- ^ a b [1] Multiple myeloma: risk factors]
- ^ Kathryn McCance, Sue Huether, Fisiopatologia ed elementi di patologia generale
- ^ Landgren O, Kyle RA, Pfeiffer RM, Katzmann JA, Caporaso NE, Hayes RB, Dispenzieri A, Kumar S, Clark RJ, Baris D, Hoover R, Rajkumar SV, Monoclonal gammopathy of undetermined significance (MGUS) consistently precedes multiple myeloma: a prospective study.
- ^ DL Roberts, C Dive, AG Renehan, Biological mechanisms linking obesity and cancer risk: new perspectives., in Annual Review of Medicine, 2010.
- ^ Koura DT, Langston AA, Inherited predisposition to multiple myeloma, in Therapeutic Advances in Hematology.
- ^ Schinasi LH, Multiple myeloma and family history of lymphohaematopoietic cancers: Results from the International Multiple Myeloma Consortium, in British Journal of Haematology.
- ^ Sekiguchi Y, Shimada A, Ichikawa K, Wakabayashi M, Sugimoto K, Ikeda K, Sekikawa I, Tomita S, Izumi H, Nakamura N, Sawada T, Ohta Y, Komatsu N, Noguchi M, Epstein-Barr virus-positive multiple myeloma developing after immunosuppressant therapy for rheumatoid arthritis: a case report and review of literature, in International Journal of Clinical and Experimental Pathology.
- ^ Glykeria Gkoliou, Andreas Agathangelidis e Georgos Karakatsoulis, Differences in the immunoglobulin gene repertoires of IgG versus IgA multiple myeloma allude to distinct immunopathogenetic trajectories, in Frontiers in Oncology, vol. 13, 2023, pp. 1123029, DOI:10.3389/fonc.2023.1123029. URL consultato il 17 marzo 2023.
- ^ International Myeloma Working Group, Criteria for the classification of monoclonal gammopathies, multiple myeloma and related disorders: a report of the International Myeloma Working Group, in Br. J. Haematol., vol. 121, n. 5, 2003, pp. 749-57, DOI:10.1046/j.1365-2141.2003.04355.x, PMID 12780789.
- ^ The remarkable scientist making new life connections, su app.secure.griffith.edu.au.
- ^ Myeloma: I am ready to enjoy each day more, su leukaemiaqld.org.au, Leukaemia Foundation. URL consultato il 27 gennaio 2017 (archiviato dall'url originale il 4 febbraio 2017).
- ^ FDA approves ciltacabtagene autoleucel for relapsed or refractory multiple myeloma, su fda.gov. URL consultato il 16 marzo 2022.
- ^ ASCO 2007 Clinical Practice Guideline Update on the Role of Bisphosphonates in Multiple Myeloma: Guideline Summary, in Journal of Oncology Practice, vol. 3, n. 4, 1º luglio 2007, p. 236, DOI:10.1200/JOP.0748502. URL consultato il 2 agosto 2016.
- ^ Allan Lipton, Karim Fizazi e Alison T. Stopeck, Superiority of denosumab to zoledronic acid for prevention of skeletal-related events: a combined analysis of 3 pivotal, randomised, phase 3 trials, in European Journal of Cancer (Oxford, England: 1990), vol. 48, n. 16, 1º novembre 2012, pp. 3082-3092, DOI:10.1016/j.ejca.2012.08.002. URL consultato il 2 agosto 2016.
- ^ Bisphosphonates in multiple myeloma - Mhaskar - 2010 - The Cochrane Library - Wiley Online Library[collegamento interrotto], DOI:10.1002/14651858.cd003188.pub2/otherversions. URL consultato il 2 agosto 2016.
- ^ Management e protocollo terapeutico delle osteonecrosi dei mascellari da bifosfonati. Mortellaro et Al 2012, linee guida SIDCO (PDF) (archiviato dall'url originale il 27 novembre 2013).
- ^ Mieloma: le cure, su myeloma-euronet.lhrm.de. URL consultato il 21 giugno 2022 (archiviato dall'url originale il 17 maggio 2021).
- ^ Informazioni sulle patologie ematologiche tra cui leucemia, linfomi e mieloma, su ail.it. URL consultato il 2 agosto 2016.
- ^ Mieloma multiplo: aspettativa di vita
- ^ These deaths are tragic - but the rotten truth of hospital food is even worse, SHEILA DILLON says - Daily Mail
- ^ Analysis of long-term survival in multiple myeloma after first-line autologous stem cell transplantation: impact of clinical risk factors and sustained response
- ^ (EN) Myeloma—Cancer Stat Facts, su SEER. URL consultato il 17 aprile 2020.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni di o su mieloma multiplo
Wikiquote contiene citazioni di o su mieloma multiplo Wikimedia Commons contiene immagini o altri file su mieloma multiplo
Wikimedia Commons contiene immagini o altri file su mieloma multiplo
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) David C. Williams, multiple myeloma, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- AIL, su ail.it.
| Controllo di autorità | Thesaurus BNCF 46839 · LCCN (EN) sh85088367 · BNE (ES) XX550059 (data) · BNF (FR) cb126493458 (data) · J9U (EN, HE) 987007550961905171 · NDL (EN, JA) 01103104 |
|---|