Pirene: differenze tra le versioni
Il pirene è un idrocarburico --> Il pirene è un idrocarburo |
ampliamento |
||
| Riga 74: | Riga 74: | ||
}} |
}} |
||
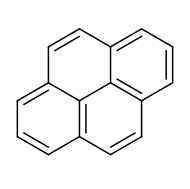
Il '''pirene''' è un idrocarburo [[Composti ciclici|tetraciclico]] avente formula C<sub>16</sub>H<sub>10</sub> e costituito da 4 [[Benzene|anelli benzenici]] condensati che condividono con gli altri anelli due o tre lati del proprio anello, e non uno solo, come accade nella serie degli [[aceni]] (come nelll'[[antracene]]) o in quella dei [[fenaceni]]<ref name=":0">{{Cita libro|autore=Michael B. Smith|autore2=Jerry March|titolo=MARCH’S ADVANCED ORGANIC CHEMISTRY|ed=8|anno=2020|lingua=en|pp=84-85|ISBN=9781119371786}}</ref> (come nel [[fenantrene]]). Sebbene sia annoverato tra gli [[idrocarburi policiclici aromatici]] (IPA), la sua molecola contiene un totale di 16 elettroni π (4n elettroni, con n = 4), rientrando così, formalmente, tra gli idrocarburi [[Composti antiaromatici|antiaromatici]] secondo la [[regola di Hückel]], la quale però è strettamente valida solo per composi monociclici. |
|||
Il '''pirene''' è un [[Idrocarburi policiclici aromatici|idrocarburo policiclico aromatico]] (IPA) costituito da 4 [[anelli benzenici]] condensati. |
|||
Tuttavia, il pirene può esser visto come un [14][[Annuleni|annulene]] (che è aromatico con n = 3, anche se non molto stabile) con all'interno un frammento >C=C< che connette i carboni di tale anello esterno [C(3a), C(5a), C(8a), C(10a)], oppure anche come un [[bifenile]] (anch'esso aromatico, molto stabile) cui si aggiungono due ponti vinilene (HC=CH) nelle stesse posizioni. Quest'ultima ipotesi è avvalorata, da un punto di vista teorico, dalla [[regola di Clar]]<ref>{{Cita libro|nome=Eric|cognome=Clar|titolo=The Aromatic Sextet|url=http://link.springer.com/10.1007/978-94-009-7197-4_4|accesso=2022-07-15|data=1983|editore=Springer Netherlands|pp=49–58|ISBN=978-94-009-7199-8|DOI=10.1007/978-94-009-7197-4_4}}</ref><ref>{{Cita pubblicazione|nome=Miquel|cognome=Solà|data=2013|titolo=Forty years of Clar's aromatic π-sextet rule|rivista=Frontiers in Chemistry|volume=1|accesso=2022-07-15|doi=10.3389/fchem.2013.00022|url=http://journal.frontiersin.org/article/10.3389/fchem.2013.00022/abstract}}</ref> dei sestetti aromatici benzenoidi<ref>{{Cita pubblicazione|nome=Erich|cognome=Kleinpeter|nome2=Andreas|cognome2=Koch|data=2010-05-13|titolo=Identification of Benzenoid and Quinonoid Structures by Through-Space NMR Shieldings (TSNMRS)|rivista=The Journal of Physical Chemistry A|volume=114|numero=18|pp=5928–5931|lingua=en|accesso=2022-07-15|doi=10.1021/jp101429n|url=https://pubs.acs.org/doi/10.1021/jp101429n}}</ref> e, dal punto di vista sperimentale, dal fatto che i principali prodotti dell'idrogenazione catalitica del pirene sono quelli che derivano dalla rimozione dei due doppi legami C(4)=C(5) e C(9)=C(10), cioé quelli dei ponti vinilene, lasciando così la struttura del bifenile (altri prodotti lasciano la struttura del [[naftalene]]).<ref>{{Cita pubblicazione|nome=Masahiro|cognome=Minabe|nome2=Katsuko|cognome2=Nakada|data=1985-07-01|titolo=Hydrogenation of Pyrene and Catalytic Interconversion of Hydropyrenes|rivista=Bulletin of the Chemical Society of Japan|volume=58|numero=7|pp=1962–1966|accesso=2022-07-15|doi=10.1246/bcsj.58.1962|url=https://www.journal.csj.jp/doi/10.1246/bcsj.58.1962}}</ref> |
|||
| ⚫ | |||
| ⚫ | |||
Viene utilizzato nella produzione di [[colorante|coloranti]] e loro precursori (ad esempio la [[piranina]]). |
Viene utilizzato nella produzione di [[colorante|coloranti]] e loro precursori (ad esempio la [[piranina]]). |
||
| Riga 88: | Riga 90: | ||
==Voci correlate== |
==Voci correlate== |
||
* [[Antracene]] |
|||
* [[Fenantrene]] |
|||
* [[Naftalene]] |
|||
* [[Benzopirene]] |
* [[Benzopirene]] |
||
* [[Idrocarburi policiclici aromatici]] |
* [[Idrocarburi policiclici aromatici]] |
||
* [[Regola di Clar]] |
|||
{{Idrocarburi}} |
{{Idrocarburi}} |
||
Versione delle 21:59, 15 lug 2022
| Pirene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| pirene | |
| Nomi alternativi | |
| benzo(d,e,f)fenantrene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C16H10 |
| Massa molecolare (u) | 202,255 |
| Aspetto | solido incolore |
| Numero CAS | |
| Numero EINECS | 204-927-3 |
| PubChem | 31423 |
| SMILES | C1=CC2=C3C(=C1)C=CC4=CC=CC(=C43)C=C2 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,271 |
| Solubilità in acqua | 0,135 (a 25 °C) |
| Temperatura di fusione | 156 °C (429,15 K) [1] |
| Temperatura di ebollizione | 393,5 °C (666,65 K) [1] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 473÷493[1] |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 410 |
| Consigli P | 273 - 501 [2][3] |
Il pirene è un idrocarburo tetraciclico avente formula C16H10 e costituito da 4 anelli benzenici condensati che condividono con gli altri anelli due o tre lati del proprio anello, e non uno solo, come accade nella serie degli aceni (come nelll'antracene) o in quella dei fenaceni[4] (come nel fenantrene). Sebbene sia annoverato tra gli idrocarburi policiclici aromatici (IPA), la sua molecola contiene un totale di 16 elettroni π (4n elettroni, con n = 4), rientrando così, formalmente, tra gli idrocarburi antiaromatici secondo la regola di Hückel, la quale però è strettamente valida solo per composi monociclici.
Tuttavia, il pirene può esser visto come un [14]annulene (che è aromatico con n = 3, anche se non molto stabile) con all'interno un frammento >C=C< che connette i carboni di tale anello esterno [C(3a), C(5a), C(8a), C(10a)], oppure anche come un bifenile (anch'esso aromatico, molto stabile) cui si aggiungono due ponti vinilene (HC=CH) nelle stesse posizioni. Quest'ultima ipotesi è avvalorata, da un punto di vista teorico, dalla regola di Clar[5][6] dei sestetti aromatici benzenoidi[7] e, dal punto di vista sperimentale, dal fatto che i principali prodotti dell'idrogenazione catalitica del pirene sono quelli che derivano dalla rimozione dei due doppi legami C(4)=C(5) e C(9)=C(10), cioé quelli dei ponti vinilene, lasciando così la struttura del bifenile (altri prodotti lasciano la struttura del naftalene).[8]
Si forma durante la combustione incompleta dei composti organici. idrocarburo policiclico aromatico (IPA)
Viene utilizzato nella produzione di coloranti e loro precursori (ad esempio la piranina).
È un composto tossico per i reni e per il fegato.

Note
- ^ a b c Copia archiviata, su biade.itrust.de. URL consultato il 13 agosto 2011 (archiviato dall'url originale il 13 agosto 2011).
- ^ Sigma Aldrich; rev. del 19.09.2012
- ^ Smaltire presso un impianto di trattamento dei rifiuti autorizzato
- ^ (EN) Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 8ª ed., 2020, pp. 84-85, ISBN 9781119371786.
- ^ Eric Clar, The Aromatic Sextet, Springer Netherlands, 1983, pp. 49–58, DOI:10.1007/978-94-009-7197-4_4, ISBN 978-94-009-7199-8. URL consultato il 15 luglio 2022.
- ^ Miquel Solà, Forty years of Clar's aromatic π-sextet rule, in Frontiers in Chemistry, vol. 1, 2013, DOI:10.3389/fchem.2013.00022. URL consultato il 15 luglio 2022.
- ^ (EN) Erich Kleinpeter e Andreas Koch, Identification of Benzenoid and Quinonoid Structures by Through-Space NMR Shieldings (TSNMRS), in The Journal of Physical Chemistry A, vol. 114, n. 18, 13 maggio 2010, pp. 5928–5931, DOI:10.1021/jp101429n. URL consultato il 15 luglio 2022.
- ^ Masahiro Minabe e Katsuko Nakada, Hydrogenation of Pyrene and Catalytic Interconversion of Hydropyrenes, in Bulletin of the Chemical Society of Japan, vol. 58, n. 7, 1º luglio 1985, pp. 1962–1966, DOI:10.1246/bcsj.58.1962. URL consultato il 15 luglio 2022.
Voci correlate
| Controllo di autorità | LCCN (EN) sh2002005321 · GND (DE) 4176461-4 · J9U (EN, HE) 987007542263005171 |
|---|