Endometriosi: differenze tra le versioni
Raggrppo note |
→Altri farmaci: + note |
||
| Riga 198: | Riga 198: | ||
[[File:Ibuprofen-3D-vdW.png|thumb|Rappresentazione grafica [[tridimensionale]] di una [[molecola]] di [[ibuprofene]] ([[formula chimica]] C<sub>13</sub>H<sub>18</sub>O<sub>2</sub>), uno dei [[FANS]] utilizzato per la gestione del dolore correlato all'endometriosi]] |
[[File:Ibuprofen-3D-vdW.png|thumb|Rappresentazione grafica [[tridimensionale]] di una [[molecola]] di [[ibuprofene]] ([[formula chimica]] C<sub>13</sub>H<sub>18</sub>O<sub>2</sub>), uno dei [[FANS]] utilizzato per la gestione del dolore correlato all'endometriosi]] |
||
Il dolore è uno dei sintomi più comuni ed invalidanti dell'endometriosi. Vi sono diversi trattamenti farmacologici in grado di intervenire positivamente su questo aspetto. I [[farmaci antinfiammatori non steroidei]] (FANS) vengono comunemente utilizzati in combinazione con altre terapie. Per i casi più gravi si può ricorrere a quelli per cui è necessaria la [[prescrizione medica]]. I FANS iniettabili possono essere utili per gestire il dolore grave o se il dolore allo stomaco impedisce quelli [[per os|assunti per via orale]]. Esempi di FANS includono l'[[ibuprofene]] e il [[naprossene]]. Gli [[oppioidi]], come le compresse di [[solfato]] [[morfina]] e altri antidolorifici oppiacei, agiscono mimando l'azione delle [[endorfine]], sostanze chimiche che riducono il dolore naturalmente. Sono disponibili diverse tipologie, sia a lunga durata d'azione che a breve e che possono essere usati da soli o in combinazione per fornire un adeguato controllo del dolore. |
Il dolore è uno dei sintomi più comuni ed invalidanti dell'endometriosi. Vi sono diversi trattamenti farmacologici in grado di intervenire positivamente su questo aspetto. I [[farmaci antinfiammatori non steroidei]] (FANS) vengono comunemente utilizzati in combinazione con altre terapie. Per i casi più gravi si può ricorrere a quelli per cui è necessaria la [[prescrizione medica]]. I FANS iniettabili possono essere utili per gestire il dolore grave o se il dolore allo stomaco impedisce quelli [[per os|assunti per via orale]]. Esempi di FANS includono l'[[ibuprofene]] e il [[naprossene]]. Gli [[oppioidi]], come le compresse di [[solfato]] [[morfina]] e altri antidolorifici oppiacei, agiscono mimando l'azione delle [[endorfine]], sostanze chimiche che riducono il dolore naturalmente. Sono disponibili diverse tipologie, sia a lunga durata d'azione che a breve e che possono essere usati da soli o in combinazione per fornire un adeguato controllo del dolore.<ref>{{cita pubblicazione|rivista=Cochrane Database Syst Rev.|data=gennaio 2017|doi=10.1002/14651858.CD004753.pub4|pmid=28114727|titolo=Nonsteroidal anti‐inflammatory drugs for pain in women with endometriosis|autore=Julie Brown, Tineke J Crawford, Claire Allen, Sally Hopewell, Andrew Prentice|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6464974/}}</ref><ref>{{cita pubblicazione|rivista=Children (Basel)|data=febbraio 2019|doi=10.3390/children6020033|pmid=30795645|titolo=Multidisciplinary Pain Management for Pediatric Patients with Acute and Chronic Pain: A Foundational Treatment Approach When Prescribing Opioids|autore=Anava A. Wren,1 Alexandra C. Ross,2 Genevieve D’Souza,3 Christina Almgren, Amanda Feinstein, Amanda Marshall, Brenda Golianu3}}</ref> |
||
La [[pentossifillina]], un [[Immunomodulatore|agente immunomodulante]], è stata proposta per alleviare il dolore e aumentare i tassi di gravidanza nelle donne con endometriosi. Tuttavia, una revisione della ''[[Cochrane Collaboration]]'' del 2012 ha rilevato che non vi erano prove sufficienti a sostegno dell'efficacia o della sicurezza per uno di questi usi.<ref>{{Cita pubblicazione|coautori= Lu D, Song H, Li Y, Clarke J, Shi G |titolo= Pentoxifylline for endometriosis |rivista= The Cochrane Database of Systematic Reviews |volume= 1 |pp= CD007677 |data= January 2012 | pmid = 22258970 | doi = 10.1002/14651858.CD007677.pub3 }}</ref> Le attuali linee guida del ''American Congress of Obstetricians and Gynecologists ''(ACOG) non includono questa tipologia di farmaci nei protocolli di trattamento standard.<ref>{{Cita pubblicazione|titolo= Practice bulletin no. 114: management of endometriosis |rivista= Obstetrics and Gynecology |volume= 116 |numero= 1 |pp= 223–36 |data= July 2010 | pmid = 20567196 | doi = 10.1097/AOG.0b013e3181e8b073 }}</ref> |
La [[pentossifillina]], un [[Immunomodulatore|agente immunomodulante]], è stata proposta per alleviare il dolore e aumentare i tassi di gravidanza nelle donne con endometriosi. Tuttavia, una revisione della ''[[Cochrane Collaboration]]'' del 2012 ha rilevato che non vi erano prove sufficienti a sostegno dell'efficacia o della sicurezza per uno di questi usi.<ref>{{Cita pubblicazione|coautori= Lu D, Song H, Li Y, Clarke J, Shi G |titolo= Pentoxifylline for endometriosis |rivista= The Cochrane Database of Systematic Reviews |volume= 1 |pp= CD007677 |data= January 2012 | pmid = 22258970 | doi = 10.1002/14651858.CD007677.pub3 }}</ref> Le attuali linee guida del ''American Congress of Obstetricians and Gynecologists ''(ACOG) non includono questa tipologia di farmaci nei protocolli di trattamento standard.<ref>{{Cita pubblicazione|titolo= Practice bulletin no. 114: management of endometriosis |rivista= Obstetrics and Gynecology |volume= 116 |numero= 1 |pp= 223–36 |data= July 2010 | pmid = 20567196 | doi = 10.1097/AOG.0b013e3181e8b073 }}</ref> |
||
Versione delle 14:54, 4 lug 2019
| Endometriosi | |
|---|---|
 | |
| Specialità | ginecologia |
| Eziologia | sconosciuta[1] |
| Sede colpita | più frequentemente: ovaie, tuba di Falloppio, parete esterna dell'utero. Meno frequentemente: vagina, cervice, vulva, intestino, vescica, retto. Raramente: polmoni, encefalo, cute[2] |
| Mortalità mondiale | ~100 casi (2015)[3] |
| Incidenza mondiale | 10.8 milioni di casi (2015)[3] |
| Classificazione e risorse esterne (EN) | |
| OMIM | 131200 |
| MeSH | D004715 |
| MedlinePlus | 000915 |
| eMedicine | 271899 e 795771 |
L'endometriosi (dal greco ἔνδον, éndon, dentro; μήτρα, mētra, utero; suffisso -ωσις, -osis, condizione morbosa) è una malattia cronica e complessa, che colpisce quasi esclusivamente le donne. Origina dalla presenza anomala (ectopia) di endometrio (il tessuto che riveste la parete interna dell'utero) in organi diversi dall'utero, principalmente ovaie, tube, peritoneo, vagina, intestino.[4][5]
Come avviene nell'endometrio normale, le aree interessate dall'endometriosi sono sensibili ai livelli plasmatici di estrogeno e di progesterone, pertanto esse sanguinano durante il ciclo mestruale, provocando frequentemente infiammazione, cicatrici e aderenze.[1][2] Poiché i livelli di estrogeni si riducono drasticamente dopo i 50 anni, il problema clinico dell'endometriosi si presenta soprattutto prima della menopausa.
I sintomi principali sono infertilità e dolore pelvico cronico, ciascuno dei quali si osserva in circa il 50% dei casi, ma la frequenza può salire al 70% durante le mestruazioni.[1] È comune anche il dolore nel corso di rapporti sessuali, mentre si manifestano con minor frequenza sintomi urinari o intestinali.[1] Circa il 25% delle donne risulta comunque asintomatica.[1] L'endometriosi può comportare effetti sia sociali che psicologici.[6]
La causa non è del tutto chiara, per cui sono state proposte diverse teorie al riguardo.[1] Tra i fattori di rischio vi è la presenza di casi nella storia familiare.[2] La diagnosi viene solitamente sospettata sulla base dei sintomi, mentre l'accertamento diagnostico si avvale dei risultati ottenuti tramite le tecniche di imaging biomedico[2] e soprattutto della biopsia, che è l'unico metodo che ne dà certezza.[2] La diagnosi differenziale considera altre condizioni con sintomi simili, come la malattia infiammatoria pelvica, la sindrome dell'intestino irritabile, la cistite interstiziale e la fibromialgia.[1]
Prove sperimentali suggeriscono che l'uso di contraccettivi orali possa ridurre il rischio di endometriosi, così come il regolare esercizio fisico e la limitazione di bevande alcoliche.[2] Al 2019 non esiste una cura farmacologica risolutiva, ma sono possibili alcuni trattamenti per i sintomi,[1] come l'assunzione di farmaci antidolorifici (preferibilmente FANS) o i trattamenti ormonali.[2] Può anche essere utile assumere il componente attivo della pillola anticoncezionale o utilizzare un dispositivo intrauterino con progestinico.[2] Nei casi refrattari alla terapia farmacologica può essere necessaria la rimozione chirurgica del tessuto ectopico.[2] L'agonista dell'ormone di rilascio delle gonadotropine può migliorare la probabilità di concepimento nelle donne con difficoltà.[2]
Secondo un'ampia indagine epidemiologica, nel 2015 l'endometriosi ha interessato 10,8 milioni di donne,[7] mentre altre fonti stimano che circa il 6-10% della popolazione femminile ne sia colpita.[1] Più comune tra le trentenni e le quarantenni, può comunque iniziare a presentarsi anche nelle ragazze a partire dagli otto anni.[2][8] Pochi casi portano al decesso.[9]
Riconosciuta come malattia a sé stante, differenziandola dall'adenomiosi, solo a partire dagli anni 1920,[10] non è chiaro a chi si debba la prima descrizione, tuttavia Karl von Rokitansky fu il primo a identificarla al microscopio nel 1860.[10]
Storia

L'endometriosi venne scoperta per la prima volta al microscopio da Karl von Rokitansky nel 1860,[11] sebbene fosse una condizione documentata in testi medici risalenti a più di 4000 anni fa.[12]
Il Corpus Hippocraticum del IV secolo a.C. descrive alcuni sintomi simili a quelli riscontrabili nell'endometriosi, tra cui ulcerazioni uterine, aderenze e infertilità. I medici ippocratici ritenevano che ritardare la gravidanza avrebbe potuto scatenare le malattie dell'utero responsabili di questi sintomi, tanto che le donne con dismenorrea venivano incoraggiate a sposarsi e avere figli in giovane età. Il fatto che gli ippocratici raccomandassero cambiamenti nelle pratiche matrimoniali a causa di una malattia simile all'endometriosi dimostra che questa condizione fosse molto probabilmente comune, con tassi superiori alla prevalenza del 5-15% spesso citata oggi.[13]
Storicamente, le donne che accusavano sintomi di endometriosi venivano curate con l'applicazione di sanguisughe, della camicia di forza, tramite i salassi, ricorrendo alle mutilazioni genitali, con la gravidanza (come forma di trattamento), appendendole a testa in giù, o sottoponendole ad un intervento chirurgico; in alcuni casi, venivano persino uccise per via di un presunto possesso demoniaco.[12] Sebbene 2 500 anni fa i medici ippocratici avessero riconosciuto e trattato il dolore pelvico cronico come una vera malattia organica, nel corso del medioevo si tornò a ritenere che le donne con tale dolore fossero pazze, immorali, che si immaginavano il dolore o che semplicemente si comportavano male.[12] I sintomi del dolore pelvico cronico inspiegabile erano spesso attribuiti ad una follia immaginaria, alla debolezza femminile, alla promiscuità o all'isteria. L'idea che il dolore pelvico cronico fosse correlato ad una malattia mentale influenzò l'atteggiamento moderno nei confronti delle donne affette da tale condizione, causando ritardi nella corretta diagnosi e l'indifferenza nei confronti del dolore vero per le pazienti vissute durante il XX secolo.[12]
Se davvero questo disturbo fu in passato così comune, si potrebbero dimostrare le teorie moderne che suggeriscono una correlazione tra l'endometriosi e le diossine o i policlorobifenili.[12]
Epidemiologia
Non è facile determinare dati epidemiologici precisi riguardo all'endometriosi. Sembra che la sempre maggiore disponibilità della video-laparoscopia per l'indagine pelvica abbia comportato un sensibile aumento delle diagnosi, specie per i casi relativi a lesioni minime o lievi.[14] Si stima che, nel 2015, vi fossero in tutto il mondo 10,8 milioni di donne colpite dall'endometriosi.[7] Altre fonti stimano che circa il 6-10% delle donne fossero interessate dalla condizione,[1] con una prevalenza di circa il 10% nella popolazione generale, dello 0,5-5% nelle donne fertili e del 25-40% in quelle infertili[15]. In Friuli Venezia Giulia, dal 2011 al 2013, tra i 15 e i 50 anni, l'incidenza di endometriosi è stata di circa lo 0,14%/anno.[16] Si ritiene che possa colpire oltre l'11% delle donne statunitensi tra i 15 e i 44 anni.[2] L'endometriosi risulta più comune tra le trentenni e le quarantenni; tuttavia, può riscontrarsi nelle ragazze già dagli 8 anni.[2][8] Si stima che in Italia le donne affette da endometriosi siano circa 3 milioni.[17] In passato si è ipotizzato che la condizione affliggesse maggiormente le donne benestanti appartenenti ad un contesto di elevato livello socio culturale, tuttavia è più probabile che ciò sia dovuto al fatto che tali donne siano tendenzialmente più attente al loro stato di salute e quindi con maggior probabilità di vedersi diagnosticata una endometriosi relativamente lieve.[14]
In ogni caso, può interessare qualsiasi donna, di età che va dal pre menarca alla post menopausa, indipendentemente dalla razza o dall'etnia o dal fatto che abbiano o meno avuto figli. È principalmente una malattia che si riscontra negli anni riproduttivi.[18] Casi di endometriosi si sono verificate nelle donne in postmenopausa,[19] e raramente, le ragazze possono avere sintomi di endometriosi prima ancora che raggiungano il menarca.[20][21] Si ritiene che dal 30% al 40% dei casi di infertilità femminile sia dovuto a endometriosi. Tra i fattori di rischio vi è da annoverare una parentela di primo grado con una donna affetta dalla condizione e un basso indice di massa corporea.[22] Le donne con cicli mestruali corti, regolari, con flussi abbondanti e prolungati hanno una probabilità maggiore di sviluppare endometriosi. Non aver mai partorito o aver sperimentato lunghi periodi senza sviluppare una gravidanza, sono situazioni che sono state correlate positivamente con la condizione.[14]
Si stima che il tasso di recidiva dell'endometriosi possa attestarsi, negli adulti, tra il 40% e il 50% su un periodo di 5 anni.[23] È stato dimostrato che tale dato aumenti col passare del tempo dall'intervento chirurgico, ma non è correlato allo stadio della malattia, al sito iniziale, al metodo chirurgico utilizzato o al trattamento post-chirurgico.[23] Sono stati effettuati diversi studi per valutare una possibile correlazione tra l'utilizzo di metodi contraccettivi e lo sviluppo della malattia, tuttavia le molte distorsioni statistiche, tra cui il fatto che spesso vengono prescritti proprio per trattare i sintomi della malattia come la dismenorrea, hanno reso i risultati inconcludenti.[24]
Eziologia
L'endometriosi è una malattia cronica e complessa che consiste nell'anomala presenza di endometrio (il tessuto che riveste la parete interna dell'utero) in regioni anatomiche diverse da dove dovrebbe trovarsi e in particolare nelle ovaie, nelle tube, nel peritoneo, nella vagina, nell'intestino provocando una serie di segni e sintomi.[4] La sua esatta eziologia non è certa, nel corso del tempo sono state formulate diverse teorie, non necessariamente in contrasto tra loro, ma di cui nessuna in grado di spiegarla esaustivamente. Di conseguenza si ritiene che la causa sia multifattoriale e che implichi un'interazione tra diversi fattori.[25]
Una delle teorie più antiche ed accreditate è quella dell'innesto (chiamata anche "delle mestruazioni retrograde") e venne proposta dal ginecologo John Sampson.[25][26] Questa prevede che durante il flusso mestruale piccole parti di tessuto endometriale si muoverebbero in senso inverso nelle tube per poi impiantarsi nell'addome o comunque al di fuori della cavità uterina, aderendo al peritoneo (il rivestimento della cavità addominale) da dove possono invadere il tessuto dando origine ad una condizione di endometriosi.[25][27] Questa teoria, comunque, non è da sola in grado di spiegare tutti i casi di endometriosi, in quanto non spiega perché molte donne con ciclo mestruale retrogrado non presentano endometriosi, un fatto da attribuirsi probabilmente ad ulteriori fattori come la genetica e le malattie autoimmuni. Inoltre, seppur raramente, l'endometriosi si è riscontrata in individui che non hanno mai avuto le mestruazioni, come uomini,[28] feti,[29] e ragazze in età prepuberale.[30][31] Inoltre sono stati riscontrati casi di endometriosi nel cervello[32] e nei polmoni,[33] situazioni non compatibili con i presupposti della teoria.[34]
Un'altra teoria che desta molto interesse è quella che imputa l'endometriosi alla metaplasia celomatica delle cellule peritoneali.[35] Le cellule celomatiche sono l'antenato comune sia della cellule endometriali che peritoneali e possono quindi essere sottoposte ad una trasformazione (metaplasia) da un tipo all'altro a seguito di un innesco, come l'infiammazione.[36] Una delle prove a sostegno di questa teoria è il verificarsi di endometriosi alla prostata negli uomini sottoposti a terapia estrogenica.[37]
Nonostante goda sempre di minor consenso, è da annoverare anche la teoria metastatica, ovvero la diffusione di isole endometriali (sotto forma di microscopici frustuli di endometrio) per via linfatica o ematica. Tale ipotesi ha il vantaggio di spiegare le pur rare localizzazioni a distanza.[38] Altre teorie proposte riguardano la possibilità che l'endometriosi possa derivare da cellule staminali provenienti dal midollo osseo,[39] oppure che sia causata da tossine ambientali (ad esempio diossina, nichel, ...)[40][41] o dallo stress ossidativo in quanto l'afflusso di ferro è associato alla distruzione locale del mesotelio peritoneale che porta all'adesione delle cellule endometriali ectopiche.[42] Si è osservato che le donne affette da malattia di Graves, una malattia autoimmune caratterizzata da ipertiroidismo, gozzo, oftalmopatia e dermopatia, abbiano maggiori probabilità di soffrire di endometriosi, portando così sostegno alla possibilità che l'origine della malattia possa coinvolgere fattori autoimmuni.[43][44]
Localizzazione
Tra i diversi organi in cui l'endometriosi può localizzarsi, i più comuni sono le ovaie, le tube di Falloppio, i legamenti dell'utero e la sua superficie esterna. Può essere riscontrata con minor frequenza nella vagina, nel cervice, nella vulva, nell'intestino, nella vescica o nel retto, mentre è possibile (anche se assai raro) che possa comparire in altre parti del corpo come nei polmoni, nel cervello e sulla cute.[2] L'endometriosi rettovaginale o intestinale rappresenta tra i 5% e il 12% dei casi e può essere causa di un forte dolore conseguente ai movimenti intestinali.[46]
L'endometriosi può diffondersi nella cervice e nella vagina o nei siti di un'incisione chirurgica addominale, una condizione nota come "endometriosi della cicatrice".[47] Tra gli interventi che comportano un maggior rischio vi possono essere il taglio cesareo o una gravidanze ectopiche, una salpingostomia post parto, una procedura di laparoscopia, l'amniocentesi, una appendicectomia, una episiotomia, una isterectomia o un intervento per la risoluzione di un'ernia.[48][49][50] Molto rara è anche l'endometriosi diaframmatica e quasi sempre interessa l'emidiaframma destro, comportando un dolore ciclico della spalla destra appena prima e durante il ciclo mestruale.[51]
Segni e sintomi
Nell'endometriosi, l'infertilità e il dolore sono due manifestazioni molto frequenti, anche se tra il 20% e i 25% delle donne colpite risultano asintomatiche indipendentemente dall'estensione del tessuto endometriale ectopico.[45][1] Circa un terzo delle donne infertili è colpita dall'endometriosi e tra le donne con endometriosi circa il 40% sono sterili.[1]
La sensazione di dolore, che si manifesta nel 60% circa dei casi, presenta tratti assai caratteristici. Può variare da lieve a molto grave, con crampi o dolori lancinanti localizzati su entrambi i lati del bacino, nella zona lombare e rettale, con irradiazione fino anche nelle gambe. Non vi è una correlazione tra il livello di dolore e lo stadio o estensione dell'endometriosi, con alcune donne che sperimentano dolore lieve in condizioni di malattia grave e, viceversa, donne con sintomatologia dolorosa importante a fronte di una endometriosi di lieve entità.[52] La sintomatologia, infatti, viene influenzata dalla sede e dalla profondità degli impianti endometriali ectopici e non dallo stadio della malattia.[53] Tipicamente, il dolore più intenso si riscontra nel corso delle mestruazioni, iniziando anche una settimana prima del ciclo mestruale e permanendo fino ad una settimana dopo; in alcuni casi, tuttavia, è costante. Sebbene possa essere frequente che le donne accusino crampi durante le mestruazioni, i soggetti con endometriosi descrivono il dolore come molto più grave del solito, tanto che in alcuni casi può arrivare ad essere debilitante e a comportare uno stress emotivo.[54][55]
Il dolore può essere accompagnato da altri sintomi come: dismenorrea secondaria (crampi dolorosi durante il periodo mestruale), dispareunia (dolore durante il rapporto sessuale) soprattutto nelle donne con una profonda infiltrazione di endometrio ectopico dei legamenti utero-sacrali, disuria (urgenza urinaria e occasionalmente svuotamento doloroso della vescica),[56] mittelschmerz (dolore associato all'ovulazione),[45][57] dolore durante l'attività fisica.[56]
Altri sintomi
Altri sintomi che possono manifestarsi, singolarmente o in concomitanza tra loro, includono diarrea o stitichezza, spesso con dischezia,[53][56] affaticamento cronico,[56] nausea e vomito, cefalea, irregolarità nel ciclo mestruale, menorragia (mestruazione abbondante), metrorragia (perdita di sangue al di fuori della mestruazione) e ipoglicemia.[45][58][59]
Talvolta l'endometriosi è riscontrabile anche in sede intestinale e vescicale, sui legamenti utero-sacrali, nel setto retto vaginale, nelle tube. Nel caso di endometriosi vescicale, i sintomi sono quelli tipici di infiammazione e cistite o anche di incontinenza senza che risultino infezioni batteriche o virali a carico della vescica. La loro ricorrenza ciclica è un elemento determinante per distinguerne le cause. Sintomi più rari che si presentano in modo "catameniale" (cioè, in corrispondenza delle mestruazioni) includono epistassi (quando vi è un coinvolgimento polmonare), ematuria, ematochezia e sanguinamenti dall'ombelico. Ancora più raramente vi possono essere degli impianti endometriosici nel cervello che possono causare convulsioni in occasione delle mestruazioni.[53] Talvolta lesioni o aderenze possono portare ad una occlusione intestinale parziale o completa.[53]
Un caso particolare può essere rappresentato dalla presenza di tessuto ectopico a livello polmonare e pleurico. In questo caso, l'endometriosi può causare emottisi e pneumotorace catameniale, dovuto al danno causato alla pleura viscerale dal tessuto endometriosico e dall'occlusione bronchiale a cui esso può dare origine, che determina l'aumento della pressione alveolare nei distretti a valle ed eventualmente la formazione di bolle, con rischio di rottura e pneumotorace.[60][61]
Esiste una correlazione tra endometriosi e alcuni tipi di tumore, in particolare alcuni tipi di carcinoma dell'ovaio,[62][63] linfoma non Hodgkin e tumore al cervello.[64] L'endometriosi non è correlata al tumore dell'endometrio.[65]
Patogenesi del dolore
Spesso è difficile determinare una singola causa del dolore pelvico conseguente all'endometriosi; è più probabile che esso sia da attribuire a diversi fattori che coinvolgono sia meccanismi locali neuroendocrini, sia cause meccaniche, sia l'elaborazione del dolore da parte del sistema nervoso centrale.[66] Tra le varie cause proposte vi è la possibilità che le lesioni, reagendo alla stimolazione ormonale, possano "sanguinare" al momento delle mestruazioni. Il sangue, se non viene eliminato velocemente, si accumula localmente provocando gonfiore. Questo innesca una risposta infiammatoria con attivazione di citochine, che si traduce in dolore. Un'ulteriore origine del dolore è la dislocazione d'organo che deriva dalla formazione di aderenze che legano insieme gli organi interni, come le ovaie, l'utero, il peritoneo, la vescica. Il dolore innescato in questo modo può durare costantemente, non solo durante i periodi mestruali.[67] Altre possibili cause individuate sono l'azione meccanica del tessuto endometriale, le anomalie nella sintesi dei neuropeptidi dedicati alla modulazione del dolore e alcuni disturbi emotivi.[45] È stato inoltre dimostrato che le lesioni endometriosiche possono sviluppare una propria innervazione, creando un'interazione diretta e bidirezionale tra le lesioni e il sistema nervoso centrale che comporta una percezione del dolore differente da donna a donna.[52] Si ritiene che le fibre nervose e i vasi sanguigni si formino mediante un processo noto come neuroangiogenesi.[68]
Patogenesi dell'infertilità
La patogenesi della sterilità dipende dallo stadio della malattia.[45] Nei casi lievi e moderati, si ipotizza che ciò sia secondario a una risposta infiammatoria che altera diversi aspetti legati al concepimento. Alcuni studi hanno suggerito che la presenza di tessuto endometriale fuori sede provochi una produzione eccessiva di prostaglandina F2α all'interno del peritoneo, a sua volta causa di alterazione della motilità tubarica, mancata ovulazione e distruzione del corpo luteo. Anche la presenza nel liquido peritoneale di molti macrofagi attivati è stata correlata con l'infertilità. È stato infatti suggerito che essi potrebbero essere responsabili della fagocitosi degli spermatozoi oltre che della sintesi di fattori di crescita e Interleuchina 1 che innescherebbero una reazione immunitaria a cascata; ciò comporterebbe il richiamo di fibroblasti, con conseguente instaurarsi di aderenze che renderebbero l'ambiente non idoneo per la fecondazione dell'ovocita.[45][69] Le forme più gravi comportano la distorsione dell'anatomia pelvica ed in particolare alterazioni dei rapporti anatomici delle tube di Falloppio, nonché la presenza di estese aderenze localizzate nelle pelvi che contribuiscono a compromettere la capacità di concepimento.[45][69]
Diagnosi
Vi sono molte metodiche utilizzabili per la formulazione di una diagnosi di endometriosi, sia invasive che non. Il punto di partenza, solitamente, è una anamnesi completa seguita da un accurato esame obiettivo ginecologico e rettale in cui ricercare reperti tipici. L'esame del sangue può essere utile per identificare specifici biomarcatori. Tra le tecniche di imaging biomedico, una radiografia (con o senza mezzo di contrasto al bario) e la tomografia computerizzata (TC) non si sono dimostrate utili poiché non sufficientemente sensibili, tuttavia possono essere utilizzate per lo studio di alcune complicanze. La risonanza magnetica può dare ottimi risultati nell'individuare le lesioni più profonde mentre l'ecografia permette di rilevare gli impianti più piccoli e constatare una retroversione uterina fissa conseguente ad aderenze che vincolano l'utero alla pelvi.[66][70]
Talvolta è necessaria l'esecuzione di una indagine esplorativa tramite video laparoscopia, una procedura che permette di formulare una diagnosi certa ma che consta in un intervento invasivo da effettuarsi in anestesia generale. Oltre che per la diagnosi, questo esame è importante anche per determinare la stadiazione della malattia e per trattarla terapeuticamente (asportazione del tessuto, vacuolizzazione e lisi delle aderenze) ripristinando la normale anatomia della pelvi femminili. L'esame istologico dopo biopsia tissutale è in grado confermare la diagnosi.[70]
Esame obiettivo

Molto spesso le pazienti con endometriosi non presentano alcun riscontro fisico correlabile alla condizione.[71] Tuttavia, un esame obiettivo ginecologico approfondito può essere utile per riscontrare reperti che suggeriscono la presenza di endometriosi, anche se ciò non è sufficiente per formulare una diagnosi.[71] Nel corso della visita deve essere esaminato accuratamente, tramite l'utilizzo dello speculum, il fornice vaginale posteriore e la zona rerocervicale, in cui in caso di malattia si possono riscontrare masse nodulari tenere infiltranti la tonaca muscolare e, occasionalmente, noduli bluastri e creste di colore rosso.[71][66]
Dovrebbe essere, inoltre, effettuato un completo esame pelvico in modalità vagino-rettale combinata, con cui valutare la zona retto-vaginale, la parete rettale anteriore, il cavo del Douglas e le gonadi. Qui si possono apprezzare, alla palpazione, noduli infiltrativi non visibili all'ecografia che appaiono anelastici, nodulari e dolenti.[66] La presenza di una retroversione uterina fissa insieme ad una obliterazione del cavo del Douglas può far supporre la presenza di una endometriosi molto estesa.[71] È consigliabile procedere con l'esame obiettivo nel corso delle mestruazioni, affinché possa essere maggiormente sensibile. Un addome acuto può essere riscontrato nel caso di rottura di un endometrioma ovarico.[71]
Biomarcatori
Al 2010, tutti i biomarcatori proposti per la diagnosi dell'endometriosi non presentavano un uso clinico sufficientemente chiaro, anche se alcuni sembravano essere promettenti.[72] L'unico biomarcatore utilizzato costantemente a partire dagli anni 1990 è il CA-125.[72] Una revisione del 2016 ha rilevato che nelle donne che presentano sintomi di endometriosi e a cui è stato escluso un tumore dell'ovaio, un CA-125 positivo possa essere un dato in grado di confermare la diagnosi.[73] Tuttavia, la sua affidabilità per l'esclusione dell'endometriosi è bassa.[73] I livelli di CA-125 sembrano diminuire durante il trattamento della condizione, ma non hanno mostrato una correlazione con la risposta della malattia alle cure.[72]
Un'altra revisione nel 2011 ha identificato sulla biopsia diversi biomarcatori possibili, compresi i reperti di piccole fibre nervose sensoriali o la subunità dell'integrina β3 espressa in modo errato.[74] È stato ipotizzato che, in futuro, uno strumento diagnostico per l'endometriosi possa consistere in un gruppo di diversi biomarcatori specifici e sensibili, comprese le concentrazioni di sostanze e la predisposizione genetica.[72]
Ecografia

L'ecografia pelvica è in grado di identificare grandi cisti endometriosiche (chiamate endometriomi), tuttavia quelle di dimensioni più piccole possono essere difficili da osservare.
L'ecografia vaginale ha un valore clinico nella diagnosi di endometrioma e viene eseguita anche prima di un intervento chirurgico per l'endometriosi profonda.[75] Ciò per consentire l'identificazione della diffusione della malattia nelle donne con sospetto clinico accertato di endometriosi.[75] L'ecografia vaginale è una metodica economica, facilmente accessibile, non presenta controindicazioni e non richiede alcuna preparazione.[75] In ogni caso, i professionisti sanitari che effettuano gli esami mediante ultrasuoni devono aver maturato una certa esperienza.[75] Estendendo la valutazione dell'esame ecografico alle zone pelviche posteriore e anteriore, chi esegue l'esame è in grado di valutare la mobilità strutturale e cercare i noduli endometriosici infiltranti profondi, rilevando la dimensione, la posizione e, se possibile, la distanza dall'ano.[76] Un miglioramento nel rilevamento ecografico dell'endometriosi infiltrante profonda non solo ridurrà il numero di laparoscopie diagnostiche, ma sarà in grado di guidare verso i più corretti trattamenti e consentirà un apprezzabile miglioramento della qualità della vita.[76]
Risonanza magnetica
Il ricorso alla risonanza magnetica (RM) è un'altra metodica per rilevare lesioni in modo non invasivo.[77] Tuttavia il suo impiego non è diffusissimo a causa del suo costo elevato e della sua scarsa disponibilità, nonostante sia in grado di rilevare lesioni profonde e di dimensioni relativamente piccole (di solito > 1 cm).[77] La visibilità di innesti endometriosici alla RM dipende dalla concentrazione in essi di ferro e proteine, prodotti della degradazione degli eritrociti.[78][79] Nelle immagini ottenute, la maggior parte di questi innesti appare come delle grosse masse cistiche iperintense nelle sequenze pesate in T1 e ipointense in quelle in T2.[77] La risonanza magnetica è una metodica diagnostica che vanta una sensibilità del 90-92% e una specificità del 91-98% e pertanto risulta molto utile per distinguere gli innesti endometriosici da altre masse con maggior accuratezza rispetto all'ecografia.[78][79][80][77]
La risonanza magnetica fornisce scarsi risultati nella ricerca di impianti superficiali, come nel caso di impianti peritoneali, e quindi da sola non può essere sufficiente per escludere completamente la presenza della condizione. Talvolta possono riscontrarsi falsi positivi nelle neoplasie cistiche o nelle citi funzionali.[81] Occasionalmente, nelle pazienti con endometriosi, è possibile riscontrare una dilatazione delle tube di Falloppio che alla risonanza magnetica appare come un'intensità elevata di segnale nelle sequenze T1 dovuto alla presenza di fluido sanguinante.[82]
Essendo la risonanza magnetica una procedura di imaging biomedico molto lunga da eseguire ed estremamente sensibile ai movimenti del corpo, spesso è necessario assumere dei farmaci antiperistaltici come preparazione all'esame al fine di ottenere immagini di sufficiente qualità.[77]
Video-laparoscopia

La video-laparoscopia, una procedura chirurgica in cui una fotocamera viene utilizzata per osservare l'interno della cavità addominale, è l'unico metodo per diagnosticare con sicurezza l'entità e la gravità dell'endometriosi.[77] Se le escrescenze (lesioni) non sono visibili, può essere eseguita una biopsia per formulare la diagnosi.[83] Oltre che per la diagnosi, l'intervento laparoscopico consente nello stesso momento anche il trattamento chirurgico.
Durante una procedura laparoscopica, le lesioni possono apparire blu scure, nere, rosse, bianche, gialle, marroni o non pigmentate. Le lesioni variano di dimensioni.[84] Alcune lesioni presenti all'interno delle pareti pelviche potrebbero non essere visibili, poiché il normale peritoneo delle donne infertili rivela l'endometriosi tramite biopsia nel 6-13% dei casi.[85] L'endometriosi precoce si verifica tipicamente sulle superfici degli organi nelle aree pelviche e intra-addominali.[84] Gli operatori sanitari possono chiamare le aree di endometriosi con nomi diversi, come protesi, lesioni o noduli. Ovaie più grandi possono essere viste all'interno delle ovaie come endometriomi o "cisti di cioccolato", perché contengono uno spesso liquido brunastro, per lo più sangue vecchio.[84]
Frequentemente, durante una procedura di laparoscopia diagnostica, non si riscontrano lesioni in donne con dolore pelvico cronico, un sintomo comune ad altri disturbi tra cui adenomiosi, aderenze pelviche, malattia infiammatoria pelvica, anomalie congenite del tratto riproduttivo e masse ovariche o tubariche.[86]
Istopatologia

Le tipiche lesioni endometriosiche mostrano caratteristiche istopatologiche simili all'endometrio, vale a dire la presenza di stroma endometriale, epitelio endometriale e ghiandole che rispondono agli stimoli ormonali; la presenza in contemporanea ciò è necessario per la diagnosi istologica. Le lesioni più vecchie potrebbero non mostrare ghiandole ma residui di emosiderina conseguente alla fagocitosi dei globuli rossi da parte dei fagociti e dalla degradazione dell'emoglobina successiva a sanguinamenti locali. Ad una analisi macroscopica si possono riscontrare diversi tipi di lesioni, come ridotti impianti peritoneali e la presenza di una sindrome della "pelvi congelata" simile ad un quadro neoplastico.[87]
Tra le cisti endometriosiche, quella "di cioccolato" è la più frequente che si possa riscontrare ed è caratterizzata da una parete formata da fibroblasti, da tessuto stromale da alcune zone di epitelio endometriale diffuse. Inoltre, in caso di rottura, vi sarà una fuoriuscita di liquido denso marroncino dall'interno ricco di globuli rossi degradati e macrofagi con elevati livelli di emosiderina, formatosi di conseguenza alle frequenti emorragie. Le grandi cisti (da alcuni millimentri a 10-12 centimetri) spesso sono accompagnate da consistenti aderenze.[87]
Il ricorso all'immunoistochimica è apparso utile nella formulazione della diagnosi di endometriosi in quanto le cellule stromali presentano un particolare antigene di superficie, il CD10, consentendo così al patologo di esaminare direttamente un'area di colorazione e quindi confermare la presenza di cellule stromali e talvolta di tessuto ghiandolare che possono non essere visti nella colorazione con ematossilina eosina di routine.[88]
Stadiazione

Al 2019, il metodo più utilizzato per la stadiazione dell'endometriosi è la classificazione proposta dall'American Society of Reproductive Medicine, nella versione rivista nel 1997.[89] Tale metodo è costituito da un complesso sistema di punteggi che valuta le lesioni e le aderenze negli organi pelvici. Si tratta di una classificazione chirurgica: le classi I e II riguardano lesioni superficiali; le classi III e IV sono considerate gravi, includendo endometriosi cistica e con aderenze. E' importante notare che la stadiazione valuta solo la malattia fisica, non il livello dei sintomi come il dolore o infertilità. Una persona con endometriosi allo stadio I può, dunque, presentare una malattia di tipo lieve ma un dolore severo, allo stesso tempo una condizione allo stadio IV può manifestarsi con una sintomatologia dolorosa lieve o totalmente assente. I parametri considerati per l'attribuzione del punteggio, tutti apprezzabili in seguito a video laparoscopia, sono il numero delle lesioni, la loro dimensione, la sede, l'eventuale obliterazione del cavo del Douglas, estensione e caratterizzazione dell'aderenza.[90]
In linea di principio i vari stadi si possono riassumere in questa tabella:[91][92][93]
| Stadio | Punteggio | Descrizione |
|---|---|---|
| Stadio I (minima, sottile) | 1-5 | Reperti limitati alle sole lesioni superficiali di 2-3 mm a forma vescicolare o di piccola fiamma e possibilmente alcune aderenze. Questa condizione, quando si presenta da sola, non è solitamente considerata una patologia ed è riscontrabile nell'80% delle donne. |
| Stadio II (lieve, tipica) | 6-15 | Si contraddistingue per la presenza di lesioni superficiali nere, definite solitamente "powder burn" o "gun shot", con dimensioni variabili da 1 a 3 centimetri. Sono inoltre presenti alcune lesioni profonde nel cavo del Douglas. |
| Stadio III (moderata, cistica) | 16-40 | Come nello stadio II, più la presenza di endometriomi sull'ovaio e maggiori aderenze solitamente di tipo cistico, conosciute come "cisti cioccolato, medialmente di 3-4 centimetri di diametro ma che possono svilupparsi fino a 15 centimetri. E' necessario l'intervento chirurgico in quanto la terapia farmacologica risulta inefficace |
| Stadio IV (severa, profonda) | > 40 | Come nello stadio III ma endometriomi appaiono più grandi (circa 5-6 centimetri) e solidi e le aderenze estese, localizzandosi soprattutto nel cavo del Douglas estendendosi anche agli organi pelvici contigui. Quando arrivano a coinvolgere lo spazio prevescicale e la vescica possono causare disuria (dolore nella minzione). |
La probabilità che vi sia la presenza di endometriosi sottile, tipica, cistica o profonda nelle donne che soffrono di infertilità o dolore pelvico è rispettivamente di circa l'80%, 50%, 25% e 3-4%.[94] Nonostante che la scala di stadiazione dell'endometriosi sia afflitta da una alta variabilità tra diverse osservazione e tra diversi osservatori, rendendola non del tutto efficace per la prognosi, può essere molto utile per valutare il follow up del paziente alle terapie.[95][96]
Quantificazione del dolore
La scala visuo-analogica del dolore (VAS) è la più comune scala utilizzata per la quantificazione del dolore correlato all'endometriosi. Per scopi di ricerca e per una misurazione del dolore più dettagliata nella pratica clinica, la VAS viene utilizzata per quantificare ogni tipo di dolore tipico correlato all'endometriosi (dismenorrea, dispareunia profonda e dolore pelvico cronico non mestruale) insieme con le scale di impressione clinica globale e della qualità della vita.[97]
Diagnosi differenziale
Moto spesso l'endometriosi può essere scambiata con la dismenorrea primaria (dolore durante le mestruazione non conseguente ad altre cause). Tuttavia, un dolore che non risponde all'assunzione di farmaci antinfiammatori non steroidei o alla terapia contraccetiva orale deve far abbandonare la prima ipotesi. Vi sono anche altre diverse condizioni che devono essere considerate nella diagnosi differenziale di endometriosi. Tra queste: cisti ovariche, malformazioni uterine, adenomiosi, tumore del colon, carcinoma ovarico, appendicite, clamidia, infezione del tratto urinario, diverticolite, gravidanza extrauterina, gonorrea, torsione ovarica e malattia infiammatoria pelvica.[98]
Terapia
Nonostante che al 2019 non esista una cura definitiva per l'endometriosi, vi è la possibilità di intervenire concretamente sul dolore e sull'infertilità correlata alla condizione.[99] In molte donne, la menopausa (naturale o chirurgica) attenuerà il processo e i sintomi.[100] Nelle donne che si trovano negli anni riproduttivi, l'endometriosi viene semplicemente gestita con l'obiettivo di alleviare il dolore e limitare la progressione del processo, ripristinando o preservando la fertilità ove sia necessario. Nelle donne più giovani, può essere tentato un intervento chirurgico al fine di rimuovere il tessuto endometriale e preservare le ovaie senza danneggiare il tessuto normale.[101]
In generale, la diagnosi di endometriosi viene confermata durante l'intervento chirurgico, momento in cui si può procedere con il trattamento tramite escissione o ablazione. L'opportunità di ulteriori azioni dipende dalle circostanze: ad una donna fertile può essere prescritto l'assunzione di farmaci ormonali in grado di sopprimere il ciclo mestruale naturale e quindi diminuire il dolore, mentre ad una donna infertile può essere indicata una terapia farmacologica o una fecondazione in vitro con trasferimento dell'embrione per favorire il concepimento.[101][1]
Chirurgia

Il trattamento conservativo consiste nella escissione o ablazione dell'endometrio ectopico, delle aderenze, della resezione degli endometriomi e del ripristino, il più possibile, dell'anatomia pelvica normale.[102] La laparoscopia, oltre ad essere utilizzata per la diagnosi, può essere eseguita come intervento chirurgico "minimamente invasivo". Con tale procedura vengono praticati 3 o 4 fori di piccole dimensioni sull'addome attraverso i quali vengono introdotti gli strumenti chirurgici, tra cui una piccola telecamera con cui si esplora la cavità addominale alla ricerca di eventuali isole endometriosiche, cisti o noduli. Nel caso in cui fossero presenti lesioni ben visibili, si procede alla loro eliminazione grazie all'ablazione a radiofrequenza realizzabile mediante diversi tipi di laser o per mezzo di scariche elettrice[103] oppure con l'escissione del tessuto; in quest'ultimo caso potrà essere anche prelevato del materiale utile per la biopsia. La degenza in ospedale si riduce ad un massimo di 3 giorni, la ripresa è rapida e le cicatrici sono poco visibili. Le donne che si sono sottoposte a laparoscopia hanno un rischio minore di sviluppare in seguito aderenze.[104] La laparotomia è, invece, un intervento chirurgico che si pratica nella maggior parte dei casi con un'incisione orizzontale all'altezza del pube, risultando così più invasiva della laparoscopia. Con questa tecnica i tempi di degenza si allungano e la cicatrice risulta sicuramente più visibile rispetto alla laparoscopia. Visti gli svantaggi essa viene effettuata molto raramente ovvero nei casi in cui le lesioni e le aderenze sono particolarmente estese.[105]
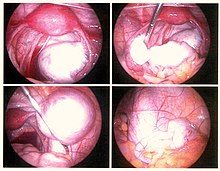
Dal 55% al 100% delle donne sviluppano aderenze dopo un intervento chirurgico pelvico[106] e ciò può causare infertilità, dolore cronico addominale e pelvico. La sospensione ovarica temporanea di Trehan, una tecnica in cui le ovaie vengono sospese per una settimana dopo l'intervento chirurgico, può essere utilizzata per ridurre l'incidenza delle aderenze dopo il trattamento chirurgico dell'endometriosi.[107][108] Il trattamento conservativo prevede l'escissione dell'endometriosi preservando le ovaie e l'utero, una soluzione molto importante per le donne che desiderano concepire, tuttavia aumentando il rischio di recidiva.[109] La ricorrenza dell'endometriosi a seguito di chirurgia conservativa è stimata al 21,5% a 2 anni e al 40-50% a 5 anni.[110]
Un'isterectomia (rimozione dell'utero) può essere utilizzata per il trattamento dell'endometriosi nelle donne che non desiderano concepire. Tuttavia, questo dovrebbe essere fatto solo se combinato insieme con la rimozione dell'endometriosi mediante escissione. Se l'endometriosi non fosse rimossa anche al momento dell'isterectomia, il dolore potrebbe persistere.[111]
Per le donne con dolore estremo, può essere indicata una neurectomia del plesso ipograstrico superiore (nervo presacrale). Questa procedura consiste nel tagliare i nervi all'utero in cui decorrono le fibre del sistema simpatico e parasimpatico.[105] Tuttavia, questa tecnica non viene quasi mai utilizzata a causa dell'elevata incidenza di complicanze associate, tra cui l'ematoma presacrale e problemi irreversibili con la minzione e con la costipazione.[111]
Terapia farmacologica
Terapia ormonale
L'assunzione della pillola anticoncezionale a scopo terapeutico è una pratica in grado di ridurre il dolore mestruale associato all'endometriosi, grazie alla diminuzione o sospensione del flusso.[112] Una combinazione di estroprogestinici (estrogeno e progestinico) somministrati con diverse modalità (pillola anticoncezionale, anello vaginale, spirale al progesterone, progesterone I.M. depot), è il trattamento di prima linea per la maggior parte delle donne per via del fatto che questo è utilizzabile per lunghi periodi di tempo, è relativamente economico, presenta una facilità d'utilizzo e comporta l'ulteriore vantaggio della riduzione del rischio di sviluppare un tumore dell'ovaio o dell'endometrio.[113] Tuttavia gli estroprogestinici possono comportare alcuni effetti indesiderati come: nausea, cefalea, secchezza vaginale, calo del desiderio sessuale. Assumere progesterone contrasta l'azione dell'estrogeno e conseguentemente inibisce la crescita dell'endometrio.[114] Tale terapia può ridurre o eliminare le mestruazioni in modo controllato e reversibile. I progestinici sono varianti chimiche del progesterone naturale; un esempio è il dienogest (Visanne). Sebbene i progestinici vengano spesso somministrati come parte di una terapia ormonale combinata con l'aggiunta di estrogeni, il trattamento con solo progestinico può essere comunque un'alternativa accettabile.[115][116][117]
Il danazolo e il più moderno gestrinone sono steroidi soppressivi con una certa attività androgenica.[101] Entrambi sono in grado di inibire la crescita dell'endometriosi, tuttavia il loro uso rimane limitato in quanto possono causare effetti collaterali come irsutismo, virilizzazione, acne, seborrea, capelli e pelle untuosa e aumento di peso.[118]
Si ritiene che i modulatori dell'ormone di rilascio delle gonadotropine (GnRH), che comprendono gli agonisti del GnRH come la leuprorelina e gli antagonisti del GnRH come l'elagolix, possano essere in grado di diminuire i livelli di estrogeni.[119] Una revisione della Cochrane del 2010 ha rilevato che i modulatori del GnRH erano più efficaci per il sollievo dal dolore nell'endometriosi rispetto al placebo o a nessun trattamento, ma non erano più efficaci del danazolo o del progestinico intrauterino e avevano più effetti collaterali del danazolo.[119] Una revisione sistematica svedese del 2018 ha rilevato che i modulatori del GnRH abbiano effetti analgesici simili a quelli dei gestageni ma che comportavano una diminuzione della densità ossea.[75]
Altri farmaci

Il dolore è uno dei sintomi più comuni ed invalidanti dell'endometriosi. Vi sono diversi trattamenti farmacologici in grado di intervenire positivamente su questo aspetto. I farmaci antinfiammatori non steroidei (FANS) vengono comunemente utilizzati in combinazione con altre terapie. Per i casi più gravi si può ricorrere a quelli per cui è necessaria la prescrizione medica. I FANS iniettabili possono essere utili per gestire il dolore grave o se il dolore allo stomaco impedisce quelli assunti per via orale. Esempi di FANS includono l'ibuprofene e il naprossene. Gli oppioidi, come le compresse di solfato morfina e altri antidolorifici oppiacei, agiscono mimando l'azione delle endorfine, sostanze chimiche che riducono il dolore naturalmente. Sono disponibili diverse tipologie, sia a lunga durata d'azione che a breve e che possono essere usati da soli o in combinazione per fornire un adeguato controllo del dolore.[120][121]
La pentossifillina, un agente immunomodulante, è stata proposta per alleviare il dolore e aumentare i tassi di gravidanza nelle donne con endometriosi. Tuttavia, una revisione della Cochrane Collaboration del 2012 ha rilevato che non vi erano prove sufficienti a sostegno dell'efficacia o della sicurezza per uno di questi usi.[122] Le attuali linee guida del American Congress of Obstetricians and Gynecologists (ACOG) non includono questa tipologia di farmaci nei protocolli di trattamento standard.[123]
Anche gli inibitori dell'angiogenesi mancano di una valida evidenza clinica di efficacia nella terapia dell'endometriosi.[124] In condizioni sperimentali in vitro e in vivo, i composti che hanno dimostrato di esercitare effetti inibitori sulle lesioni endometriosiche includono inibitori del fattore di crescita, inibitori dell'angiogenesi endogena, analoghi della fumagillina, statine, Inibitori selettivi della COX-2, composti fitochimici, immunomodulatori, Agonisti dopaminergici, inibitori dei recettori attivati da proliferatori perossisomiali, perossisomi, progestina, danazolo e agonisti dell'ormone che rilascia la gonadotropina.[124] Tuttavia, molti di questi agenti sono stati correlati a effetti collaterali indesiderati e sono ad oggi (2018) necessarie ulteriori ricerche. Una terapia ideale dovrebbe essere in grado di ridurre l'infiammazione e i sintomi sottostanti senza influire negativamente sulla capacità di concepimento.[125][126]
Comparazione tra i trattamenti
Gli interventi chirurgici e farmacologici sono in grado di comportare benefici sovrapponibili riguardo alla gestione del dolore, con una ricorrenza della sofferenza pari al 53% e al 44% rispettivamente.[127] In ogni caso, qualsiasi approccio presenta sia vantaggi che svantaggi.[36]
Fino al 2013 vi erano pochi dati disponibili per sostenere l'efficacia del trattamento farmacologico per alleviare il dolore associato all'endometriosi.[99] Una revisione sistematica svedese del 2018 ha riscontrato un gran numero di studi, ma una mancanza generale di prove scientifiche a sostegno della maggior parte dei trattamenti,[75] con un solo studio, qualitativamente sufficiente e contestualmente appropriato, che confrontasse i risultati dell'approccio chirurgico con quello farmacologico.[128] Studi di coorte indicano che la chirurgia è efficace nel ridurre il dolore.[128] La maggior parte delle complicanze post chirurgiche si sono verificate in caso di anastomosi intestinale bassa, mentre il rischio di creazione di una fistola si è verificato nei casi di chirurgia addominale o vaginale combinata. Problemi concernenti il tratto urinario si sono dimostrati comuni a seguito della chirurgia intestinale.[128]
In conclusione, i vantaggi dell'approccio chirurgico sono l'efficacia dimostrata per il controllo del dolore,[129] una maggior probabilità di successo per quanto concerne il trattamento della sterilità rispetto alla somministrazione di farmaci,[101] la possibilità di raggiungere una contestuale diagnosi definitiva[101] e la frequente opportunità di ricorrere a procedure minimamente invasive (laparoscopica) in grado di ridurre la morbilità e minimizzare il rischio di sviluppo di adesioni post-operatoria.[130] Sono stati intrapresi sforzi per sviluppare strategie efficaci per ridurre o prevenire le aderenze, ma la loro formazione rimane un frequente effetto collaterale della chirurgia addominale.[106]
Alcune tecniche di terapia fisica presentano i vantaggi di un minor costo, assenza di effetti collaterali importanti, nessuna interferenza con la fertilità e della funzione sessuale,[131] tuttavia al 2018 non esistono studi effettuati su di un lungo arco temporale che ne possono attestare i risultati per il trattamento del dolore o dell'infertilità correlata all'endometriosi.[131]
Trattamento della sterilità
L'approccio chirurgico è più efficace rispetto all'assunzione di farmaci per affrontare l'infertilità correlata all'endometriosi.[101] La chirurgia tenta di rimuovere il tessuto endometriale e preservare le ovaie senza danneggiare il tessuto normale.[101] Le procedure di fecondazione in vitro (FIV) risultano efficaci nel migliorare la fertilità in molte donne con endometriosi.[132][133]
Durante il trattamento per la fertilità, un lungo pretrattamento con l'agonista del GnRH presenta una maggiore probabilità di consentire l'instaurarsi di una gravidanza nelle con endometriosi rispetto allo stesso ma di breve durata.[75]
Prognosi
Una corretta valutazione della prognosi nelle donne con endometriosi richiede una particolare attenzione ai diversi aspetti che caratterizzano la condizione. Di primaria importanza è la stadiazione iniziale della malattia al fine di ottenere un adeguato e veritiero quadro della situazione su cui poi basare le future decisioni concernenti la terapia. I sintomi della donna e il suo eventuale desiderio di procreare in futuro concorrono a determinare quale sia la terapia appropriata. Non tutti i trattamenti portano gli stessi risultati in tutte le donne e talvolta può accadere che una terapia possa rivelarsi appropriata per una paziente e nello stesso tempo totalmente inadeguata per un'altra. Alcune donne accusano recidive dopo l'intervento chirurgico o dopo la pseudo-menopausa indotta farmacologicamente. Nella maggior parte dei casi, il trattamento garantirà alle donne un significativo sollievo dal dolore pelvico e le aiuterà a raggiungere la gravidanza.[134]
Tuttavia, ad oggi (2018) non è possibile guarire dall'endometriosi e pertanto il processo sottostante che ne è causa non può cessare dopo l'intervento chirurgico o farmacologico. Gli studi hanno dimostrato che l'endometriosi si ripresenta tra il 20% e il 40% dei casi a cinque anni in seguito a chirurgia conservativa,[135] a meno che non venga eseguita un'isterectomia o che venga raggiunta la menopausa. Il follow up delle donne consiste nel sottoporsi ad esami clinici periodici e ad una valutazione mediante ecografia.
La condizione può comportare alcune complicanze, come la formazione di cicatrici interne, aderenze, cisti pelviche, cisti cioccolato nelle ovaie, rottura di cisti, ostruzione intestinale e dell'uretere dovute ad aderenze pelviche.[136] L'endometriosi ovarica può complicare una gravidanza già in atto.[137] L'endometriosi toracica è associata a ricorrente pneumotorace nel corso dei periodi mestruali, denominato "pneumotorace catameniale".[138] Uno studio durato venti anni ed effettuato su di un campione di 12.000 donne con endometriosi, ha dimostrato quelle al di sotto dei 40 anni accusano una probabilità 3 volte maggiore di avere problemi cardiaci rispetto alle loro coetanee sane.[139][140] Decessi dovuti all'endometriosi sono assai rari.[9]
Note
- ^ a b c d e f g h i j k l m Bulletti C, Coccia ME, Battistoni S, Borini A, Endometriosis and infertility, in Journal of Assisted Reproduction and Genetics, vol. 27, n. 8, August 2010, pp. 441–7, DOI:10.1007/s10815-010-9436-1, PMC 2941592, PMID 20574791.
- ^ a b c d e f g h i j k l m n (EN) Endometriosis, su womenshealth.gov, 13 febbraio 2017. URL consultato il 20 maggio 2017 (archiviato il 13 maggio 2017).
- ^ a b Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: a systematic analysis for the Global Burden of Disease Study 2015, in Lancet, vol. 388, n. 10053, October 2016, pp. 1459–1544, DOI:10.1016/S0140-6736(16)31012-1, PMC 5388903, PMID 27733281.
- ^ a b (EN) Endometriosis: Overview, su www.nichd.nih.gov. URL consultato il 20 maggio 2017 (archiviato il 18 maggio 2017).
- ^ (EN) Endometriosis: Condition Information, su www.nichd.nih.gov. URL consultato il 20 maggio 2017 (archiviato il 30 aprile 2017).
- ^ (EN) Culley L, Law C, Hudson N, Denny E, Mitchell H, Baumgarten M, Raine-Fenning N, The social and psychological impact of endometriosis on women's lives: a critical narrative review, in Human Reproduction Update, vol. 19, n. 6, 1º novembre 2013, pp. 625–39, DOI:10.1093/humupd/dmt027, PMID 23884896.
- ^ a b (EN) Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015, in Lancet, vol. 388, n. 10053, October 2016, pp. 1545–1602, DOI:10.1016/S0140-6736(16)31678-6, PMC 5055577, PMID 27733282.
- ^ a b (EN) Patrick J. McGrath, Bonnie J. Stevens, Suellen M. Walker e William T. Zempsky, Oxford Textbook of Paediatric Pain, OUP Oxford, 2013, p. 300, ISBN 978-0-19-964265-6 (archiviato il 10 settembre 2017).
- ^ a b (EN) (GBD 2013 Mortality and Causes of Death Collaborators), Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013, in Lancet, vol. 385, n. 9963, January 2015, pp. 117–71, DOI:10.1016/S0140-6736(14)61682-2, PMC 4340604, PMID 25530442.
- ^ a b (EN) Brosens I, Endometriosis: Science and Practice, John Wiley & Sons, 2012, p. 3, ISBN 978-1-4443-9849-6.
- ^ (EN) Ronald E. Batt, A history of endometriosis, London, Springer, 2011, pp. 13–38, ISBN 978-0-85729-585-9.
- ^ a b c d e (EN) Nezhat C, Nezhat F, Nezhat C, Endometriosis: ancient disease, ancient treatments, in Fertility and Sterility, vol. 98, 6 Suppl, December 2012, pp. S1-62, DOI:10.1016/j.fertnstert.2012.08.001, PMID 23084567.
- ^ (EN) Nezhat C1, Nezhat F, Nezhat C., Endometriosis: ancient disease, ancient treatments., in Fertil Steril, 2012, DOI:10.1016/j.fertnstert.2012.08.001, PMID 23084567.
- ^ a b c Vercellini e Genazzani, 1992, p. 3.
- ^ (EN) S. Ozkan, Endometriosis and infertility: epidemiology and evidence-based treatments (abstract), in Ann. New York Acad. Scienc., vol. 1127, 2008, pp. 92–100, PMID 18443335.
- ^ (EN) C. Morassutto, Incidence and Estimated Prevalence of Endometriosis and Adenomyosis in Northeast Italy: A Data Linkage Study, in PLoS One, vol. 11, 2016, p. e0154227, PMID 27101396.
- ^ Ministero della Salute, Endometriosi, su salute.gov.it. URL consultato il 16 novembre 2018.
- ^ (EN) Nothnick WB, The emerging use of aromatase inhibitors for endometriosis treatment, in Reproductive Biology and Endocrinology, vol. 9, June 2011, pp. 87, DOI:10.1186/1477-7827-9-87, PMC 3135533, PMID 21693036.
- ^ (EN) Bulun SE, Zeitoun K, Sasano H, Simpson ER, Aromatase in aging women, in Seminars in Reproductive Endocrinology, vol. 17, n. 4, 1999, pp. 349–58, DOI:10.1055/s-2007-1016244, PMID 10851574.
- ^ (EN) Batt RE, Mitwally MF, Endometriosis from thelarche to midteens: pathogenesis and prognosis, prevention and pedagogy, in Journal of Pediatric and Adolescent Gynecology, vol. 16, n. 6, December 2003, pp. 337–47, DOI:10.1016/j.jpag.2003.09.008, PMID 14642954.
- ^ (EN) Marsh EE, Laufer MR, Endometriosis in premenarcheal girls who do not have an associated obstructive anomaly, in Fertility and Sterility, vol. 83, n. 3, March 2005, pp. 758–60, DOI:10.1016/j.fertnstert.2004.08.025, PMID 15749511.
- ^ Vercellini e Genazzani, 1992, pp. 3-4.
- ^ a b (EN) S.-W. Guo, Recurrence of endometriosis and its control, in Human Reproduction Update, vol. 15, n. 4, 11 marzo 2009, pp. 441–461, DOI:10.1093/humupd/dmp007, ISSN 1355-4786.
- ^ Vercellini e Genazzani, 1992, p. 4.
- ^ a b c (EN) Fauser BC, Diedrich K, Bouchard P, Domínguez F, Matzuk M, Franks S, Hamamah S, Simón C, Devroey P, Ezcurra D, Howles CM, Contemporary genetic technologies and female reproduction, in Human Reproduction Update, vol. 17, n. 6, 2011, pp. 829–47, DOI:10.1093/humupd/dmr033, PMC 3191938, PMID 21896560.
- ^ (EN) van der Linden PJ, Theories on the pathogenesis of endometriosis, in Human Reproduction, 11 Suppl 3, November 1996, pp. 53–65, DOI:10.1093/humrep/11.suppl_3.53, PMID 9147102.
- ^ Vercellini e Genazzani, 1992, pp. 4-5.
- ^ (EN) Pinkert TC, Catlow CE, Straus R, Endometriosis of the urinary bladder in a man with prostatic carcinoma, in Cancer, vol. 43, n. 4, April 1979, pp. 1562–7, DOI:10.1002/1097-0142(197904)43:4%3C1562::aid-cncr2820430451%3E3.0.co;2-w, PMID 445352.
- ^ (EN) Signorile PG, Baldi F, Bussani R, D'Armiento M, De Falco M, Baldi A, Ectopic endometrium in human foetuses is a common event and sustains the theory of müllerianosis in the pathogenesis of endometriosis, a disease that predisposes to cancer, in Journal of Experimental & Clinical Cancer Research, vol. 28, April 2009, pp. 49, DOI:10.1186/1756-9966-28-49, PMC 2671494, PMID 19358700.
- ^ (EN) Mok-Lin EY, Wolfberg A, Hollinquist H, Laufer MR, Endometriosis in a patient with Mayer-Rokitansky-Küster-Hauser syndrome and complete uterine agenesis: evidence to support the theory of coelomic metaplasia, in Journal of Pediatric and Adolescent Gynecology, vol. 23, n. 1, February 2010, pp. e35-7, DOI:10.1016/j.jpag.2009.02.010, PMID 19589710.
- ^ (EN) Marsh EE, Laufer MR, Endometriosis in premenarcheal girls who do not have an associated obstructive anomaly, in Fertility and Sterility, vol. 83, n. 3, March 2005, pp. 758–60, DOI:10.1016/j.fertnstert.2004.08.025, PMID 15749511.
- ^ (EN) Thibodeau LL, Prioleau GR, Manuelidis EE, Merino MJ, Heafner MD, Cerebral endometriosis. Case report, in Journal of Neurosurgery, vol. 66, n. 4, April 1987, pp. 609–10, DOI:10.3171/jns.1987.66.4.0609, PMID 3559727.
- ^ (EN) Rodman MH, Jones CW, Catamenial hemoptysis due to bronchial endometriosis, in The New England Journal of Medicine, vol. 266, n. 16, April 1962, pp. 805–8, DOI:10.1056/nejm196204192661604, PMID 14493132.
- ^ Endopædia, su endopaedia.info. URL consultato il 3 luglio 2018.
- ^ Vercellini e Genazzani, 1992, p. 5.
- ^ a b (EN) Diagnosis and Treatment of Endometriosis, su aafp.org, American Academy of Family Physicians, 15 ottobre 1999. URL consultato il 26 luglio 2011 (archiviato il 6 giugno 2011).
- ^ Vercellini e Genazzani, 1992, pp. 5-6.
- ^ Vercellini e Genazzani, 1992, p. 6.
- ^ Hufnagel D, Li F, Cosar E, Krikun G, Taylor HS, The Role of Stem Cells in the Etiology and Pathophysiology of Endometriosis, in Seminars in Reproductive Medicine, vol. 33, n. 5, September 2015, pp. 333–40, DOI:10.1055/s-0035-1564609, PMC 4986990, PMID 26375413.
- ^ Bruner-Tran KL, Yeaman GR, Crispens MA, Igarashi TM, Osteen KG, Dioxin may promote inflammation-related development of endometriosis, in Fertility and Sterility, vol. 89, 5 Suppl, May 2008, pp. 1287–98, DOI:10.1016/j.fertnstert.2008.02.102, PMC 2430157, PMID 18394613.
- ^ Yuk JS, Shin JS, Shin JY, Oh E, Kim H, Park WI, Nickel Allergy Is a Risk Factor for Endometriosis: An 11-Year Population-Based Nested Case-Control Study, in PLOS One, vol. 10, n. 10, 2015, pp. e0139388, DOI:10.1371/journal.pone.0139388, PMC 4594920, PMID 26439741.
- ^ Scutiero G, Iannone P, Bernardi G, Bonaccorsi G, Spadaro S, Volta CA, Greco P, Nappi L, Oxidative Stress and Endometriosis: A Systematic Review of the Literature, in Oxidative Medicine and Cellular Longevity, vol. 2017, 2017, pp. 7265238, DOI:10.1155/2017/7265238, PMC 5625949, PMID 29057034.
- ^ Yuk JS, Park EJ, Seo YS, Kim HJ, Kwon SY, Park WI, Graves Disease Is Associated With Endometriosis: A 3-Year Population-Based Cross-Sectional Study, in Medicine, vol. 95, n. 10, March 2016, pp. e2975, DOI:10.1097/MD.0000000000002975, PMC 4998884, PMID 26962803.
- ^ Giudice LC, Kao LC, Endometriosis, in Lancet, vol. 364, n. 9447, 2004, pp. 1789–99, DOI:10.1016/S0140-6736(04)17403-5, PMID 15541453.
- ^ a b c d e f g h Vercellini e Genazzani, 1992, p. 9.
- ^ Weed JC, Ray JE, Endometriosis of the bowel, in Obstetrics and Gynecology, vol. 69, n. 5, May 1987, pp. 727–30, PMID 3574800.
- ^ Uzunçakmak C, Güldaş A, Ozçam H, Dinç K, Scar endometriosis: a case report of this uncommon entity and review of the literature, in Case Reports in Obstetrics and Gynecology, vol. 2013, 2013, pp. 386783, DOI:10.1155/2013/386783, PMC 3665185, PMID 23762683.
- ^ Dwivedi AJ, Agrawal SN, Silva YJ, Abdominal wall endometriomas, in Digestive Diseases and Sciences, vol. 47, n. 2, February 2002, pp. 456–61, DOI:10.1023/a:1013711314870, PMID 11855568.
- ^ Kaunitz A, Di Sant'Agnese PA, Needle tract endometriosis: an unusual complication of amniocentesis, in Obstetrics and Gynecology, vol. 54, n. 6, December 1979, pp. 753–5, PMID 160025.
- ^ Koger KE, Shatney CH, Hodge K, McClenathan JH, Surgical scar endometrioma, in Surgery, Gynecology & Obstetrics, vol. 177, n. 3, September 1993, pp. 243–6, PMID 8356497.
- ^ Daly S, Endometrioma/Endometriosis, su emedicine.com, WebMD, 18 ottobre 2004. URL consultato il 19 dicembre 2006 (archiviato il 6 febbraio 2007).
- ^ a b Stratton P, Berkley KJ, Chronic pelvic pain and endometriosis: translational evidence of the relationship and implications, in Human Reproduction Update, vol. 17, n. 3, 2011, pp. 327–46, DOI:10.1093/humupd/dmq050, PMC 3072022, PMID 21106492.
- ^ a b c d (EN) G Willy Davila, Endometriosis Clinical Presentation, su emedicine.medscape.com. URL consultato il 13 marzo 2019.
- ^ (EN) Mayo Clinic, Endometriosis, su mayoclinic.org. URL consultato il 13 marzo 2019.
- ^ Colette S, Donnez J, Are aromatase inhibitors effective in endometriosis treatment?, in Expert Opinion on Investigational Drugs, vol. 20, n. 7, July 2011, pp. 917–31, DOI:10.1517/13543784.2011.581226, PMID 21529311.
- ^ a b c d (EN) What are the symptoms of endometriosis?, su National Institutes of Health. URL consultato il 4 ottobre 2018.
- ^ Brown J, Farquhar C, Endometriosis: an overview of Cochrane Reviews, in The Cochrane Database of Systematic Reviews, n. 3, March 2014, pp. CD009590, DOI:10.1002/14651858.cd009590.pub2, PMID 24610050.
- ^ Wolthuis AM, Meuleman C, Tomassetti C, D'Hooghe T, de Buck van Overstraeten A, D'Hoore A, Bowel endometriosis: colorectal surgeon's perspective in a multidisciplinary surgical team, in World Journal of Gastroenterology, vol. 20, n. 42, November 2014, pp. 15616–23, DOI:10.3748/wjg.v20.i42.15616, PMC 4229526, PMID 25400445.
- ^ Arbique D, Carter S, Van Sell S, Endometriosis can evade diagnosis, in Rn, vol. 71, n. 9, September 2008, pp. 28–32; quiz 33, PMID 18833741.
- ^ P. Rousset, Thoracic endometriosis syndrome: CT and MRI features, in Clinical Radiology, vol. 69, n. 3, March 2014, pp. 323–330, DOI:10.1016/j.crad.2013.10.014.
- ^ Tomasz Marjański, Catamenial pneumothorax – a review of the literature, vol. 13, n. 3, June 2016, pp. 117-121, DOI:10.5114/kitp.2016.61044.
- ^ Pearce CL, Templeman C, Rossing MA, Lee A, Near AM, Webb PM, Nagle CM, Doherty JA, Cushing-Haugen KL, Wicklund KG, Chang-Claude J, Hein R, Lurie G, Wilkens LR, Carney ME, Goodman MT, Moysich K, Kjaer SK, Hogdall E, Jensen A, Goode EL, Fridley BL, Larson MC, Schildkraut JM, Palmieri RT, Cramer DW, Terry KL, Vitonis AF, Titus LJ, Ziogas A, Brewster W, Anton-Culver H, Gentry-Maharaj A, Ramus SJ, Anderson AR, Brueggmann D, Fasching PA, Gayther SA, Huntsman DG, Menon U, Ness RB, Pike MC, Risch H, Wu AH, Berchuck A, Association between endometriosis and risk of histological subtypes of ovarian cancer: a pooled analysis of case-control studies, in The Lancet. Oncology, vol. 13, n. 4, April 2012, pp. 385–94, DOI:10.1016/S1470-2045(11)70404-1, PMC 3664011, PMID 22361336.
- ^ Nezhat F. Article by Prof. Farr Nezhat, MD, FACOG, FACS, University of Columbia, May 1, 2012 Archiviato il 2 novembre 2012 in Internet Archive.
- ^ (FR) Audebert A, [Women with endometriosis: are they different from others?] [Women with endometriosis: are they different from others?], in Gynecologie, Obstetrique & Fertilite, vol. 33, n. 4, April 2005, pp. 239–46, DOI:10.1016/j.gyobfe.2005.03.010, PMID 15894210.
- ^ Rowlands IJ, Nagle CM, Spurdle AB, Webb PM, Gynecological conditions and the risk of endometrial cancer, in Gynecologic Oncology, vol. 123, n. 3, December 2011, pp. 537–41, DOI:10.1016/j.ygyno.2011.08.022, PMID 21925719.
- ^ a b c d Vercellini e Genazzani, 1992, p. 10.
- ^ Ballard K, Lane H, Hudelist G, Banerjee S, Wright J, Can specific pain symptoms help in the diagnosis of endometriosis? A cohort study of women with chronic pelvic pain, in Fertility and Sterility, vol. 94, n. 1, June 2010, pp. 20–7, DOI:10.1016/j.fertnstert.2009.01.164, PMID 19342028.
- ^ Asante A, Taylor RN, Endometriosis: the role of neuroangiogenesis, in Annual Review of Physiology, vol. 73, 2011, pp. 163–82, DOI:10.1146/annurev-physiol-012110-142158, PMID 21054165.
- ^ a b (EN) Treatment of infertility in women with endometriosis, su www.uptodate.com. URL consultato il 18 dicembre 2017.
- ^ a b Shawn Daly, Imaging in Endometrioma/Endometriosis !lingua=en, su emedicine.medscape.com. URL consultato il 14 marzo 2019.
- ^ a b c d e (EN) G Willy Davila, Endometriosis Clinical Presentation, su emedicine.medscape.com, Medscape. URL consultato il 14 marzo 2019.
- ^ a b c d May KE, Conduit-Hulbert SA, Villar J, Kirtley S, Kennedy SH, Becker CM, Peripheral biomarkers of endometriosis: a systematic review, in Human Reproduction Update, vol. 16, n. 6, 2010, pp. 651–74, DOI:10.1093/humupd/dmq009, PMC 2953938, PMID 20462942.
- ^ a b Hirsch M, Duffy J, Davis CJ, Nieves Plana M, Khan KS, Diagnostic accuracy of cancer antigen 125 for endometriosis: a systematic review and meta-analysis, in BJOG, vol. 123, n. 11, October 2016, pp. 1761–8, DOI:10.1111/1471-0528.14055, PMID 27173590.
- ^ May KE, Villar J, Kirtley S, Kennedy SH, Becker CM, Endometrial alterations in endometriosis: a systematic review of putative biomarkers, in Human Reproduction Update, vol. 17, n. 5, 2011, pp. 637–53, DOI:10.1093/humupd/dmr013, PMID 21672902.
- ^ a b c d e f g (EN) Endometriosis – Diagnosis, treatment and patient experiences, su sbu.se, Swedish Agency for Health Technology Assessment and Assessment of Social Services (SBU), 4 maggio 2018. URL consultato il 13 giugno 2018.
- ^ a b Fang J, Piessens S, A step‐by‐step guide to sonographic evaluation of deep infiltrating endometriosis, in Sonography, vol. 5, n. 2, June 2018, pp. 67–75, DOI:10.1002/sono.12149.
- ^ a b c d e f Nisenblat V, Bossuyt PM, Farquhar C, Johnson N, Hull ML, Imaging modalities for the non-invasive diagnosis of endometriosis, in The Cochrane Database of Systematic Reviews, vol. 2, February 2016, pp. CD009591, DOI:10.1002/14651858.cd009591.pub2, PMID 26919512.
- ^ a b Togashi K, Nishimura K, Kimura I, Tsuda Y, Yamashita K, Shibata T, Nakano Y, Konishi J, Konishi I, Mori T, Endometrial cysts: diagnosis with MR imaging, in Radiology, vol. 180, n. 1, July 1991, pp. 73–8, DOI:10.1148/radiology.180.1.2052726, PMID 2052726.
- ^ a b Kurtz AB, Tsimikas JV, Tempany CM, Hamper UM, Arger PH, Bree RL, Wechsler RJ, Francis IR, Kuhlman JE, Siegelman ES, Mitchell DG, Silverman SG, Brown DL, Sheth S, Coleman BG, Ellis JH, Kurman RJ, Caudry DJ, McNeil BJ, Diagnosis and staging of ovarian cancer: comparative values of Doppler and conventional US, CT, and MR imaging correlated with surgery and histopathologic analysis--report of the Radiology Diagnostic Oncology Group, in Radiology, vol. 212, n. 1, July 1999, pp. 19–27, DOI:10.1148/radiology.212.1.r99jl3619, PMID 10405715.
- ^ McDermott S, Oei TN, Iyer VR, Lee SI, MR imaging of malignancies arising in endometriomas and extraovarian endometriosis, in Radiographics, vol. 32, n. 3, 2012, pp. 845–63, DOI:10.1148/rg.323115736, PMID 22582363.
- ^ Takahashi K, Okada S, Okada M, Kitao M, Kaji Y, Sugimura K, Magnetic resonance relaxation time in evaluating the cyst fluid characteristics of endometrioma, in Hum. Reprod., vol. 11, n. 4, April 1996, pp. 857–60, PMID 8671340.
- ^ Outwater EK, Siegelman ES, Chiowanich P, Kilger AM, Dunton CJ, Talerman A, Dilated fallopian tubes: MR imaging characteristics, in Radiology, vol. 208, n. 2, August 1998, pp. 463–9, DOI:10.1148/radiology.208.2.9680577, PMID 9680577.
- ^ Office on Women’s Health, U.S. Department of Health and Human Services. (16 July 2012). Endometriosis Fact Sheet. Retrieved from Womenshealth.gov Archived copy, su womenshealth.gov. URL consultato l'11 luglio 2015 (archiviato il 3 luglio 2015).
- ^ a b c Hsu AL, Khachikyan I, Stratton P, Invasive and noninvasive methods for the diagnosis of endometriosis, in Clin Obstet Gynecol, vol. 53, n. 2, June 2010, pp. 413–9, DOI:10.1097/GRF.0b013e3181db7ce8, PMC 2880548, PMID 20436318.
- ^ Nisolle M, Paindaveine B, Bourdon A, Berlière M, Casanas-Roux F, Donnez J, Histologic study of peritoneal endometriosis in infertile women, in Fertility and Sterility, vol. 53, n. 6, June 1990, pp. 984–8, PMID 2351237.
- ^ Treatment of pelvic pain associated with endometriosis: a committee opinion, in Fertility and Sterility, vol. 101, n. 4, April 2014, pp. 927–35, DOI:10.1016/j.fertnstert.2014.02.012, PMID 24630080.
- ^ a b Vercellini e Genazzani, 1992, p. 6.
- ^ Potlog-Nahari C, Feldman AL, Stratton P, Koziol DE, Segars J, Merino MJ, Nieman LK, CD10 immunohistochemical staining enhances the histological detection of endometriosis, in Fertil. Steril., vol. 82, n. 1, July 2004, pp. 86–92, DOI:10.1016/j.fertnstert.2003.11.059, PMID 15236994.
- ^ Revised American Society for Reproductive Medicine classification of endometriosis: 1996, in Fertility and Sterility, vol. 67, n. 5, May 1997, pp. 817–21, DOI:10.1016/S0015-0282(97)81391-X, PMID 9130884.
- ^ Koninckx PR, Meuleman C, Demeyere S, Lesaffre E, Cornillie FJ, Suggestive evidence that pelvic endometriosis is a progressive disease, whereas deeply infiltrating endometriosis is associated with pelvic pain, in Fertil. Steril., vol. 55, n. 4, April 1991, pp. 759–65, DOI:10.1016/S0015-0282(16)54244-7, PMID 2010001.
- ^ Vercellini P, Fedele L, Aimi G, Pietropaolo G, Consonni D, Crosignani PG, Association between endometriosis stage, lesion type, patient characteristics and severity of pelvic pain symptoms: a multivariate analysis of over 1000 patients, in Human Reproduction, vol. 22, n. 1, January 2007, pp. 266–71, DOI:10.1093/humrep/del339, PMID 16936305.
- ^ Immagine di Endometriosi : tipi, severità e classificazione, su mondoginecologico.it. URL consultato il 18 marzo 2019.
- ^ Triolo O, Laganà AS, Sturlese E, Chronic pelvic pain in endometriosis: an overview, in J Clin Med Res, vol. 5, n. 3, June 2013, pp. 153–63, DOI:10.4021/jocmr1288w, PMC 3651065, PMID 23671540.
- ^ Koninckx,P.R.; Meuleman,C.; Demeyere,S.; Lesaffre,E.; Cornillie,F.J., Suggestive evidence that pelvic endometriosis is a progressive disease, whereas deeply infiltrating endometriosis is associated with pelvic pain, in Fertil.Steril, vol. 55, n. 4.
- ^ Hornstein MD, Gleason RE, Orav J, Haas ST, Friedman AJ, Rein MS, Hill JA, Barbieri RL, The reproducibility of the revised American Fertility Society classification of endometriosis, in Fertil. Steril., vol. 59, n. 5, May 1993, pp. 1015–21, DOI:10.1016/S0015-0282(16)55921-4, PMID 8486168.
- ^ (EN) G Willy Davila, Endometriosis Clinical Presentation, su emedicine.medscape.com, Medscape. URL consultato il 18 marzo 2019.
- ^ Bourdel N, Alves J, Pickering G, Ramilo I, Roman H, Canis M, Systematic review of endometriosis pain assessment: how to choose a scale?, in Human Reproduction Update, vol. 21, n. 1, 2014, pp. 136–52, DOI:10.1093/humupd/dmu046, PMID 25180023.
- ^ (EN) G Willy Davila, Endometriosis Differential Diagnoses, su emedicine.medscape.com, Medscape. URL consultato il 12 marzo 2019..
- ^ a b What are the treatments for endometriosis, su nichd.nih.gov, Eunice Kennedy Shriver National Institute of Child Health and Human Development. URL consultato il 20 agosto 2013 (archiviato il 3 agosto 2013).
- ^ Moen MH, Rees M, Brincat M, Erel T, Gambacciani M, Lambrinoudaki I, Schenck-Gustafsson K, Tremollieres F, Vujovic S, Rozenberg S, EMAS position statement: Managing the menopause in women with a past history of endometriosis, in Maturitas, vol. 67, n. 1, September 2010, pp. 94–7, DOI:10.1016/j.maturitas.2010.04.018, PMID 20627430.
- ^ a b c d e f g Wellbery C, Diagnosis and treatment of endometriosis, in American Family Physician, vol. 60, n. 6, October 1999, pp. 1753–62, 1767–8, PMID 10537390 (archiviato il 29 ottobre 2013).
- ^ Speroff L, Glass RH, Kase NG, Clinical Gynecologic Endocrinology and Infertility, 6th, Lippincott Willimas Wilkins, 1999, p. 1057, ISBN 0-683-30379-1.
- ^ Vercellini e Genazzani, 1992, p. 13.
- ^ Endometriosis and Infertility: Can Surgery Help? (PDF), su asrm.org, American Society for Reproductive Medicine, 2008. URL consultato il 31 ottobre 2010 (archiviato l'11 ottobre 2010).
- ^ a b Vercellini e Genazzani, 1992, p. 14.
- ^ a b Liakakos T, Thomakos N, Fine PM, Dervenis C, Young RL, Peritoneal adhesions: etiology, pathophysiology, and clinical significance. Recent advances in prevention and management, in Digestive Surgery, vol. 18, n. 4, 2001, pp. 260–73, DOI:10.1159/000050149, PMID 11528133.
- ^ Trehan AK, Temporary ovarian suspension, in Gynaecological Endoscopy, vol. 11, n. 1, 2002, pp. 309–314, DOI:10.1046/j.1365-2508.2002.00520.x.
- ^ Abuzeid MI, Ashraf M, Shamma FN, Temporary ovarian suspension at laparoscopy for prevention of adhesions, in The Journal of the American Association of Gynecologic Laparoscopists, vol. 9, n. 1, February 2002, pp. 98–102, PMID 11821616.
- ^ Namnoum AB, Hickman TN, Goodman SB, Gehlbach DL, Rock JA, Incidence of symptom recurrence after hysterectomy for endometriosis, in Fertility and Sterility, vol. 64, n. 5, November 1995, pp. 898–902, PMID 7589631.
- ^ Guo SW, Recurrence of endometriosis and its control, in Human Reproduction Update, vol. 15, n. 4, 2009, pp. 441–61, DOI:10.1093/humupd/dmp007, PMID 19279046.
- ^ a b Johnson NP, Hummelshoj L, Consensus on current management of endometriosis, in Human Reproduction, vol. 28, n. 6, June 2013, pp. 1552–68, DOI:10.1093/humrep/det050, PMID 23528916.
- ^ Zorbas KA, Economopoulos KP, Vlahos NF, Continuous versus cyclic oral contraceptives for the treatment of endometriosis: a systematic review, in Archives of Gynecology and Obstetrics, vol. 292, n. 1, July 2015, pp. 37–43, DOI:10.1007/s00404-015-3641-1, PMID 25644508.
- ^ Endometriosis: Treatment of pelvic pain, su www.uptodate.com. URL consultato il 18 dicembre 2017.
- ^ Patel B, Elguero S, Thakore S, Dahoud W, Bedaiwy M, Mesiano S, Role of nuclear progesterone receptor isoforms in uterine pathophysiology, in Human Reproduction Update, vol. 21, n. 2, 2014, pp. 155–73, DOI:10.1093/humupd/dmu056, PMC 4366574, PMID 25406186.
- ^ Andres Mde P, Lopes LA, Baracat EC, Podgaec S, Dienogest in the treatment of endometriosis: systematic review, in Arch. Gynecol. Obstet., vol. 292, n. 3, September 2015, pp. 523–9, DOI:10.1007/s00404-015-3681-6, PMID 25749349.
- ^ McCormack PL, Dienogest: a review of its use in the treatment of endometriosis, in Drugs, vol. 70, n. 16, 2010, pp. 2073–88, DOI:10.2165/11206320-000000000-00000, PMID 20964453.
- ^ Dienogest for the treatment of endometriosis (PDF), in London New Drugs Group. URL consultato il 7 dicembre 2010 (archiviato dall'url originale il 2 ottobre 2011).
- ^ O'Callaghan D, Endometriosis--an update, in Aust Fam Physician, vol. 35, n. 11, November 2006, pp. 864–7, PMID 17099804.
- ^ a b Brown J, Pan A, Hart RJ, Gonadotrophin-releasing hormone analogues for pain associated with endometriosis, in The Cochrane Database of Systematic Reviews, n. 12, December 2010, pp. CD008475, DOI:10.1002/14651858.CD008475.pub2, PMID 21154398.
- ^ Julie Brown, Tineke J Crawford, Claire Allen, Sally Hopewell, Andrew Prentice, Nonsteroidal anti‐inflammatory drugs for pain in women with endometriosis, in Cochrane Database Syst Rev., gennaio 2017, DOI:10.1002/14651858.CD004753.pub4, PMID 28114727.
- ^ Anava A. Wren,1 Alexandra C. Ross,2 Genevieve D’Souza,3 Christina Almgren, Amanda Feinstein, Amanda Marshall, Brenda Golianu3, Multidisciplinary Pain Management for Pediatric Patients with Acute and Chronic Pain: A Foundational Treatment Approach When Prescribing Opioids, in Children (Basel), febbraio 2019, DOI:10.3390/children6020033, PMID 30795645.
- ^ Lu D, Song H, Li Y, Clarke J, Shi G, Pentoxifylline for endometriosis, in The Cochrane Database of Systematic Reviews, vol. 1, January 2012, pp. CD007677, DOI:10.1002/14651858.CD007677.pub3, PMID 22258970.
- ^ Practice bulletin no. 114: management of endometriosis, in Obstetrics and Gynecology, vol. 116, n. 1, July 2010, pp. 223–36, DOI:10.1097/AOG.0b013e3181e8b073, PMID 20567196.
- ^ a b Laschke MW, Menger MD, Anti-angiogenic treatment strategies for the therapy of endometriosis, in Human Reproduction Update, vol. 18, n. 6, 2012, pp. 682–702, DOI:10.1093/humupd/dms026, PMID 22718320.
- ^ Canny GO, Lessey BA, The role of lipoxin A4 in endometrial biology and endometriosis, in Mucosal Immunology, vol. 6, n. 3, May 2013, pp. 439–50, DOI:10.1038/mi.2013.9, PMC 4062302, PMID 23485944.
- ^ Streuli I, de Ziegler D, Santulli P, Marcellin L, Borghese B, Batteux F, Chapron C, An update on the pharmacological management of endometriosis, in Expert Opinion on Pharmacotherapy, vol. 14, n. 3, February 2013, pp. 291–305, DOI:10.1517/14656566.2013.767334, PMID 23356536.
- ^ Kapoor D, Davila W (2005). Endometriosis, Archiviato l'11 novembre 2007 in Internet Archive. eMedicine.
- ^ a b c (SV) Endometrios – diagnostik, behandling och bemötande, su www.sbu.se, Statens beredning för medicinsk och social utvärdering (SBU); Swedish Agency for Health Technology Assessment and Assessment of Social Services, p. 121. URL consultato il 13 giugno 2018.
- ^ Kaiser A, Kopf A, Gericke C, Bartley J, Mechsner S, The influence of peritoneal endometriotic lesions on the generation of endometriosis-related pain and pain reduction after surgical excision, in Archives of Gynecology and Obstetrics, vol. 280, n. 3, September 2009, pp. 369–73, DOI:10.1007/s00404-008-0921-z, PMID 19148660.
- ^ Radosa MP, Bernardi TS, Georgiev I, Diebolder H, Camara O, Runnebaum IB, Coagulation versus excision of primary superficial endometriosis: a 2-year follow-up, in European Journal of Obstetrics, Gynecology, and Reproductive Biology, vol. 150, n. 2, June 2010, pp. 195–8, DOI:10.1016/j.ejogrb.2010.02.022, PMID 20303642.
- ^ a b Wurn BF, Wurn LJ, Patterson K, King CR, Scharf ES, Decreasing dyspareunia and dysmenorrhea in women with endometriosis via a manual physical therapy: Results from two independent studies, in Journal of Endometriosis and Pelvic Pain Disorders, vol. 3, 2011, pp. 188–196, DOI:10.5301/JE.2012.9088 (archiviato il 29 ottobre 2013).
- ^ Catenacci M, Falcone T, The effect of endometriosis on in vitro fertilization outcome, in Minerva Ginecol, vol. 60, n. 3, June 2008, pp. 209–21, PMID 18547983.
- ^ AlKudmani B, Gat I, Buell D, Salman J, Zohni K, Librach C, Sharma P, In Vitro Fertilization Success Rates after Surgically Treated Endometriosis and Effect of Time Interval between Surgery and In Vitro Fertilization, in J Minim Invasive Gynecol, vol. 25, n. 1, January 2018, pp. 99–104, DOI:10.1016/j.jmig.2017.08.641, PMID 28807807.
- ^ Memarzadeh S, Muse KN, Fox, MD, Endometriosis, in Differential Diagnosis and Treatment of endometriosis., Armenian Health Network, Health.am, 21 settembre 2006. URL consultato il 19 dicembre 2006 (archiviato il 31 gennaio 2007).
- ^ Recurrent Endometriosis: Surgical Management, in Endometriosis, The Cleveland Clinic, 7 gennaio 2010. URL consultato il 31 ottobre 2010 (archiviato il 1º maggio 2010).
- ^ (SV) Acosta S, Leandersson U, Svensson SE, Johnsen J, [A case report. Endometriosis caused colonic ileus, ureteral obstruction and hypertension] [A case report. Endometriosis caused colonic ileus, ureteral obstruction and hypertension], in Lakartidningen, vol. 98, n. 18, May 2001, pp. 2208–12, PMID 11402601.
- ^ Ueda Y, Enomoto T, Miyatake T, Fujita M, Yamamoto R, Kanagawa T, Shimizu H, Kimura T, A retrospective analysis of ovarian endometriosis during pregnancy, in Fertility and Sterility, vol. 94, n. 1, June 2010, pp. 78–84, DOI:10.1016/j.fertnstert.2009.02.092, PMID 19356751.
- ^ Visouli AN, Zarogoulidis K, Kougioumtzi I, Huang H, Li Q, Dryllis G, Kioumis I, Pitsiou G, Machairiotis N, Katsikogiannis N, Papaiwannou A, Lampaki S, Zaric B, Branislav P, Porpodis K, Zarogoulidis P, Catamenial pneumothorax, in Journal of Thoracic Disease, vol. 6, Suppl 4, October 2014, pp. S448-60, DOI:10.3978/j.issn.2072-1439.2014.08.49, PMC 4203986, PMID 25337402.
- ^ Jacqui Wise, Women with endometriosis show higher risk for heart disease, in BMJ, vol. 353, 1º aprile 2016, pp. i1851, DOI:10.1136/bmj.i1851, ISSN 1756-1833, PMID 27036948.
- ^ Women with endometriosis at higher risk for heart disease | American Heart Association, su newsroom.heart.org. URL consultato il 3 luglio 2018.
Bibliografia
- Paolo Vercellini e Andrea Genazzani, Endometriosi, Roma, CIC Edizioni Internazionali, 1992, ISBN 88-7141-155-3
ISBNnon valido (aiuto). - (EN) Patrick J. McGrath, Bonnie J. Stevens, Suellen M. Walker e William T. Zempsky, Oxford Textbook of Paediatric Pain, OUP Oxford, 2013, ISBN 978-0-19-964265-6.
- (EN) Brosens I, Endometriosis: Science and Practice, John Wiley & Sons, 2012, ISBN 978-1-4443-9849-6.
- (EN) Ronald E. Batt, A history of endometriosis, Londra, Springer, 2011, ISBN 978-0-85729-585-9.
- (EN) Speroff L, Glass RH, Kase NG, Clinical Gynecologic Endocrinology and Infertility, 6th, Lippincott Willimas Wilkins, 1999, ISBN 0-683-30379-1.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su endometriosi
Wikimedia Commons contiene immagini o altri file su endometriosi
Collegamenti esterni
- (EN) endometriosis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- APEonlus, Associazione Progetto Endometriosi
- ARIANNe Associazione ARIANNe Onlus - Endometriosi
- AIEonlus Associazione Italiana Endometriosi onlus
- Ændo – Associazione Italiana Dolore Pelvico ed Endometriosi, su aendoassociazione.com.
- Comitato Io ho l'endometriosi, il blog delle donne affette da endometriosi
| Classificazione e risorse esterne (EN) |
ICD-9-CM: 617, 617.9 e 617.8; ICD-10-CM: N80 e N80.9; OMIM: 131200; MeSH: D004715; DiseasesDB: 4269; |
| Controllo di autorità | Thesaurus BNCF 32159 · LCCN (EN) sh85043079 · GND (DE) 4152177-8 · BNE (ES) XX4576836 (data) · BNF (FR) cb119937878 (data) · J9U (EN, HE) 987007543212105171 · NDL (EN, JA) 00936311 |
|---|