Lantanoidi
| Z | Nome | Simbolo |
|---|---|---|
| 57 | Lantanio | La |
| 58 | Cerio | Ce |
| 59 | Praseodimio | Pr |
| 60 | Neodimio | Nd |
| 61 | Promezio | Pm |
| 62 | Samario | Sm |
| 63 | Europio | Eu |
| 64 | Gadolinio | Gd |
| 65 | Terbio | Tb |
| 66 | Disprosio | Dy |
| 67 | Olmio | Ho |
| 68 | Erbio | Er |
| 69 | Tulio | Tm |
| 70 | Itterbio | Yb |
| 71 | Lutezio | Lu |
La serie dei lantanoidi (in passato lantanidi, termine coniato da Victor Moritz Goldschmidt nel 1925)[1] è costituita dai 15 elementi chimici, che sulla tavola periodica si trovano fra il bario e l'afnio. Essi hanno numero atomico compreso fra 57 e 71 (estremi inclusi).[2][3][4] Essi costituiscono, insieme a scandio e ittrio, le cosiddette terre rare.[5]
Nei lantanoidi (spesso indicati con il simbolo generico Ln) gli orbitali atomici 4f sono parzialmente o completamente riempiti, mentre gli orbitali p e d, più esterni, restano ancora vuoti. Visto lo scarso effetto degli orbitali f sulle proprietà chimiche di un elemento rispetto agli orbitali s, p e d, tutti i lantanoidi mostrano sostanzialmente lo stesso comportamento e le stesse proprietà, rendendo molto difficile una loro separazione per via chimico-fisica.
D'altra parte gli orbitali f conferiscono loro una serie di proprietà magnetiche e ottiche molto interessanti: il samario è molto usato in lega con il cobalto per fabbricare magneti permanenti, mentre l'erbio viene sfruttato come drogante per fibre ottiche allo scopo di renderle attive, cioè capaci di amplificare il segnale luminoso che le attraversa direttamente.
Per motivi di compattezza grafica, i lantanoidi e gli attinoidi sono in genere posti come nota sotto la tavola periodica, in cui al loro posto compare solo un rimando.
I lantanoidi così come i metalli di transizione possono dare luogo a ioni complessi, sebbene le specie derivanti abbiano caratteristiche completamente diverse.
Il tutto è correlabile al fatto che gli orbitali 4f risultano essere orbitali interni per cui non subiscono alterazioni in seguito all'azione del campo dei leganti, cosa che invece accade per i complessi di metalli di transizione. Va inoltre detto che per tutta la serie, lo stato di ossidazione caratteristico è il +3, gli altri stati (+2 e +4) sono molto più rari, la spiegazione di ciò risiede sempre nella considerazione che gli orbitali 4f risultano essere orbitali interni per cui difficilmente ionizzabili.
Caratteristica dei composti dei lantanoidi è la luminescenza, qualità sfruttata per la costruzione di schermi televisivi prima dell'avvento del display al plasma.

Etimologia[modifica | modifica wikitesto]
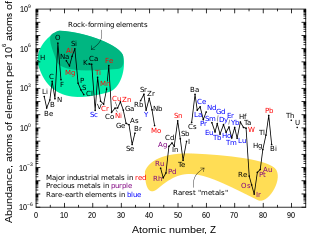
Insieme a scandio e ittrio, il termine terre rare è talvolta usato per descrivere tutti i lantanoidi. Questo nome deriva dai minerali da cui sono stati isolati, che erano rari minerali di tipo ossido. Tuttavia, l'uso del nome è deprecato dalla IUPAC, in quanto gli elementi non sono né rari né "terre" (un termine obsoleto per gli ossidi fortemente basici insolubili in acqua di metalli elettropositivi incapaci di essere fusi in metallo con la tecnologia del tardo XVIII secolo)[senza fonte]. Il cerio è il 26º elemento più abbondante nella crosta terrestre, il neodimio è più abbondante dell'oro e persino il tulio (il comune lantanoide meno naturale) è più abbondante dello iodio, che è di per sé abbastanza comune per la biologia da aver assunto ruoli speciali in alcuni ambiti, anche medici. Nonostante la loro abbondanza, anche i termini tecnici "lantanidi" o "lantanoidi" potrebbero indicarne l'inafferrabilità, in quanto queste definizioni derivano dal greco λανθάνειν, lanthànein, "restare nascosto". Tuttavia questa interpretazione è in effetti appropriata se non si fa riferimento alla loro abbondanza naturale, ma piuttosto alla loro proprietà di "nascondersi" dietro l'un l'altro nei minerali. L'etimologia del termine va ricercata nella prima scoperta del lantanio, a quel tempo un cosiddetto nuovo elemento di terre rare "che giace nascosto" in un minerale di cerio. Il lantanio, essendo stato successivamente identificato come il primo di tutta una serie di elementi chimicamente simili, darà poi il nome a tutto il gruppo di questi elementi.
Il termine "lantanidi" è stato introdotto da Victor Moritz Goldschmidt nel 1925.
Fonti[modifica | modifica wikitesto]
Esistono più di 100 minerali contenenti lantanoidi, ma solo due sono importanti dal punto di vista commerciale: la monazite (un fosfato misto di lantanio, torio, cerio e altri lantanoidi) e la bastnasite (un fluorocarbonato di lantanio e altri lantanoidi). La monazite è diffusa ma in modo molto sparso, sempre insieme ad altri minerali come ilmenite e cassiterite, e ha lo svantaggio di contenere anche torio, un elemento radioattivo che va accuratamente rimosso prima di procedere all'isolamento dei lantanoidi. La bastnasite è presente in grandi depositi negli USA e in Cina. Attualmente più del 90% della produzione dei lantanoidi viene dalla Cina (circa 120 000 tonnellate all'anno). A seconda del minerale di partenza vengono utilizzate diverse procedure di estrazione, fino a ottenere una miscela grezza di ossidi o cloruri dei lantanoidi. Per molte applicazioni non è necessario isolare i singoli elementi, e ci si limita ad ottenere leghe metalliche o miscele di composti. La separazione dei singoli lantanoidi è molto complessa. In passato si usavano metodi di cristallizzazione frazionata e cromatografia a scambio ionico, mentre oggi esistono tecniche di estrazione liquido-liquido molto più efficienti, isolando i cloruri dei singoli elementi. La riduzione allo stato elementare è difficile dato che questi metalli hanno punti di fusione elevati e si ossidano facilmente. Quando è necessario ottenere il metallo si procede tramite elettrolisi dei sali fusi o per riduzione ad alta temperatura con calcio metallico.[6][7]
Tossicità e ruolo biologico[modifica | modifica wikitesto]
I lantanoidi non hanno alcun ruolo biologico nelle specie viventi. Sono presenti in piccola quantità nel terreno e attraverso le piante entrano nella catena alimentare, senza creare alcun problema di tossicità. Composti insolubili come ossidi e solfati dei lantanoidi non danno alcun effetto tossico per ingestione. I metalli in forma massiva non sono pericolosi, mentre in forma di polvere possono essere irritanti per gli occhi. Piccole quantità di fumi inalate si accumulano nei polmoni senza dare effetti dannosi; gli unici pericoli derivano dalla eventuale presenza di impurezze radioattive di torio e uranio, che sono pressoché nulle con i moderni metodi di separazione.[7][8]
Applicazioni[modifica | modifica wikitesto]
Industria[modifica | modifica wikitesto]
Gli elementi della serie dei lantanoidi e i loro composti hanno molti usi, ma le quantità consumate sono relativamente piccole in confronto ad altri elementi. Circa 15 000 ton/anno di lantanoidi sono consumati come catalizzatori nell'industria chimica, nella produzione di vetri e ceramiche colorate, magneti e fosfori. Queste 15 000 tonnellate corrispondono a circa l'85% della produzione dei lantanoidi. Tuttavia dal punto di vista del valore commerciale le applicazioni per fosfori e magneti sono più importanti.[8] Le tipologie di applicazione e la loro importanza sono riassunte nella tabella seguente:[9]
| Applicazione | Percentuale |
|---|---|
| Convertitori catalitici | 45 |
| Catalizzatori per la raffinazione del petrolio | 25 |
| Magneti permanenti | 12 |
| Levigatura del vetro e ceramica | 7 |
| Metallurgia | 7 |
| Fosfori | 3 |
| Altri | 1 |
I dispositivi in cui vengono impiegati i lantanoidi includono superconduttori, magneti permanenti in samario-cobalto e neodimio-ferro-boro, leghe di magnesio, levigatrici per strumenti ottici, catalizzatori chimici e componenti per auto ibride, principalmente batterie e magneti.[10] Gli ioni dei lantanoidi vengono usati come ioni attivi in materiali luminescenti utilizzati in applicazioni di optoelettronica, in particolare il laser Nd:YAG. Amplificatori a fibra drogata con erbio sono dispositivi significativi nei sistemi di comunicazione in fibra ottica. Fosfori drogati con lantanoidi sono anche ampiamente utilizzati nella tecnologia dei tubi a raggi catodici come nei televisori. I primi televisori a colori CRT avevano un rosso di scarsa qualità; l'europio come drogante del fosforo ha reso possibile un rosso della giusta tonalità. Le sfere di granato di ferro-ittrio (YIG) possono agire come risonatori a microonde accordabili. Ossidi di lantanoidi sono mescolati con il tungsteno per migliorarne le proprietà ad alte temperature per la saldatura, sostituendo il torio, con il quale era pericoloso lavorare. Molti prodotti per la difesa utilizzano i lantanoidi, ad esempio in occhiali per la visione notturna e telemetri. Il radar SPY-1 utilizzato in alcune navi da guerra Aegis attrezzate ed il sistema di propulsione ibrido del cacciatorpediniere Arleigh Burke-class utilizzano tutti magneti di terre rare.[11]
Quasi tutti i lantanoidi sono ampiamente utilizzati in laser, come (co)droganti in amplificatori ottici a fibra drogata (erbio) e nei ripetitori nei collegamenti di trasmissione in fibra ottica terrestri e sottomarini che portano traffico dati di internet. Questi elementi assorbono la radiazione ultravioletta ed infrarossa e sono comunemente impiegati nella produzione di lenti per strumenti ottici e occhiali da sole. L’ossido di cerio CeO2 è usato come abrasivo lucidante nella lavorazione del vetro, per tutti i prodotti che vanno da un semplice specchio alle lenti più sofisticate (prima del 1950 si usava Fe2O3). Complessi di gadolinio sono importanti nella diagnostica RNM, in virtù del loro paramagnetismo. Il cosiddetto mischmetal è una miscela contenente circa il 50% di cerio, 25% di lantanio e 25% di altri lantanoidi, ed è usato come additivo in varie leghe metalliche, come getter in tubi a vuoto e come lega piroforica per le "pietrine" degli accendini.[6]
In molte applicazioni, i lantanoidi sono vantaggiosi per la loro bassa tossicità. Ad esempio il lantanio può essere usato nelle batterie ricaricabili NiMH (nichel-metallo idruro), che hanno migliori prestazioni e meno problemi di smaltimento di quelle NiCd; pigmenti rossi o arancio basati su lantanio e cerio sono proposti in sostituzione di quelli basati su cadmio o altri metalli pesanti tossici.[12]
Scienze naturali[modifica | modifica wikitesto]
Come accennato nella sezione delle applicazioni industriali, i metalli lantanoidi sono particolarmente utili nelle tecnologie che sfruttano la loro reattività alle specifiche lunghezze d'onda della luce.[13] Alcune applicazioni delle scienze naturali sfruttano le proprietà di fluorescenza uniche di complessi di ioni lantanoidi (Ln (III) chelati o criptati). Questi sono particolarmente adatti per questa applicazione a causa del loro grande spostamento di Stokes (Stokes shift) e della loro vita di emissione estremamente lunga (da microsecondi a millisecondi) rispetto ai fluorofori più tradizionali (ad esempio, alloficocianina, fluoresceina, ficoeritrina, e rodamina B). I fluidi biologici o sieri comunemente utilizzati in queste applicazioni di ricerca contengono molti composti e proteine che sono naturalmente fluorescenti, pertanto l'uso della misurazione della fluorescenza convenzionale allo stato stazionario presenta gravi limiti di sensibilità del saggio. Fluorofori longevi, come i lantanoidi, in combinazione con la rilevazione risolta nel tempo (un ritardo tra l'eccitazione e la rilevazione delle emissioni) riducono al minimo il prompt di interferenze di fluorescenza.
La spettroscopia risolta nel tempo (time-resolved spectroscopy, abbreviata in TRS oppure TRF, dove la "F" sta per fluorometry) in combinazione con il trasferimento di energia di risonanza di fluorescenza (FRET), offre un potente strumento per i ricercatori drug discovery: il Time-Resolved Fluorescence Resonance Energy Transfer o TR-FRET. Il TR-FRET combina l'aspetto di fondo della TRF con il formato di dosaggio omogeneo del FRET. Il saggio risultante fornisce un aumento di flessibilità, affidabilità e sensibilità oltre a uno scambio di materia più elevato.
Questo metodo comporta due fluorofori: un donatore ed un accettore. L'eccitazione del fluoroforo donatore, in questo caso il complesso di ioni lantanoidi da una sorgente di energia, per esempio una lampada flash o laser, produce un trasferimento di energia al fluoroforo accettore se entrambi sono all'interno di una determinata distanza l'uno dall'altro (nota come raggio di Förster). Il fluoroforo accettore a sua volta emette luce con la sua lunghezza d'onda caratteristica.
I due lantanoidi più comunemente usati negli esperimenti di scienze naturali (europio e terbio) sono riportati di seguito, insieme con il loro corrispondente colorante accettore, le lunghezze d'onda di eccitazione e di emissione ed il conseguente spostamento di Stokes (separazione delle lunghezze d'onda di eccitazione e di emissione).
| Donatore | Eccitazione⇒Emissione λ (nm) | Accettore | Eccitazione⇒Emissione λ (nm) | Stokes Shift (nm) |
|---|---|---|---|---|
| Eu3+ | 340⇒615 | Alloficocianina | 615⇒660 | 320 |
| Tb3+ | 340⇒545 | Ficoeritrina | 545⇒575 | 235 |
Proprietà degli elementi[modifica | modifica wikitesto]


Questi elementi hanno tutti un tipico aspetto metallico lucente. Sono piuttosto teneri, ma diventano più duri lungo la serie. Al crescere del numero atomico si alternano ovviamente elementi col numero atomico pari e dispari; questo fa sì che si alternino elementi con molti o pochi isotopi stabili, con conseguenze sull'abbondanza naturale (regola di Oddo-Harkins) e sull’incertezza sul peso atomico.[6]
Le configurazioni elettroniche degli atomi neutri sono difficili da determinate perché gli spettri atomici sono molto complessi; come indicato nella tabella seguente, si osserva qualche caso di riempimento anomalo. Come conseguenza delle anomalie di configurazione, varie proprietà di questi metalli allo stato elementare mostrano un andamento irregolare. Un esempio è dato dalla temperatura di fusione; un altro è dato dalle dimensioni del raggio metallico. Nello stato di ossidazione +3, che è il più comune di tutta la serie dei lantanidi, si ha invece un riempimento regolare e progressivo degli elettroni 4f, e le varie proprietà dei metalli variano in modo molto progressivo. Ad esempio si vede nella figura come diminuiscono i raggi degli ioni Ln(III). Queste diminuzioni di dimensione, sia del raggio metallico che dello ione 3+, danno luogo alla cosiddetta contrazione lantanoidea, che ha le seguenti conseguenze:
(a) la differenza di dimensioni tra uno ione Ln(III) e il successivo rende possibile la loro separazione, che però risulta difficile, dato che la differenza è molto piccola;
(b) la contrazione dei lantanidi è di dimensioni simili all'espansione che si ha nel passare da una serie d alla successiva. In pratica la presenza dei lantanidi va a cancellare pressoché esattamente l’aumento di dimensioni atomiche che ci si aspetterebbe nel passare dalla serie 4d alla 5d. Di conseguenza i due congeneri più pesanti nel blocco d hanno di solito dimensioni e proprietà molto simili.
| Elemento chimico | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Numero atomico | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 | |
| Immagine |  |
 |
 |
 |
||||||||||||
| Densità (g·cm-3) | 6,17 | 6,770 | 6,773 | 7,007 | - | 7,520 | 5,234 | 7,900 | 8,229 | 8,550 | 8,795 | 9,066 | 9,321 | 6,965 | 9,840 | |
| Punto di fusione °C | 920 | 798 | 931 | 1 021 | 1 042 | 1 074 | 822 | 1 313 | 1 365 | 1 412 | 1 474 | 1 529 | 1 545 | 819 | 1 663 | |
| Punto di ebollizione °C | 3 420 | 3 433 | 3 520 | 3 074 | 3 000 | 1 794 | 1 429 | 3 273 | 3 230 | 2 567 | 2 700 | 2 868 | 1 950 | 1 196 | 3 402 | |
| Configurazione elettronica in fase di gas * | 4f05d16s2 | 4f15d16s2 | 4f36s2 | 4f46s2 | 4f56s2 | 4f66s2 | 4f76s2 | 4f75d16s2 | 4f96s2 | 4f106s2 | 4f116s2 | 4f126s2 | 4f136s2 | 4f146s2 | 4f145d16s2 | |
| Configurazione elettronica dell'atomo allo stato solido * |
5d1 | 4f15d1 | 4f25d1 | 4f35d1 | 4f45d1 | 4f55d1 | 4f7 | 4f75d1 | 4f85d1 | 4f95d1 | 4f105d1 | 4f115d1 | 4f125d1 | 4f14 | 4f145d1 | |
| Tipo di reticolo | dhcp | fcc | dhcp | dhcp | dhcp | ** | bcc | hcp | hcp | hcp | hcp | hcp | hcp | fcc | hcp | |
| Raggio metallico (pm) | 162 | 181,8 | 182,4 | 181,4 | 183,4 | 180,4 | 208,4 | 180,4 | 177,3 | 178,1 | 176,2 | 176,1 | 175,9 | 193,3 | 173,8 | |
| Entalpia di fusione (kJ·mol−1) | 8,5 | 5,2 | 11,3 | 7,13 | - | 8,9 | - | - | - | - | - | - | - | 3,35 | - | |
| Entalpia di vaporizzazione (kJ·mol−1) | 402 | 398 | 331 | 289 | - | 165 | 176 | 301 | 293 | 280 | 280 | 280 | 247 | 159 | 414 | |
| Entalpia di formazione (kJ·mol−1) | 423 | 419 | 356 | 328 | 301 | 207 | 178 | 398 | 389 | 291 | 301 | 317 | 232 | 152 | - | |
| Resistività elettrica a 25 °C (μOhm·cm) | 57-80 | 73 | 68 | 64 | (50) | 88 | 90 | 134 | 114 | 57 | 87 | 87 | 79 | 29 | 79 | |
| Suscettività magnetica χmol /10−6(cm³·mol−1) |
+95.9 | +2500 (β) | +5530(α) | +5930 (α) | +1278(α) | +30900 | +185000 (350 K) |
+170000 (α) | +98000 | +72900 | +48000 | +24700 | +67 (β) | +183 |
- Note
* Configurazione compresa fra quella iniziale dell'elemento Xe e quella finale del livello energetico 6s2.
** Il samario possiede una struttura reticolare ad impacchettamento compatto come altri lantanoidi, appartiene alla famiglia delle terre rare e dei metalli del blocco f, con alcune particolarità collegate alla forma romboedrica[14].
Due tipologie di reticoli cristallini frequenti in natura sono: il reticolo esagonale caratterizzato da sequenza ABAB e periodicità pari a 2, e il reticolo cubico avente sequenza di tipo ABCABC e periodicità pari a 3[15].
Gschneider and Daane (1988) attribuiscono l'andamento del punto di fusione (lantanio a 920 °C – lutezio a 1622 °C) al grado di ibridazione degli orbitali 6s, 5d, e 4f. Si ritiene che il cerio abbia la maggiore stabilità termica, poiché possiede il più basso punto di fusione (795 °C)[16].
Con la sola eccezione di La, Yb, e Lu (che non hanno coppie incomplete di elettroni negli orbitali del livello energetico f), i lantanoidi sono metalli fortemente paramagnetici, proprietà misurata dai valori di suscettibilità. Il gadolinio perde le proprietà ferromagnetiche a temperature maggiori di 16 °C (punto di Curie). Gli altri lantanoidi (terbio, disprosio, olmio, erbio, tulio, e itterbio) che presentano valori di suscettibilità maggiori, sono caratterizzati da una temperatura di Curie più bassa[17].
Proprietà chimiche dei lantanoidi[modifica | modifica wikitesto]
| Elemento chimico | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Numero atomico | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
| Configurazione elettronica Ln3+[6] | 4f0 | 4f1 | 4f2 | 4f3 | 4f4 | 4f5 | 4f6 | 4f7 | 4f8 | 4f9 | 4f10 | 4f11 | 4f12 | 4f13 |
4f14 |
| Raggio ionico Ln3+ (pm)[6] | 103,2 | 102 | 99 | 98,3 | 97 | 95,8 | 94,7 | 93,8 | 92,3 | 91,2 | 90,1 | 89,0 | 88,0 | 86,8 | 86,1 |
| Potenziale standard di riduzione (E°(M3+→M0) V)[6] | -2,37 | -2,34 | -2,35 | -2,32 | -2,29 | -2,30 | -1,99 | -2,28 | -2,31 | -2,29 | -2,33 | -2,32 | -2,32 | -2,22 | -2,30 |
| Ln4+ colore in soluzione acquosa[18] | — | Giallo-arancio | Giallo | Blu-viola | — | — | — | — | Marrone-rosso | Giallo-arancio | — | — | — | — | — |
| Ln3+ colore in soluzione acquosa[19] | Incolore | Incolore | Verde | Viola | Rosa | Giallo pallido | Incolore | Incolore | Rosa pallido | Giallo pallido | Giallo | Rosa | Verde chiaro | Incolore | Incolore |
| Ln2+ colore in soluzione acquosa[6] | — | — | — | — | — | Rosso sangue | Incolore | — | — | — | — | — | Viola-rosso | Giallo-verde | — |
| Stato di ossidazione | 57 | 58 | 59 | 60 | 61 | 62 | 63 | 64 | 65 | 66 | 67 | 68 | 69 | 70 | 71 |
| +2 | Sm2+ | Eu2+ | Tm2+ | Yb2+ | |||||||||||
| +3 | La3+ | Ce3+ | Pr3+ | Nd3+ | Pm3+ | Sm3+ | Eu3+ | Gd3+ | Tb3+ | Dy3+ | Ho3+ | Er3+ | Tm3+ | Yb3+ | Lu3+ |
| +4 | Ce4+ | Pr4+ | Nd4+ | Tb4+ | Dy4+ |
Reattività chimica e andamenti nella serie[modifica | modifica wikitesto]
[6][22][23][24] Come indicano i valori del potenziale di riduzione, i lantanoidi sono tutti elementi molto elettropositivi e quindi reattivi. Scuriscono all'aria e se incendiati bruciano per dare l'ossido, che in genere ma non esclusivamente ha formula Ln2O3. Se riscaldati reagiscono anche con gli alogeni e con la maggior parte dei non metalli. In acqua danno gli ossidi idrati, e si sciolgono rapidamente in acidi diluiti anche a freddo per dare gli ioni Ln3+.
Lo stato di ossidazione di gran lunga favorito è +3. La stabilità di questo stato di ossidazione è dovuta alla configurazione elettronica degli ioni, che all’esterno hanno una nuvola elettronica praticamente corrispondente a quelle del gas nobile precedente, lo xeno. Ci sono in più gli elettroni 4f, ma questi sono così nascosti all'interno della nuvola elettronica che riescono ad influenzare ben poco il comportamento chimico. C'è comunque la possibilità di avere anche gli stati di ossidazione +2 e +4. Questi però sono importanti solo in Ce(IV) ed Eu(II), che sono stabili in acqua, anche se naturalmente il primo è un forte ossidante e il secondo è un forte riducente. La maggior stabilità di questi due ioni può essere ricondotta alla loro configurazione elettronica, che è rispettivamente [Xe] 4f0 e [Xe] 4f7, con il livello f rispettivamente vuoto o semiriempito. La maggior parte della chimica dei lantanoidi riguarda comunque lo stato di ossidazione +3, nel quale formano tipicamente legami ionici.
Chimica di coordinazione[modifica | modifica wikitesto]

Per quanto concerne la chimica di coordinazione, i cationi Ln3+ si comportano da acidi hard, con una tipica preferenza per leganti con ossigeno donatore. La chimica di coordinazione di questi cationi è tuttavia meno estesa e alquanto differente da quella degli elementi del blocco d. Il numero di coordinazione 6 si osserva, ma è inusuale; date le dimensioni abbastanza grandi dei cationi Ln3+ sono più normali i numeri di coordinazione 7, 8 e 9. In soluzione acquosa il catione Ln3+ forma aquo ioni spesso con numero di coordinazione 8 o 9. I sali idrati dei comuni anioni contengono in genere lo ione [Ln(H2O)9]3+.
Il numero di coordinazione può arrivare anche a 10 o 12 con leganti chelanti che abbiano un “morso” piccolo, come NO3– e SO42–. Ad esempio, lo ione [Ce(NO3)6]3–/2– ha coordinazione 12 (figura); la struttura è quella di un icosaedro, e può essere visualizzata come derivata dall'ottaedro considerando che ogni NO3– occupi un sito di coordinazione, con il legante coordinato in modo bidentato. Inoltre, va considerato che gli orbitali f sono molto interni all'atomo, e non interagiscono con i leganti in modo analogo a quanto fanno gli orbitali d; di conseguenza mancano vincoli direzionali e la stereochimica è spesso poco definita, determinata solo dalle esigenze steriche dei leganti. Normalmente i complessi sono molto labili; da soluzioni acquose si riescono ad isolare complessi solo con leganti chelanti, ed è difficile sostituire tutte le molecole d’acqua coordinate (l'acqua è una legante hard ideale).
Proprietà magnetiche e spettri di assorbimento[modifica | modifica wikitesto]
Gli ioni Ln3+ sono caratterizzati da un regolare riempimento del livello elettronico 4f (vedi tabella). Questi elettroni 4f sono molto sepolti all’interno della nuvola elettronica dello ione, e non sono influenzati dall'ambiente circostante, neanche dai leganti presenti all'esterno. In prima approssimazione, si può considerare che gli orbitali f restino degeneri anche quando si forma un complesso. La situazione è quindi profondamente diversa da quella dei metalli di transizione, dove gli elettroni negli orbitali d risentono direttamente dei leganti esterni, che provocano nel complesso una separazione del campo cristallino (Δ).
Per quanto riguarda le proprietà magnetiche dei lantanoidi, il numero di elettroni spaiati si può quindi prevedere riempiendo progressivamente i sette orbitali f come se fossero degeneri. Di conseguenza, gli ioni Ln3+ sono tutti paramagnetici tranne La3+ e Lu3+ che hanno configurazione f0 e f14. Anche Ce4+ è diamagnetico. Nel Gd3+ si ha il numero massimo di elettroni spaiati, cioè 7, e per questo è sfruttato nella diagnostica RNM. Essendo dovute agli elettroni f, le proprietà magnetiche dei lantanoidi sono poco influenzate dall'ambiente chimico in cui si trovano.
Per quanto riguarda lo spettro di assorbimento, si osserva che gli spettri dei lantanoidi sono caratterizzati da numerose bande di assorbimento molto strette e molto deboli rispetto agli spettri dei metalli di transizione. Queste differenze sono dovute al fatto che gli spettri di assorbimento dei lantanoidi derivano da transizioni f-f, mentre nei metalli di transizione coinvolgono gli orbitali d. Dato che gli orbitali f sono sepolti nell'atomo e non sono influenzati dall'intorno chimico, gli spettri di assorbimento dei lantanoidi finiscono con l'essere simili a quelli di atomi isolati, che danno spettri a righe. Inoltre, un certo ione mostra sostanzialmente le stesse bande f-f in tutti i suoi composti, indipendentemente dai leganti utilizzati e dal numero di coordinazione del complesso.
Riguardo all'intensità delle bande, sia le transizioni f-f che le transizioni d-d sono proibite in base alla regola di selezione di simmetria. Tuttavia nel caso delle transizioni d-d dei metalli di transizione la proibizione viene parzialmente rimossa quando c'è una distorsione della simmetria del complesso (accoppiamento vibronico). Nel caso dei lantanoidi gli orbitali f sono sepolti nell'atomo e risentono ben poco di questi effetti di distorsione; di conseguenza la proibizione di simmetria è più stringente, e l'intensità di assorbimento è minore.
Va infine notato che l'interpretazione teorica dello spettro di assorbimento dei lantanoidi è complessa per la difficoltà di ricavare un diagramma di stati relativo alle possibili transizioni, dato che nei lantanoidi l'accoppiamento spin-orbita diventa molto più importante della separazione del campo cristallino.
Note[modifica | modifica wikitesto]
- ^ (EN) Reino W. Hakala, Letters, in Journal of Chemical Education, vol. 29, n. 11, 1952-11, pp. 581, DOI:10.1021/ed029p581.2. URL consultato il 25 marzo 2022.
- ^ Theodore Gray, The Elements: A Visual Exploration of Every Known Atom in the Universe, New York, Black Dog & Leventhal Publishers, 2009, p. 240., ISBN 978-1-57912-814-2.
- ^ Lanthanide (archiviato dall'url originale l'11 settembre 2011)., Encyclopædia Britannica on-line
- ^ Norman E. Holden e Tyler Coplen, The Periodic Table of the Elements, in Chemistry International, vol. 26, n. 1, gennaio–February 2004, p. 8, DOI:10.1515/ci.2004.26.1.8.
- ^ Connelly et al. 2005.
- ^ a b c d e f g h i j Greenwood e Earnshaw 1997.
- ^ a b Emsley 2011.
- ^ a b McGill 2002.
- ^ Aspinall 2001.
- ^ Haxel et al. 2002.
- ^ Livergood 2010.
- ^ Sabot e Maestro 1998.
- ^ Bünzli e Piguet 2005.
- ^ (EN) F. H. Ellinger, and W. H. Zachariasen, The Crystal Structure of Samarium Metal and of Samarium Monoxide, in Journal of the American Chemical Society, vol. 75, n. 22, novembre 1953, pp. 5650–5652, DOI:10.1021/ja01118a052. URL consultato il 21 maggio 2018.
- ^ (EN) Close-Packed Structures, su International Union of Crystallography, 1981, 1997. URL consultato il 21 maggio 2018.
- ^ Krishnamurthy, Nagaiyar and Gupta, Chiranjib Kumar (2004), Extractive Metallurgy of Rare Earths, CRC Press, ISBN 0-415-33340-7
- ^ (EN) Cullity B. D.m, Graham C. D., Introduction to Magnetic Materials, John Wiley & Sons, 2011, ISBN 978-1-118-21149-6.
- ^ Sroor e Edelmann 2012.
- ^ Cotton 2006.
- ^ Holleman e Wiberg 2007.
- ^ Breuer e Breuer 2000.
- ^ Atkins et al. 2010.
- ^ Cotton et al. 1991.
- ^ Housecroft e Sharpe 2008.
Bibliografia[modifica | modifica wikitesto]
- (EN) H. C. Aspinall, Chemistry of the f-block elements, Amsterdam, Gordon and Breach, 2001, ISBN 90-5699-333-X.
- (EN) P. Atkins, T. Overton, J. Rourke, M. Weller, F. Armstrong e M. Hagerman, Shriver & Atkins' Inorganic Chemistry, 5ª ed., Oxford University Press, 2010, ISBN 978-0-19-959960-8.
- (DE) H. Breuer e R. Breuer, dtv-Atlas Chemie, 1. Allgemeine und anorganische Chemie, 10ª ed., Dtv, 2000, ISBN 978-3-423-03217-9.
- (EN) J.-C. Bünzli e C. Piguet, Taking advantage of luminescent lanthanide ions, in Chemical Society Reviews, vol. 34, n. 12, 2005, pp. 1048-1077, DOI:10.1039/B406082M.
- (EN) N. G. Connelly, T. Damhus, R. M. Hartshorn e A. T. Hutton (a cura di), Nomenclature of Inorganic Chemistry - IUPAC Recommendations 2005 (PDF), Cambridge, UK, RCS Publishing, 2005, ISBN 0-85404-438-8.
- F. A. Cotton, G. Wilkinson e P. L. Gaus, Principi di chimica inorganica, Milano, Casa Editrice Ambrosiana, 1991.
- (EN) S. Cotton, Lanthanide and Actinide Chemistry, John Wiley & Sons Ltd, 2006, DOI:10.1002/0470010088, ISBN 978-0-470-01005-1.
- (EN) J. Emsley, Nature's Building Blocks: An A-Z Guide to the Elements (New ed.), New York, Oxford University Press, 2011, ISBN 978-0-19-960563-7.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- G. Haxel, J. B. Hedrick, G. J.Orris, Rare earth elements critical resources for high technology (PDF), su pubs.usgs.gov, United States Geological Survey, 2002. URL consultato il 17 gennaio 2017.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- R. Livergood, Rare Earth Elements: A Wrench in the Supply Chain (PDF), su csis.org, Center for Strategic and International Studies, 2010. URL consultato il 17 gennaio 2017 (archiviato dall'url originale il 12 aprile 2016).
- (EN) I. McGill, Rare Earth Elements, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a22_607.
- (EN) J.-L. Sabot e P. Maestro, Lanthanides, in Kirk-Othmer Encyclopedia of Chemical Technology, 4ª ed., John Wiley & Sons, 1998.
- (EN) F. M. A. Sroor e F. T. Edelmann, Lanthanides: Tetravalent Inorganic, in Encyclopedia of Inorganic and Bioinorganic Chemistry, Wiley, 2012, DOI:10.1002/9781119951438.eibc2033.
Voci correlate[modifica | modifica wikitesto]
- Tavola periodica
- Metalli del blocco f
- Metalli del blocco d
- Terre rare
- Contrazione lantanidica
- Attinoidi
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su lantanoidi
Wikimedia Commons contiene immagini o altri file su lantanoidi
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) lanthanide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 26395 · LCCN (EN) sh85040502 · GND (DE) 4074013-4 · BNF (FR) cb12142135v (data) · J9U (EN, HE) 987007567862105171 · NDL (EN, JA) 00569294 |
|---|