Colesterolo: differenze tra le versioni
→I possibili pericoli per la salute della bassa colesterolemia: Piccole correzioni |
→I possibili pericoli per la salute della bassa colesterolemia: Inserito bibliografia |
||
| Riga 218: | Riga 218: | ||
Nonostante l'enorme mole di dati a favore dell'importanza della colesterolemia come fattore di rischio cardiovascolare, numerose pubblicazioni sottolineano il pericolo di una bassa colesterolemia o contestano il ruolo del colesterolo nello sviluppo della malattia aterosclerotica<ref>{{cita web|url=http://www.thincs.org/news.htm|titolo=The International Network of Cholesterol Skeptics" - News|accesso=25 novembre 2008|lingua=en}}</ref>. Immich<ref>{{cita pubblicazione|autore=H. Immich|anno=1997|titolo=Cholesterin und Koronarsklerose|rivista=Versicherungsmedizin|volume=49|p=86 ss|lingua=de}}</ref> si è dedicato allo studio di ''Framingham'' e ha notato, nel [[1997]], che questo studio parlava già negli [[anni 1960|anni sessanta]] di ''nessuna correlazione statisticamente significativa tra colesterolemia e sclerosi coronaria''. |
Nonostante l'enorme mole di dati a favore dell'importanza della colesterolemia come fattore di rischio cardiovascolare, numerose pubblicazioni sottolineano il pericolo di una bassa colesterolemia o contestano il ruolo del colesterolo nello sviluppo della malattia aterosclerotica<ref>{{cita web|url=http://www.thincs.org/news.htm|titolo=The International Network of Cholesterol Skeptics" - News|accesso=25 novembre 2008|lingua=en}}</ref>. Immich<ref>{{cita pubblicazione|autore=H. Immich|anno=1997|titolo=Cholesterin und Koronarsklerose|rivista=Versicherungsmedizin|volume=49|p=86 ss|lingua=de}}</ref> si è dedicato allo studio di ''Framingham'' e ha notato, nel [[1997]], che questo studio parlava già negli [[anni 1960|anni sessanta]] di ''nessuna correlazione statisticamente significativa tra colesterolemia e sclerosi coronaria''. |
||
Nella metanalisi di Jacobs ([[1992]]),<ref name=":7" /> gli uomini e, in minor misura le donne, con concentrazioni sieriche di colesterolo totale <4,2 mmol/l (160 mg/dL) (6° percentile) mostravano un aumento della mortalità totale di circa il 10%-20% rispetto ai soggetti con valori compresi tra 4,2 e 5,2 mmol/L (160–199 mg/dL). Sebbene il problema sia reale e ancora irrisolto, l'eccesso di mortalità totale e di motalità per cancro potrebbe essere parzialmente spiegato dalla preesistenza, al basale, di malattie subcliniche e dalla coesistenza di altri fattori aggressivi sconosciuti o non misurati, correlati sia alla bassa colesterolemia che alla mortalità. Ad esempio, nello studio prospettico ''Honolulu Heart Program'', condotto su circa 8000 uomini di ascendenza giapponese, residenti a [[Oahu]] ([[Hawaii]]), nel ''follow-up'' a 16 anni, nei soggetti in cui la colesterolemia si era ridotta dai livelli medi a quelli bassi, vi era un aumento della mortalità totale e un maggior numero di morti per alcuni tipi di cancro e per malattie epatiche, mentre nei soggetti che avevano mantenuto una bassa colesterolemia stabile, tale eccesso di mortalità non era riscontrabile; dopo 23 anni di ''follow-up'', negli individui con colesterolo totale <180 mg/dl, in assenza di elevato consumo di alcool, di fumo e di ipertensione la bassa colesterolemia non era associata né alla mortalità totale né a quella per cancro. D'altra parte, vanno menzionati i lavori di Iribarren, in cui una bassa colesterolemia era associata con rischio maggiore di alcune infezioni, specialmente del tratto urinario, nonché con un maggior rischio di ospedalizzazione per polmonite. |
Nella metanalisi di Jacobs ([[1992]]),<ref name=":7" /> gli uomini e, in minor misura le donne, con concentrazioni sieriche di colesterolo totale <4,2 mmol/l (160 mg/dL) (6° percentile) mostravano un aumento della mortalità totale di circa il 10%-20% rispetto ai soggetti con valori compresi tra 4,2 e 5,2 mmol/L (160–199 mg/dL). Sebbene il problema sia reale e ancora irrisolto, l'eccesso di mortalità totale e di motalità per cancro potrebbe essere parzialmente spiegato dalla preesistenza, al basale, di malattie subcliniche e dalla coesistenza di altri fattori aggressivi sconosciuti o non misurati, correlati sia alla bassa colesterolemia che alla mortalità.<ref>{{Cita pubblicazione|autore=J. Ahn|anno=2009|titolo=Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer|rivista=Cancer Epidemiol. Biomarkers Prev.|volume=18|numero=|pp=2814-2821|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3534759/}}</ref><ref>{{Cita pubblicazione|autore=A.M. Tonkin|anno=2009|titolo=The evidence on trial: cholesterol lowering and cance|rivista=Heart Asia|volume=1|numero=|pp=:6-10|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4898325/}}</ref><ref>{{Cita pubblicazione|autore=U. Ravnskov|anno=2016|titolo=Lack of an association or an inverse association between low-density-lipoprotein cholesterol and mortality in the elderly: a systematic review|rivista=BMJ|volume=|numero=e010401|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4908872/}}</ref><ref>{{Cita pubblicazione|autore=Y. Takata|anno=2014|titolo=Serum total cholesterol concentration and 10-year mortality in an 85-year-old population|rivista=Clin Interv Aging|volume=9|numero=|pp=293-300|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3928456/}}</ref><ref>{{Cita pubblicazione|autore=J.M. Bae|anno=2012|titolo=Low cholesterol is associated with mortality from cardiovascular diseases: a dynamic cohort study in Korean adults|rivista=J. Korean Med. Sci.|volume=27|numero=|pp=58-63|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3247776/}}</ref><ref>{{Cita pubblicazione|autore=H. Petursson|anno=2012|titolo=Is the use of cholesterol in mortality risk algorithms in clinical guidelines valid? Ten years prospective data from the Norwegian HUNT 2 study|rivista=J. Eval. Clin. Pract.|volume=18|numero=|pp=159-168|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3303886/}}</ref> Ad esempio, nello studio prospettico ''Honolulu Heart Program'', condotto su circa 8000 uomini di ascendenza giapponese, residenti a [[Oahu]] ([[Hawaii]]), nel ''follow-up'' a 16 anni, nei soggetti in cui la colesterolemia si era ridotta dai livelli medi a quelli bassi, vi era un aumento della mortalità totale e un maggior numero di morti per alcuni tipi di cancro e per malattie epatiche, mentre nei soggetti che avevano mantenuto una bassa colesterolemia stabile, tale eccesso di mortalità non era riscontrabile; dopo 23 anni di ''follow-up'', negli individui con colesterolo totale <180 mg/dl, in assenza di elevato consumo di alcool, di fumo e di ipertensione la bassa colesterolemia non era associata né alla mortalità totale né a quella per cancro. D'altra parte, vanno menzionati i lavori di Iribarren, in cui una bassa colesterolemia era associata con rischio maggiore di alcune infezioni, specialmente del tratto urinario, nonché con un maggior rischio di ospedalizzazione per polmonite. Va sottolineato ancora una volta che gli studi epidemiologici non hanno il potere di dimostrare un rapporto di causa-effetto tra gli elementi osservati. |
||
Se esistono dubbi sul "pericolo" di una bassa colesterolemia "naturale", diverso è il discorso della bassa colesterolemia ottenuta con il trattamento terapeutico: i più recenti studi con le statine hanno dimostrato che, in soggetti ad alto rischio cardiovascolare, valori anche molto bassi di LDL (70–80 mg/dl) si accompagnano a riduzione degli eventi cardiovascolari, senza che la mortalità totale aumenti oppure, come nel caso dello studio HPS, facendo registrare una sua diminuzione. Resta da chiarire se questi risultati dipendano dalla sola riduzione della colesterolemia o invece dall'azione pleiotropica delle statine o dall'insieme dei due fattori (vedi [[ipercolesterolemia]]). |
Se esistono dubbi sul "pericolo" di una bassa colesterolemia "naturale", diverso è il discorso della bassa colesterolemia ottenuta con il trattamento terapeutico: i più recenti studi con le statine hanno dimostrato che, in soggetti ad alto rischio cardiovascolare, valori anche molto bassi di LDL (70–80 mg/dl) si accompagnano a riduzione degli eventi cardiovascolari, senza che la mortalità totale aumenti oppure, come nel caso dello studio HPS, facendo registrare una sua diminuzione.<ref>{{Cita pubblicazione|autore=H. Soran|anno=2017|titolo=Evidence-based goals in LDL-C reduction|rivista=Clin. Res. Cardiol..|volume=106|numero=|pp=237–248|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5360845/}}</ref><ref>{{Cita pubblicazione|autore=Heart Protection Study Collaborative Group|anno=2011|titolo=Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20,536 high-risk individuals: a randomised controlled trial|rivista=Lancet|volume=378|numero=|pp=2013-2020|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3242163/}}</ref><ref>{{Cita pubblicazione|autore=K.R. Solomon|anno=2011|titolo=The complex interplay between cholesterol and prostate malignancy|rivista=Urol. Clin. North. Am.|volume=38|numero=|pp=243-259|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3146741/}}</ref>Resta da chiarire se questi risultati dipendano dalla sola riduzione della colesterolemia o invece dall'azione pleiotropica delle statine o dall'insieme dei due fattori (vedi [[ipercolesterolemia]]). |
||
== Grandi studi epidemiologici == |
== Grandi studi epidemiologici == |
||
Versione delle 12:51, 15 mag 2017
| Colesterolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| (10R,13R)-10,13-dimetil-17-(6-metileptan-2-il) -2,3,4,7,8,9,11,12,14,15,16,17-dodecaidro -1H-ciclopenta[α]fenantren-3-olo | |
| Nomi alternativi | |
| (3β)-colest-5-en-3-olo (3β)-idrossicolest-5-ene (3β)-idrossi-5-colestene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C27H45OH |
| Massa molecolare (u) | 386,67 |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 200-353-2 |
| PubChem | 5997 |
| DrugBank | DB04540 |
| SMILES | CC(C)CCCC(C)C1CCC2C1(CCC3C2CC=C4C3(CCC(C4)O)C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,07 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 147 °C (420 K) |
| Temperatura di ebollizione | ~ 360 °C (~ 633 K) con decomposizione |
| Indicazioni di sicurezza | |
| Punto di fiamma | 250 °C (523,15 K) |
| Frasi H | --- |
| Consigli P | --- |
Il colesterolo è una molecola lipidica[1] della classe degli steroli che riveste un ruolo particolarmente importante nella fisiologia degli animali, uomo incluso. Il colesterolo, per la sua struttura a quattro anelli rigidi, è un costituente insostituibile delle membrane cellulari animali ed è il precursore degli ormoni steroidei, della vitamina D e degli acidi biliari. In patologia concorre alla formazione dei calcoli biliari e degli ateromi.
Per colesterolemia si intende la concentrazione della sostanza nel sangue; poiché nel sangue il colesterolo è contenuto nelle lipoproteine plasmatiche, si usa, in termini più precisi, far riferimento al colesterolo plasmatico totale, al colesterolo LDL o al colesterolo HDL. La colesterolemia (colesterolo plasmatico totale) può essere normale oppure dar vita a ipocolesterolemia e ipercolesterolemia, condizioni potenzialmente pericolose per la salute.[2]
La produzione eccessiva di lipoproteine plasmatiche ricche di colesterolo (LDL) può provocare malattie molto gravi come l'aterosclerosi, in quanto esse si accumulano nelle arterie e avviano una reazione infiammatoria che conduce alla formazione di ateromi, il cui nucleo è ricco di colesterolo. Le placche aterosclerotiche possono provocare l'occlusione dei vasi ed eventualmente la morte, nel caso in cui siano interessati distretti vitali (es. arterie coronarie).
Etimologia e notizie storiche
La parola colesterolo proviene dal greco chole (bile) e stereos (solido) ed è stata utilizzata per la prima volta nel 1894.
La sua presenza, in forma di scaglie, era già stata riscontrata nei calcoli della cistifellea nel 1784 da Poulletier de la Salle, prima, e da Conradi, poco dopo. Nel 1815 Chevreul chiamò questa sostanza colesterina. Reinitzer (1888) ne ha definito la formula empirica (C27H46O) e Windaus (1919) quella di struttura, poi corretta nel 1932. Nel 1975 il premio Nobel John Cornforth ne ha chiarito la stereochimica e stabilito la configurazione degli stereocentri.
Vogel (1843) ha isolato il colesterolo dagli ateromi e negli anni dieci del 900 il patologo russo Nikolaj Aničkov scoprì il ruolo leader del colesterolo nello sviluppo dell'aterosclerosi[3] (vedi voce Storia dell'aterosclerosi).
Caratteristiche chimiche
Il colesterolo è un alcool policiclico alifatico, costituito dal nucleo peridro-1,2-ciclopentano-fenantrene (nucleo tetraciclico proprio degli steroidi), con un doppio legame in C5 e una catena laterale isottilica in C17. La desinenza -olo deriva dal fatto che sul C3 del primo anello di atomi di carbonio (anello A) è presente il gruppo ossidrile -OH. La sua formula bruta è C27H45OH. Le sue dimensioni sono 5.2 x 6.2 x 18.9 Å.[4] I quattro anelli che costituiscono la molecola sono indicati con le lettere dell'alfabeto (A, B, C, D), hanno tutti una conformazione a sedia e una configurazione stereochimica trans. Il gruppo ossidrilico in C3, i gruppi metilici angolari in C18 e C19 e la catena laterale sono in configurazione cis (posizione β).
Il colesterolo appare come una sostanza solida, quasi inodore, di colore bianco, di consistenza simile a quella della cera, con struttura cristallina, non combustibile. Il colesterolo forma due tipi di cristalli: cristalli aghiformi e cristalli poliedrici (scaglie). Praticamente insolubile in acqua, è modestamente solubile in alcool e molto solubile nei solventi organici (es. cloroformio, benzene), in grassi e oli. La solubilità massima del colesterolo in soluzione acquosa è di soli 1.8 μg/ml o 4.7 μM/100ml.
La molecola del colesterolo è anfipatica, con l'estremità idrofila costituita dal gruppo ossidrilico e con la voluminosa parte idrofobica rappresentata dal nucleo tetraciclico rigido e dalla flessibile catena laterale. Per questa sua natura il colesterolo dà luogo, in acqua, a una soluzione micellare (concentrazione micellare critica, o CMC, di 25-40 nM a 25°) e presenta a 124 °C una fase liquido-cristallina di tipo smectico.[4][5][6]
Il gruppo ossidrilico forma esteri con gli acidi grassi trasformandosi in colesterolo esterificato, mentre il doppio legame tra C5 e C6 permette reazioni di addizione.
Nel corpo umano il colesterolo è presente principalmente come alcol non esterificato (anche detto colesterolo libero) e in tal caso è una molecola anfipatica, con il gruppo ossidrile polare in posizione 3 e la restante parte della molecola apolare. Può essere presente anche come colesterolo esterificato, ovvero come estere del colesterolo (colesteril estere), formatosi per reazione del gruppo ossidrile con un acido carbossilico, nel qual caso l'estere risultante è una molecola completamente apolare.
Funzioni
Il colesterolo è indispensabile per la vita animale, mentre è assente nelle piante, le quali contengono però sostanze lipidiche strutturalmente simili (fitosterine o fitosteroli). Le più importanti funzioni svolte dal colesterolo sono:
- Funzioni strutturali:
- Il colesterolo è un componente insostituibile delle membrane di tutte le cellule animali, in quanto è l'unica specie lipidica dell'organismo ad avere una struttura ad anelli rigidi, mentre tutti gli altri lipidi di membrana presentano catene idrocarboniose notevolmente flessibili. L'85% del colesterolo libero intracellulare si trova nella membrana plasmatca, dove si inserisce per >90% nel foglietto fosfolipidico interno (citoplasmatico) e per il 3-5% in quello esterno,[7] orientandosi con il gruppo -OH vicino alle teste polari dei fosfolipidi. In tal modo esso diminuisce la fluidità della membrana (vedi modello a mosaico fluido), dalla quale dipendono importanti funzioni, per es: permeabilità a piccole molecole idrosolubili; attività dei recettori e degli enzimi di membrana, che influenzano la generazione di sostanze messaggere intracellulari; stabilità meccanica; formazione di vescicole in grado di trasportare il loro contenuto ai vari organuli cellulari.[8]
- Il colesterolo è essenziale nella crescita e nella divisione cellulare, soprattutto nei tessuti ad alto turnover (es. epidermide, epiteli).
- Il colesterolo è essenziale per lo sviluppo embrionale: le malformazioni di neonati dopo la somministrazione di Contergan alle madri erano causate da un disturbo nella biosintesi di colesterolo.
- Funzioni metaboliche:
- Il colesterolo è la sostanza base per la sintesi degli ormoni steroidei delle ghiandole surrenali (aldosterone, cortisone) e delle gonadi (testosterone, estradiolo, ecc.).
- Il colesterolo è essenziale per la sintesi della vitamina D operata dall'azione dei raggi ultravioletti sulla cute.
- Il colesterolo prodotto nel fegato viene impiegato in buona parte per la produzione degli acidi biliari della bile, una sostanza escreta nel duodeno che serve a emulsionare i lipidi alimentari per renderli assorbibili dall'intestino tenue.
Metabolismo
Il contenuto di colesterolo dell'organismo umano è di circa 150 grammi; l'encefalo da solo ne contiene 30 g[9] e il plasma circa 8 g. L'uomo produce per biosintesi autonoma la maggior parte del colesterolo necessario (pool endogeno), solo una piccola parte, in media 0,1 fino 0,3, massimo 0,5 grammi, viene assunta giornalmente con l'alimentazione (pool esogeno); entrambi i pools sono soggetti a meccanismi regolatori, in modo tale che, in condizioni di equilibrio, negli adulti, la quantità di colesterolo sintetizzata più quella assorbita dagli alimenti corrisponde al colesterolo libero eliminato con la bile più quello trasformato in acidi biliari. Negli adulti la sintesi endogena di colesterolo è tra 1 e 2 grammi.[10] In particolare, in presenza di una dieta contenente 450 mg/die di colesterolo, la sintesi endogena si aggira intorno a 11–13 mg/kg/die.[11]
Tutte le cellule dell'organismo sono capaci di sintetizzare colesterolo a partire dall'acetilcoenzima A, ma l'organo centrale del metabolismo del colesterolo è il fegato. Esso, infatti, riceve il colesterolo proveniente dall'assorbimento intestinale e lo utilizza per la produzione delle lipoproteine plasmatiche destinate al trasporto del colesterolo ai tessuti periferici; inoltre il fegato è l'unico organo in grado di eliminare dall'organismo, servendosi della bile, il colesterolo in eccesso che gli perviene dai tessuti mediante le HDL (high density lipoproteins).
A livello epatico, il colesterolo di origine alimentare giunge trasportato dalle particelle rimanenti dei chilomicroni; ad esso si aggiungono il colesterolo endogeno di sintesi epatica e quello di ritorno dai tessuti periferici tramite le HDL. La produzione del colesterolo endogeno è regolata dai componenti della dieta, in modo tale che la sua sintesi viene inibita dal colesterolo alimentare e stimolata dagli acidi grassi. Negli epatociti il colesterolo è assemblato nelle VLDL (very low density lipoproteins), affinché possa essere trasportato in tutto l'organismo. Il colesterolo epatico viene utilizzato anche per la secrezione nella bile, sia in forma di sali biliari (circa 500 mg/die),[12] sia come colesterolo non esterificato (circa 800–1400 mg/die).[13]
Anche a livello dei tessuti periferici il pool intracellulare di colesterolo deriva in parte dall'esterno e in parte dalla sintesi endogena. Il primo è costituito dal colesterolo trasportato dalle LDL (low density lipoproteins) che vengono endocitate grazie all'intervento dei recettori specifici (LDLR). Quando la disponibilità intracellulare di colesterolo è alta vengono inibite sia la sintesi endogena sia l'espressione dei recettori LDLR, così da evitare un eccesso di colesterolo libero nelle membrane e un suo accumulo nel citoplasma in forma di colesterolo esterificato. Dalla membrana plasmatica il colesterolo libero può essere rimosso dalle HDL che lo riportano nuovamente al fegato. Poiché le LDL non riescono a superare la barriera ematoencefalica, il cervello deve produrre da solo il colesterolo di cui necessita.
Per maggiori dettagli sulle lipoproteine plasmatiche vedi voce Lipoproteina.
Assorbimento intestinale


Oltre ai 300–450 mg/die di colesterolo,[13] la dieta occidentale contiene in media circa 70-80 g/die di trigliceridi, 5 g/die di fosfolipidi e 400 mg/die di steroli vegetali (fitosteroli), per lo più sitosterolo e campesterolo (frutta, mandorle, noci, anacardi, semi, ecc.);[14] un uovo contiene circa 200 mg di colesterolo. Nel lume intestinale, al colesterolo della dieta si aggiungono gli 800–1400 mg/die di colesterolo endogeno provenienti dalla bile, per un totale di 1000–1800 mg/die: 1/3 alimentare (colesterolo esogeno) e 2/3 biliare (colesterolo endogeno); a questi pools andrebbe sommata una quantità imprecisata di colesterolo proveniente dalla esfoliazione dell'epitelio intestinale, una notevole percentuale del quale non è tuttavia materialmente presente nel tratto enterico deputato all'assorbimento (duodeno e, in minor misura, digiuno).


La percentuale di colesterolo luminale assorbita dalla mucosa intestinale, a parità di contenuto dietetico, mostra una notevolissima variabilità individuale che oscilla tra il 25% e il 75%, attestandosi in media intorno al 50%.[15][16] Normalmente la percentuale assorbita è inversamente correlata con la quantità di colesterolo presente nel lume intestinale, sia nel caso di assunzione acuta (risposta a un'unica somministrazione),[17] sia in quello di assunzione cronica (risposta dopo somministrazione protratta per giorni);[18] la percentuale di assorbimento si riduce al 25-30% quando il carico di colesterolo è grande: un apporto dietetico eccezionale di 3 g di colesterolo comporta un assorbimento di 1 g.[19] L'assorbimento dei fitosteroli è invece del 5%-15%.[20]
Poiché una parte del colesterolo di origine alimentare è in forma esterificata (10%-15%), essa viene idrolizzata a colesterolo libero per opera dell'enzima colinesterasi pancreatica. Il colesterolo libero penetra nelle micelle, che ne consentono la solubilizzazione[21] per effetto degli acidi biliari e delle molecole lipidiche anfipatiche (monogliceridi, fosfolipidi, acidi grassi). A differenza del colesterolo alimentare, che si trova prima in forma di emulsione e poi, in presenza di acidi biliari, nelle micelle, il colesterolo endogeno giunge nel duodeno già in micelle rapidamente assorbibili. In questa forma il colesterolo viene in contatto con l'orletto a spazzola dell'epitelio intestinale, dal quale viene assorbito, incorporato nei chilomicroni e immesso in circolo attraverso la linfa.
L’assorbimento del colesterolo è influenzato dalla velocità del transito intestinale e dalla quantità degli steroli vegetali (in quanto competono sia per l'incorporazione nelle micelle che per il trasporto negli enterociti) e delle fibre alimentari. La mucina, che riveste la superficie luminale degli enterociti, potrebbe legare il colesterolo e facilitare il suo assorbimento, in quanto i topi MUC1-/- presentano una riduzione del 50% dell’assorbimento del colesterolo.
L'assorbimento negli enterociti avviene per trasporto facilitato (energia-indipendente), nel quale sono coinvolte una serie di proteine di membrana, quali scavenger receptors (SR-BI e CD36) e Niemann–Pick C1-like protein1 (NPC1L1).[22][23] Il ruolo fondamentale sembra essere rivestito da NPC1L1 (bersaglio del farmaco ezetimibe), che recluta il colesterolo nella membrana apicale, promuove la formazione di microdomini ricchi di colesterolo e ne determina l'endocitosi clatrina-dipendente verso il reticolo endoplasmatico, dove il colesterolo viene esterificato ad opera della acil-CoA-colesterol-aciltransferasi 2 (ACAT2) .[24][25] La selettività dei sistemi di trasporto assicura un più elevato assorbimento del colesterolo rispetto ai fitosteroli, che sono molto poco assorbiti. Inoltre due proteine della membrana luminale degli enterociti sono preposte all'eliminazione del surplus degli steroli assorbiti (soprattutto sitosteroli): ABCG5 e ABCG8; la loro mutazione è causa della β-sitosterolemia.[21] Ne consegue che la concentrazione plasmatica dei fitosteroli è molto bassa (< 1 mg/dl);[14] non essendo i fitosteroli sintetizzati nell'organismo umano, i livelli di campesterolo sono utilizzati nella ricerca clinica come marker dell'assorbimento intestinale degli steroli, sia pure con qualche riserva.[26][27]
Biosintesi
Il colesterolo si forma dall’Acetil-CoA. Nello stadio iniziale tre molecole di acetil-CoA (C2) vengono condensate per formare l’acido mevalonico (C6) che viene convertito in un’unità isoprenoide (C5), l’isopentenil-pirofosfato. Gli isoprenoidi sono una famiglia di composti le cui strutture sono costituite da unità di isoprene (C5): CH2=C(CH3)-CH=CH2. Nel processo di biosintesi hanno quindi luogo una serie di condensazioni che danno origine a composti isoprenoidi progressivamente più ricchi di carbonio: geranil-pirofosfato (C10), farnesil-pirofosfato (C15) e infine squalene (C30). Successivamente, lo squalene si ciclizza formando lanosterolo, che è convertito in colesterolo. Le complesse tappe biosintetiche seguono la via metabolica dell'acido mevalonico:

- nella prima tappa si ha la conversione dell'acetil-CoA in mevalonato. È suddivisa in tre sotto-tappe: nella prima si ha la condensazione di due molecole di acetil-CoA per formare acetoacetil-CoA (reazione catalizzata dalla β-chetotiolasi); nella seconda tappa l'acetoacetil-CoA prodotto reagisce con un'altra molecola di acetil-CoA e si forma 3-idrossi-3-metilglutaril-CoA, abbreviato HMG-CoA (reazione catalizzata dalla HMG-CoA sintasi); nella terza tappa l'HMG-CoA viene ridotto, in presenza di NADPH, a mevalonato dall'enzima HMG-CoA reduttasi. Le prime due tappe sono reversibili, mentre la terza è una tappa obbligata che determina la velocità della reazione.
- nella seconda tappa si ha la formazione di unità isopreniche attivate. Per prima cosa tre gruppi fosfato vengono aggiunti al mevalonato per trasferimento dall'ATP (che viene quindi idrolizzato ad ADP). Successivamente il gruppo ossidrilico sul carbonio-3 viene rimosso, insieme al gruppo carbossilico vicino, e si forma in questo modo la prima unità isoprenica attivata, il Δ3-isopentenil pirofosfato. Per isomerizzazione di quest'ultima sostanza, si forma un ulteriore unità isoprenica attivata: il dimetilallil pirofosfato.
- nella terza tappa (in tre sotto-tappe) si forma lo squalene per condensazioni "testa-coda" (prime due tappe) o "testa-testa" (terza tappa) tra le unità isopreniche attivate formatesi nelle reazioni precedenti.
- nella quarta tappa lo squalene viene convertito in colesterolo in una serie di reazioni. Durante queste reazioni la molecola dello squalene, lineare, viene ciclizzata, convertendolo (negli animali) in lanosterolo. Il lanosterolo viene poi convertito (in 19 tappe) in colesterolo, tramite spostamento o rimozione di gruppi metilici.

L'enzima chiave (enzima regolatore) della sintesi del colesterolo è l'3-idrossi,3-metilglutaril-CoA-reduttasi (HMG-CoA riduttasi), presente nella membrana del reticolo endoplasmatico. La biosintesi del colesterolo è regolata dalla concentrazione intracellulare di isoprenoidi, lanosterolo, colesterolo, ossisteroli e da alcuni ormoni, in primo luogo insulina e glucagone. Un'elevata concentrazione intracellulare di isoprenoidi (farnesil-pirofosfato), di steroli (colesterolo e, soprattutto, lanosterolo) inibisce l'enzima HMG-CoA riduttasi, bloccando la biosintesi del colesterolo. Il carciofo e l'aglio bloccano la sintesi del colesterolo per inibizione della HMG-CoA reduttasi. L'aglio inibisce anche la lanosterolo 14-alfa demetilasi. L'insulina stimola la sintesi endogena di colesterolo, mentre il glucagone la inibisce.
Questi fattori di controllo permettono l'esistenza di un feedback negativo tra assorbimento e sintesi di colesterolo: la quantità di colesterolo sintetizzato è inversamente proporzionale alla quantità di colesterolo assunto con la dieta. Tuttavia l'efficienza del meccanismo di feedback varia ampiamente tra gli individui. Ad esempio, nel lavoro di McNamara (1987), a cui si riferisce il grafico riportato a fianco, a fronte di un aumento del contenuto in colesterolo della dieta, gli individui cosiddetti compensatori mostravano una riduzione della sintesi del 26%, mentre per i soggetti non-compensatori la riduzione era del 12%; in questo studio i non-compensatori erano circa il 30%.[18]

Regolazione dell'enzima HMG-CoA riduttasi
L'HMG-CoA riduttasi è soggetto a regolazione sia a breve che a lungo termine. La prima è mediata dalla fosforilazione e da effetti allosterici, mentre la seconda coinvolge la sintesi e la degradazione dell’enzima.
Sia la sintesi che la degradazione dell'enzima sono sotto il controllo diretto del colesterolo. Il colesterolo libero della membrana del reticolo endoplasmatico sopprime la trascrizione del gene della HMG-CoA riduttasi e accelera la degradazione della proteina enzimatica. Entrambe queste azioni sono mediate dalle proteine Insig (insulin-induced gene proteins).
L’HMGCoA riduttasi contiene un domini che lega lanosterolo, colesterolo e ossisteroli (sterol-sensing domain). Quando questi steroli sono abbondanti, promuovono l’interazione dell'enzima con la proteina Insig. Per effetto di questo legame, l’HMGCoA riduttasi viene ubiquitinata e degradata, ponendo fine alla sintesi del colesterolo. In caso di carenza di colesterolo l’emivita dell’HMGCoA riduttasi è di oltre 12 h, mentre nel caso opposto l’emivita è inferiore a 1 h circa.
La sintesi della HMG-CoA reduttasi è stimolata dal fattore di trascrizione colesterolo-sensibile SREBP (sterol regulatory element binding protein). In condizioni di abbondanza di colesterolo, SREBP è presente nella membrana del reticolo endoplasmatico in forma inattiva, complessata con la proteina SCAP (SREBP cleavage-activating protein, proteina contenente sterol-sensing domain), a sua volta legata alla proteina Insig. In stato di carenza di colesterolo, il complesso SREBP-SCAP si sgancia da Insig e passa nel Golgi, dove SREBP viene attivata per proteolisi dagli enzimi di membrana S1P (Site-1 protease) e S2P (Site-2 protease). Il frammento attivo di SREBP passa nel nucleo, dove regola più di venti geni chiave per la sintesi del colesterolo e degli acidi grassi, nonché del recettore delle LDL (LDLR).
L'insulina stimola l'espressione di SREBP-1 e il glucagone la reprime. Le statine deprimono la sintesi del colesterolo, massimamente nel fegato, inibendo la HMG-CoA reduttasi.
Trasporto nell'organismo
Visto che il colesterolo, come tutti i grassi, non è solubile nel sangue, per il trasporto ematico deve essere "imballato" in complessi aggregati sferici o discali di trasporto (lipoproteine plasmatiche). Questi aggregati consistono essenzialmente di:
- un involucro a singolo strato di fosfolipidi;
- apolipoproteine e colesterolo non esterificato intercalati nell'involucro di fosfolipidi;
- un nucleo di acidi grassi, trigliceridi e colesterolo esterificato;
Secondo la loro composizione in colesterolo, fosfolipidi, proteine, trigliceridi e acidi grassi, questi aggregati vengono ulteriormente distinti in diverse classi (classificabilità di laboratorio secondo il loro peso specifico tra <0.98 e 1.17 g/cm3): chilomicroni, VLDL, IDL, LDL, HDL2 e HDL3.
Nell'epitelio intestinale, il colesterolo e gli altri lipidi assorbiti, insieme a quelli neosintetizzati, vengono "assemblati" durante la fase prandiale sotto forma di chilomicroni. Questi, per l'idrolisi della lipoprotein-lipasi presente sulla superficie delle cellule endoteliali, cedono trigliceridi (in forma di acidi grassi e glicerolo) ai tessuti periferici e, come "chilomicroni rimanenti" ricchi di colesterolo, portano il loro contenuto al fegato.
Nel fegato, soprattutto durante il digiuno, i lipidi vengono incorporati nelle VLDL (very low density lipoproteins), le quali vengono rilasciate nella circolazione sanguigna. Nel microcircolo, le VLDL sono idrolizzate dalla lipoprotein-lipasi, rilasciando gran parte del proprio contenuto di trigliceridi (che diffondono nei tessuti) e trasformandosi in IDL o particelle rimanenti (intermediary density lipoproteins). Le IDL sono quindi idrolizzate a livello epatico e convertite in LDL (low density lipoproteins).
Le LDL fuoriescono dalla circolazione e, dopo aver attraversato la matrice fondamentale del tessuto connettivo, raggiungono le cellule parenchimatiche, alla cui superficie si legano tramite l'interazione con i recettori cellulari per le apoproteine B100/E (LDLR) e vengono trasportate nell'interno delle cellule, cedendo così il loro carico di colesterolo. Per evitare che le cellule siano sovraccaricate di colesterolo, i recettori LDLR sono soggetti a un meccanismo di controllo a feedback negativo, in modo tale che, quando il contenuto di colesterolo libero nelle membrane cellulari diviene sovrabbondante, la sintesi dei recettori è soppressa (attraverso la regolazione del fattore di trascrizione SREBP sopra descritto).
Poiché il colesterolo in eccesso non può essere degradato nelle cellule, esso può essere immagazzinato come gocce di colesterolo esterificato oppure viene trasportato come colesterolo libero nella membrana plasmatica, da dove può essere trasferito alle HDL (high density lipoproteins) grazie all'intervento di alcune proteine di trasporto di membrana (ABCA1, ABCG1/G4) e del recettore SR-B1 (scavenger receptor B1). In questo modo, le HDL raccolgono il colesterolo in eccesso dai tessuti periferici e lo trasportano al fegato (cosiddetto trasporto inverso), affinché possa essere eliminato con la bile. Il grafico accanto illustra schematicamente il processo. In realtà il processo è un po' più complesso[28].
Colesterolemia
Quando in medicina si parla di "colesterolo", non si intende il colesterolo chimico (si tratta di un'ambiguità semplificatoria), ma si parla in effetti delle lipoproteine plasmatiche che circolano nel sangue durante il digiuno: la relativa concentrazione si chiama colesterolemia. La colesterolemia viene distinta in colesterolemia totale, LDL e HDL. Livelli elevati dei primi due parametri sono considerati dannosi per la salute, mentre alla colesterolemia HDL è attribuito un ruolo protettivo.
Su raccomandazioni dell'organizzazione mondiale della sanità (OMS), i valori consigliati per la colesterolemia sono:[29]
- colesterolemia totale inferiore a 200 mg/dl (limiti più restrittivi sono suggeriti dalle linee guida della Società europea di cardiologia per i soli soggetti affetti da patologie cardiocircolatorie, con valori limite differenziati in base alla gravità della condizione soggettiva)[30]
- rapporto colesterolo totale/HDL non superiore a 5 per gli uomini e a 4,5 per le donne.
Da quanto visto finora appare chiaro che i valori della colesterolemia dipendono sia dall'equilibrio tra assorbimento intestinale, sintesi endogena, eliminazione biliare del colesterolo e trasformazione del colesterolo in acidi biliari, sia dal metabolismo plasmatico delle lipoproteine, che ne determina la persistenza in circolo, come nel caso della degradazione ad opera delle varie lipasi (lipoproteinlipasi, lipasi epatica, lipasi endoteliale), della esistenza di una moltitudine di varianti genetiche delle apolipoproteine o della rimozione dal plasma tramite i recettori specifici (vedi voce Lipoproteina).
Colesterolemia e alimentazione
Contrariamente a quanto si pensa, non è tanto il colesterolo introdotto con l'alimentazione ad aumentare la colesterolemia, quanto piuttosto il consumo di alcuni acidi grassi saturi (SFA), contenuti negli alimenti, anche se non tutti i grassi saturi agiscono nello stesso modo. I grassi saturi C12:0-C16:0, in particolar modo l'acido miristico (C14:0), aumentano il livello di LDL, mentre i trans-saturi inibiscono l'assorbimento degli omega 3, i quali aumentano le HDL.[31] Al contrario, gli acidi grassi monoinsaturi (MUFA) e polinsaturi (PUFA) abbassano i livelli plasmatici di LDL. A questo proposito le raccomandazioni dell'American Heart Association Nutrition Committee prevedono di limitare l'introito giornaliero di colesterolo a <300 mg, quello di SFA a <7% del totale calorico, con gli acidi grassi trans-insaturi (TFA) a <1% delle calorie totali.[32] Le raccomandazioni (2010) della FAO/WHO (Food and Agriculture Organiation/World Health Organisation) includono: consumo di grassi totali pari al 20-35% dell'apporto calorico giornaliero, SFA < 10%, PUFA totali 6-11%, n-6 PUFA 2,5-9%, n-3 PUFA 0,5-2%, TFA < 1%.
Colesterolo alimentare. Gli effetti del colesterolo della dieta sulla colesterolemia sono complessi, per il fatto che la relazione tra questi due parametri è influenzata da numerosi fattori: composizione della dieta (contenuto in acidi grassi totali, SFA, MUFA e PUFA; fibre; fito- e sitosteroli; ecc.), consumo abituale medio di colesterolo (nei bassi consumatori l’assorbimento è maggiore), variazioni individuali nella capacità di assorbimento intestinale (iper- e ipo-assorbenti) e nella sensibilità della regolazione della sintesi endogena di colesterolo (iper- verso ipo-responders). Si spiega così il fatto che alcuni popoli che si nutrono prevalentemente di prodotti animali come gli Inuit delle regioni polari o i Masai delle steppe africane hanno delle colesterolemie minori di europei o statunitensi. Nel 15-25% della popolazione la soppressione della sintesi endogena è particolarmente marcata (soggetti iper-rispondenti) e la colesterolemia non aumenta con l'aumentare del consumo di colesterolo alimentare. Particolarmente iper-rispondente si è rivelata la popolazione dei Masai: la colesterolemia e la prevalenza dell’aterosclerosi sono basse nonostante che l'apporto di colesterolo possa raggiungere i 2000 mg /die per l’elevato consumo di prodotti derivati dagli zebù.[11]
Il Ministero della Salute tedesco, tra il 1987 e il 1988, ha condotto uno studio epidemiologico di tipo osservazionale (studio di popolazione), il Verbundstudie Ernahrungserhebung und Risikofaktoren-Analytic (VERA) o Nutrition Survey and Risk Factor Analysis Study, che ha preso in esame le abitudini nutrizionali e ha effettuato rilevazioni antropometriche ed ematochimiche. Lo studio VERA (1993), che ha riguardato circa 2000 individui adulti, non ha rilevato alcuna correlazione tra contenuto abituale di colesterolo nella dieta (latte, panna, uova, burro, grassi animali ecc.) e colesterolemia.[33]

Indipendentemente da queste considerazioni preliminari basate sugli studi epidemiologici, gli studi sperimentali in volontari, durante i quali è stata somministrata una quantità certa di colesterolo e sono stati misurati i livelli di colesterolemia, hanno registrato, almeno sino a 1000 md/die di colesterolo,[34] una relazione direttamente proporzionale tra colesterolo della dieta e colesterolemia.[35] Tuttavia, grazie ai meccanismi omeostatici che regolano l’assorbimento e la sintesi del colesterolo, secondo una metanalisi del 2001,[36] la colesterolemia totale aumenta in media soltanto di circa 2,2 mg/100ml per ogni incremento di 100 mg/die di colesterolo dietetico, sebbene anche in questo caso le oscillazioni siano marcate,[11] il colesterolo LDL aumenta di 1,93/100 ml e quello HDL di 0,3 mg/100 ml e il rapporto colesterolemia totale/HDL aumenta di 0,02. Un incremento della colesterolemia di queste proporzioni è relativamente modesto, se si considera che la colesterolemia totale normale oscilla intorno ai 200 mg/100 ml, ma non per questo è da ritenersi irrilevante: dai dati epidemiologici (sia pure con tutti i loro limiti) risulta che 1 mg/100ml di aumento della colesterolemia totale innalza il rischio cardio-vascolare di circa l’1%.
Una metanalisi del 1992 mette in evidenza come l'innalzamento della colesterolemia in risposta ai più elevati contenuti di coleterolo dietetico (>1000 mg/die) segua un andamento curvilineare, nel senso che la variazione della colesterolemia è progressivamente più contenuta.[37]
Sulla base di queste evidenze il Dietary Guidelines Advisory Committee del 2015 afferma che non esistono apprezzabili relazioni tra consumo di colesterolo dietetico e colesterolemia,[38] mentre le linee guida Dietary Guidelines for Americans 2015-2020 consigliano il più basso consumo possibile di colesterolo.[39]

Grassi alimentari. Dagli studi sperimentali è emerso che la percentuale di calorie giornaliere assunte in forma di SFA è strettamente correlata con l'aumento della colesterolemia: sono state elaborate alcune equazioni (es. Keys, Hegsted) che permettono di calcolare le variazioni della colesterolemia in funzione del contenuto di SFA e PUFA della dieta.[40]
L'OMS, nel suo Food and health in Europe: a new basis for action[41] del 2004, sintetizza i risultati degli studi su colesterolo e alimentazione: gli SFA influiscono, anche se in maniera diversa, sul livello del colesterolo, aumentando le LDL e in minor misura le HDL.[42] Nel dettaglio:
- l'acido miristico (C14:0), contenuto nel latte vaccino intero (non scremato), è il più forte stimolatore della produzione di LDL
- l'acido laurico, (C12:0), contenuto negli olii e grassi di piante tropicali e nel latte in piccole quantità, l'acido palmitico (C16:0), contenuto nei grassi animali (carne, pesce e molluschi) e in oli e grassi da piante tropicali, e alcuni acidi trans-insaturi (C18:1n-9) sono forti stimolatori della produzione di LDL[43]
- l'acido stearico (C18:0), contenuto nel grasso di manzo e nel lardo di suino, non aumenta il colesterolo LDL[44]
L'aumento della concentrazione delle LDL indotto da questi SFA è dipendende sia da una maggiore produzione epatica di lipoproteine, sia dalla downregulation dei recettori LDL.[40]
Gli acidi trans-insaturi (TFA) aumentano le LDL, sono senza effetto sulle HDL e riducono l'apporto di acidi grassi polinsaturi, soprattutto di omega 3. Tali grassi (principalmente l'acido elaidico C18:1n-9, derivato dall'acido linoleico) sono generati soprattutto nell'idrogenazione dei grassi insaturi, processo utilizzato per la produzione di margarine industriali a partire da oli vegetali. Gli acidi polinsaturi (PUFA) e quelli monoinsaturi (MUFA) abbassano i livelli delle LDL e innalzano modestamente quelli delle HDL. In particolare l'effeto sulle HDL è tale che SFA > MUFA > PUFA.[40] I PUFA riducono il rapporto LDL/HDL, mentre i MUFA hanno effetto ridotto o non hanno effetto.[45] È dunque la qualità dei grassi, e non il loro apporto totale, a determinare il rapporto LDL/HDL. Tuttavia anche un eccesso di PUFA può essere dannoso, in quanto i doppio legami sono altamente reattivi e, quando esposti all'aria e al calore, combinandosi con l'ossigeno, possono formare perossidi.
Colesterolemia e stress
Esiste un teoria secondo la quale fattori psicologici, e in particolare lo stress emotivo, influenzerebbero la colesterolemia. I suoi sostenitori affermano che ne sarebbe responsabile l'aumento di ormoni e neuroormoni come adrenalina, noradrenalina e cortisolo. In particolare è stato sottolineato come il cortisolo, promuovendo la lipolisi, inibisca l'elaborazione di LDL da parte del fegato (il che fa aumentare la colesterolemia e peggiora la relazione LDL/HDL)[46].
Colesterolemia e rischio cardio-vascolare
Gli studi epidemiologici possono essere distinti in studi osservazionali e studi di intervento o sperimentali, i primi possono ulteriormente essere classificati, in base alla metodologia adottata, in: studi descrittivi; studi trasversali o di prevalenza; studi retrospettivi o di casi di malattia; studi longitudinali o prospettici o di coorte.
Gli studi longitudinali sono studi epidemiologici che prendono in esame uno o più gruppi di individui, seguendoli con esami periodici per un periodo di tempo piuttosto lungo. Questi studi permettono di prendere in considerazione un numero notevole di caratteristiche (es. peso, pressione arteriosa, parametri ematochimici, dati elettrocardiografici, dieta, abitudini di vita, come attività fisica e fumo, tipo di occupazione). Grazie ad essi si è giunti all'identificazione di alcuni importanti fattori di rischio per la cardiopatia ischemica, tra i quali l'elevata colesterolemia è uno dei più importanti (vedi Aterosclerosi). Si parla di fattori di rischio e non di fattori eziologici (cause) proprio perché gli studi epidemiologici non sono sperimentazioni scientifiche: il loro ruolo è limitato alla identificazione di associazioni naturali tra alcune caratteristiche e lo stato di malattia considerato, senza fornire informazioni sulla natura di tale associazione. La loro importante funzione è quella di formulare ipotesi da verificare con successive sperimentazioni scientifiche.
Sono stati i grandi studi osservazionali prospettici (vedi paragrafo sottostante) a documentare la relazione positiva di tipo esponenziale esistente tra colesterolemia e mortalità cardiovascolare, mentre hanno evidenziato una correlazione ad U tra mortalità totale e colesterolemia (cioè la mortalità totale aumenta sia per i valori più bassi di colesterolemia, sia per quelli più alti).[47]
Gli studi epidemiologici non consentono di trarre conclusioni certe sui rapporti causa-effetto tra i fenomeni esaminati, tuttavia le correlazioni statistiche individuate suggeriscono che:
- valori elevati di colesterolemia sono correlati con l'aumento della mortalità dovuta ad alcune malattie, in particolare quelle cardiovascolari su base aterosclerotica (prevalentemente infarto del miocardio e ictus ischemico)
- valori ridotti di colesterolemia, sotto una certa soglia, sono correlati con una più elevata mortalità per cause accidentali (es. suicidi) e per altre malattie (es. cancro polmonare, ictus emorragico); come detto sopra la natura di tale relazione è fortemente discussa
- la colesterolemia corrispondente alla minima mortalità è più alta nelle donne (200-240mg/dl) che negli uomini (160–200 mg/dl)
Ulteriori domande che attendono risposta definitiva sono:
- la colesterolemia può concorrere allo sviluppo di altre malattie, oltre a quelle cardiovascolari su base ischemica?
- per quali motivi (oltre al ruolo protettivo degli estrogeni) nelle donne il rischio coronarico è correlato con valori di colesterolemia totale più alti che negli uomini?
Come parametro metabolico la colesterolemia è connessa con un gran numero di processi metabolici che si influenzano a vicenda. Valutando tutto questo, non è né sensato né scientifico tirare, sulla base dei soli studi epidemiologici osservazionali, una conclusione riduttiva del tipo: "basta abbassare la colesterolemia per prevenire l'infarto cardiaco", anche se questa sembra essere al momento l'opinione più diffusa nel grande pubblico. Una tesi del genere non può in nessun caso essere sostenuta da uno studio epidemiologico osservazionale. Il fatto che dagli studi epidemiologici osservazionali risulti che una colesterolemia bassa è associata a una bassa mortalità coronarica non comporta automaticamente che abbassando una colesterolemia alta si riduca la mortalità. Per poter giungere a una simile conclusione sono stati necessari studi di intervento terapeutico, randomizzati, in doppio cieco e placebo-controllati, che hanno valutato come obiettivo finale principale (endpoint primario) l'effetto di una terapia (farmacologica o di altro tipo) a lungo termine sulla mortalità totale e cardiovascolare e sugli eventi cardiovascolari.
Sono stati condotti anche alcuni studi epidemiologici di carattere autoptico (Stary e McGill), dai quali è emersa una correlazione positiva tra colesterolemia e gravità ed estensione delle lesioni aterosclerotiche avanzate (tale correlazione non esiste per le strie lipidiche; vedi voce Aterosclerosi).
Valori di riferimento
I valori di riferimento per i parametri medici vengono normalmente rilevati da un campione di persone sane. Del parametro rilevato si determinano media aritmetica semplice m e la deviazione standard , una misura per la dispersione dei singoli valori. Il valore di riferimento è di solito
m±2 che include circa il 97% della popolazione sana.
Esempio: per l'intera popolazione tedesca è m=210, =30; perciò l'intervallo di valori normali sarà 210 +/- 60 = da 150 a 270 mg/dl. Poiché questi valori "normali" sono eccessivamente alti, per la determinazione dei livelli ottimali di colesterolemia nella Consensus Conference del 1984 e nelle successive linee guida ATP si è preferito seguire il criterio del rischio di CHD, per cui sono considerati elevati quei valori per i quali il rischio coronarico è elevato. Il Pschyrembel, la "bibbia" dei medici tedeschi, dà un valore di riferimento colesterolemico da 115 a 220 mg/dl.[48]
Fondamentale comunque è la suddivisione tra frazione di colesterolo LDL e HDL: tanto più il rapporto è favorevole alla prima, tanto più alto è il rischio di malattie cardiovascolari. Questo fatto è ben documentato da studi epidemiologici recenti, che non focalizzandosi solo su uno dei due tipi di colesterolo, guardano alla loro percentuale relativa e al colesterolo LDL totale. L'unione dei due parametri consente una buona predittività dei rischi di malattie cardiovascolari.[31]
Ipercolesterolemia
L'ipercolesterolemia è una dislipidemia caratterizzata da un'elevata concentrazione plasmatica di colesterolo totale e LDL. Se, come è convenzione, sono considerati elevati i valori che eccedono il 95 percentile di quelli della popolazione in esame, nel caso della colesterolemia i valori desiderabili mutano a seconda del rischio cardio-vascolare globale: in presenza di nessuno o di un solo fattore di rischio, i livelli ottimali di LDL sono <160 mg/100 ml; con 2 0 più fattori di rischio, i tali livelli sono <130 mg/100 ml; nel caso di diabete o coronaropatia sono <100 mg/100 ml o <70 mg/100 ml.
L'ipercolesterolemia può presentarsi come Ipercolesterolemia familiare (FH), come altre forme familiari monogeniche o nella più comune forma poligenica; l'ipercolesterolemia è spesso associata ad altre malattie endocrine e metaboliche (ipercolesterolemia secondaria), come il diabete mellito di tipo 2 o le malattie della tiroide. Come altre malattie del metabolismo dei lipidi, l'ipercolesterolemia implica un rischio elevato di aterosclerosi.
I parametri metabolici caratteristici dell'ipercolesterolemia sono:
- lipoproteine a bassa densità (LDL) alte
- lipoproteine a bassissima densità (VLDL) normali
- beta-lipoproteine alte
- trigliceridi normali o elevati
Clinicamente l'Ipercolesterolemia familiare (FH) si manifesta con ipercolesterolemia totale molto elevata (1000-300 mg), xantomi, tendinosi, xantelasmi e arcus lipoides corneae (un alone intorno alla pupilla).
I possibili pericoli per la salute della bassa colesterolemia
Nonostante l'enorme mole di dati a favore dell'importanza della colesterolemia come fattore di rischio cardiovascolare, numerose pubblicazioni sottolineano il pericolo di una bassa colesterolemia o contestano il ruolo del colesterolo nello sviluppo della malattia aterosclerotica[49]. Immich[50] si è dedicato allo studio di Framingham e ha notato, nel 1997, che questo studio parlava già negli anni sessanta di nessuna correlazione statisticamente significativa tra colesterolemia e sclerosi coronaria.
Nella metanalisi di Jacobs (1992),[47] gli uomini e, in minor misura le donne, con concentrazioni sieriche di colesterolo totale <4,2 mmol/l (160 mg/dL) (6° percentile) mostravano un aumento della mortalità totale di circa il 10%-20% rispetto ai soggetti con valori compresi tra 4,2 e 5,2 mmol/L (160–199 mg/dL). Sebbene il problema sia reale e ancora irrisolto, l'eccesso di mortalità totale e di motalità per cancro potrebbe essere parzialmente spiegato dalla preesistenza, al basale, di malattie subcliniche e dalla coesistenza di altri fattori aggressivi sconosciuti o non misurati, correlati sia alla bassa colesterolemia che alla mortalità.[51][52][53][54][55][56] Ad esempio, nello studio prospettico Honolulu Heart Program, condotto su circa 8000 uomini di ascendenza giapponese, residenti a Oahu (Hawaii), nel follow-up a 16 anni, nei soggetti in cui la colesterolemia si era ridotta dai livelli medi a quelli bassi, vi era un aumento della mortalità totale e un maggior numero di morti per alcuni tipi di cancro e per malattie epatiche, mentre nei soggetti che avevano mantenuto una bassa colesterolemia stabile, tale eccesso di mortalità non era riscontrabile; dopo 23 anni di follow-up, negli individui con colesterolo totale <180 mg/dl, in assenza di elevato consumo di alcool, di fumo e di ipertensione la bassa colesterolemia non era associata né alla mortalità totale né a quella per cancro. D'altra parte, vanno menzionati i lavori di Iribarren, in cui una bassa colesterolemia era associata con rischio maggiore di alcune infezioni, specialmente del tratto urinario, nonché con un maggior rischio di ospedalizzazione per polmonite. Va sottolineato ancora una volta che gli studi epidemiologici non hanno il potere di dimostrare un rapporto di causa-effetto tra gli elementi osservati.
Se esistono dubbi sul "pericolo" di una bassa colesterolemia "naturale", diverso è il discorso della bassa colesterolemia ottenuta con il trattamento terapeutico: i più recenti studi con le statine hanno dimostrato che, in soggetti ad alto rischio cardiovascolare, valori anche molto bassi di LDL (70–80 mg/dl) si accompagnano a riduzione degli eventi cardiovascolari, senza che la mortalità totale aumenti oppure, come nel caso dello studio HPS, facendo registrare una sua diminuzione.[57][58][59]Resta da chiarire se questi risultati dipendano dalla sola riduzione della colesterolemia o invece dall'azione pleiotropica delle statine o dall'insieme dei due fattori (vedi ipercolesterolemia).
Grandi studi epidemiologici
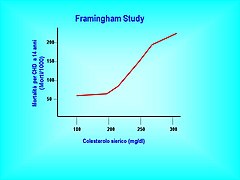
Il Framingham Heart Study, lo studio di Framingham (Massachusetts), è una enorme opera epidemiologica statunitense che riempie una biblioteca intera e decorre fin dagli anni cinquanta (nel frattempo si è giunti ai nipoti dei primi partecipanti). Il follow-up a 30 anni di 1959 uomini e 2415 donne sani, di età compresa tra 31 e 65 anni, attesta che, al di sotto dei 50 anni, i livelli di colesterolo sono direttamente correlati con la mortalità totale e cardiovascolare, in misura tale che per ogni incremento di 10 mg/dl di colesterolo sierico la mortalità totale e quella cardiovascolare aumentano rispettivamente del 5% e del 9%. Questa associazione rimane statisticamente significativa negli uomini anche dopo le correzioni statistiche per pressione, fumo, peso corporeo e diabete; nelle donne l'associazione rimane positiva sebbene non raggiunga la significatività statistica. Dopo i 50 anni non vi è incremento della mortalità totale né per valori alti di colesterolemia, né per quelli bassi, ma il rapporto è confuso dalla presenza di individui in cui la colesterolemia diminuisce, probabilmente a causa dello sviluppo di gravi malattie. In quei soggetti in cui la colesterolemia diminuisce spontaneamente, per ogni mg/dl di discesa del colesterolo nei primi 14 anni di osservazione si registra un incremento entro 18 anni dell'11% della mortalità totale e del 14% di quella cardiovascolare.
-
Mortalità CHD a 10 anni in funzione della colesterolemia (colesterolo sierico)
-
Mortalità CHD in funzione della colesterolemia in uomini tra 30-49 anni all'inizio dello studio
-
Mortalità CHD in funzione della colesterolemia
-
Mortalità totale in funzione della colesterolemia
Lo studio statunitense Multiple Risk Factor Intervention Trial (MRFIT, iniziato nel 1973), in cui 361.662 uomini, di età compresa tra 35 e 57 anni, sono stati seguiti per 6 anni, ha evidenziato che la correlazione tra colesterolemia totale e mortalità per coronaropatia è lineare per valori compresi tra 200 e 240 mg/dl, mentre al di sopra dei 240 mg/dl diviene esponenziale, cosicché a più alte concentrazioni di colesterolo, la mortalità da CHD (Coronary Heart Disease) aumenta più rapidamente. Inoltre i dati del MRFIT sembrano negare la validità del concetto di soglia per i valori della colesterolemia, da questo studio risulta infatti che non vi è un limite per il colesterolo totale sierico, al di sotto del quale il rischio di CHD non esiste. È interessante notare che nel MRFIT, come è emerso anche dal Framingham Heart Study, l'importanza del colesterolo totale come fattore di rischio si riduce con l'età. In questo studio, il rapporto tra mortalità totale e colesterolo totale è rappresentato graficamente da una curva a J, piuttosto che a U.
Il Prospective Cardiovascular Münster (PROCAM) Heart Study è uno dei più ampi studi prospettici europei sui fattori di rischio cardiovascolari. Lo studio, iniziato nel 1979 e completato nel 1991, ha riguardato 23.616 impiegati della Germania nord-occidentale (tra Münster e la Ruhr). Dopo un follow-up di 14 anni, il colesterolo totale, il colesterolo LDL ed il rapporto LDL/HDL mostravano una relazione esponenziale con la mortalità per CHD e una relazione a J con la mortalità totale. Ad alti livelli di colesterolo totale e LDL, l'aumento della mortalità totale era dovuto all'aumento delle morti coronariche, mentre a bassi livelli di colesterolo totale e LDL l'incremento della mortalità totale si verificava soltanto nei fumatori ed era in rapporto con una maggiore mortalità per cancro correlato al fumo.
Una meta-analisi effettuata su 18 studi epidemiologici e risalente al 1992 dimostra che la mortalità totale è minima per valori di colesterolemia totale compresi tra 160 e 200 mg/dl per gli uomini e tra 200 e 240 per le donne (le tabelle di rischio cardiovascolare fornite dal Ministero della Salute ai medici di famiglia italiani tengono conto di tale differenza legata al sesso). Valori troppo bassi sono correlati ad un aumentato rischio di morte causata da alcuni tumori, ictus cerebrali e polmonari, alcune malattie infettive, incidenti, suicidi e malattie degenerative, mentre valori troppo alti sono correlati ad un aumentato rischio d'infarto del miocardio. Nella pratica medica si parla solo dei rischi connessi a valori elevati, ma quasi mai di quelli derivanti da valori troppo bassi, in quanto la relazione causale tra bassa colesterolemia ed eventi avversi è estremamente dubbia.
La ricerca della Carelia è uno studio epidemiologico a intervento; il governo finlandese (preoccupato dai tanti decessi cardiovascolari) ha promosso uno studio intervenendo con delle misure nutrizionali: educazione alla salute, campagna antifumo, antialcol e abbassamento farmaceutico della colesterolemia nella regione della Carelia del Nord, mentre in tutte le altre regioni non è stato fatto alcun intervento. Il risultato è stato una riduzione di circa il 20% di decessi per morte cardiovascolare. Per questo fatto lo studio viene spesso citato da coloro che sostengono e vogliono promuovere "l'abbassamento del colesterolo per minimizzare i rischi cardiovascolari". Nello stesso lasso di tempo, però, nelle altre regioni della Finlandia, i decessi cardiovascolari si sono abbassati del 22%, come illustrato da Vartiainen (vedi fonti). Nessuno sa spiegarselo, sebbene le interpretazioni adotte possano apparire anche molto fantasiose.
In base a queste e ad altre esperienze J. McCormick e P. Skrabanek sono arrivati alla conclusione che "non è possibile prevenire le malattie cardiache coronariche con degli interventi sulla popolazione"[60]
I rischi di cardiopatia ischemica

Nonostante la stretta correlazione tra colesterolemia totale e mortalità per CHD emersa dagli studi longitudinali, i valori di colesterolo totale, a livello individuale, non rappresentano un indice altamente specifico per individuare i soggetti a rischio di malattia coronarica. Infatti, dallo studio di Framingham è emerso che le curve di distribuzione della colesterolemia, rispettivamente per gli uomini che sviluppano coronaropatia nel corso dei primi 16 anni dello studio e per quelli che ne rimangono esenti, mostrano una notevole sovrapposizione nell'ambito dei livelli di colesterolo totale compresi tra 150 e 300 mg/dl. Inoltre circa la metà degli eventi coronarici si sono manifestati nei soggetti con colesterolemia < 240 mg/dl: soltanto il 41% degli eventi CHD negli uomini e il 61% nelle donne di età 35-64 erano associati a valori pari o superiori a 240 mg/dl.
Nel tentativo di individuare markers più sensibili per valutare il rischio di CHD, l'attenzione è stata rivolta allo studio dell'intero profilo lipidico. Durante l'undicesimo esame biennale del Framingham Study, in 1023 uomini e 1434 donne, liberi da CHD, sono state misurate le concentrazioni sieriche di LDL, HDL, colesterolo totale (CT) e trigliceridi. Considerato isolatamente, il livello delle HDL è il singolo parametro lipidico più specifico, mentre il rapporto tra colesterolo totale e HDL è risultato la variabile più specifica nell'individuare gli individui a rischio di CHD, di quanto non lo fossero il colesterolo totale o le LDL. Il rischio di CHD aumenta, per qualsiasi valore di colesterolemia, con il crescere del rapporto CT/HDL. Quando i livelli di colesterolo totale sono al di sotto di 240 mg/dl, il rischio varia ampiamente in dipendenza dei valori delle HDL sieriche. Comunque anche questo marker lipidico risulta insoddisfacente per la determinazione del rischio cardiovascolare e la sua valutazione deve tener conto dell'insieme dei fattori di rischio presenti nel soggetto in esame.
Sulla base di queste considerazioni appare evidente che sono necessari markers più specifici, che non la sola colesterolemia, per determinare il rischio di CHD, così da evitare di allarmare inutilmente soggetti apparentemente a rischio maggiore di CHD (falsi positivi) o, al contrario, di rassicurare falsamente quegli individui che in base alle linee guida non risultassero nelle categorie a maggior rischio (falsi negativi). Un semplice innalzamento dei valori di colesterolemia considerati pericolosi avrebbe il risultato di diminuire il numero dei falsi positivi, ma porterebbe d'altra parte all'aumento dei falsi negativi. La stesura di carte di rischio globale, che tengono conto di un numero maggiore di fattori di rischio, oltre alla colesterolemia, assicura una maggiore sensibilità nella valutazione del rischio di CHD (vedi valori ottimali di colesterolemia), mentre studi epidemiologici condotti nell'ultimo decennio sono stati indirizzati verso la ricerca di nuovi markers.
Dati statistici
Gli studi epidemiologici che confrontano tra loro gruppi (popolazioni) diversi di individui hanno un limite tanto maggiore quanto più disomogenei sono i gruppi presi in esame. La disomogeneità è massima quando si prendono in considerazione popolazioni di nazioni differenti, a causa dei numerosi "fattori confondenti" (razza, abitudini alimentari e stile di vita, condizioni ambientali, livello di sviluppo sanitario, metodologia di rilevazione dei dati e di misurazione dei parametri presi in esame dallo studio, ecc.). Nonostante ciò dall'esame di tali studi emerge che nei singoli paesi esiste una correlazione positiva tra colesterolemia e mortalità per cardiopatia ischemica, nel senso che anche nei paesi dove la mortalità per cardiopatia ischemica è relativamente bassa esiste una relazione positiva tra valori di colesterolemia e mortalità per malattia coronarica, come attestato dallo studio prospettico internazionale noto come Seven Country Study[61] e confermato dallo studio prospettico di Shanghai su un campione di circa 9000 cinesi di entrambi i sessi, seguiti per 8-13 anni (1991). Tuttavia, proprio per la natura multifattoriale della CHD e per la presenza di numerosi fattori confondenti, a parità di colesterolemia la mortalità mostra ampie differenze fra i diversi paesi.
I dati provenienti dallo studio trasversale (di prevalenza) MONICA illustrano bene questo aspetto. Il WHO MONICA Project Health Organization Multinational Monitoring of Trends and Determinants in Cardiovascular Disease Project (MONItoring of CArdiovascular diseases) è uno studio iniziato nel 1981 con lo scopo di rilevare l'andamento della patologia cardiovascolare e i rispettivi fattori di rischio in 38 differenti popolazioni di 21 nazioni in quattro continenti durante un periodo di 10 anni, interessando una popolazione totale di circa 13 milioni di uomini e donne di età compresa tra 35 e 64 anni (facoltativamente anche tra 25 e 35 anni). I dati demografici sono presi dai registri ufficiali e dai censimenti, mentre le informazioni sui fattori di rischio sono state ottenute da campioni delle popolazioni esaminate, effettuando due o tre screening per i fattori di rischio, in primo luogo pressione arteriosa, colesterolemia e fumo, e per molte altre caratteristiche (come il livello culturale): il primo all'inizio dello studio, il secondo verso la metà e l'ultimo al termine dei dieci anni. Inoltre sono stati effettuati due o tre screenings del trattamento dell'infarto miocardico acuto. Nel 1994 il WHO/MONICA Project ha completato la sua osservazione decennale. Più di 300.000 uomini e donne sono stati esaminati durante gli screenings e sono stati registrati 166.000 infarti del miocardio.
Le località italiane partecipanti allo studio sono state Montegiorgio, in Italia Centrale, e Crevalcore, nel Nord Italia. Nei diversi paesi coinvolti nello studio MONICA, a fronte di valori simili di colesterolemia totale si riscontrano variazioni molto ampie della mortalità da CHD. Negli uomini, gli eventi coronarici fatali e non-fatali, registrati all'inizio dello studio (1985-1987), standardizzati per l'età, mostrano un intervallo di variazione di 12 volte dai 915 casi su 100.000 nella Carelia settentrionale (Finlandia) ai 76 casi/100.000 a Pechino (Cina); nelle donne l'intervallo di variazione è di 8,5 volte, da 256/100.000 a Glasgow (UK) a 30/100.000 in Catalogna (Spagna). Anche prendendo in considerazione altri due maggiori fattori di rischio, pressione arteriosa e fumo, nello studio MONICA rimangono inspiegabili oltre i 3/4 delle morti per CHD; questo sottolinea il fatto che l'incidenza delle malattie a base aterosclerotica, pur restando l'importanza dei tre maggiori fattori di rischio, è legata ad una più ampia costellazione di fattori sia aggressivi che protettivi.
Note
- ^ J. McMurry, 27, in Organic Chemistry, 8ª ed., Belmont, Brooks/Cole, 2012, ISBN 0840054440.
- ^ Colesterolemia, in Treccani, dizionario della salute, 2010.
- ^ Meyer Friedman, Gerald W. Friedland, Le 10 più grandi scoperte della medicina, Baldini & Castoldi, Milano 2000, p. 252
- ^ a b M.E. Haberland, Self-association of Cholesterol in Aqueous Solution (PDF), in Proc. Nat. Acad. Sci. USA, vol. 70, 1973, p. 2315.
- ^ C.R. Loomis, The phase behavior of hydrated cholesterol (PDF), in J. Lipid Res., vol. 20, 1979, pp. 525-535.
- ^ P.F. Renshaw, On the nature of dilute aqueous cholesterol suspensions (PDF), in J. Lipid Res., vol. 24, 1983, pp. 47-51.
- ^ C.J. Fielding, Intracellular cholesterol transport, in J. Lipid Res., vol. 38, 1997, pp. 1503-1521.
- ^ Vander, 3,, in Fisiologia, Milano, CEA, 2011, p. 49. ISBN 978-88-08-18510-5
- ^ Dinesh Puri, Textbook of medical biochemistry, 3ª ed., Elsevier, 2011, p. 250, ISBN 978-81-312-2312-3.
- ^ D.E. Cohen, Balancing Cholesterol Synthesis and Absorption in the Gastrointestinal Tract, in J. Clin. Lipidol., vol. 2, 2008, pp. S1–S3.
- ^ a b c K.M. Kostner, Understanding Cholesterol Synthesis and Absorption Is the Key to Achieving Cholesterol Targets (PDF), in Asia Pacific Cardiology, vol. 1, 2007, pp. 7-10.
- ^ J. Rodès, Textbook of hepatology, 3ª ed., Oxford, Blackwell publishing, 2007, p. 174, ISBN 978-1-4051-2741-7.
- ^ a b J-M. Lecerf, Dietary cholesterol: from physiology to cardiovascular risk (PDF), in Br. J. Nutr., vol. 106, 2011, pp. 6-14.
- ^ a b B. Genser, Plant sterols and cardiovascular disease: a systematic review and meta-analysis, in Eur. Heart J., vol. 33, 2012, pp. 444-451.
- ^ E. Sehayek, U-shaped relationship between change in dietary cholesterol absorption and plasma lipoprotein responsiveness and evidence for extreme interindividual variation in dietary cholesterol absorption in humans, in J. Lipid Res., vol. 39, 1998, pp. 2415–2422.
- ^ E. Sehayek, Genetic regulation of cholesterol absorption and plasma plant sterol levels: commonalities and differences, in J. Lipid Res., vol. 44, 2003, pp. 2030-2038.
- ^ R.E. Ostlund Jr., Cholesterol absorption efficiency declines at moderate dietary doses in normal human subjects, in J. Lipid Res., vol. 40, 1999, pp. 1453-1458.
- ^ a b D.J. McNamara, Heterogeneity of cholesterol homeostasis in man. response to changes in dietary fat quality and cholesterol quantity, in J. Clin. Invest., vol. 79, 1987, pp. 1729–1739.
- ^ E. Quintao, Effects of dietary cholesterol on the regulation of total body cholesterol in man, in J. Lipid Res., vol. 12, 1971, pp. 233-247.
- ^ Y. Yamanashi, Transporters for the Intestinal Absorption of Cholesterol, Vitamin E, and Vitamin K, in J. Atheroscler. Thromb., vol. 24, 2017, pp. 347–359.
- ^ a b J. Iqbal, Intestinal lipid absorption, in Am. J. Physiol. Endocrinol. Metab., vol. 296, 2009, pp. E1183–E1194.
- ^ A. BR. Thomson, Recent advances in small bowel diseases: Part II (PDF), in World J. Gastroenterol., vol. 18, 2012, pp. 3353–3374.
- ^ L. Jia, Niemann-Pick C1-Like 1 (NPC1L1) Protein in Intestinal and Hepatic Cholesterol Transport, in Ann. Rev. Physiol., vol. 73, 2011, pp. 239–259.
- ^ J.L. Betters, NPC1L1 and Cholesterol Transport, in FEBS Lett., vol. 584, 2010, pp. 2740–2747.
- ^ N.A. Abumrad, Role of the gut in lipid homeostasis, in Physiol. Rev., vol. 92, 2012, pp. 1061–1085.
- ^ R.S. Tilvis, Serum plant sterols and their relation to cholesterol absorption, in Am. J. Clin. Nutr., vol. 43, 1986, pp. 92-97.
- ^ L. Jakulj, Plasma plant sterols serve as poor markers of cholesterol absorption in man, in J. Lipid Res., vol. 54, 2013, pp. 1144-1150.
- ^ (EN) M.W. King, S. Marchesini, Lipid digestion and Lipoproteins, su themedicalbiochemistrypage.org, 21 novembre 2008. URL consultato il 25 novembre 2008.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 25-27, ISBN 92-890-1363-X.
- ^ (EN) Alberico L. Catapano, Ian Graham, Guy De Backer, Olov Wiklund, M. John Chapman, Heinz Drexel, Arno W. Hoes, Catriona S. Jennings, Ulf Landmesser, Terje R. Pedersen, Željko Reiner, Gabriele Riccardi, Marja-Riita Taskinen, Lale Tokgozoglu, W. M. Monique Verschuren, Charalambos Vlachopoulos, David A. Wood, Jose Luis Zamorano, 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias, in European Heart Journal, 27 agosto 2016, DOI:10.1093/eurheartj/ehw272. URL consultato il 31 agosto 2016.
- ^ a b (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 25-27, ISBN 92-890-1363-X.
- ^ A.H. Lichtenstein, Diet and lifestyle recommendations revision 2006: a scientific statement from the American Heart Association Nutrition Committee, in Circulation, vol. 114, 2006, pp. 82–96.
- ^ (DE) M. Kohlmeier et al., Verbreitung von klinisch-chemischen Risikofaktoren, Niederkleen, VERA-Schriftenreihe Band VII, 1993.
- ^ J.D. Griffin, Dietary cholesterol and plasma lipoprotein profiles: randomized-controlled trials, in Curr. Nutr. Rep., vol. 2, 2013, pp. 274–282.
- ^ A.M. Freeman, Trending Cardiovascular Nutrition Controversies (PDF), in JACC, vol. 19, 2017, pp. 1172-1187.
- ^ R.M. Weggemans, Dietary cholesterol from eggs increases the ratio of total cholesterol to high-density lipoprotein cholesterol in humans: a meta-analysis, in Am. J. Clin. Nutr., vol. 73, 2001, pp. 885-891.
- ^ P.N. Hopkins, Effects of dietary cholesterol on serum cholesterol: a meta-analysis and review, in Am. J. Clin. Nutr., vol. 55, 1992, pp. 1060-1070.
- ^ Scientific Report of the 2015 Dietary Guidelines Advisory Committee https://health.gov/dietaryguidelines/2015-scientific-report/pdfs/scientific-report-of-the-2015-dietary-guidelines-advisory-committee.pdf
- ^ 2015–2020 Dietary Guidelines for Americans, su health.gov.
- ^ a b c M.H. Stipanuk, Biochemical and physiological aspects of human nutrition, Philadelphia, W.B. Saunders Company, 2000, pp. 927-933, ISBN 0-7216-4452-X.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, ISBN 92-890-1363-X.
- ^ A.M. Salter, Dietary fatty acids and cardiovascular disease, in Animal, 7:suppl.1, 2013, pp. 163–171.
- ^ (EN) Muller, H. et al., Serum cholesterol predictive equations with special emphasis on trans and saturated fatty acids: an analysis from designed controlled studies, in Lipids, n. 36, 2001, pp. 783–791.
- ^ (EN) YU, S. et al., Plasma cholesterol–predictive equations demonstrate that stearic acid is neutral and monounsaturated fatty acids are hypocholesterolemic, in American journal of clinical nutrition, n. 61, 1995, pp. 1129–1139.
- ^ (EN) A. Robertson et al. (a cura di), Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, pp. 24-27, ISBN 92-890-1363-X.
- ^ (EN) Rosenman R.H., Psycological Influence on the Variability of Plasma Colesterol, in Homeostasis, n. 34, 1993, pp. 129 - 136.
- ^ a b D. Jacobs, Report of the Conference on Low Blood Cholesterol: Mortality Associations, in Circulation, vol. 86, 1992, pp. 1046-1060.
- ^ Pschyrembel.
- ^ (EN) The International Network of Cholesterol Skeptics" - News, su thincs.org. URL consultato il 25 novembre 2008.
- ^ (DE) H. Immich, Cholesterin und Koronarsklerose, in Versicherungsmedizin, vol. 49, 1997, p. 86 ss.
- ^ J. Ahn, Prediagnostic total and high-density lipoprotein cholesterol and risk of cancer, in Cancer Epidemiol. Biomarkers Prev., vol. 18, 2009, pp. 2814-2821.
- ^ A.M. Tonkin, The evidence on trial: cholesterol lowering and cance, in Heart Asia, vol. 1, 2009, pp. :6-10.
- ^ U. Ravnskov, Lack of an association or an inverse association between low-density-lipoprotein cholesterol and mortality in the elderly: a systematic review, in BMJ, e010401, 2016.
- ^ Y. Takata, Serum total cholesterol concentration and 10-year mortality in an 85-year-old population, in Clin Interv Aging, vol. 9, 2014, pp. 293-300.
- ^ J.M. Bae, Low cholesterol is associated with mortality from cardiovascular diseases: a dynamic cohort study in Korean adults, in J. Korean Med. Sci., vol. 27, 2012, pp. 58-63.
- ^ H. Petursson, Is the use of cholesterol in mortality risk algorithms in clinical guidelines valid? Ten years prospective data from the Norwegian HUNT 2 study, in J. Eval. Clin. Pract., vol. 18, 2012, pp. 159-168.
- ^ H. Soran, Evidence-based goals in LDL-C reduction, in Clin. Res. Cardiol.., vol. 106, 2017, pp. 237–248.
- ^ Heart Protection Study Collaborative Group, Effects on 11-year mortality and morbidity of lowering LDL cholesterol with simvastatin for about 5 years in 20,536 high-risk individuals: a randomised controlled trial, in Lancet, vol. 378, 2011, pp. 2013-2020.
- ^ K.R. Solomon, The complex interplay between cholesterol and prostate malignancy, in Urol. Clin. North. Am., vol. 38, 2011, pp. 243-259.
- ^ L'articolo è stato pubblicato nel Lancet, una delle più rinomate riviste scientifiche in campo medico.
(EN) J. McCormick, P. Skrabanek, Coronary heart disease is not preventable by population interventions, in The Lancet, II, 1988, pp. 839 ss.. - ^ (EN) Ancel B. Keys, Seven countries: a multivariate analysis of death and coronary heart disease., Cambridge, Harvard University Press, 1980.
Bibliografia
- (IT) Enzo Ferroni. Enciclopedia della chimica. Volume 3. Firenze, USES, 1974. ISBN 88-03-00066-6.
- (EN) B. Caballero. Encyclopedia of human nutrition. Elsevier-Academic Press, 2005. 2ed. ISBN 0-12-150110-8.
- (EN) Pollmer U., Warmuth S., Lexikon der populären Ernährungsirrtümer, Weltbild, 2003, ISBN 3-8289-1930-8.
- (EN) E. Vartiainen et al., Twenty-year trends in coronary risk factors in North Karelia and in other areas of Finland, in International Journal of Epidemiology, n. 23, 1994, p. 495.
- (DE) M. Kohlmeier et al., Verbreitung von klinisch-chemischen Risikofaktoren, Niederkleen, VERA-Schriftenreihe Band VII, 1993.
- (EN) Jacobs et al., Report of of the conference of low blood cholesterol. Mortality associations., in Circulation, n. 86, 1992, p. 1046.
- (DE) Willibald Pschyrembel, Pschyrembel: Klinisches Wörterbuch, Berlino, Walter de Gruyter GmbH & Co., 2004, ISBN 3-11-017621-1.
Voci correlate
- 24-idrossicolesterolo 7alfa-idrossilasi
- 25-idrossicolesterolo 7alfa-idrossilasi
- 27-idrossicolesterolo 7alfa-monoossigenasi
- Alirocumab
- Acido pantotenico
- Aterosclerosi
- Colelitiasi
- Colesterolo monoossigenasi (taglia la catena laterale)
- Colesterolo 7alfa-monoossigenasi
- Colesterolo ossidasi
- Colesterolo 25-idrossilasi
- Colesterolo 24-idrossilasi
- Determinazione del colesterolo
- Evolocumab
- Ezetimibe
- Ipercolesterolemia
- Infarto del miocardio
- Metabolismo dei lipidi
- Niacina
- Statine
- Steroli
Altri progetti
 Wikiquote contiene citazioni sul colesterolo
Wikiquote contiene citazioni sul colesterolo Wikizionario contiene il lemma di dizionario «colesterolo»
Wikizionario contiene il lemma di dizionario «colesterolo» Wikimedia Commons contiene immagini o altri file sul colesterolo
Wikimedia Commons contiene immagini o altri file sul colesterolo
Collegamenti esterni
- Template:Thesaurus BNCF
- (EN) Medical Crossfire - Lipid/Metabolic, su theheart.org. URL consultato il 25 novembre 2008.
- (EN) Medical Crossfire - Hot Topics in Hypercholesterolemia: Impact of Recent Clinical Trial Data on Clinical Practice, su theheart.org. URL consultato il 25 novembre 2008.
- (EN) Effetto dell'androstenedione sull'HDL (PDF), su crnusa.org, gennaio 2002, 40. URL consultato il 25 novembre 2008.
| Controllo di autorità | Thesaurus BNCF 20899 · LCCN (EN) sh85024654 · GND (DE) 4010034-0 · BNF (FR) cb11931193t (data) · J9U (EN, HE) 987007285757605171 · NDL (EN, JA) 00566626 |
|---|