Endometriosi: differenze tra le versioni
Nessun oggetto della modifica |
→Terapia ormonale: integro con traduziione da en.wiki |
||
| Riga 179: | Riga 179: | ||
[[File:Testosteron.svg|thumb|left|[[Formula chimica]] di una [[molecola]] di [[testosterone]], un [[estrogeno]]]] |
[[File:Testosteron.svg|thumb|left|[[Formula chimica]] di una [[molecola]] di [[testosterone]], un [[estrogeno]]]] |
||
L'assunzione della [[pillola anticoncezionale]] a scopo terapeutico è in grado di ridurre il dolore mestruale associato all'endometriosi, riducendo eliminando il flusso.<ref>{{cite journal | vauthors = Zorbas KA, Economopoulos KP, Vlahos NF | title = Continuous versus cyclic oral contraceptives for the treatment of endometriosis: a systematic review | journal = Archives of Gynecology and Obstetrics | volume = 292 | issue = 1 | pages = 37–43 | date = July 2015 | pmid = 25644508 | doi = 10.1007/s00404-015-3641-1 }}</ref> Una combinazione di di estroprogestinici ([[estrogeno]] e [[progestinico]]) (pillola anticoncezionale, anello vaginale, spirale al progesterone, progesterone I.M. depot), è il trattamento di prima linea per la maggior parte delle donne con endometriosi per via del fatto che è utilizzabile per lunghi periodi di tempo, è relativamente economico, vanta una facilità d'uso e comporta l'ulteriore vantaggio della riduzione del rischio di sviluppare un [[tumore all'ovaio]] o [[tumore dell'edometrio|dell'endometrio]].<ref>{{Cite web|url=https://www.uptodate.com/contents/endometriosis-treatment-of-pelvic-pain?search=endometriosis&selectedTitle=2~150&usage_type=default&display_rank=2#H6|title=Endometriosis: Treatment of pelvic pain|website=www.uptodate.com|access-date=2017-12-18}}</ref> Tuttavia possono comportare effetti indesiderati come: [[nausea]], [[cefalea]], secchezza vaginale, calo del desiderio. Assumere [[progesterone]] contrasta l'azione dell'estrogeno e conseguentemente inibisce la crescita dell'endometrio.<ref name="PatelElguero2014">{{cite journal | vauthors = Patel B, Elguero S, Thakore S, Dahoud W, Bedaiwy M, Mesiano S | title = Role of nuclear progesterone receptor isoforms in uterine pathophysiology | journal = Human Reproduction Update | volume = 21 | issue = 2 | pages = 155–73 | year = 2014 | pmid = 25406186 | pmc = 4366574 | doi = 10.1093/humupd/dmu056 }}</ref> Tale terapia può ridurre o eliminare le mestruazioni in modo controllato e reversibile. I progestinici sono varianti chimiche del progesterone naturale; un esempio è il [[dienogest]] (Visanne). Sebbenei progestinici vengono spesso somministrati come parte di una terapia ormonale combinata con l'aggiunta di estrogeni, il trattamento con solo progestinico può essere comunque un'alternativa accettabile. |
|||
A seconda dei casi, dell'età della donna, del grado di dolore, del desiderio di maternità e della gravità delle lesioni si procede in diversi modi: |
|||
Il [[danazolo]] e il più moderno [[gestrinone]] sono [[steroidi]] soppressivi con una certa attività [[androgeno|androgenica]].<ref name="AFFDiagnosisandTreat"/> Entrambi sono in grado di inibire la crescita dell'endometriosi, tuttavia il loro uso rimane limitato in quanto possono causare [[effetti collaterali]] come [[irsutismo]], [[virilizzazione]], [[acne]], [[seborrea]], capelli e pelle untuosa e aumento di peso.<ref name="pmid17099804">{{cite journal |vauthors=O'Callaghan D |title=Endometriosis--an update |journal=Aust Fam Physician |volume=35 |issue=11 |pages=864–7 |date=November 2006 |pmid=17099804 |doi= |url=http://www.racgp.org.au/afp/200611/12796}}</ref> |
|||
* riduzione della presenza degli [[estrogeni]] in modo da frenare lo sviluppo dell'endometriosi provocando, quindi, una [[menopausa]] artificiale tramite gli antagonisti del [[Ormone di rilascio delle gonadotropine|GnRH]] i quali simulano una menopausa artificiale e temporanea. Gli eventuali effetti collaterali sono i classici effetti della menopausa: vampate di calore, aumento di peso, sudorazione notturna, irritabilità, perdita di [[Calcio (metallo)|calcio]]. Non vanno somministrati più a lungo di 3-6 mesi. |
|||
* estroprogestinici combinati (pillola anticoncezionale, anello vaginale, spirale al progesterone, progesterone I.M. depot) i quali possono dare come effetti indesiderati: nausea, cefalea, secchezza vaginale, calo del desiderio. |
|||
Si ritiene che i modulatori dell'[[ormone di rilascio della gonadotropina]] (GnRH), che comprendono gli [[agonisti del GnRH]] come la [[leuprorelina]] e gli [[antagonisti del GnRH]] come l'[[elagolix]], possano essere in grado di diminuire i livelli di estrogeni.<ref name="brown2010" /> Una revisione della ''Cochrane'' del 2010 ha rilevato che i modulatori del GnRH erano più efficaci per il sollievo dal dolore nell'endometriosi rispetto a non intraprendere alcun trattamento o al [[placebo]], ma non erano più efficaci del danazolo o del progestinico intrauterino e avevano più effetti collaterali del danazolo.<ref name="brown2010">{{cite journal | vauthors = Brown J, Pan A, Hart RJ | title = Gonadotrophin-releasing hormone analogues for pain associated with endometriosis | journal = The Cochrane Database of Systematic Reviews | issue = 12 | pages = CD008475 | date = December 2010 | pmid = 21154398 | doi = 10.1002/14651858.CD008475.pub2 }}</ref> Una revisione sistematica svedese del 2018 ha rilevato che i modulatori del GnRH abbiano effetti [[analgesia|analgesici]] simili a quelli del [[gestageno]] ma che comportavano una diminuzione della densità [[osso|ossea]].<ref name=":0" /> |
|||
* terapia con [[androgeni]], per la capacità di antagonizzare l'azione degli estrogeni e del [[progesterone]]. Gli androgeni usati sono: il [[gestrinone]] e il più datato [[danazolo]], questi farmaci sono gravati da effetti collaterali simili, meno intensi per il gestinone<ref name="O'Callaghan">{{en}} David O'Callaghan Endometriosis: An update. Aust Fam Physician. 2006 Nov; 35(11): 864-7. PMID 17099804</ref>, tipici dell'effetto androgenico: [[irsutismo]], virilizzazione, [[acne]], [[seborrea]], capelli e pelle untuosa e aumento di peso. |
|||
*Trattamento con [[Dienogest]] |
|||
==== Altri farmaci ==== |
==== Altri farmaci ==== |
||
Versione delle 11:50, 21 mar 2019
| Endometriosi | |
|---|---|
 | |
| Specialità | ginecologia |
| Classificazione e risorse esterne (EN) | |
| OMIM | 131200 |
| MeSH | D004715 |
| MedlinePlus | 000915 |
| eMedicine | 271899 e 795771 |
L'endometriosi (da endo, dentro e metra, utero) è una malattia cronica e complessa, originata dalla presenza anomala di endometrio (il tessuto che riveste la parete interna dell'utero) in organi diversi dall'utero, principalmente ovaie, tube, peritoneo, vagina, intestino.[1][2]
Le aree interessate dell'endometriosi sanguinano ogni mese provocando infiammazione, cicatrici e aderenze.[3][4] I sintomi principali sono dolore pelvico e infertilità.[3] Quasi la metà delle donne colpite accusa un dolore pelvico cronico, mentre nel 70% questo si verifica solo durante le mestruazioni.[3] È comune anche un dolore nel corso di rapporti sessuali.[3] L'infertilità si ha in più della metà delle donne colpite.[3] Sintomi meno frequenti includono i sintomi urinari o intestinali.[3] Circa il 25% delle donne è asintomatica.[3] L'endometriosi può avere effetti sia sociali che psicologici.[5]
La causa non è del tutto chiara[3] ma tra i fattori di rischio vi è una storia familiare della condizione.[4] La diagnosi viene solitamente formulata sulla base di sintomi in combinazione con l'imaging biomedico,[4] tuttavia, il ricorso alla biopsia è il metodo di diagnosi più sicuro.[4] La diagnosi differenziale va fatta con le altre condizioni che causano sintomi simili, soprattutto la malattia infiammatoria pelvica, la sindrome dell'intestino irritabile, la cistite interstiziale e la fibromialgia.[3]
Prove sperimentali suggeriscono che l'uso di contraccettivi orali riduce il rischio di incorrere nell'endometriosi, come compiere un regolare esercizio fisico ed evitare l'assunzione di ingenti quantità di bevande alcoliche.[4] Non esiste una cura per l'endometriosi, ma alcuni trattamenti possono migliorare i sintomi.[3] Questi possono comprendere alcuni farmaci antidolorifici (preferibilmente appartenenti alla famiglia dei FANS), trattamenti ormonali o il ricorso al intervento chirurgico.[4] Può anche essere utile prendere il componente attivo della pillola anticoncezionale o utilizzare un dispositivo intrauterino con progestinico.[4] L'agonista dell'ormone di rilascio delle gonadotropine può migliorare la probabilità di concepire nelle donne con difficoltà.[4] La rimozione chirurgica dell'endometriosi può essere utilizzata per trattare i casi i cui sintomi non sono gestibili con altri trattamenti.[4]
Secondo un'ampia indagine epidemiologica del 2015, 10,8 milioni di donne sono state colpite da tale condizione.[6] Altre fonti stimano che circa il 6-10% delle donne sono interessate.[3] L'endometriosi è più comune tra le trentenni e le quarantenni; tuttavia, può iniziare anche nelle ragazze intorno agli otto anni.[4][7] Pochi casi portano al decesso.[8]
Negli anni 1920, l'endometriosi venne descritta per la prima volta come una condizione a se stante.[9] Prima di allora, l'endometriosi e l'adenomiosi erano considerate la stessa malattia.[9] Non è chiaro chi abbia descritto per primo la condizione, tuttavia la prima identificazione al microscopio si deve a Karl von Rokitansky nel 1860.[9]
Storia

L'endometriosi venne scoperta per la prima volta al microscopio da Karl von Rokitansky nel 1860,[10] sebbene fosse una condizione documentata in testi medici risalenti a più di 4000 anni fa.[11]
Il Corpus Hippocraticum descrive alcuni sintomi simili a quelli riscontrabili nell'endometriosi, tra cui ulcerazioni uterine, aderenze e infertilità. I medici ippocratici ritenevano che ritardare la gravidanza avrebbe potuto scatenare le malattie dell'utero responsabili di questi sintomi. Le donne con dismenorrea venivano incoraggiate a sposarsi e avere figli in giovane età. Il fatto che gli ippocratici raccomandassero cambiamenti nelle pratiche matrimoniali a causa di una malattia simile all'endometriosi implica che questa malattia era probabilmente comune, con tassi superiori alla prevalenza del 5-15% spesso citata oggi.
Storicamente, le donne con i sintomi di endometriosi sintomi venivano curate con l'applicazione di sanguisughe, camicie di forza, salassi, mutilazioni genitali, gravidanza (come forma di trattamento), venivano appese a testa in giù, sottoposte ad intervento chirurgico e persino uccise per via di un presunto possesso demoniaco.[11] Anche se 2500 anni fa i medici ippocratici riconobbero e trattarono il dolore pelvico cronico come una vera malattia organica, nel corso del medioevo si tornò a ritenere che le donne che accusassero tale dolore fossero pazze, immorali, che si immaginavano il dolore o che semplicemente si comportavano male.[11] I sintomi del dolore pelvico cronico inspiegabile erano spesso attribuiti ad una follia immaginaria, alla debolezza femminile, alla promiscuità o all'isteria. La diagnosi storica dell'isteria, che si pensava fosse una malattia psicologica, poteva essere in effetti un caso di endometriosi. L'idea che il dolore pelvico cronico fosse correlato ad una malattia mentale influenzò l'atteggiamento moderno nei confronti delle donne affette da tale condizione, causando ritardi nella corretta diagnosi e indifferenza nei confronti del dolore vero per le pazienti vissute durante il XX secolo.[11]
Se davvero questo disturbo fu storicamente così comune, si potrebbero così dimostrare le teorie moderne che suggeriscono una correlazione tra l'endometriosi e le diossine o i policlorobifenili.[11]
Epidemiologia
Non è facile determinare dati epidemiologici precisi riguardo all'endometriosi. Sembra che la sempre maggiore disponibilità della video-laparoscopia per l'indagine pelvica abbia comportato un sensibile aumento delle diagnosi, specie per i casi relativi a lesioni minime o lievi.[12] Si stima che, nel 2015, vi fossero in tutto il mondo 10,8 milioni di donne colpite dall'endometriosi.[6] Altre fonti stimano che circa il 6-10% delle donne fossero interessate dalla condizione.[3] Si ritiene che possa colpire oltre l'11% delle donne statunitensi tra i 15 e i 44 anni.[4] L'endometriosi risulta più comune tra le trentenni e le quarantenni; tuttavia, può riscontrarsi nelle ragazze già dagli 8 anni.[4][7] Si stima che in Italia le donne con affette da endometriosi siano circa 3 milioni.[13] In passato si è ipotizzato che la condizione affliggesse maggiormente le donne benestanti appartenenti ad un contesto di elevato livello socio culturale, tuttavia è più probabile che ciò sia dovuto al fatto che tali donne siano tendenzialmente più attente al loro stato di salute e quindi con maggior probabilità di vedersi diagnosticata una endometriosi relativamente lieve.[12]
In ogni caso, può interessare qualsiasi donna, di età che va dal pre menarca alla post menopausa, indipendentemente dalla razza o dall'etnia o dal fatto che abbiano o meno avuto figli. È principalmente una malattia che si riscontra negli anni riproduttivi.[14] Casi di endometriosi si sono verificate nelle donne in postmenopausa,[15] e raramente, le ragazze possono avere sintomi di endometriosi prima ancora che raggiungano il menarca.[16][17] Si ritiene che dal 30% al 40% dei casi di infertilità femminile sia dovuto a endometriosi. Tra i fattori di rischio vi è da annoverare una parentela di primo grado con una donna affetta dalla condizione e un basso indice di massa corporea.[18] Le donne con un cicli mestruali corti, regolari, con flussi abbondanti e prolungati hanno una probabilità maggiore di sviluppare endometriosi. Non aver mai partorito o aver sperimentato lunghi periodi senza sviluppare una gravidanza, sono situazioni che sono state correlate positivamente con la condizione.[12]
Si stima che il tasso di recidiva dell'endometriosi possa attestarsi, negli adulti, tra il 40% e il 50% su un periodo di 5 anni.[19] È stato dimostrato che tale dato aumenti col passare del tempo dall'intervento chirurgico, ma non è correlato allo stadio della malattia, al sito iniziale, al metodo chirurgico utilizzato o al trattamento post-chirurgico.[19] Sono stati effettuati diversi studi per valutare una possibile correlazione tra l'utilizzo di metodi contraccettivi e lo sviluppo della malattia, tuttavia le molte distorsioni statistiche, tra cui il fatto che spesso vengono prescritti proprio per trattare i sintomi della malattia come la dismenorrea, hanno reso i risultati inconcludenti.[20]
Eziologia
Le teorie circa la causa dell'endometriosi sono diverse, senza necessità che si escludano a vicenda.
Una prima ipotesi potrebbe essere quella metastatica, ovvero la diffusione di isole endometriali (sotto forma di microscopici frustuli di endometrio) per via linfatica o ematica. Tale ipotesi ha il vantaggio di spiegare le pur rare localizzazioni a distanza. Strettamente connessa a tale teoria è l'ipotesi della mestruazione retrograda: secondo questa teoria, durante la mestruazione, piccole parti di tessuto endometriale si muoverebbero in senso inverso nelle tube per poi impiantarsi nell'addome o comunque al di fuori della cavità uterina. Secondo alcuni esperti, la mestruazione retrograda sarebbe moderatamente presente in tutte le donne, ma soltanto in alcune di esse, per difetti immunitari, ormonali o per cause legate all'ambiente, il tessuto endometriale riuscirebbe a crescere e a radicarsi. Fra queste ultime, potrebbero esserci sostanze interferenti endocrine quali i PCB e il bisfenolo A.[21][22], oppure lo stress e il troppo affaticamento fisico.
Un'altra teoria propone il viraggio metaplasico dei tessuti celomatici.
Segni e sintomi
Nell'endometriosi, l'infertilità e il dolore sono due manifestazioni molto frequenti, anche se tra il 20% e i 25% delle donne colpite risultano asintomatiche indipendentemente dall'estensione del tessuto endometriale ectopico.[23][3] Circa un terzo delle donne infertili è colpita dall'endometriosi e tra le donne con endometriosi circa il 40% sono sterili.[3]
La sensazione di dolore, che si manifesta nel 60% circa dei casi, presenta tratti assai caratteristici. Può variare da lieve a molto grave, con crampi o dolori lancinanti localizzati su entrambi i lati del bacino, nella zona lombare e rettale, con irradiazione fino anche nelle gambe. Non vi è una correlazione tra il livello di dolore e lo stadio o estensione dell'endometriosi, con alcune donne che sperimentano dolore lieve in condizioni di malattia grave e viceversa donne con sintomatologia dolorosa importante a fronte di una endometriosi di lieve entità.[24] La sintomatologia, infatti, viene influenzata dalla sede e dalla profondità degli impianti endometriali ectopici e non dallo stadio della malattia.[25] Tipicamente, il dolore più intenso si riscontra nel corso delle mestruazioni, iniziando anche una settimana prima del ciclo mestruale e permanendo fino ad una settimana dopo; in certi casi, tuttavia, è costante. Sebbene possa essere frequente che le donne accusino crampi durante le mestruazioni, i soggetti con endometriosi descrivono il dolore come molto più grave del solito, tanto che in alcuni casi può arrivare ad essere debilitante e a comportare uno stress emotivo.[26][27]
Il dolore può essere accompagnato da altri sintomi come: dismenorrea secondaria (crampi dolorosi durante il periodo mestruale), dispareunia (dolore durante il rapporto sessuale) soprattutto nelle donne con una profonda infiltrazione di endometrio ectopico dei legamenti utero-sacrali, disuria (urgenza urinaria e occasionalmente svuotamento doloroso della vescica),[28] mittelschmerz (dolore associato all'ovulazione),[23][29] dolore durante l'attività fisica.[28]
Altri sintomi
Altri sintomi che possono manifestarsi, singolarmente o in concomitanza, includono diarrea o stitichezza, spesso con dischezia,[25][28] affaticamento cronico,[28] nausea e vomito, cefalea, irregolarità nel ciclo mestruale, menorragia (mestruazione abbondante), metrorragia (perdita di sangue al di fuori della mestruazione) e ipoglicemia.[23][30][31]
Talvolta l'endometriosi è riscontrabile anche in sede intestinale e vescicale, sui legamenti utero-sacrali, nel setto retto vaginale, nelle tube. Nel caso di endometriosi vescicale, i sintomi sono quelli tipici di infiammazione e cistite o anche di incontinenza senza che risultino infezioni batteriche o virali a carico della vescica. La loro ricorrenza ciclica è un elemento determinante per distinguerne le cause. Sintomi più rari che si presentano in modo "catameniale" (cioè, in corrispondenza delle mestruazioni) includono epistassi (quando vi è un coinvolgimento polmonare), ematuria, ematochezia e sanguinamenti dall'ombelico. Ancora più raramente vi possono essere degli impianti endometriosici nel cervello che possono causare convulsioni in occasione delle mestruazioni.[25] Talvolta lesioni o aderenze possono portare ad una occlusione intestinale parziale o completa.[25]
Un caso particolare può essere rappresentato dalla presenza di tessuto ectopico al livello polmonare e pleurico. In questo caso, l'endometriosi può essere causa di emottisi e pneumotorace catameniale, dovuto al danno causato alla pleura viscerale dal tessuto endometriosico e dall'occlusione bronchiale a cui esso può dare origine: l'occlusione bronchiale da tessuto ectopico determina l'aumento della pressione alveolare nei distretti a valle ed eventualmente la formazione di bolle, con rischio di rottura e pneumotorace.
Esiste una correlazione tra endometriosi e alcuni tipi di tumore, in particolare alcuni tipi di carcinoma dell'ovaio,[32][33] linfoma non Hodgkin e tumore al cervello.[34] L'endometriosi non è correlata al tumore dell'endometrio.[35]
Patogenesi del dolore
Spesso è difficile determinare una singola causa del dolore pelvico conseguente all'endometriosi; è più probabile che esso sia da attribuire a diversi fattori che coinvolgono sia meccanismi locali neuroendocrini, sia cause meccaniche, sia l'elaborazione del dolore da parte del sistema nervoso centrale.[36] Tra le varie cause proposte vi è la possibilità che le lesioni, reagendo alla stimolazione ormonale, possano "sanguinare" al momento delle mestruazioni. Il sangue, se non viene eliminato velocemente, si accumula localmente provocando gonfiore. Questo innesca una risposta infiammatoria con attivazione di citochine, che si traduce in dolore. Un'ulteriore origine del dolore è la dislocazione d'organo che deriva dalla formazione di aderenze che legano insieme gli organi interni, come le ovaie, l'utero, il peritoneo, la vescica. Il dolore innescato in questo modo può durare costantemente, non solo durante i periodi mestruali.[37] Altre possibili cause individuate sono l'azione meccanica del tessuto endometrialie, le anomalie nella sintesi dei neuropeptidi dedicati alla modulazione del dolore e alcuni disturbi emotivi.[23] E' stato, inoltre, dimostrato che le lesioni endometriosiche possano sviluppare una propria innervazione, creando un'interazione diretta e bidirezionale tra le lesioni e il sistema nervoso centrale che comporta una percezione del dolore differente da donna a donna.[24] Si ritiene che le fibre nervose e i vasi sanguigni si formino mediante un processo noto come neuroangiogenesi.[38]
Patogenesi dell'infertilità
La patogenesi della sterilità dipende dallo stadio della malattia.[23] Nei casi lievi e moderati, si ipotizza che ciò sia secondario a una risposta infiammatoria che altera diversi aspetti legati al concepimento. Alcuni studi hanno suggerito che la presenza di tessuto endometriale fuori sede provochi una produzione eccessiva di prostaglandina F2α all'interno del peritoneo che a sua volta causa una alterazione della motilità tubarica, mancata ovulazione e distruzione del corpo luteo. Anche la presenza nel liquido peritoneale di molti macrofagi attivati è stata correlata con l'infertilità. E' stato infatti suggerito che essi potrebbero essere responsabili della fagocitosi degli spermatozoi oltre che della sintesi di fattori di crescita e Interleuchina 1 che innescherebbero una reazione immunitaria a cascata che comporterebbe il richiamo di fibroblasti, con conseguente instaurarsi di aderenze che renderebbero l'ambiente non idoneo per la fecondazione dell'ovocita.[23][39] Le forme più gravi comportano la distorsione dell'anatomia pelvica ed in particolare alterazioni dei rapporti anatomici delle tube di Falloppio, nonché la presenza di estese aderenze localizzate nelle pelvi che contribuiscono a compromettere la capacità di concepimento.[23][39]
Diagnosi
Vi sono molte metodiche utilizzabili per la formulazione di una diagnosi di endometriosi, sia invasive che non. Il punto di partenza, solitamente, è una anamnesi completa seguita da un accurato esame obiettivo ginecologico e rettale in cui ricercare reperti tipici. L'esame del sangue può essere utile per identificare specifici biomarcatori. Tra le tecniche di imaging biomedico, una radiografia (con o senza mezzo di contrasto al bario) e la tomografia computerizzata (TC) non si sono dimostrate utili poiché non sufficientemente sensibili, tuttavia possono essere utilizzate per lo studio di alcune complicanze. La risonanza magnetica può dare ottimi risultati nell'individuare le lesioni più profonde mentre l'ecografia permette di rilevare gli impianti più piccoli e constatare una retroversione uterina fissa conseguente ad aderenze che vincolano l'utero alla pelvi.[36][40]
Talvolta è necessaria l'esecuzione di una indagine esplorativa tramite video laparoscopia, una procedura che permette di formulare una diagnosi certa ma che consta in un intervento invasivo da effettuarsi in anestesia generale. Oltre che per la diagnosi, questo esame è importante anche per determinare la stadiazione della malattia e per trattarla terapeuticamente (asportazione del tessuto, vacuolizzazione e lisi delle aderenze) ripristinando la normale anatomia della pelvi femminili. L'esame istologico dopo biopsia tissutale è in grado confermare la diagnosi.[40]
Esame obiettivo

Molto spesso le pazienti con endometriosi non presentano alcun riscontro fisico correlabile alla condizione.[41] Tuttavia, un esame obiettivo ginecologico approfondito può essere utile per riscontrare reperti che suggeriscono la presenza di endometriosi, anche se ciò non è sufficiente per formulare una diagnosi.[41] Nel corso della visita deve essere esaminato accuratamente, tramite l'utilizzo dello speculum, il fornice vaginale posteriore e la zona rerocervicale, in cui in caso di malattia si possono riscontrare masse nodulari tenere infiltranti la tonaca muscolare e, occasionalmente, noduli bluastri e creste di colore rosso.[41][36]
Dovrebbe essere, inoltre, effettuato un completo esame pelvico in modalità vagino-rettale combinata, con cui valutare la zona retto-vaginale, la parete rettale anteriore, il cavo del Douglas e le gonadi. Qui si possono apprezzare, alla palpazione, noduli infiltrativi che non visibili all'ecografia che appaiono anelastici, nodulari e dolenti.[36] La presenza di una retroversione uterina fissa insieme ad una obliterazione del cavo del Douglas può far supporre la presenza di una endometriosi molto estesa.[41] E' consigliabile procedere con l'esame obiettivo nel corso delle mestruazioni, affinché possa essere maggiormente sensibile. Un addome acuto può essere riscontrato nel caso di rottura di un endometrioma ovarico.[41]
Biomarcatori
Al 2010, tutti i biomarcatori proposti per la diagnosi dell'endometriosi non presentavano un uso clinico sufficientemente chiaro, anche se alcuni sembravano essere promettenti.[42] L'unico biomarcatore utilizzato costantemente a partire dagli anni 1990 è il CA-125.[42] Una revisione del 2016 ha rilevato che nelle donne che presentano sintomi di endometriosi e a cui è stato escluso un tumore dell'ovaio, un CA-125 positivo possa essere un dato in grado di confermare la diagnosi.[43] Tuttavia, la sua affidabilità per l'esclusione dell'endometriosi è bassa.[43] I livelli di CA-125 sembrano diminuire durante il trattamento della condizione, ma non hanno mostrato una correlazione con la risposta della malattia alle cure.[42]
Un'altra revisione nel 2011 ha identificato sulla biopsia diversi biomarcatori possibili, compresi i reperti di piccole fibre nervose sensoriali o la subunità dell'integrina β3 espressa in modo errato.[44] È stato ipotizzato che, in futuro, uno strumento diagnostico per l'endometriosi possa consistere in un gruppo di diversi biomarcatori specifici e sensibili, comprese le concentrazioni di sostanze e la predisposizione genetica.[42]
Ecografia

L'ecografia pelvica è in grado di identificare grandi cisti endometriosiche (chiamate endometriomi), tuttavia quelle di dimensioni più piccole possono essere difficili da osservare.
L'ecografia vaginale ha un valore clinico nella diagnosi di endometrioma e viene eseguita anche prima di un intervento chirurgico per l'endometriosi profonda.[45] Ciò per consentire l'identificazione della diffusione della malattia nelle donne con sospetto clinico accertato di endometriosi.[45] L'ecografia vaginale è una metodica economica, facilmente accessibile, non presenta controindicazioni e non richiede alcuna preparazione.[45] In ogni caso, i professionisti sanitari che effettuano gli esami mediante ultrasuoni devono aver maturato una certa esperienza.[45] Estendendo la valutazione dell'esame ecografico alle zone pelviche posteriore e anteriore, chi esegue l'esame è in grado di valutare la mobilità strutturale e cercare i noduli endometriosici infiltranti profondi, rilevando la dimensione, la posizione e, se possibile, la distanza dall'ano.[46] Un miglioramento nel rilevamento ecografico dell'endometriosi infiltrante profonda non solo ridurrà il numero di laparoscopie diagnostiche, ma sarà in grado di guidare verso i più corretti trattamenti e consentirà un apprezzabile miglioramento della qualità della vita.[46]
Risonanza magnetica
Il ricorso alla risonanza magnetica (RM) è un'altra metodica per rilevare lesioni in modo non invasivo.[47] Tuttavia il suo impiego non è diffusissimo a causa del suo costo elevato e della sua scarsa disponibilità, nonostante sia in grado di rilevare lesioni profonde e di piccole dimensioni.[47] La visibilità di innesti endometriosici alla RM dipende dalla concentrazione in essi di ferro e proteine, prodotti della degradazione degli eritrociti.[48][49] Nelle immagini ottenute, la maggior parte di questi innesti appare come delle grosse masse cistiche iperintense nelle sequenze pesate in T1 e ipointense in quelle in T2.[47] La risonanza magnetica è una metodica diagnostica che vanta una sensibilità del 90-92% e una specificità del 91-98% e pertanto risulta molto utile per distinguere gli innesti endometriosici da altre masse con maggior accuratezza rispetto all'ecografia.[48][49][50][47]
La risonanza magnetica fornisce scarsi risultati nella ricerca di impianti superficiali, come nel caso di impianti peritoneali, e quindi da sola non può essere sufficiente per escludere completamente la presenza della condizione. Talvolta possono riscontrarsi falsi positivi nelle neoplasie cistiche o nelle citi funzionali.[51] Occasionalmente, nelle pazienti con endometriosi, è possibile riscontrare una dilatazione delle tube di Falloppio che alla risonanza magnetica appare come un'intensità elevata di segnale nelle sequenze T1 dovuto alla presenza di fluido sanguinante.[52]
Essendo la risonanza magnetica una procedura di imaging biomedico molto lunga da eseguire ed estremamente sensibile ai movimenti del copro, spesso è necessario assumere dei farmaci antiperistaltici come preparazione all'esame al fine di ottenere immagini di sufficiente qualità.[47]
Video-laparoscopia

La video-laparoscopia, una procedura chirurgica in cui una fotocamera viene utilizzata per osservare l'interno della cavità addominale, è l'unico metodo per diagnosticare con sicurezza l'entità e la gravità dell'endometriosi.[47] Se le escrescenze (lesioni) non sono visibili, può essere eseguita una biopsia per formulare la diagnosi.[53] Oltre che per la diagnosi, l'intervento laparoscopico consente nello stesso momento anche il trattamento chirurgico.
Durante una procedura laparoscopica, le lesioni possono apparire blu scure, nere, rosse, bianche, gialle, marroni o non pigmentate. Le lesioni variano di dimensioni.[54] Alcune lesioni presenti all'interno delle pareti pelviche potrebbero non essere visibili, poiché il normale peritoneo delle donne infertili rivela l'endometriosi tramite biopsia nel 6-13% dei casi.[55] L'endometriosi precoce si verifica tipicamente sulle superfici degli organi nelle aree pelviche e intra-addominali.[54] Gli operatori sanitari possono chiamare le aree di endometriosi con nomi diversi, come protesi, lesioni o noduli. Ovaie più grandi possono essere viste all'interno delle ovaie come endometriomi o "cisti di cioccolato", perché contengono uno spesso liquido brunastro, per lo più sangue vecchio.[54]
Frequentemente, durante una procedura di laparoscopia diagnostica, non si riscontrano lesioni in donne con dolore pelvico cronico, un sintomo comune ad altri disturbi tra cui adenomiosi, aderenze pelviche, malattia infiammatoria pelvica, anomalie congenite del tratto riproduttivo e masse ovariche o tubariche.[56]
Istopatologia

Le tipiche lesioni endometriosiche mostrano caratteristiche istopatologiche simili all'endometrio, vale a dire la presenza di stroma endometriale, epitelio endometriale e ghiandole che rispondono agli stimoli ormonali; la presenza in contemporanea ciò è necessario per la diagnosi istologica. Le lesioni più vecchie potrebbero non mostrare ghiandole ma residui di emosiderina conseguente alla fagocitosi dei globuli rossi da parte dei fagociti e dalla degradazione dell'emoglobina successiva a sanguinamenti locali. Ad una analisi macroscopica si possono riscontrare diversi tipi di lesioni, come ridotti impianti peritoneali e la presenza di una sindrome della "pelvi congelata" simile ad un quadro neoplastico.[57]
Tra le cisti endometriosiche, quella "di cioccolato" è la più frequente che si possa riscontrare ed è caratterizzata da una parete formata da fibroblasti, da tessuto stromale da alcune zone di epitelio endometriale diffuse. Inoltre, in caso di rottura, vi sarà una fuoriuscita di liquido denso marroncino dall'interno ricco di globuli rossi degradati e macrofagi con elevati livelli di emosiderina, formatosi di conseguenza alle frequenti emorragie. Le grandi cisti (da alcuni millimentri a 10-12 centimetri) spesso sono accompagnate da consistenti aderenze.[57]
Il ricorso all'immunoistochimica è apparso utile nella formulazione della diagnosi di endometriosi in quanto le cellule stromali presentano un particolare antigene di superficie, il CD10, consentendo così al patologo di esaminare direttamente un'area di colorazione e quindi confermare la presenza di cellule stromali e talvolta di tessuto ghiandolare che possono non essere visti nella colorazione con ematossilina eosina di routine.[58]
Stadiazione

Al 2019, il metodo più utilizzato per la stadiazione dell'endometriosi è la classificazione proposta dall'American Society of Reproductive Medicine, nella versione rivista nel 1997.[59] Tale metodo è costituito da un complesso sistema di punteggi che valuta le lesioni e le aderenze negli organi pelvici. Si tratta di una classificazione chirurgica: le classi I e II riguardano lesioni superficiali; le classi III e IV sono considerate gravi, includendo endometriosi cistica e con aderenze. E' importante notare che la stadiazione valuta solo la malattia fisica, non il livello dei sintomi come il dolore o infertilità. Una persona con endometriosi allo stadio I può, dunque, presentare una malattia di tipo lieve ma un dolore severo, allo stesso tempo una condizione allo stadio IV può manifestarsi con una sintomatologia dolorosa lieve o totalmente assente. I parametri considerati per l'attribuzione del punteggio, tutti apprezzabili in seguito a video laparoscopia, sono il numero delle lesioni, la loro dimensione, la sede, l'eventuale obliterazione del cavo del Douglas, estensione e caratterizzazione dell'aderenza.[60]
In linea di principio i vari stadi si possono riassumere in questa tabella:[61][62][63]
| Stadio | Punteggio | Descrizione |
|---|---|---|
| Stadio I (minima, sottile) | 1-5 | Reperti limitati alle sole lesioni superficiali di 2-3 mm a forma vescicolare o di piccola fiamma e possibilmente alcune aderenze. Questa condizione, quando si presenta da sola, non è solitamente considerata una patologia ed è riscontrabile nell'80% delle donne. |
| Stadio II (lieve, tipica) | 6-15 | Si contraddistingue per la presenza di le lesioni superficiale nere, definite solitamente "powder burn" o "gun shot", con dimensioni variabili da 1 a 3 centimetri. Sono inoltre presenti alcune lesioni profonde nel cavo del Douglas |
| Stadio III (moderata, cistica) | 16-40 | Come nello stadio II, più la presenza di endometriomi sull'ovaio e maggiori aderenze solitamente di tipo cistico, conosciute come "cisti cioccolato, medialmente di 3-4 centimetri di diametro ma che possono svilupparsi fino a 15 centimetri. E' necessario l'intervento chirurgico in quanto la terapia farmacologica risulta inefficace |
| Stadio IV (severa, profonda) | > 40 | Come nello stadio III ma endometriomi appaiono più grandi (circa 5-6 centimetri) e solidi e le aderenze estese, localizzandosi soprattutto nel cavo del Douglas estendendosi anche agli organi pelvici contigui. Quando arrivano a coinvolgere lo spazio prevescicale e la vescica possono causare disuria (dolore nella minzione). |
La probabilità che vi sia la presenza di endometriosi sottile, tipica, cistica o profonda nelle donne che soffrono di infertilità o dolore pelvico è rispettivamente di circa l'80%, 50%, 25% e 3-4%.[64] Nonostante che la scala di stadiazione dell'endometriosi sia afflitta da una alta variabilità tra diverse osservazione e tra diversi osservatori, rendendola non del tutto efficace per la prognosi, può essere molto utile per valutare il follow up del paziente alle terapie.[65][66]
Quantificazione del dolore
La scala visuo-analogica del dolore (VAS) è la più comune scala utilizzata per la quantificazione del dolore correlato all'endometriosi. Per scopi di ricerca e per una misurazione del dolore più dettagliata nella pratica clinica, la VAS viene utilizzata per quantificare per ogni tipo di dolore tipico correlato all'endometriosi (dismenorrea, dispareunia profonda e dolore pelvico cronico non mestruale) insieme con le scale di impressione clinica globale e della qualità della vita.[67]
Diagnosi differenziale
Moto spesso l'endometriosi può essere scambiata con la dismenorrea primaria (dolore durante le mestruazione non conseguente ad altre cause). Tuttavia, un dolore che non risponde all'assunzione di farmaci antinfiammatori non steroidei o alla terapia contraccetiva orale deve far abbandonare la prima ipotesi. Vi anche altre diverse condizioni che devono essere considerate nella diagnosi differenziale di endometriosi. Tra queste: cisti ovariche, malformazioni uterine, adenomiosi, tumore del colon, carcinoma ovarico, appendicite, clamidia, infezione del tratto urinario, diverticolite, gravidanza extrauterina, gonorrea, torsione ovarica e malattia infiammatoria pelvica.[68]
Terapia
Nonostante, al 2019, non esista una cura per l'endometriosi, vi è la possibilità di intervenire concretamente sul dolore e sull'infertilità correlata alla condizione.[69] In molte donne, la menopausa (naturale o chirurgica) attenuerà il processo e i sintomi.[70] Nelle donne che si trovano negli anni riproduttivi, l'endometriosi viene semplicemente gestita con l'obiettivo di alleviare il dolore e limitare la progressione del processo, ripristinando o preservando la fertilità, ove sia necessario. Nelle donne più giovani, può essere tentato un intervento chirurgico al fine di rimuovere il tessuto endometriale e preservare le ovaie senza danneggiare il tessuto normale.[71]
In generale, la diagnosi di endometriosi viene confermata durante l'intervento chirurgico, momento in cui si può procedere con il trattamento con ablazione a radiofrequenza. L'opportunità di ulteriori azioni dipende dalle circostanze: ad una donna fertile può essere prescritto l'assunzione di farmaci ormonali in grado di sopprimere il ciclo mestruale naturale e per il trattamento del dolore, mentre per una donna infertile può essere indicato una terapia farmacologica o una fecondazione in vitro con trasferimento dell'embrione per essere aiutate a concepire. Per quanto riguarda la procedura chirurgica, l'ablazione dell'endometriosi (che consiste nel bruciare e vaporizzare le lesioni grazie all'utilizzo di un dispositivo elettrico) ha mostrato un alto tasso di recidiva a breve termine dopo la procedura. La procedura di asportazione (escissione e rimozione) delle lesioni è quella che ha mostrato la frequenza di recidive più bassa.[senza fonte]
Chirurgia

Il trattamento conservativo consiste nella escissione dell'endometrio, delle aderenze, della resezione degli endometriomi e del ripristino, almeno il più possibile, dell'anatomia pelvica normale.[72] La laparoscopia, oltre ad essere utilizzata per la diagnosi, può essere eseguita come intervento chirurgico "minimamente invasivo". Con tale procedura, vengono praticati 3 - 4 fori di piccole dimensioni sull'addome in cui vengono introdotti gli strumenti chirurgici, tra cui una piccola telecamera con cui si esplora la cavità addominale ricercando eventuali isole endometriosiche, cisti o noduli. Nel caso in cui fossero presenti lesioni ben visibili, si procede all'eliminazione delle stesse e al prelievo di materiale per la biopsia. La degenza in ospedale si riduce ad un massimo di 3 giorni, la ripresa è rapida e le cicatrici sono poco visibili. Le donne che si sono sottopste a laparoscopia hanno un rischio minore di sviluppare aderenze.[73]
La laparotomia è un intervento chirurgico che si pratica (nella maggior parte dei casi), con un'incisione orizzontale all'altezza del pube ed è più invasiva della laparoscopia, i tempi di degenza si allungano e la cicatrice è sicuramente più visibile rispetto alla laparoscopia. Viene effettuata se le lesioni e le aderenze sono particolarmente estese anche se, come tecnica chirurgica applicata all'endometriosi, viene usata sporadicamente per lasciare posto alla laparoscopia.
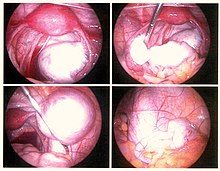
Dal 55% al 100% delle donne sviluppano aderenze dopo un intervento chirurgico pelvico[74] e ciò può causare infertilità, dolore cronico addominale e pelvico. La sospensione ovarica temporanea di Trehan, una tecnica in cui le ovaie vengono sospese per una settimana dopo l'intervento chirurgico, può essere utilizzata per ridurre l'incidenza delle aderenze dopo l'intervento chirurgico all'endometriosi.[75][76] Il trattamento conservativo prevede l'escissione dell'endometriosi preservando le ovaie e l'utero, una soluzione molto importante per le donne che desiderano concepire, tuttavia aumentando il rischio di recidiva.[77] La ricorrenza dell'endometriosi a seguito di chirurgia conservativa è stimata al 21,5% a 2 anni e al 40-50% a 5 anni.[78]
Un'isterectomia (rimozione dell'utero) può essere utilizzata per il trattamento dell'endometriosi nelle donne che non desiderano concepire. Tuttavia, questo dovrebbe essere fatto solo se combinato insieme con la rimozione dell'endometriosi mediante escissione. Se l'endometriosi non fosse rimossa anche al momento dell'isterectomia, il dolore potrebbe persistere.[79]
Per le donne con dolore estremo, una neurectomia presacrale può essere eseguita. Questa procedura consiste nel tagliare i nervi all'utero. Tuttavia, questa tecnica non viene quasi mai utilizzata a causa dell'elevata incidenza di complicanze associate, tra cui l'ematoma presacrale e problemi irreversibili con la minzione e la costipazione.[79]
Terapia farmacologica
Terapia ormonale
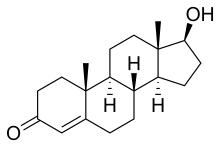
L'assunzione della pillola anticoncezionale a scopo terapeutico è in grado di ridurre il dolore mestruale associato all'endometriosi, riducendo eliminando il flusso.[80] Una combinazione di di estroprogestinici (estrogeno e progestinico) (pillola anticoncezionale, anello vaginale, spirale al progesterone, progesterone I.M. depot), è il trattamento di prima linea per la maggior parte delle donne con endometriosi per via del fatto che è utilizzabile per lunghi periodi di tempo, è relativamente economico, vanta una facilità d'uso e comporta l'ulteriore vantaggio della riduzione del rischio di sviluppare un tumore all'ovaio o dell'endometrio.[81] Tuttavia possono comportare effetti indesiderati come: nausea, cefalea, secchezza vaginale, calo del desiderio. Assumere progesterone contrasta l'azione dell'estrogeno e conseguentemente inibisce la crescita dell'endometrio.[82] Tale terapia può ridurre o eliminare le mestruazioni in modo controllato e reversibile. I progestinici sono varianti chimiche del progesterone naturale; un esempio è il dienogest (Visanne). Sebbenei progestinici vengono spesso somministrati come parte di una terapia ormonale combinata con l'aggiunta di estrogeni, il trattamento con solo progestinico può essere comunque un'alternativa accettabile.
Il danazolo e il più moderno gestrinone sono steroidi soppressivi con una certa attività androgenica.[71] Entrambi sono in grado di inibire la crescita dell'endometriosi, tuttavia il loro uso rimane limitato in quanto possono causare effetti collaterali come irsutismo, virilizzazione, acne, seborrea, capelli e pelle untuosa e aumento di peso.[83]
Si ritiene che i modulatori dell'ormone di rilascio della gonadotropina (GnRH), che comprendono gli agonisti del GnRH come la leuprorelina e gli antagonisti del GnRH come l'elagolix, possano essere in grado di diminuire i livelli di estrogeni.[84] Una revisione della Cochrane del 2010 ha rilevato che i modulatori del GnRH erano più efficaci per il sollievo dal dolore nell'endometriosi rispetto a non intraprendere alcun trattamento o al placebo, ma non erano più efficaci del danazolo o del progestinico intrauterino e avevano più effetti collaterali del danazolo.[84] Una revisione sistematica svedese del 2018 ha rilevato che i modulatori del GnRH abbiano effetti analgesici simili a quelli del gestageno ma che comportavano una diminuzione della densità ossea.[45]
Altri farmaci

Il dolore è uno dei sintomi più comuni ed invalidanti dell'endometriosi. Vi sono diversi trattamenti farmacologici in grado di intervenire positivamente su questo aspetto. I farmaci antinfiammatori non steroidei (FANS) vengono comunemente utilizzati in combinazione con altre terapie. Per i casi più gravi si può ricorrere a quelli per cui è necessaria la prescrizione medica. I FANS iniettabili possono essere utili per gestire il dolore grave o se il dolore allo stomaco impedisce quelli assunti per via orale. Esempi di FANS includono l'ibuprofene e il naprossene. Gli oppioidi, come le compresse di solfato morfina e altri antidolorifici oppiacei, agiscono mimando l'azione delle endorfine, sostanze chimiche che riducono il dolore naturalmente. Sono disponibili diverse tipologie, sia a lunga durata d'azione che a breve e che possono essere usati da soli o in combinazione per fornire un adeguato controllo del dolore.
La pentossifillina, un agente immunomodulante, è stata proposta per alleviare il dolore e aumentare i tassi di gravidanza nelle donne con endometriosi. Tuttavia, una revisione della Cochrane Collaboration del 2012 ha rilevato che non vi erano prove sufficienti a sostegno dell'efficacia o della sicurezza per uno di questi usi.[85] Le attuali linee guida del American Congress of Obstetricians and Gynecologists (ACOG) non includono questa tipologia di farmaci nei protocolli di trattamento standard.[86]
Anche gli inibitori dell'angiogenesi mancano di una valida evidenza clinica di efficacia nella terapia dell'endometriosi.[87] In condizioni sperimentali in vitro e in vivo, i composti che hanno dimostrato di esercitare effetti inibitori sulle lesioni endometriosiche includono inibitori del fattore di crescita, inibitori dell'angiogenesi endogena, analoghi della fumagillina, statine, Inibitori selettivi della COX-2, composti fitochimici, immunomodulatori, Agonisti dopaminergici, inibitori dei recettori attivati da proliferatori perossisomiali, perossisomi, progestina, danazolo e agonisti dell'ormone che rilascia la gonadotropina.[87] Tuttavia, molti di questi agenti sono stati correlati a effetti collaterali indesiderati e sono ad oggi (2018) necessarie ulteriori ricerche. Una terapia ideale dovrebbe essere in grado di ridurre l'infiammazione e i sintomi sottostanti senza influire negativamente sulla capacità di concepimento.[88][89]
Trattamento della sterilità
L'approccio chirurgia è più efficace rispetto all'assunzione di farmaci per affrontare l'infertilità correlata all'endometriosi.[71] La chirurgia tenta di rimuovere il tessuto endometriale e preservare le ovaie senza danneggiare il tessuto normale.[71] Le procedure di fecondazione in vitro (FIV) risultano efficaci nel migliorare la fertilità in molte donne con endometriosi.[90][91]
Durante il trattamento per la fertilità, un lungo pretrattamento con l'agonista del GnRH presenta una maggiore probabilità di consentire l'instaurarsi di una gravidanza nelle con endometriosi rispetto allo stesso ma di breve durata.[45]
Note
- ^ (EN) Endometriosis: Overview, su www.nichd.nih.gov. URL consultato il 20 maggio 2017 (archiviato il 18 maggio 2017).
- ^ (EN) Endometriosis: Condition Information, su www.nichd.nih.gov. URL consultato il 20 maggio 2017 (archiviato il 30 aprile 2017).
- ^ a b c d e f g h i j k l m n Bulletti C, Coccia ME, Battistoni S, Borini A, Endometriosis and infertility, in Journal of Assisted Reproduction and Genetics, vol. 27, n. 8, August 2010, pp. 441–7, DOI:10.1007/s10815-010-9436-1, PMC 2941592, PMID 20574791.
- ^ a b c d e f g h i j k l (EN) Endometriosis, su womenshealth.gov, 13 febbraio 2017. URL consultato il 20 maggio 2017 (archiviato il 13 maggio 2017).
- ^ Culley L, Law C, Hudson N, Denny E, Mitchell H, Baumgarten M, Raine-Fenning N, The social and psychological impact of endometriosis on women's lives: a critical narrative review, in Human Reproduction Update, vol. 19, n. 6, 1º novembre 2013, pp. 625–39, DOI:10.1093/humupd/dmt027, PMID 23884896.
- ^ a b Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015, in Lancet, vol. 388, n. 10053, October 2016, pp. 1545–1602, DOI:10.1016/S0140-6736(16)31678-6, PMC 5055577, PMID 27733282.
- ^ a b (EN) Patrick J. McGrath, Bonnie J. Stevens, Suellen M. Walker e William T. Zempsky, Oxford Textbook of Paediatric Pain, OUP Oxford, 2013, p. 300, ISBN 978-0-19-964265-6 (archiviato il 10 settembre 2017).
- ^ (GBD 2013 Mortality and Causes of Death Collaborators)), Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013, in Lancet, vol. 385, n. 9963, January 2015, pp. 117–71, DOI:10.1016/S0140-6736(14)61682-2, PMC 4340604, PMID 25530442.
- ^ a b c Brosens I, Endometriosis: Science and Practice, John Wiley & Sons, 2012, p. 3, ISBN 978-1-4443-9849-6.
- ^ Ronald E. Batt, A history of endometriosis, London, Springer, 2011, pp. 13–38, ISBN 978-0-85729-585-9.
- ^ a b c d e Nezhat C, Nezhat F, Nezhat C, Endometriosis: ancient disease, ancient treatments, in Fertility and Sterility, vol. 98, 6 Suppl, December 2012, pp. S1-62, DOI:10.1016/j.fertnstert.2012.08.001, PMID 23084567.
- ^ a b c Vercellini e Genazzani, 1992, p. 3.
- ^ Ministero della Salute, Endometriosi, su salute.gov.it. URL consultato il 16 novembre 2018.
- ^ Nothnick WB, The emerging use of aromatase inhibitors for endometriosis treatment, in Reproductive Biology and Endocrinology, vol. 9, June 2011, pp. 87, DOI:10.1186/1477-7827-9-87, PMC 3135533, PMID 21693036.
- ^ Bulun SE, Zeitoun K, Sasano H, Simpson ER, Aromatase in aging women, in Seminars in Reproductive Endocrinology, vol. 17, n. 4, 1999, pp. 349–58, DOI:10.1055/s-2007-1016244, PMID 10851574.
- ^ Batt RE, Mitwally MF, Endometriosis from thelarche to midteens: pathogenesis and prognosis, prevention and pedagogy, in Journal of Pediatric and Adolescent Gynecology, vol. 16, n. 6, December 2003, pp. 337–47, DOI:10.1016/j.jpag.2003.09.008, PMID 14642954.
- ^ Marsh EE, Laufer MR, Endometriosis in premenarcheal girls who do not have an associated obstructive anomaly, in Fertility and Sterility, vol. 83, n. 3, March 2005, pp. 758–60, DOI:10.1016/j.fertnstert.2004.08.025, PMID 15749511.
- ^ Vercellini e Genazzani, 1992, pp. 3-4.
- ^ a b S.-W. Guo, Recurrence of endometriosis and its control, in Human Reproduction Update, vol. 15, n. 4, 11 marzo 2009, pp. 441–461, DOI:10.1093/humupd/dmp007, ISSN 1355-4786.
- ^ Vercellini e Genazzani, 1992, p. 4.
- ^ Evidence Indicates Endometriosis Could be Linked to Environment | KSL.com, su ksl.com. URL consultato il 1º aprile 2015.
- ^ Endometriosi: sotto accusa il bisfenolo, componente della plastica, su salute24.ilsole24ore.com. URL consultato il 1º aprile 2015.
- ^ a b c d e f g h Vercellini e Genazzani, 1992, p. 9.
- ^ a b Stratton P, Berkley KJ, Chronic pelvic pain and endometriosis: translational evidence of the relationship and implications, in Human Reproduction Update, vol. 17, n. 3, 2011, pp. 327–46, DOI:10.1093/humupd/dmq050, PMC 3072022, PMID 21106492.
- ^ a b c d (EN) G Willy Davila, Endometriosis Clinical Presentation, su emedicine.medscape.com. URL consultato il 13 marzo 2019.
- ^ (EN) Mayo Clinic, Endometriosis, su mayoclinic.org. URL consultato il 13 marzo 2019.
- ^ Colette S, Donnez J, Are aromatase inhibitors effective in endometriosis treatment?, in Expert Opinion on Investigational Drugs, vol. 20, n. 7, July 2011, pp. 917–31, DOI:10.1517/13543784.2011.581226, PMID 21529311.
- ^ a b c d (EN) What are the symptoms of endometriosis?, su National Institutes of Health. URL consultato il 4 ottobre 2018.
- ^ Brown J, Farquhar C, Endometriosis: an overview of Cochrane Reviews, in The Cochrane Database of Systematic Reviews, n. 3, March 2014, pp. CD009590, DOI:10.1002/14651858.cd009590.pub2, PMID 24610050.
- ^ Wolthuis AM, Meuleman C, Tomassetti C, D'Hooghe T, de Buck van Overstraeten A, D'Hoore A, Bowel endometriosis: colorectal surgeon's perspective in a multidisciplinary surgical team, in World Journal of Gastroenterology, vol. 20, n. 42, November 2014, pp. 15616–23, DOI:10.3748/wjg.v20.i42.15616, PMC 4229526, PMID 25400445.
- ^ Arbique D, Carter S, Van Sell S, Endometriosis can evade diagnosis, in Rn, vol. 71, n. 9, September 2008, pp. 28–32; quiz 33, PMID 18833741.
- ^ Pearce CL, Templeman C, Rossing MA, Lee A, Near AM, Webb PM, Nagle CM, Doherty JA, Cushing-Haugen KL, Wicklund KG, Chang-Claude J, Hein R, Lurie G, Wilkens LR, Carney ME, Goodman MT, Moysich K, Kjaer SK, Hogdall E, Jensen A, Goode EL, Fridley BL, Larson MC, Schildkraut JM, Palmieri RT, Cramer DW, Terry KL, Vitonis AF, Titus LJ, Ziogas A, Brewster W, Anton-Culver H, Gentry-Maharaj A, Ramus SJ, Anderson AR, Brueggmann D, Fasching PA, Gayther SA, Huntsman DG, Menon U, Ness RB, Pike MC, Risch H, Wu AH, Berchuck A, Association between endometriosis and risk of histological subtypes of ovarian cancer: a pooled analysis of case-control studies, in The Lancet. Oncology, vol. 13, n. 4, April 2012, pp. 385–94, DOI:10.1016/S1470-2045(11)70404-1, PMC 3664011, PMID 22361336.
- ^ Nezhat F. Article by Prof. Farr Nezhat, MD, FACOG, FACS, University of Columbia, May 1, 2012 Archiviato il 2 novembre 2012 in Internet Archive.
- ^ (FR) Audebert A, [Women with endometriosis: are they different from others?] [Women with endometriosis: are they different from others?], in Gynecologie, Obstetrique & Fertilite, vol. 33, n. 4, April 2005, pp. 239–46, DOI:10.1016/j.gyobfe.2005.03.010, PMID 15894210.
- ^ Rowlands IJ, Nagle CM, Spurdle AB, Webb PM, Gynecological conditions and the risk of endometrial cancer, in Gynecologic Oncology, vol. 123, n. 3, December 2011, pp. 537–41, DOI:10.1016/j.ygyno.2011.08.022, PMID 21925719.
- ^ a b c d Vercellini e Genazzani, 1992, p. 10.
- ^ Ballard K, Lane H, Hudelist G, Banerjee S, Wright J, Can specific pain symptoms help in the diagnosis of endometriosis? A cohort study of women with chronic pelvic pain, in Fertility and Sterility, vol. 94, n. 1, June 2010, pp. 20–7, DOI:10.1016/j.fertnstert.2009.01.164, PMID 19342028.
- ^ Asante A, Taylor RN, Endometriosis: the role of neuroangiogenesis, in Annual Review of Physiology, vol. 73, 2011, pp. 163–82, DOI:10.1146/annurev-physiol-012110-142158, PMID 21054165.
- ^ a b (EN) Treatment of infertility in women with endometriosis, su www.uptodate.com. URL consultato il 18 dicembre 2017.
- ^ a b Shawn Daly, Imaging in Endometrioma/Endometriosis !lingua=en, su emedicine.medscape.com. URL consultato il 14 marzo 2019.
- ^ a b c d e (EN) G Willy Davila, Endometriosis Clinical Presentation, su emedicine.medscape.com, Medscape. URL consultato il 14 marzo 2019.
- ^ a b c d May KE, Conduit-Hulbert SA, Villar J, Kirtley S, Kennedy SH, Becker CM, Peripheral biomarkers of endometriosis: a systematic review, in Human Reproduction Update, vol. 16, n. 6, 2010, pp. 651–74, DOI:10.1093/humupd/dmq009, PMC 2953938, PMID 20462942.
- ^ a b Hirsch M, Duffy J, Davis CJ, Nieves Plana M, Khan KS, Diagnostic accuracy of cancer antigen 125 for endometriosis: a systematic review and meta-analysis, in BJOG, vol. 123, n. 11, October 2016, pp. 1761–8, DOI:10.1111/1471-0528.14055, PMID 27173590.
- ^ May KE, Villar J, Kirtley S, Kennedy SH, Becker CM, Endometrial alterations in endometriosis: a systematic review of putative biomarkers, in Human Reproduction Update, vol. 17, n. 5, 2011, pp. 637–53, DOI:10.1093/humupd/dmr013, PMID 21672902.
- ^ a b c d e f (EN) Endometriosis – Diagnosis, treatment and patient experiences, su sbu.se, Swedish Agency for Health Technology Assessment and Assessment of Social Services (SBU), 4 maggio 2018. URL consultato il 13 giugno 2018.
- ^ a b Fang J, Piessens S, A step‐by‐step guide to sonographic evaluation of deep infiltrating endometriosis, in Sonography, vol. 5, n. 2, June 2018, pp. 67–75, DOI:10.1002/sono.12149.
- ^ a b c d e f Nisenblat V, Bossuyt PM, Farquhar C, Johnson N, Hull ML, Imaging modalities for the non-invasive diagnosis of endometriosis, in The Cochrane Database of Systematic Reviews, vol. 2, February 2016, pp. CD009591, DOI:10.1002/14651858.cd009591.pub2, PMID 26919512.
- ^ a b Togashi K, Nishimura K, Kimura I, Tsuda Y, Yamashita K, Shibata T, Nakano Y, Konishi J, Konishi I, Mori T, Endometrial cysts: diagnosis with MR imaging, in Radiology, vol. 180, n. 1, July 1991, pp. 73–8, DOI:10.1148/radiology.180.1.2052726.
- ^ a b Kurtz AB, Tsimikas JV, Tempany CM, Hamper UM, Arger PH, Bree RL, Wechsler RJ, Francis IR, Kuhlman JE, Siegelman ES, Mitchell DG, Silverman SG, Brown DL, Sheth S, Coleman BG, Ellis JH, Kurman RJ, Caudry DJ, McNeil BJ, Diagnosis and staging of ovarian cancer: comparative values of Doppler and conventional US, CT, and MR imaging correlated with surgery and histopathologic analysis--report of the Radiology Diagnostic Oncology Group, in Radiology, vol. 212, n. 1, July 1999, pp. 19–27, DOI:10.1148/radiology.212.1.r99jl3619.
- ^ McDermott S, Oei TN, Iyer VR, Lee SI, MR imaging of malignancies arising in endometriomas and extraovarian endometriosis, in Radiographics, vol. 32, n. 3, 2012, pp. 845–63, DOI:10.1148/rg.323115736.
- ^ Takahashi K, Okada S, Okada M, Kitao M, Kaji Y, Sugimura K, Magnetic resonance relaxation time in evaluating the cyst fluid characteristics of endometrioma, in Hum. Reprod., vol. 11, n. 4, April 1996, pp. 857–60.
- ^ Outwater EK, Siegelman ES, Chiowanich P, Kilger AM, Dunton CJ, Talerman A, Dilated fallopian tubes: MR imaging characteristics, in Radiology, vol. 208, n. 2, August 1998, pp. 463–9, DOI:10.1148/radiology.208.2.9680577.
- ^ Office on Women’s Health, U.S. Department of Health and Human Services. (16 July 2012). Endometriosis Fact Sheet. Retrieved from Womenshealth.gov Archived copy, su womenshealth.gov. URL consultato l'11 luglio 2015 (archiviato il 3 luglio 2015).
- ^ a b c Hsu AL, Khachikyan I, Stratton P, Invasive and noninvasive methods for the diagnosis of endometriosis, in Clin Obstet Gynecol, vol. 53, n. 2, June 2010, pp. 413–9, DOI:10.1097/GRF.0b013e3181db7ce8, PMC 2880548, PMID 20436318.
- ^ Nisolle M, Paindaveine B, Bourdon A, Berlière M, Casanas-Roux F, Donnez J, Histologic study of peritoneal endometriosis in infertile women, in Fertility and Sterility, vol. 53, n. 6, June 1990, pp. 984–8, PMID 2351237.
- ^ Treatment of pelvic pain associated with endometriosis: a committee opinion, in Fertility and Sterility, vol. 101, n. 4, April 2014, pp. 927–35, DOI:10.1016/j.fertnstert.2014.02.012, PMID 24630080.
- ^ a b Vercellini e Genazzani, 1992, p. 6.
- ^ Potlog-Nahari C, Feldman AL, Stratton P, Koziol DE, Segars J, Merino MJ, Nieman LK, CD10 immunohistochemical staining enhances the histological detection of endometriosis, in Fertil. Steril., vol. 82, n. 1, July 2004, pp. 86–92, DOI:10.1016/j.fertnstert.2003.11.059.
- ^ Revised American Society for Reproductive Medicine classification of endometriosis: 1996, in Fertility and Sterility, vol. 67, n. 5, May 1997, pp. 817–21, DOI:10.1016/S0015-0282(97)81391-X.
- ^ Koninckx PR, Meuleman C, Demeyere S, Lesaffre E, Cornillie FJ, Suggestive evidence that pelvic endometriosis is a progressive disease, whereas deeply infiltrating endometriosis is associated with pelvic pain, in Fertil. Steril., vol. 55, n. 4, April 1991, pp. 759–65.
- ^ Vercellini P, Fedele L, Aimi G, Pietropaolo G, Consonni D, Crosignani PG, Association between endometriosis stage, lesion type, patient characteristics and severity of pelvic pain symptoms: a multivariate analysis of over 1000 patients, in Human Reproduction, vol. 22, n. 1, January 2007, pp. 266–71, DOI:10.1093/humrep/del339.
- ^ Immagine di Endometriosi : tipi, severità e classificazione, su mondoginecologico.it. URL consultato il 18 marzo 2019.
- ^ Triolo O, Laganà AS, Sturlese E, Chronic pelvic pain in endometriosis: an overview, in J Clin Med Res, vol. 5, n. 3, June 2013, pp. 153–63, DOI:10.4021/jocmr1288w.
- ^ Koninckx,P.R.; Meuleman,C.; Demeyere,S.; Lesaffre,E.; Cornillie,F.J., Suggestive evidence that pelvic endometriosis is a progressive disease, whereas deeply infiltrating endometriosis is associated with pelvic pain, in Fertil.Steril, vol. 55, n. 4.
- ^ Hornstein MD, Gleason RE, Orav J, Haas ST, Friedman AJ, Rein MS, Hill JA, Barbieri RL, The reproducibility of the revised American Fertility Society classification of endometriosis, in Fertil. Steril., vol. 59, n. 5, May 1993, pp. 1015–21.
- ^ (EN) G Willy Davila, Endometriosis Clinical Presentation, su emedicine.medscape.com, Medscape. URL consultato il 18 marzo 2019.
- ^ Bourdel N, Alves J, Pickering G, Ramilo I, Roman H, Canis M, Systematic review of endometriosis pain assessment: how to choose a scale?, in Human Reproduction Update, vol. 21, n. 1, 2014, pp. 136–52, DOI:10.1093/humupd/dmu046, PMID 25180023.
- ^ (EN) G Willy Davila, Endometriosis Differential Diagnoses, su emedicine.medscape.com, Medscape. URL consultato il 12 marzo 2019..
- ^ What are the treatments for endometriosis, su nichd.nih.gov, Eunice Kennedy Shriver National Institute of Child Health and Human Development. URL consultato il 20 August 2013 (archiviato il 3 August 2013).
- ^ Moen MH, Rees M, Brincat M, Erel T, Gambacciani M, Lambrinoudaki I, Schenck-Gustafsson K, Tremollieres F, Vujovic S, Rozenberg S, EMAS position statement: Managing the menopause in women with a past history of endometriosis, in Maturitas, vol. 67, n. 1, September 2010, pp. 94–7, DOI:10.1016/j.maturitas.2010.04.018.
- ^ a b c d Wellbery C, Diagnosis and treatment of endometriosis, in American Family Physician, vol. 60, n. 6, October 1999, pp. 1753–62, 1767–8, PMID 10537390 (archiviato il 29 ottobre 2013).
- ^ Speroff L, Glass RH, Kase NG, Clinical Gynecologic Endocrinology and Infertility, 6th, Lippincott Willimas Wilkins, 1999, p. 1057, ISBN 0-683-30379-1.
- ^ Endometriosis and Infertility: Can Surgery Help? (PDF), su asrm.org, American Society for Reproductive Medicine, 2008. URL consultato il 31 ottobre 2010 (archiviato l'11 ottobre 2010).
- ^ Liakakos T, Thomakos N, Fine PM, Dervenis C, Young RL, Peritoneal adhesions: etiology, pathophysiology, and clinical significance. Recent advances in prevention and management, in Digestive Surgery, vol. 18, n. 4, 2001, pp. 260–73, DOI:10.1159/000050149, PMID 11528133.
- ^ Trehan AK, Temporary ovarian suspension, in Gynaecological Endoscopy, vol. 11, n. 1, 2002, pp. 309–314, DOI:10.1046/j.1365-2508.2002.00520.x.
- ^ Abuzeid MI, Ashraf M, Shamma FN, Temporary ovarian suspension at laparoscopy for prevention of adhesions, in The Journal of the American Association of Gynecologic Laparoscopists, vol. 9, n. 1, February 2002, pp. 98–102, PMID 11821616.
- ^ Namnoum AB, Hickman TN, Goodman SB, Gehlbach DL, Rock JA, Incidence of symptom recurrence after hysterectomy for endometriosis, in Fertility and Sterility, vol. 64, n. 5, November 1995, pp. 898–902, PMID 7589631.
- ^ Guo SW, Recurrence of endometriosis and its control, in Human Reproduction Update, vol. 15, n. 4, 2009, pp. 441–61, DOI:10.1093/humupd/dmp007, PMID 19279046.
- ^ a b Johnson NP, Hummelshoj L, Consensus on current management of endometriosis, in Human Reproduction, vol. 28, n. 6, June 2013, pp. 1552–68, DOI:10.1093/humrep/det050, PMID 23528916.
- ^ Zorbas KA, Economopoulos KP, Vlahos NF, Continuous versus cyclic oral contraceptives for the treatment of endometriosis: a systematic review, in Archives of Gynecology and Obstetrics, vol. 292, n. 1, July 2015, pp. 37–43, DOI:10.1007/s00404-015-3641-1.
- ^ Endometriosis: Treatment of pelvic pain, su uptodate.com.
- ^ Patel B, Elguero S, Thakore S, Dahoud W, Bedaiwy M, Mesiano S, Role of nuclear progesterone receptor isoforms in uterine pathophysiology, in Human Reproduction Update, vol. 21, n. 2, 2014, pp. 155–73, DOI:10.1093/humupd/dmu056.
- ^ O'Callaghan D, Endometriosis--an update, in Aust Fam Physician, vol. 35, n. 11, November 2006, pp. 864–7.
- ^ a b Brown J, Pan A, Hart RJ, Gonadotrophin-releasing hormone analogues for pain associated with endometriosis, in The Cochrane Database of Systematic Reviews, n. 12, December 2010, pp. CD008475, DOI:10.1002/14651858.CD008475.pub2.
- ^ Lu D, Song H, Li Y, Clarke J, Shi G, Pentoxifylline for endometriosis, in The Cochrane Database of Systematic Reviews, vol. 1, January 2012, pp. CD007677, DOI:10.1002/14651858.CD007677.pub3.
- ^ Practice bulletin no. 114: management of endometriosis, in Obstetrics and Gynecology, vol. 116, n. 1, July 2010, pp. 223–36, DOI:10.1097/AOG.0b013e3181e8b073.
- ^ a b Laschke MW, Menger MD, Anti-angiogenic treatment strategies for the therapy of endometriosis, in Human Reproduction Update, vol. 18, n. 6, 2012, pp. 682–702, DOI:10.1093/humupd/dms026.
- ^ Canny GO, Lessey BA, The role of lipoxin A4 in endometrial biology and endometriosis, in Mucosal Immunology, vol. 6, n. 3, May 2013, pp. 439–50, DOI:10.1038/mi.2013.9.
- ^ Streuli I, de Ziegler D, Santulli P, Marcellin L, Borghese B, Batteux F, Chapron C, An update on the pharmacological management of endometriosis, in Expert Opinion on Pharmacotherapy, vol. 14, n. 3, February 2013, pp. 291–305, DOI:10.1517/14656566.2013.767334.
- ^ Catenacci M, Falcone T, The effect of endometriosis on in vitro fertilization outcome, in Minerva Ginecol, vol. 60, n. 3, June 2008, pp. 209–21, PMID 18547983.
- ^ AlKudmani B, Gat I, Buell D, Salman J, Zohni K, Librach C, Sharma P, In Vitro Fertilization Success Rates after Surgically Treated Endometriosis and Effect of Time Interval between Surgery and In Vitro Fertilization, in J Minim Invasive Gynecol, vol. 25, n. 1, January 2018, pp. 99–104, DOI:10.1016/j.jmig.2017.08.641, PMID 28807807.
Bibliografia
- Paolo Vercellini e Andrea Genazzani, Endometriosi, Roma, CIC Edizioni Internazionali, 1992, ISBN 88-7141-155-3
ISBNnon valido (aiuto). - (EN) Patrick J. McGrath, Bonnie J. Stevens, Suellen M. Walker e William T. Zempsky, Oxford Textbook of Paediatric Pain, OUP Oxford, 2013, ISBN 978-0-19-964265-6.
- (EN) Brosens I, Endometriosis: Science and Practice, John Wiley & Sons, 2012, ISBN 978-1-4443-9849-6.
- (EN) Ronald E. Batt, A history of endometriosis, Londra, Springer, 2011, ISBN 978-0-85729-585-9.
- (EN) Speroff L, Glass RH, Kase NG, Clinical Gynecologic Endocrinology and Infertility, 6th, Lippincott Willimas Wilkins, 1999, ISBN 0-683-30379-1.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su endometriosi
Wikimedia Commons contiene immagini o altri file su endometriosi
Collegamenti esterni
- (EN) endometriosis, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- APEonlus, Associazione Progetto Endometriosi
- ARIANNe Associazione ARIANNe Onlus - Endometriosi
- AIEonlus Associazione Italiana Endometriosi onlus
- Ændo – Associazione Italiana Dolore Pelvico ed Endometriosi, su aendoassociazione.com.
- Comitato Io ho l'endometriosi, il blog delle donne affette da endometriosi
| Controllo di autorità | Thesaurus BNCF 32159 · LCCN (EN) sh85043079 · GND (DE) 4152177-8 · BNE (ES) XX4576836 (data) · BNF (FR) cb119937878 (data) · J9U (EN, HE) 987007543212105171 · NDL (EN, JA) 00936311 |
|---|