Fenitoina
| Fenitoina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
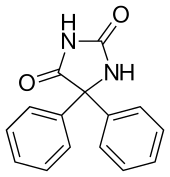
| 5,5-difenilimidazolidina-2,4-dione | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C15H12N2O2 |
| Massa molecolare (u) | 252.268 g/mol |
| Numero CAS | |
| Numero EINECS | 200-328-6 |
| Codice ATC | N03 |
| PubChem | 1775 e 146015336 |
| DrugBank | DBDB00252 |
| SMILES | C1=CC=C(C=C1)C2(C(=O)NC(=O)N2)C3=CC=CC=C3 |
| Dati farmacocinetici | |
| Emivita | 6 - 24 ore |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 302 - 350 - 360 |
| Consigli P | 201 - 308+313 [1] |
La fenitoina, (denominata anche difenilidantoina e dintoina) è un farmaco antiepilettico, classificata come un derivato idantoinico ed è uno degli anticonvulsivanti più comunemente utilizzati, nonostante il suo indice terapeutico ridotto.[2][3][4] Nonostante sia stata introdotta circa 80 anni fa, la fenitoina non solo è stata confermata come un efficace antiepilettico, ma è stata anche studiata per diverse altre indicazioni come il disturbo bipolare, la protezione della retina e la guarigione delle ferite.[5][3]
Durante la terapia con fenitoina deve essere praticato il monitoraggio terapeutico del farmaco nei pazienti, poiché anche piccole deviazioni dalla gamma terapeutica consigliata possono portare a un trattamento subottimale o a effetti indesiderati.[4][6] Sul mercato sono disponibili formulazioni sia parenterali che orali di fenitoina.[4]
Farmacologia
[modifica | modifica wikitesto]Indicazione d'uso
[modifica | modifica wikitesto]La fenitoina è indicata per il trattamento delle crisi epilettiche generalizzate, delle crisi parziali complesse e per prevenire e trattare le crisi durante o dopo interventi neurochirurgici.[7] La fenitoina iniettabile e la fosfenitoina, che è la formulazione pro-farmaco di estere fosfato della fenitoina,[8] sono indicati per il trattamento dello stato epilettico tonico-clonico e per la prevenzione e il trattamento delle crisi che si verificano durante interventi neurochirurgici.[9]
Il farmaco è inoltre impiegato per trattare le seguenti condizioni associate: disturbo delle crisi parziali complesse, crisi tonicocloniche generalizzate, stato epilettico di grande male, epilessia di Jackson, crisi di esordio parziale, epilessia di tipo petit mal, disturbo delle crisi post traumatiche, crisi, stato epilettico tonicoclonico, epilessia del lobo temporale e disturbi convulsivi.[10]
Farmacocinetica
[modifica | modifica wikitesto]La fenitoina è un farmaco antiepilettico con una stretta finestra terapeutica. Nonostante si raccomandi un range terapeutico compreso tra 10-20 mg/L, diversità nei livelli di albumina, variazioni genetiche, comorbilità e composizione corporea possono rendere difficile determinare la dose ideale di fenitoina.[11] Ad esempio, studi hanno dimostrato che il metabolismo della fenitoina può essere influenzato da polimorfismi nel gene CYP2C9 e, potenzialmente, anche dal gene CYP2C19 (anche se quest'ultimo è stato meno oggetto di approfondimenti).[11]
È importante sottolineare che, nonostante la fenitoina sia fortemente legata alle proteine, soltanto la frazione non legata è in grado di esercitare un effetto farmacologico.[12] Pertanto, fattori che riducono o aumentano la percentuale di fenitoina legata alle proteine (ad esempio, l'assunzione concomitante di farmaci che possono influenzare il legame proteico) possono avere un impatto significativo sulla terapia con fenitoina.[13][12]
Meccanismo d'azione
[modifica | modifica wikitesto]Sebbene la fenitoina sia stata menzionata per la prima volta nella letteratura nel 1946, sono occorsi molti anni per comprendere in modo più specifico il suo meccanismo d'azione.[5] Nonostante alcuni scienziati fossero convinti che la fenitoina influenzasse la permeabilità del sodio, solo negli anni '80 si è scoperto che questo fenomeno era correlato ai canali del sodio voltaggio-dipendenti.[5] La fenitoina è comunemente considerata un bloccante non specifico dei canali del sodio e agisce su quasi tutti i sottotipi dei canali del sodio voltaggio-dipendenti.[5] In particolare, previene le crisi epilettiche inibendo il ciclo di feedback positivo che causa la propagazione neuronale di potenziali d'azione ad alta frequenza.[4][14][11]
Assorbimento
[modifica | modifica wikitesto]Dato il suo stretto intervallo terapeutico, è raccomandato il monitoraggio terapeutico del farmaco per guidare la posologia.[4][6] La fenitoina viene completamente assorbita. La concentrazione plasmatica di picco si raggiunge approssimativamente tra 1,5-3 ore dopo l'assunzione della formulazione a rilascio immediato e tra 4-12 ore dopo l'assunzione della formulazione a rilascio prolungato.[15][4] È importante notare che l'assorbimento può essere significativamente prolungato in caso di ingestione acuta.[4]
Volume di distribuzione
[modifica | modifica wikitesto]Il volume di distribuzione della fenitoina è riportato essere approssimativamente di 0,75 L/kg.[16]
Legame proteico
[modifica | modifica wikitesto]La fenitoina è legata alle proteine plasmatiche per circa il 90%.[13]
Metabolismo
[modifica | modifica wikitesto]La fenitoina viene metabolizzata in modo estensivo e viene prima trasformata in un intermedio reattivo di ossido di arene.[2] Si ritiene che questo intermedio reattivo sia responsabile di molti effetti avversi indesiderati della fenitoina, come epatotossicità, SJS/TEN e altre reazioni idiosincratiche.[2] L'ossido di arene viene poi metabolizzato in un metabolita di idrossifenitoina o diidrodiolo di fenitoina, sebbene il primo rappresenti circa il 90% del metabolismo della fenitoina.[2]
È interessante notare che due stereoisomeri del metabolita di idrossifenitoina sono formati da CYP2C9 e CYP2C19: (R)-p-HPPH e (S)-p-HPPH.[2] Quando la reazione è catalizzata da CYP2C19, il rapporto degli stereoisomeri è approssimativamente 1:1, mentre quando la reazione è catalizzata da CYP2C9, il rapporto è fortemente a favore dell'isomero "S".[2] Poiché il metabolismo della fenitoina è influenzato in parte dai polimorfismi genetici di CYP2C9 e CYP2C19, questo rapporto può essere utilizzato per identificare diverse varianti genomiche degli enzimi.[11][3][2]
Gli enzimi EPHX1, CYP1A2, CYP2A6, CYP2C19, CYP2C8, CYP2C9, CYP2D6, CYP2E1 e CYP3A4 sono responsabili della produzione del metabolita diidrodiolo di fenitoina.[2]
L'idrossifenitoina può essere metabolizzata da CYP2C19, CYP3A5, CYP2C9, CYP3A4, CYP3A7, CYP2B6 e CYP2D6 in un metabolita catecolo di fenitoina o può subire glucuronidazione da parte di UGT1A6, UGT1A9, UGT1A1 e UGT1A4 in un metabolita glucuronide che può essere eliminato nelle urine.[2] D'altra parte, l'entità diidrodiolo di fenitoina viene trasformata solo nel metabolita catecolo.[2]
Il metabolita catecolo può subire metilazione da parte di COMT e successivamente essere eliminato nelle urine, oppure può ossidarsi spontaneamente a una chinone di fenitoina (NQO1 può trasformare nuovamente la chinone nel metabolita catecolo).[2] Da notare che, sebbene CYP2C18 sia scarsamente espresso nel fegato, l'enzima è attivo nella pelle ed è coinvolto nell'idrossilazione primaria e secondaria della fenitoina.[2][17] Questa bioattivazione mediata da CYP2C18 potrebbe essere correlata alla manifestazione di reazioni avverse cutanee associate alla fenitoina.[2]
Via di eliminazione
[modifica | modifica wikitesto]La maggior parte della fenitoina viene escreta come metaboliti inattivi nella bile.[9][7] Si stima che l'1-5% della fenitoina venga eliminata inalterata nelle urine.[4]
Emivita
[modifica | modifica wikitesto]Nella somministrazione per via orale l'emivita della fenitoina varia da 7 a 42 ore, con una media di 22 ore.[16][7]
In caso di somministrazione per via endovenosa l'emivita della fenitoina varia da 10-15 ore.[9]
Clearance
[modifica | modifica wikitesto]La clearance della fenitoina è non lineare.[6] A basse concentrazioni sieriche (inferiori a 10 mg/L), l'eliminazione segue una cinetica di primo ordine.[15] Con l'aumento delle concentrazioni plasmatiche, la cinetica si sposta gradualmente verso l'ordine zero e infine raggiunge una cinetica di ordine zero una volta che il sistema è saturo.[15]
Tossicità
[modifica | modifica wikitesto]L'esperienza di tossicità da fenitoina non è limitata alle situazioni di ingestione acuta, ma può verificarsi anche a causa di interazioni farmacologiche o circostanze fisiologiche che influenzano la concentrazione di albumina sierica (ad esempio, malattie renali) o il metabolismo del farmaco.[15] Altri cambiamenti che possono portare alla tossicità da fenitoina includono la gravidanza, la malnutrizione e la presenza di tumori maligni.[15]
La tossicità da fenitoina colpisce più comunemente i sistemi cardiovascolare e nervoso.[15] La presentazione più comune della tossicità dipende dalla via di somministrazione del farmaco. Gli effetti avversi cardiovascolari sono più frequentemente correlati alla somministrazione endovenosa della fenitoina, mentre gli effetti avversi neurologici sono più comuni con la somministrazione orale della fenitoina.[15]
La neurotossicità dipende solitamente dalle concentrazioni sieriche di fenitoina.[15] Quando le concentrazioni variano tra 10-20 mg/L, può verificarsi un lieve nistagmo e sguardo laterale, mentre un nistagmo più significativo è associato a concentrazioni comprese tra 20-30 mg/L.[15] A concentrazioni di 30-40 mg/L, sono state segnalate discorsi confusi, tremori, nausea, vomito e atassia.[15] Nei casi più gravi, con livelli sierici compresi tra 40-50 mg/L, i pazienti sono a rischio di letargia, confusione e iperattività, e a livelli superiori a 50 mg/L, possono verificarsi coma e crisi epilettiche.[15]
La fenitoina è classificata come un antiaritmico e può causare blocchi dei nodi del seno e atrioventricolari, così come disritmie a causa del suo effetto sui canali del sodio voltaggio-dipendenti.[15] Inoltre, poiché la fenitoina è scarsamente solubile, la formulazione endovenosa viene somministrata con propilenglicole, che ha un effetto depressivo sul sistema cardiaco.[15] Il tasso di infusione della fenitoina endovenosa non dovrebbe superare i 50 mg al minuto a causa del rischio di ipotensione, bradicardia e asistolia.[15]
Il trattamento per la tossicità da fenitoina è non specifico e si basa sul supporto delle cure.[15] Una dose di carbone attivo può essere utilizzata per prevenire l'assorbimento della fenitoina nei casi di ingestione acuta.[15]
Sebbene l'emodialisi sia moderatamente efficace nel rimuovere la fenitoina, di solito non viene raccomandata a causa dei rischi associati alla procedura e dell'efficacia generale delle cure di supporto.[15]
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 17.10.2011
- ^ a b c d e f g h i j k l m Caroline F. Thorn, Michelle Whirl-Carrillo e J. Steven Leeder, PharmGKB summary: phenytoin pathway, in Pharmacogenetics and Genomics, vol. 22, n. 6, 2012-06, pp. 466–470, DOI:10.1097/FPC.0b013e32834aeedb. URL consultato l'11 luglio 2023.
- ^ a b c Carlos Eduardo Silvado, Vera Cristina Terra e Carlos Alexandre Twardowschy, CYP2C9 polymorphisms in epilepsy: influence on phenytoin treatment, in Pharmacogenomics and Personalized Medicine, vol. 11, 2018, pp. 51–58, DOI:10.2147/PGPM.S108113. URL consultato l'11 luglio 2023.
- ^ a b c d e f g h Mohit Gupta e Jayson Tripp, Phenytoin, StatPearls Publishing, 2023. URL consultato l'11 luglio 2023.
- ^ a b c d Jan M. Keppel Hesselink, Phenytoin: a step by step insight into its multiple mechanisms of action-80 years of mechanistic studies in neuropharmacology, in Journal of Neurology, vol. 264, n. 9, 2017-09, pp. 2043–2047, DOI:10.1007/s00415-017-8465-4. URL consultato l'11 luglio 2023.
- ^ a b c R. L. Nation, A. M. Evans e R. W. Milne, Pharmacokinetic drug interactions with phenytoin (Part I), in Clinical Pharmacokinetics, vol. 18, n. 1, 1990-01, pp. 37–60, DOI:10.2165/00003088-199018010-00003. URL consultato l'11 luglio 2023.
- ^ a b c FDA Approved Drugs: Dilantin - DILANTIN® (extended phenytoin sodium capsules), for oral use Initial U.S. Approval: 1953 (PDF), su accessdata.fda.gov.
- ^ James H. Fischer, Tejal V. Patel e Patricia A. Fischer, Fosphenytoin: clinical pharmacokinetics and comparative advantages in the acute treatment of seizures, in Clinical Pharmacokinetics, vol. 42, n. 1, 2003, pp. 33–58, DOI:10.2165/00003088-200342010-00002. URL consultato l'11 luglio 2023.
- ^ a b c CEREBYX® FDA Label - CEREBYX® (fosphenytoin sodium) injection. Initial U.S. Approval: 1996 (PDF), su accessdata.fda.gov.
- ^ Phenytoin, su go.drugbank.com. URL consultato l'11 luglio 2023.
- ^ a b c d Renée Dagenais, Kyle John Wilby e Hazem Elewa, Impact of Genetic Polymorphisms on Phenytoin Pharmacokinetics and Clinical Outcomes in the Middle East and North Africa Region, in Drugs in R&D, vol. 17, n. 3, 2017-09, pp. 341–361, DOI:10.1007/s40268-017-0195-7. URL consultato l'11 luglio 2023.
- ^ a b (EN) Melissa Faye Wu e Wai Hing Lim, Phenytoin: A Guide to Therapeutic Drug Monitoring, in Proceedings of Singapore Healthcare, vol. 22, n. 3, 2013-09, pp. 198–202, DOI:10.1177/201010581302200307. URL consultato l'11 luglio 2023.
- ^ a b A. Richens, Clinical pharmacokinetics of phenytoin, in Clinical Pharmacokinetics, vol. 4, n. 3, 1979, pp. 153–169, DOI:10.2165/00003088-197904030-00001. URL consultato l'11 luglio 2023.
- ^ Mena Abdelsayed e Stanislav Sokolov, Voltage-gated sodium channels: pharmaceutical targets via anticonvulsants to treat epileptic syndromes, in Channels (Austin, Tex.), vol. 7, n. 3, 2013, pp. 146–152, DOI:10.4161/chan.24380. URL consultato l'11 luglio 2023.
- ^ a b c d e f g h i j k l m n o p q Alexandru Iorga e B. Zane Horowitz, Phenytoin Toxicity, StatPearls Publishing, 2023. URL consultato l'11 luglio 2023.
- ^ a b Donna C. Bergen, Pharmacokinetics of phenytoin: reminders and discoveries, in Epilepsy Currents, vol. 9, n. 4, 2009, pp. 102–104, DOI:10.1111/j.1535-7511.2009.01307.x. URL consultato l'11 luglio 2023.
- ^ Robert T. Kinobe, Oliver T. Parkinson e Deanne J. Mitchell, P450 2C18 catalyzes the metabolic bioactivation of phenytoin, in Chemical Research in Toxicology, vol. 18, n. 12, 2005-12, pp. 1868–1875, DOI:10.1021/tx050181o. URL consultato l'11 luglio 2023.
Voci correlate
[modifica | modifica wikitesto]- Antiepilettici
- Assenza tipica
- Benzodiazepine
- Carbammati
- Epilessia
- Epilessia tipo assenza infantile
- Idantoina
- Imminostilbeni
- Ossazolidindioni
- Succinimmidi
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su fenitoina
Wikimedia Commons contiene immagini o altri file su fenitoina
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) phenytoin, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.