Oxcarbazepina
| Oxcarbazepina | |
|---|---|
 | |
 | |
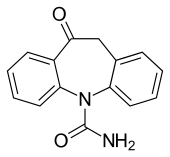
| Nome IUPAC | |
| 10,11-diidro-10-osso-5H-dibenzo(b,f)azepina-5-carbossammide | |
| Nomi alternativi | |
| Oxcarbamazepine[1] oscarbazepina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C15H12N2O2 |
| Massa molecolare (u) | 252,268 |
| Numero CAS | |
| Numero EINECS | 249-188-8 |
| Codice ATC | N03 |
| PubChem | 34312 |
| DrugBank | DB00776 |
| SMILES | O=C1Cc2ccccc2N (C(=O)N)c2ccccc12 |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | 308 mg/L a 25 °C[1] |
| Temperatura di fusione | 215,5 °C |
| Dati farmacologici | |
| Categoria farmacoterapeutica | anticonvulsivante |
| Modalità di somministrazione | Orale |
| Dati farmacocinetici | |
| Biodisponibilità | >95% |
| Legame proteico | 40% Met. attivo: 10-monoidrossi metabolita (MHD) |
| Metabolismo | Coniugazione con Acido glicuronico |
| Emivita | 2 ore Molecola madre; 9 ore MHD metabolita attivo principale |
| Escrezione | Urinaria (l'1% in forma immodificata) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- [2] |
L'oxcarbazepina[1] o oxcarbamazepina è un farmaco chimicamente correlato alla carbamazepina dalla quale deriva; differisce clinicamente da questa per il minor impegno metabolico a livello epatico e per la riduzione dei, se pur rari, fenomeni di grave anemia.
Pur con minori effetti collaterali della carbamazepina, l'oxcarbazepina mostra la stessa efficacia, lo stesso meccanismo d'azione sul canale Voltaggio dipendente del Na+ ed è, inoltre, generalmente usata per il trattamento delle stesse condizioni patologiche.
Il farmaco è stato studiato dalla Novartis Pharmaceuticals Corporation ed è in commercio nel mondo, nelle formulazioni in compresse e sospensione orale, con i nomi commerciali: Alox; Apydan; Atoxecar; Aurene; Oxrate; Oxcazen; Tolep; Trileptal[3].
Solamente in Italia, sin dal 1994, è in commercio con il nome Tolep[1] ed è disponibile solo in compresse.
Storia[modifica | modifica wikitesto]
La sintesi è del 1965, la molecola è stato protetta da un brevetto Geigy del 24 09 1970: DE2011087[4].
È stato approvato per l'uso come anticonvulsivante per la prima volta in Danimarca nel 1990, in Spagna nel 1993, in Portogallo nel 1997, e infine per tutti gli altri paesi dell'UE nel 1999. È stato approvato negli USA il 23 maggio 2001 (NDA) 021285[5].
In Italia[modifica | modifica wikitesto]
In Italia è in commercio dal 31.10.1994 con il nome di Tolep[1] e come farmaco equivalente prodotto dalla Technigen.
Caratteristiche strutturali e fisiche[modifica | modifica wikitesto]
Sintesi del composto[modifica | modifica wikitesto]
Chimicamente l'oxcarbazepina è 10,11-diidro-10-oxocarbamazepina ed è simile alla carbamazepina; essa ha una sostituzione con il 5-carbossammide sul nucleo dibenzazepinico, tuttavia, è diverso il legame a ponte in posizione 10-11 e si differenzia pertanto dal carbamazepina per il diverso destino metabolico[6] .
Reattività e caratteristiche chimiche[modifica | modifica wikitesto]
L'Oxcarbazepina è una polvere bianca/arancione debolmente cristallina. È scarsamente solubile in cloroformio, diclorometano, acetone e metanolo e praticamente insolubile in etanolo, etere e acqua. Il suo peso molecolare è 252,27
Farmacocinetica[modifica | modifica wikitesto]
Assorbimento[modifica | modifica wikitesto]
L'assorbimento per via orale è completo, inoltre non viene influenzato dalla presenza di cibo.
Distribuzione[modifica | modifica wikitesto]
La distribuzione è alta in virtù della lipofilia della molecola; il suo volume di distribuzione è di 49 L. Il legame con le siero proteine è di circa il 40%.
Metabolismo[modifica | modifica wikitesto]
L'Oxcarbazepina è rapidamente ridotta dagli enzimi epatici nel suo metabolita 10-monoidrossi, MHD, che è il principale responsabile dell'effetto farmacologico. Il MHD è ulteriormente metabolizzato mediante coniugazione con acido glucuronico. Più piccole quantità (4% della dose) vengono ossidate nel metabolita farmacologicamente inattivo che è il 10,11-diidrossi (DHD).
Eliminazione[modifica | modifica wikitesto]
Il 95% della dose somministrata è eliminata con le urine, con meno dell'1% in forma immodificata. L'eliminazione fecale è inferiore al 4%. L'80% della dose eliminata è sotto forma di MHD glucoronide, il 27% MHD immodificato.
Farmacodinamica[modifica | modifica wikitesto]
L'esatto meccanismo attraverso il quale oxcarbazepina esercita il suo effetto anticonvulsivante non è del tutto conosciuto, si sa però che l'attività farmacologica dell'oxcarbazepina avviene soprattutto attraverso il suo metabolita 10-monoidrossi (MHD). Studi in vitro indicano il metabolita MHD provoca un blocco sui canali del sodio voltaggio-dipendenti, con conseguente stabilizzazione delle membrane neuronali ipereccitate, questa cosa comporta l'inibizione delle scariche neuronali ripetitive determinando come conseguenza una diminuzione della propagazione degli impulsi sinaptici.
Usi clinici[modifica | modifica wikitesto]
In label[modifica | modifica wikitesto]
Le indicazioni approvate da RCP[1] sono solamente: Epilessia, crisi parziali con o senza generalizzazione secondaria; crisi generalizzate tonico-cloniche.
Off-label[modifica | modifica wikitesto]
- Crisi da astinenza alcolica[7][8][9][10][11][12][13][14][15]
- Disturbo bipolare[16][17][18][19][20][21][22][23][24]
- Dolore neuropatico[22][25][26][27][28][29][30][31][32]
- Nevralgia del trigemino[22][33]
Tossicologia[modifica | modifica wikitesto]
Il farmaco in opportuni test in vitro e in vivo non ha mostrato effetti genotossici e capacità mutagena.
In caso di sovradosaggio, non esiste antidoto, si richiede un monitoraggio del paziente in ambiente ospedaliero.
Controindicazioni[modifica | modifica wikitesto]
Ipersensibilità al farmaco o alla carbamazepina o agli antidepressivi triciclici (TCA), precedenti di depressione midollare e blocco atrioventricolare, contemporaneo uso di IMAO[1].
Effetti collaterali[modifica | modifica wikitesto]
Ai dosaggi consigliati le reazioni avverse sono modeste solitamente si presentano: astenia, vertigini, disturbi della memoria, cefalea, tremori, disturbi del sonno, parestesie; labilità psichica, tinnito, atassia, depressione, diplopia, ansia, perdita di peso, ipotensione posturale.
In virtù di una analogia strutturale con la carbamazepina si possono prevedere gravi reazioni. Si segnalano casi di sindrome di Stevens-Johnson[34] ed eruzioni cutanee[35][36].
Dosi terapeutiche[modifica | modifica wikitesto]
Il dosaggio terapeutico ottimale va raggiunto gradualmente e va personalizzato per ogni paziente, le dosi sono[1]:
- adulti: 600-1.200 mg/die (max 3.000 mg/die) in 2-3 dosi giornaliere;
- pediatria: non va usato prima dei 3 anni, manca l'esperienza negli altri casi.
Sovradosaggio[modifica | modifica wikitesto]
Non esiste un antidodo specifico; il paziente va ricoverato in struttura ospedaliera dove verranno attentamente monitorizzate: i disturbi della conduzione cardiaca, i problemi respiratori e le anomalie elettrolitiche[1].
Gravidanza e allattamento[modifica | modifica wikitesto]
Va evitato l'uso in entrambe le situazioni[1].
Avvertenze[modifica | modifica wikitesto]
L'RCP[1] indica la necessità di utilizzo sotto stretto controllo medico. Si possono avere casi di diminuzione della natriemia.
Il cibo non determina una diminuzione dell'assorbimento del farmaco[1].
Ne pazienti in politerapia con più antiepilettici bisogna fare attenzioni alle possibili interazioni con: carbamazepina, fenitoina, valproato e lamotrigina. Inoltre interaggisce con: cimetidina, eritromicina, destropropossifene, felodipina.
In circa il 25% dei pazienti allergici alla carbamazepina si hanno fenomeni di allergia crociata.
Ogni modifica della crasi ematica, che va controllata durante la terapia, merita la sospensione della terapia; i sintomi premonitori delle alterazioni ematiche gravi sono: emorragie cutanee, ulcerazioni del cavo orale, febbre.
Interazioni[modifica | modifica wikitesto]
Ci sono complesse interazioni tra antiepilettici e la loro tossicità che può aumentare senza un corrispondente aumento dell'attività antiepilettica. Tali interazioni sono molto variabili e imprevedibili e il monitoraggio plasmatico è spesso consigliabile specie con terapie di combinazione tra vari farmaci.
Le concentrazioni plasmatiche del metabolita attivo di oxcarbazepina possono essere ridotta dagli induttori degli isoenzimi del citocromo P450, come la: carbamazepina, fenitoina o fenobarbital. L'oxcarbazepina sembra indurre gli enzimi epatici, in misura minore rispetto carbamazepina. Tuttavia, oxcarbazepina e il suo metabolita attivo inibiscono il citocromo P450 CYP2C19; e a dosi elevate può aumentare le concentrazioni plasmatiche di: fenobarbital o fenitoina. L'oxcarbazepina e il suo metabolita hanno la capacità di indurre anche il citocromo P450 CYP3A4 e CYP3A5, con la conseguenza di ridurre le concentrazioni plasmatiche di farmaci come: la carbamazepina, i calcio-antagonisti diidropiridinici e i contraccettivi orali.
Linee guida[modifica | modifica wikitesto]
La letteratura su oxcarbazepina è notevole; sono, infatti, 1106 i diversi lavori pubblicati presenti su Pubmed alla data di giugno 2010. Rilevante, inoltre, il fatto che sono ben 12 le Linee Guida che citano l'oxcarbazepina nel trattamento di diverse patologie, esse sono raggruppate per patologia:
Epilessia[modifica | modifica wikitesto]
* Management issues for women with epilepsy--focus on pregnancy (an evidence-based review)[37]
* Practice parameter update: management issues for women with epilepsy--focus on pregnancy (an evidence-based review)[38]
* ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes[39]
* Efficacy and tolerability of the new antiepileptic drugs I[40]
* Efficacy and tolerability of the new antiepileptic drugs II[41]
* Efficacy and tolerability of the new antiepileptic drugs, I: Treatment of new-onset epilepsy[42]
* Efficacy and tolerability of the new antiepileptic drugs, II: Treatment of refractory epilepsy[43]
* Psychopharmacological treatment with lithium and antiepileptic drugs[44]
Nevralgia del trigemino[modifica | modifica wikitesto]
* Trigeminal neuralgia[45]
* AAN-EFNS guidelines on trigeminal neuralgia management[46]
* Practice parameter: the diagnostic evaluation and treatment of trigeminal neuralgia (an evidence-based review)[47]
LG Oxcarbazepine[modifica | modifica wikitesto]
* Clinical recommendations for oxcarbazepine[48]
Note[modifica | modifica wikitesto]
- ^ a b c d e f g h i j k l TOLEP compresse divisibili, su torrinomedica.it. URL consultato l'8 luglio 2010.
- ^ Sigma Aldrich; rev. del 22.01.2014
- ^ S. Sweetman, Oxcarbazepine, in London: Pharmaceutical Press. (a cura di), Martindale: The Complete Drug Reference, lEectronic version, (2005).. URL consultato il 4 luglio 2010.
- ^ Brevetto: DE2011087 [collegamento interrotto], su wikipatents.com. URL consultato il 22 luglio 2010.
- ^ FDA (NDA) 021285, su accessdata.fda.gov. URL consultato il 22 luglio 2010.
- ^ Alfred Burger, Donald J. Abraham, Burger's medicinal chemistry and drug discovery, Hoboken, N.J., Wiley, 2003, p. 269, ISBN 0-471-37028-2.
- ^ Barrons R, Roberts N, The role of carbamazepine and oxcarbazepine in alcohol withdrawal syndrome, in J Clin Pharm Ther, vol. 35, n. 2, aprile 2010, pp. 153–67, DOI:10.1111/j.1365-2710.2009.01098.x, PMID 20456734. URL consultato il 22 luglio 2010.
- ^ B. Croissant, S. Loeber; A. Diehl; H. Nakovics; F. Wagner; F. Kiefer; K. Mann, Oxcarbazepine in combination with Tiaprid in inpatient alcohol-withdrawal--a RCT., in Pharmacopsychiatry, vol. 42, n. 5, settembre 2009, pp. 175-81, DOI:10.1055/s-0029-1202264, PMID 19724979.
- ^ A. De Sousa, The role of topiramate and other anticonvulsants in the treatment of alcohol dependence: a clinical review., in CNS Neurol Disord Drug Targets, vol. 9, n. 1, marzo 2010, pp. 45-9, PMID 20201814.
- ^ U. Bonnet, M. Schäfer; C. Richter; J. Milkereit; J. Wiltfang; N. Scherbaum; B. Lieb, [Anticonvulsants in the treatment of alcoholism], in Fortschr Neurol Psychiatr, vol. 77, n. 4, aprile 2009, pp. 192-202, DOI:10.1055/s-0028-1109214, PMID 19347790.
- ^ D. Koethe, A. Juelicher; BM. Nolden; WD. Braunwarth; J. Klosterkötter; G. Niklewski; N. Wodarz; J. Klatt; W. Burtscheidt; W. Gaebel; F. Markus Leweke, Oxcarbazepine--efficacy and tolerability during treatment of alcohol withdrawal: a double-blind, randomized, placebo-controlled multicenter pilot study., in Alcohol Clin Exp Res, vol. 31, n. 7, luglio 2007, pp. 1188-94, DOI:10.1111/j.1530-0277.2007.00419.x, PMID 17511748.
- ^ G. Martinotti, M. Di Nicola; R. Romanelli; S. Andreoli; G. Pozzi; N. Moroni; L. Janiri, High and low dosage oxcarbazepine versus naltrexone for the prevention of relapse in alcohol-dependent patients., in Hum Psychopharmacol, vol. 22, n. 3, aprile 2007, pp. 149-56, DOI:10.1002/hup.833, PMID 17397097.
- ^ G. Schik, FR. Wedegaertner; J. Liersch; L. Hoy; HM. Emrich; U. Schneider, Oxcarbazepine versus carbamazepine in the treatment of alcohol withdrawal., in Addict Biol, vol. 10, n. 3, settembre 2005, pp. 283-8, DOI:10.1080/13556210500224015, PMID 16109591.
- ^ G. Ponce, R. Rodríguez-Jiménez; H. Ortiz; G. Rubio; MA. Jiménez-Arriero; T. Palomo, [Oxcarbazepine in the prevention of epileptic syndromes in alcohol detoxification], in Rev Neurol, vol. 40, n. 10, pp. 577-80, PMID 15926128.
- ^ JA. French, The role of new antiepileptic drugs., in Am J Manag Care, vol. 7, 7 Suppl, luglio 2001, pp. S209-14, PMID 11474769.
- ^ CT. Gualtieri, LG. Johnson, Comparative neurocognitive effects of 5 psychotropic anticonvulsants and lithium., in MedGenMed, vol. 8, n. 3, 2006, p. 46, PMID 17406176.
- ^ R. Baldessarini, H. Henk; A. Sklar; J. Chang; L. Leahy, Psychotropic medications for patients with bipolar disorder in the United States: polytherapy and adherence., in Psychiatr Serv, vol. 59, n. 10, ottobre 2008, pp. 1175-83, DOI:10.1176/appi.ps.59.10.1175, PMID 18832504.
- ^ B. Waslick, Oxcarbazepine and pediatric bipolar disorder., in Am J Psychiatry, vol. 163, n. 12, dicembre 2006, pp. 2195; author reply 2196, DOI:10.1176/appi.ajp.163.12.2195, PMID 17151179.
- ^ KD. Wagner, RA. Kowatch; GJ. Emslie; RL. Findling; TE. Wilens; K. McCague; J. D'Souza; A. Wamil; RB. Lehman; D. Berv; D. Linden, A double-blind, randomized, placebo-controlled trial of oxcarbazepine in the treatment of bipolar disorder in children and adolescents., in Am J Psychiatry, vol. 163, n. 7, luglio 2006, pp. 1179-86, DOI:10.1176/appi.ajp.163.7.1179, PMID 16816222.
- ^ RA. Moreno, DH. Moreno; MB. Soares; R. Ratzke, [Anticonvulsants and antipsychotics in the treatment of bipolar disorder], in Rev Bras Psiquiatr, 26 Suppl 3, ottobre 2004, pp. 37-43, DOI:10./S1516-44462004000700009, PMID 15597138.
- ^ RS. McIntyre, DA. Mancini; P. Lin; J. Jordan, Treating bipolar disorder. Evidence-based guidelines for family medicine., in Can Fam Physician, vol. 50, marzo 2004, pp. 388-94, PMID 15318676.
- ^ a b c E. Spina, G. Perugi, Antiepileptic drugs: indications other than epilepsy., in Epileptic Disord, vol. 6, n. 2, giugno 2004, pp. 57-75, PMID 15246950.
- ^ JW. Jefferson, Oxcarbazepine in Bipolar Disorder., in Prim Care Companion J Clin Psychiatry, vol. 3, n. 4, agosto 2001, p. 181, PMID 15014606.
- ^ S. Nasr, Oxcarbazepine for mood disorders., in Am J Psychiatry, vol. 159, n. 10, ottobre 2002, p. 1793, PMID 12359694.
- ^ RM. Stepanovic-Petrovic, MA. Tomic; SM. Vuckovic; S. Paranos; ND. Ugresic; MS. Prostran; S. Milovanovic; B. Boskovic, The antinociceptive effects of anticonvulsants in a mouse visceral pain model., in Anesth Analg, vol. 106, n. 6, giugno 2008, pp. 1897-903, DOI:10.1213/ane.0b013e318172b993, PMID 18499629.
- ^ AK. Erdemoglu, A. Varlibas, Effectiveness of oxcarbazepine in symptomatic treatment of painful diabetic neuropathy., in Neurol India, vol. 54, n. 2, giugno 2006, pp. 173-7; discussion 177, PMID 16804263.
- ^ Y. Jang, ES. Kim; SS. Park; J. Lee; DE. Moon, The suppressive effects of oxcarbazepine on mechanical and cold allodynia in a rat model of neuropathic pain., in Anesth Analg, vol. 101, n. 3, settembre 2005, pp. 800-6, table of contents, DOI:10.1213/01.ane.0000167283.80463.d7, PMID 16115994.
- ^ P. Fenollosa-Vázquez, MA. Canós-Verdecho; C. Núñez-Cornejo; J. Pallarés-Delgado, [Effectiveness and safety of oxcarbazepine in chronic neuropathic pain: a study of 40 cases], in Rev Neurol, vol. 40, n. 12, pp. 711-5, PMID 15973635.
- ^ SP. Cohen, A. Sireci; CL. Wu; TM. Larkin; KA. Williams; RW. Hurley, Pulsed radiofrequency of the dorsal root ganglia is superior to pharmacotherapy or pulsed radiofrequency of the intercostal nerves in the treatment of chronic postsurgical thoracic pain., in Pain Physician, vol. 9, n. 3, luglio 2006, pp. 227-35, PMID 16886031.
- ^ TS. Jensen, NB. Finnerup, Management of neuropathic pain., in Curr Opin Support Palliat Care, vol. 1, n. 2, agosto 2007, pp. 126-31, DOI:10.1097/SPC.0b013e3282eeb45f, PMID 18685353.
- ^ CS. Zin, LM. Nissen; MT. Smith; JP. O'Callaghan; BJ. Moore, An update on the pharmacological management of post-herpetic neuralgia and painful diabetic neuropathy., in CNS Drugs, vol. 22, n. 5, 2008, pp. 417-42, PMID 18399710.
- ^ W. Pöllmann, W. Feneberg, Current management of pain associated with multiple sclerosis., in CNS Drugs, vol. 22, n. 4, 2008, pp. 291-324, PMID 18336059.
- ^ JM. Zakrzewska, PN. Patsalos, Oxcarbazepine: a new drug in the management of intractable trigeminal neuralgia., in J Neurol Neurosurg Psychiatry, vol. 52, n. 4, aprile 1989, pp. 472-6, PMID 2738589.
- ^ LC. Lin, PC. Lai; SF. Yang; RC. Yang, Oxcarbazepine-induced Stevens-Johnson syndrome: a case report., in Kaohsiung J Med Sci, vol. 25, n. 2, febbraio 2009, pp. 82-6, DOI:10.1016/S1607-551X(09)70045-2, PMID 19321411.
- ^ TC. Beswick, JB. Cohen, Dose-related levetiracetam-induced reticulated drug eruption., in J Drugs Dermatol, vol. 9, n. 4, aprile 2010, pp. 409-10, PMID 20514803.
- ^ SI. Hung, WH. Chung; ZS. Liu; CH. Chen; MS. Hsih; RC. Hui; CY. Chu; YT. Chen, Common risk allele in aromatic antiepileptic-drug induced Stevens-Johnson syndrome and toxic epidermal necrolysis in Han Chinese., in Pharmacogenomics, vol. 11, n. 3, marzo 2010, pp. 349-56, DOI:10.2217/pgs.09.162, PMID 20235791.
- ^ CL. Harden, PB. Pennell; BS. Koppel; CA. Hovinga; B. Gidal; KJ. Meador; J. Hopp; TY. Ting; WA. Hauser; D. Thurman; PW. Kaplan, Management issues for women with epilepsy--focus on pregnancy (an evidence-based review): III. Vitamin K, folic acid, blood levels, and breast-feeding: Report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and the American Epilepsy Society., in Epilepsia, vol. 50, n. 5, maggio 2009, pp. 1247-55, PMID 19507305.
- ^ CL. Harden, PB. Pennell; BS. Koppel; CA. Hovinga; B. Gidal; KJ. Meador; J. Hopp; TY. Ting; WA. Hauser; D. Thurman; PW. Kaplan, Practice parameter update: management issues for women with epilepsy--focus on pregnancy (an evidence-based review): vitamin K, folic acid, blood levels, and breastfeeding: report of the Quality Standards Subcommittee and Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology and American Epilepsy Society., in Neurology, vol. 73, n. 2, luglio 2009, pp. 142-9, DOI:10.1212/WNL.0b013e3181a6b325, PMID 19398680.
- ^ T. Glauser, E. Ben-Menachem; B. Bourgeois; A. Cnaan; D. Chadwick; C. Guerreiro; R. Kalviainen; R. Mattson; E. Perucca; T. Tomson, ILAE treatment guidelines: evidence-based analysis of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes., in Epilepsia, vol. 47, n. 7, luglio 2006, pp. 1094-120, DOI:10.1111/j.1528-1167.2006.00585.x, PMID 16886973.
- ^ JA. French, AM. Kanner; J. Bautista; B. Abou-Khalil; T. Browne; CL. Harden; WH. Theodore; C. Bazil; J. Stern; SC. Schachter; D. Bergen, Efficacy and tolerability of the new antiepileptic drugs I: treatment of new onset epilepsy: report of the Therapeutics and Technology Assessment Subcommittee and Quality Standards Subcommittee of the American Academy of Neurology and the American Epilepsy Society., in Neurology, vol. 62, n. 8, aprile 2004, pp. 1252-60, PMID 15111659.
- ^ JA. French, AM. Kanner; J. Bautista; B. Abou-Khalil; T. Browne; CL. Harden; WH. Theodore; C. Bazil; J. Stern; SC. Schachter; D. Bergen, Efficacy and tolerability of the new antiepileptic drugs II: treatment of refractory epilepsy: report of the Therapeutics and Technology Assessment Subcommittee and Quality Standards Subcommittee of the American Academy of Neurology and the American Epilepsy Society., in Neurology, vol. 62, n. 8, aprile 2004, pp. 1261-73, PMID 15111660.
- ^ JA. French, AM. Kanner; J. Bautista; B. Abou-Khalil; T. Browne; CL. Harden; WH. Theodore; C. Bazil; J. Stern; SC. Schachter; D. Bergen, Efficacy and tolerability of the new antiepileptic drugs, I: Treatment of new-onset epilepsy: report of the TTA and QSS Subcommittees of the American Academy of Neurology and the American Epilepsy Society., in Epilepsia, vol. 45, n. 5, maggio 2004, pp. 401-9, DOI:10.1111/j.0013-9580.2004.06204.x, PMID 15101821.
- ^ JA. French, AM. Kanner; J. Bautista; B. Abou-Khalil; T. Browne; CL. Harden; WH. Theodore; C. Bazil; J. Stern; SC. Schachter; D. Bergen, Efficacy and tolerability of the new antiepileptic drugs, II: Treatment of refractory epilepsy: report of the TTA and QSS Subcommittees of the American Academy of Neurology and the American Epilepsy Society., in Epilepsia, vol. 45, n. 5, maggio 2004, pp. 410-23, DOI:10.1111/j.0013-9580.2004.06304.x, PMID 15101822.
- ^ RW. Licht, P. Vestergaard; LV. Kessing; JK. Larsen; PH. Thomsen, Psychopharmacological treatment with lithium and antiepileptic drugs: suggested guidelines from the Danish Psychiatric Association and the Child and Adolescent Psychiatric Association in Denmark., in Acta Psychiatr Scand Suppl, n. 419, 2003, pp. 1-22, PMID 12974784.
- ^ M. van Kleef, WE. van Genderen; S. Narouze; TJ. Nurmikko; J. van Zundert; JW. Geurts; N. Mekhail, 1. Trigeminal neuralgia., in Pain Pract, vol. 9, n. 4, pp. 252-9, DOI:10.1111/j.1533-2500.2009.00298.x, PMID 19619267.
- ^ G. Cruccu, G. Gronseth; J. Alksne; C. Argoff; M. Brainin; K. Burchiel; T. Nurmikko; JM. Zakrzewska, AAN-EFNS guidelines on trigeminal neuralgia management., in Eur J Neurol, vol. 15, n. 10, ottobre 2008, pp. 1013-28, DOI:10.1111/j.1468-1331.2008.02185.x, PMID 18721143.
- ^ G. Gronseth, G. Cruccu; J. Alksne; C. Argoff; M. Brainin; K. Burchiel; T. Nurmikko; JM. Zakrzewska, Practice parameter: the diagnostic evaluation and treatment of trigeminal neuralgia (an evidence-based review): report of the Quality Standards Subcommittee of the American Academy of Neurology and the European Federation of Neurological Societies., in Neurology, vol. 71, n. 15, ottobre 2008, pp. 1183-90, DOI:10.1212/01.wnl.0000326598.83183.04, PMID 18716236.
- ^ PE. Smith, Clinical recommendations for oxcarbazepine., in Seizure, vol. 10, n. 2, marzo 2001, pp. 87-91, PMID 11421225.
Bibliografia[modifica | modifica wikitesto]
- Burger, BURGER'S MEDICINAL CHEMISTRY AND DRUG DISCOVERY Sixth Edition, a cura di Abraham john Wiley and Sons, Inc.,, Nervous System Agents, ISBN 0-471-37028-2.
- Kleemann e Engel, Pharmaceutical Substances. 4th Edition, a cura di Thieme, ISBN 0-471-37028-2.
- Sweetman, Martindale: The complete drug reference. London: Pharmaceutical Press, a cura di London: Pharmaceutical Press, 2005, ISBN 0-471-37028-2.<
- Wolfgang e Ritschel, Handbook of Basic Pharmacokinetics: Including Clinical Applications, 2009, ISBN 1-58212-126-5.
- Donato Sica e Franco Zollo, Chimica dei composti eterociclici farmacologicamente attivi, PICCIN, 2007, pp. 1–, ISBN 978-88-299-1881-2.
- Avanzini, Manuale italiano di epilettologia, PICCIN, 1992, pp. 1093–, ISBN 978-88-299-1056-4.
- Angelo Sghirlanzoni, Terapia Delle Malattie Neurologiche, Springer, 3 aprile 2010, pp. 466–, ISBN 978-88-470-1119-9.
- Giovanni B. Cassano e Antonio Tundo, Lo spettro dell'umore. Psicopatologia e clinica, Elsevier srl, 2008, pp. 591–, ISBN 978-88-214-2947-7.
- Macchi2005, 14 June 2011, PICCIN, 2005, pp. 870–, ISBN 978-88-299-1739-6.
- Elisa Trevisan e RIccardo Soffietti, Complicanze neurologiche nel paziente oncologico, SEEd, 2009, pp. 95–, ISBN 978-88-89688-40-3.
- Karl E. Misulis e Thomas C. Head, Neurologia di Netter, Elsevier srl, 2008, pp. 532–, ISBN 978-88-214-3041-1.
- G. Conti, E. Iannuzzi e F. Imperatore, Terapia intensiva. Con CD-ROM, Elsevier srl, 2007, pp. 1623–, ISBN 978-88-214-2990-3.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Oxcarbazepina
Wikimedia Commons contiene immagini o altri file su Oxcarbazepina
Collegamenti esterni[modifica | modifica wikitesto]
- www.guidausofarmaci.it, su guidausofarmaci.it.
- SIN epilessia [collegamento interrotto], su neuro.it.
- FA.NE.P. - Associazione Famiglie Neurologia Pediatrica, su fanep.org.
- L.I.C.E. - Lega Italiana Contro L'Epilessia, su lice.it.
- (EN) RCP USA-Mysoline, su rxlist.com.
- (EN) epilepsyfoundation.org.
- (EN) eMedicine: Antiepilettici: una panoramica, su emedicine.com.
- (EN) NINDS, su ninds.nih.gov. URL consultato il 7 luglio 2010 (archiviato dall'url originale l'11 marzo 2007).
- (EN) Uso degli Anticolvulsivanti nella farmacologia dell'asma bronchiale, su asthma.ge.
- (EN) MDNG: Anticonvulsanti e salute dell'Osso, su mdng.com. URL consultato il 7 luglio 2010 (archiviato dall'url originale il 28 aprile 2006).