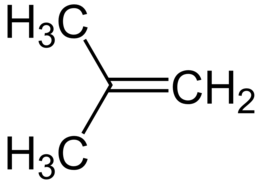
Isobutene
| Isobutene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 2-metilpropene | |
| Nomi alternativi | |
| isobutene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H8 |
| Massa molecolare (u) | 56,106 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 204-066-3 |
| PubChem | 8255 |
| SMILES | CC(=C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,5879 (in fase liquida) |
| Indice di rifrazione | 1,381 |
| Solubilità in acqua | 263 mg/L a 25 °C |
| Coefficiente di ripartizione 1-ottanolo/acqua | 2,34 |
| Temperatura di fusione | −140,3 °C (132,8 K) |
| Temperatura di ebollizione | −6,9 °C (266,2 K) |
| Punto critico | 144 °C |
| Indicazioni di sicurezza | |
| Limiti di esplosione | 1,8 - 9,6% vol. |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 220 - 280 |
| Consigli P | 210 - 377 - 381 - 403 [1] |
L'isobutene (o isobutilene, nome sistematico 2-metilpropene) è un idrocarburo alifatico, in particolare un alchene ramificato, isomero dell'alchene lineare 1-butene; la sua formula molecolare è (CH3)2C=CH2, a volte scritta anche Me2C=CH2.[2] L'isobutene è una sostanza di notevole interesse industriale.[3]
Proprietà e struttura molecolare[modifica | modifica wikitesto]
L'isobutene è un composto leggermente esotermico, ΔHƒ° = -17,9 kJ/mol.[4] A temperatura ambiente è in forma gassosa, anche se tecnicamente è un vapore (Teb = -7,1 °C; Tcr = 144,7 °C), più denso dell'aria (~2 volte). È incolore e ha lieve odore di benzina, è molto infiammabile e con l'aria forma miscele esplosive.[5] È quasi insolubile in acqua (263 mg/L a 25 °C), ma è solubile in alcool e etere, in benzene e in acido solforico.[6] Sotto pressione polimerizza facilmente.[6]
Lo scheletro di atomi di carbonio della molecola è planare con simmetria molecolare C2v; i carboni dei gruppi metilici (CH3, o Me) sono ibridati sp3, gli altri due, sp2. Questa molecola idrocarburica è lievemente polare: il suo momento di dipolo è pari a 0,50 D.[7]
Da indagini di diffrazione elettronica in fase gassosa sono stati ricavati i dati salienti della struttura molecolare. Dall'analisi dei dati è stato possibile ricavare angoli e lunghezze di legame; alcuni di questi parametri sono i seguenti:[8]
r(C–C) = 150,8 pm r(C=C) = 134,2 pm;
∠(CH3–C2–CH3) = 116,0°; ∠(CH3–C2=CH2) = 122,0°; ∠(H–C1–H) = 117,2°.
Mentre il legame C=C ha lunghezza quasi normale (134 pm[9]), il legame C–C è significativamente più corto dello standard (154 pm[9]). Questo accorciamento è previsto in base al fenomeno dell'iperconiugazione degli H dei metili con il doppio legame (in una forma limite questo legame è doppio).[10][11]
L'angolo tra i metili sul C2 e quello tra gli idrogeni sul C1 (metilene) sono un po' più stretti rispetto al valore ottimale di 120° per un C ibridato sp2. Entrambi questi restringimenti di angoli sono in accordo con le indicazioni VSEPR in base alle quali un doppio legame richiede più spazio angolare di un legame semplice e infatti l'angolo sul C2 tra metile e metilene è invece un po' maggiore dei 120°.[12]
Sintesi[modifica | modifica wikitesto]
Viene prodotto industrialmente per cracking catalitico o termico di frazioni altobollenti del petrolio o di miscele di idrocarburi saturi. Viene isolato e purificato o per assorbimento su acido solforico al 50% e successiva rigenerazione per distillazione in corrente di vapore o per rimozione degli altri buteni isomeri per assorbimento su setacci molecolari.
Altri processi di produzione dell'isobutene sono la disidratazione dell'alcol t-butilico e la deidrogenazione catalitica dell'isobutano,[13] che avviene secondo la reazione:

Si stima che nel 2002 la produzione mondiale abbia superato i 10 milioni di tonnellate, concentrata per l'80% negli Stati Uniti, seguiti da Europa e Giappone.
Complessi metallo-olefina[modifica | modifica wikitesto]
Diversi sali metallici, posti in atmosfera di olefine, le assorbono formando complessi π in cui l'olefina si dispone con il legame >C=C< perpendicolare all'asse di legame con il centro metallico.[14] L'argento tetrafluoroborato AgBF4 forma complessi di questo tipo con etilene, propilene e i vari buteni. In particolare, con l'isobutene si ottiene la coordinazione allo ione Ag+ (configurazione elettronica d10) di due molecole:[15]
AgBF4 + 2 i-C4H8 → AgBF4 • (i-C4H8)2
Il complesso è piuttosto stabile: a 25 °C la pressione di vapore dell'isobutene dal complesso è di soli 8,83 mm Hg.[15]
Applicazioni[modifica | modifica wikitesto]
L'isobutene non ha applicazioni dirette; trova uso solo come intermedio nella sintesi di altri materiali. Il suo utilizzo principale è come monomero nella produzione del corrispondente polimero; i polimeri e co-polimeri dell'isobutene sono gomme e materie plastiche.
Circa il 72% dell'isobutene prodotto viene convertito in gomma butilica; una frazione minore è usata per la produzione di antiossidanti per alimenti, imballi e materie plastiche. Altri impieghi sono nella sintesi di additivi per oli lubrificanti.
Combinato con formaldeide dà Isoprenolo, la cui produzione mondiale è stimata sulle 6-13.000 tonnellate.[16]
L’isobutene è anche un reagente fondamentale per la protezione del gruppo carbossilico, procedura importante nella sintesi di peptidi e proteine.
Note[modifica | modifica wikitesto]
- ^ scheda dell'isobutene su IFA-GESTIS
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 103-104.
- ^ (EN) Frank M.A. Geilen, Guido Stochniol e Stephan Peitz, Butenes, Wiley-VCH Verlag GmbH & Co. KGaA, 31 gennaio 2014, pp. 1–13, DOI:10.1002/14356007.a04_483.pub3, ISBN 978-3-527-30673-2. URL consultato il 15 marzo 2023.
- ^ (EN) 1-Propene, 2-methyl-, su webbook.nist.gov. URL consultato il 15 marzo 2023.
- ^ GESTIS-Stoffdatenbank, su gestis.dguv.de. URL consultato il 15 marzo 2023.
- ^ a b (EN) PubChem, Isobutylene, su pubchem.ncbi.nlm.nih.gov. URL consultato il 15 marzo 2023.
- ^ methylpropene, su www.stenutz.eu. URL consultato il 15 marzo 2023.
- ^ (EN) Ikuo Tokue, Tsutomu Fukuyama e Kozo Kuchitsu, Molecular structures of isobutene and 2,3-dimethyl-2-butene as studied by gas electron diffraction, in Journal of Molecular Structure, vol. 23, n. 1, 1º ottobre 1974, pp. 33–52, DOI:10.1016/0022-2860(74)85053-2. URL consultato il 15 aprile 2023.
- ^ a b J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ (EN) Robert S. Mulliken, Carol A. Rieke e Weldon G. Brown, Hyperconjugation *, in Journal of the American Chemical Society, vol. 63, n. 1, 1941-01, pp. 41–56, DOI:10.1021/ja01846a008. URL consultato il 15 marzo 2023.
- ^ (EN) J. O. Williams, C. Van Alsenoy e J. N. Scarsdale, Ab initio studies of structural features not easily amenable to experiment: Part 13. Structural consequences of methyl hyperconjugation in some CH3C(X)Y systems, in Journal of Molecular Structure: THEOCHEM, vol. 86, n. 1, 1º dicembre 1981, pp. 103–109, DOI:10.1016/0166-1280(81)85075-0. URL consultato il 15 marzo 2023.
- ^ J.E. Huheey, E.A. Keiter e R.L. Keiter, 6 - La struttura e la reattività delle molecole, in Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Piccin Nuova Libraria, Padova, 1999, pp. 209-223, ISBN 88-299-1470-3.
- ^ Hydrocarbon Chemistry, George A. Olah and Árpád Molnár, Wiley-Interscience, ISBN 978-0-471-41782-8
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 691-693, ISBN 88-299-1470-3.
- ^ a b (EN) H. W. Quinn e D. N. Glew, COORDINATION COMPOUNDS OF OLEFINS WITH SOLID COMPLEX SILVER SALTS: I. COORDINATION COMPOUNDS WITH ANHYDROUS SILVER FLUOBORATE, in Canadian Journal of Chemistry, vol. 40, n. 6, 1º giugno 1962, pp. 1103–1112, DOI:10.1139/v62-168. URL consultato il 15 aprile 2023.
- ^ Dati 2001, vedere la voce relativa al composto.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su isobutene
Wikimedia Commons contiene immagini o altri file su isobutene
| Controllo di autorità | Thesaurus BNCF 20018 |
|---|