Esafluoruro di zolfo
| Esafluoruro di zolfo | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SF6 |
| Massa molecolare (u) | 146,06 g/mol |
| Aspetto | gas incolore e inodore |
| Numero CAS | |
| Numero EINECS | 219-854-2 |
| PubChem | 17358 |
| DrugBank | DB11104 |
| SMILES | FS(F)(F)(F)(F)F |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,329 |
| Densità (kg·m−3, in c.s.) | 6,164 g/L ad 1 bar (~5,1 volte più denso dell'aria) |
| Solubilità in acqua | Bassa |
| Temperatura di fusione | −64 °C (209 K) (sublima);
decompone a 773 K (500 °C) |
| Temperatura di ebollizione | Sublima a condizioni normali |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 280 |
| Consigli P | 410+403 [1] |
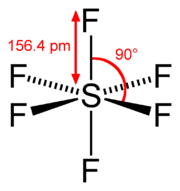
L'esafluoruro di zolfo è un composto inorganico con formula SF6. È un gas trasparente, privo di odore, non-tossico e non-infiammabile (sotto condizioni standard); ad 1 bar ha densità 6,164 g/L (è circa 5,1 volte più denso dell'aria). La molecola di SF6 ha una geometria ottaedrica, consistente in sei atomi di fluoro legati ad un atomo centrale di zolfo. È una molecola ipervalente. È poco solubile in acqua ma solubile in solventi organici apolari. È generalmente trasportato in forma liquefatta.
Sintesi e reazioni[modifica | modifica wikitesto]
SF6 può essere preparato a partire dagli elementi, tramite esposizione di S8 (solido) a F2 (gas).
Questo è il metodo scoperto e usato da Henri Moissan e Paul Lebeau nel 1901. Durante la sintesi si formano altri fluoruri (S2F10 ; SF4) i quali vengono eliminati tramite calore e lavando il prodotto con NaOH.
Alternativamente è possibile preparare l'esafluoruro di zolfo a partire da SF4 e CoF3 a bassa temperatura (circa 100 °C) in presenza di Bromo[2].
Il vantaggio di questa via sintetica è la maggiore purezza del prodotto.
Applicazioni[modifica | modifica wikitesto]
SF6 è un gas inerte e non è praticamente usato in reazioni di sintesi di altri prodotti.
- come gas tracciante in esperimenti per controllare ventilazione, perdite o infiltrazioni in edifici; è usato anche in idrogeologia;
- nella metallurgia per la produzione di alluminio e magnesio;
- nella fabbricazione di semiconduttori grazie al suo carattere inerte ed all'elevata densità (l'aria e gli inquinanti, più leggeri, vengono così allontanati);
- è usato negli acceleratori di particelle (bassa tendenza a ionizzarsi);
- è utilizzato come mezzo spegni arco elettrico negli interruttori MT e AT vista la sua elevata rigidità dielettrica (89 kV/cm) che aumenta con la pressione[3];
- viene utilizzato come dielettrico in cabine e stazioni, elettriche, blindate[4];
- in ambito medico per la disinfezione di presidi respiratori contro i microbi aerobi, come mezzo di contrasto in ecografia (sotto forma di microbolle iniettabili), e come tamponante intraoculare;
- nella fabbricazione di innovative celle fotovoltaiche denominate black silicon;
- in edilizia, all'interno delle vetrate isolanti (vetrocamera), per migliorare le prestazioni di isolamento acustico delle stesse.
- nell’ambito della propulsione dei siluri, è utilizzato nel moderno sistema propulsivo SCEPS (Stored Chemical Energy Propulsion System). In detto sistema, funzionante tramite ciclo Rankine, si fa avvenire all’interno di una caldaia la fusione di una massa di litio allo stato solido. Nel litio fuso si inietta successivamente una certa quantità di esafluoruro di zolfo che dà origine a una forte reazione esotermica controllata che permette all’acqua presente nelle serpentine della caldaia di evaporare e alimentare una piccola turbina. Quest’ultima aziona le classiche eliche controrotanti del sistema propulsivo del siluro, permettendo allo stesso di avanzare.
Data la sua elevata densità l'esafluoruro di zolfo è usato come trucco magico per simulare la presenza di "acqua invisibile" sulla quale far galleggiare oggetti leggeri (ad esempio una barchetta di alluminio).
L'esafluoruro di zolfo altera la voce: inalandone una piccola quantità si ottiene un tono più profondo, effetto opposto a quello che si ottiene inalando elio che, essendo meno denso dell'aria, provoca un innalzamento del tono.
Aspetti ambientali[modifica | modifica wikitesto]
SF6 è un gas serra, cioè uno dei gas che contribuiscono all'aumento dell'effetto serra, e risulta 24000 volte più pericoloso per l'ambiente dell'anidride carbonica.[5] Per questa ragione in Europa sono previste forti limitazioni al suo impiego[6][7].
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 05.12.2012
- ^ R. W. Winter, J. R. Pugh e P. W. Cook, SF5Cl, SF4 and SF6: Their Bromine−facilitated Production & a New Preparation Method for SF5Br, in 20th Winter Fluorine Conference, gennaio 9–14, 2011.
- ^ Gaetano Conte, Tecnologie e progettazione di sistemi elettrici ed elettronici, HOEPLI.
- ^ Gaetano Conte, Tecnologie e progettazione di sistemi elettrici ed elettronici, Milano, HOEPLI.
- ^ Nuova termocamera a infrarossi., in La Chimica & l'Industria, n. 9, Società Chimica Italiana, Novembre 2009, p. 67.
- ^ https://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX%3A32014R0517&qid=1608306002561
- ^ CEI EN 60480 https://mycatalogo.ceinorme.it/cei/item/0000017047?sso=y
Bibliografia[modifica | modifica wikitesto]
- E. Quaia, Mezzi di contrasto in ecografia: applicazioni addominali, Springer, 2007, ISBN 978-88-470-0616-4.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Esafluoruro di zolfo
Wikimedia Commons contiene immagini o altri file su Esafluoruro di zolfo
Collegamenti esterni[modifica | modifica wikitesto]
- Un oggetto leggero galleggia su esafluoruro di zolfo (video), su it.youtube.com.
- Esperimenti vocali divertenti (video), su youtube.com.
| Controllo di autorità | LCCN (EN) sh85130381 · GND (DE) 4180408-9 · J9U (EN, HE) 987007548504405171 |
|---|

