Perossido di idrogeno
| Perossido di idrogeno | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Diossido di diidrogeno | |
| Nomi alternativi | |
| acqua ossigenata | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H2O2 |
| Massa molecolare (u) | 34,0 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 231-765-0 |
| PubChem | 784 e 22326046 |
| DrugBank | DBDB11091 |
| SMILES | OO |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,45 |
| Temperatura di fusione | −0,4 °C (272,6 K) |
| Temperatura di ebollizione | 150 °C (423 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −187,8 |
| ΔfG0 (kJ·mol−1) | −120,4 |
| S0m(J·K−1mol−1) | 109,6 |
| C0p,m(J·K−1mol−1) | 89,1 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 271 - 302 - 314 - 332 - 335 [1] |
| Consigli P | 220 - 261 - 280 - 305+351+338 - 310 |
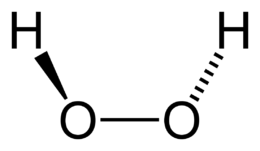
Il perossido di idrogeno, noto anche come acqua ossigenata, è il più semplice dei perossidi. La sua formula chimica è H2O2. Fu sintetizzato per la prima volta nel 1818 da Louis Jacques Thénard. La sua molecola, i cui due legami formano tra loro un angolo diedro di 111°, non è planare.
Proprietà chimiche
[modifica | modifica wikitesto]A temperatura ambiente è un liquido incolore, acquoso, corrosivo, che emana un caratteristico odore pungente. Per questo non è mai utilizzato puro, ma sempre in soluzione acquosa.
Si decompone convertendosi in acqua e ossigeno attraverso la seguente reazione esotermica:[2]
L'aumento della temperatura provocato dall'emissione di calore rende la sostanza ancora meno stabile, provocando una reazione di dissociazione a catena. Inoltre la decomposizione è catalizzata dalla presenza di ioni metallici, specialmente di ferro.
Lo stato d'ossidazione dell'ossigeno in acqua ossigenata è -1. Essendo uno stato intermedio tra gli stati 0 e -2, il perossido di idrogeno può funzionare sia da ossidante sia da riducente.
- Come ossidante:
- Come riducente:
La prima reazione è favorita in ambiente acido, mentre la seconda è favorita in ambiente basico.
L'acqua ossigenata può funzionare da ossidante o riducente estremamente ecologico; infatti, quando si comporta da riducente, si ossida a dare ossigeno, mentre, quando si comporta da ossidante, dà acqua, due composti dotati di potere inquinante nullo. Queste proprietà hanno fatto sì che alcuni processi chimici industriali (processi della green chemistry) utilizzino l'acqua ossigenata come reagente in modo da minimizzare il proprio impatto ambientale[3][4][5]. Un esempio è l'impiego di acqua ossigenata e acido peracetico al posto del cloro come sbiancante per la polpa di legno nella produzione della carta.[6]
Inoltre, l'acqua ossigenata è usata come precursore di iniziatori radicalici utilizzabili in reazioni di polimerizzazione radicalica. Ad esempio, l'azione dell'acqua ossigenata su sali acquosi di Fe2+ produce radicali HO• secondo la reazione:
Il perossido di idrogeno è un acido un po' più forte dell'acqua; in soluzioni acquose esso presenta un pKa di 11,75, corrispondente alla reazione:
La particolare struttura chimica fa sì che l'acqua ossigenata venga utilizzata per la sintesi di acidi organici percarbossilici mediante trattamento delle anidridi corrispondenti o degli acidi stessi. È anche un componente delle reazioni oscillanti di Briggs-Rauscher[7] e Bray-Liebhafsky[8].
Produzione
[modifica | modifica wikitesto]
L'acqua ossigenata è preparata in laboratorio facendo reagire perossido di bario e acido solforico:[2]
Industrialmente è prodotto con svariati processi. Uno dei più diffusi è quello che utilizza l'elettrolisi dell'acido solforico o del bisolfato di ammonio (NH4HSO4), seguito dall'idrolisi dello ione perossidisolfato (S2O82-) che si viene a formare. Un altro processo passa invece per l'auto-ossidazione dell'idrochinone (p-C6H4(OH)2) o uno dei suoi derivati. È in fase di sviluppo un metodo alternativo ecologico basato sulla riduzione elettrochimica di ossigeno e ossidazione dell'acqua[9][3].
Concentrazione in volumi
[modifica | modifica wikitesto]
L'acqua ossigenata si trova in commercio sotto forma di soluzione acquosa. Per indicare la concentrazione di acqua ossigenata si indicano i cosiddetti "volumi", che indicano il numero di litri di ossigeno che possono essere sviluppati in condizioni normali da un litro di soluzione acquosa di H2O2.[2] Ad esempio, un litro di soluzione di H2O2 a 5 volumi può sviluppare 5 litri di ossigeno, e corrisponde a una concentrazione dell'1,46% in peso.
L'utilizzo dell'indicazione dei "volumi" di una certa diluizione di perossido di idrogeno differisce dall'indicazione delle concentrazioni in percentuale e l'utilizzo di questi due metodi di misurazione è talvolta causa di errore. Per ovviare a questo esistono formule di conversione che permettono di passare da concentrazione percentuale a volumi, e viceversa.
In genere i fornitori per laboratori di analisi chimiche indicano la concentrazione percentuale dell'acqua ossigenata, mentre i produttori di articoli destinati all'uso domestico indicano i "volumi". Qui di seguito è riportato un elenco con le due misure di concentrazione a confronto:
Fra la concentrazione espressa in volumi e quella espressa in percentuale massa su massa, sussiste la seguente relazione:
Volumi = 3,294758315 × (Densità sz.)×(% m/m)
- Perossido di idrogeno 3% corrisponde a 10 volumi.
- Perossido di idrogeno 3,6% corrisponde a 12 volumi.
- Perossido di idrogeno 10% corrisponde a 34 volumi.
- Perossido di idrogeno 30% corrisponde a 111 volumi.
- Perossido di idrogeno 40% corrisponde a 154 volumi.
Concentrazioni elevate sono molto tossiche, anche letali, soprattutto se il prodotto è ingerito.[10]
Applicazioni
[modifica | modifica wikitesto]Come antisettico
[modifica | modifica wikitesto]È utilizzato come antisettico per escoriazioni, ferite e ulcere. Nell'utilizzo bisogna evitare che venga a contatto con la pelle sana e con gli occhi. Da evitare preparati che contengano permanganato di potassio o ioduro per incompatibilità. Si utilizza in misura che varia dal 3% al 6% (20 volumi) e dosi maggiori vengono diluite.[11]
Le bollicine che si formano al momento del contatto nascono per via dell'enzima catalasi che scinde la composizione del preparato liberando l'ossigeno, ciò comporta che la parte del tessuto necrotizzato si distacchi. Può portare a irritazione e dolore[12].
L'azione disinfettante è dovuta a un duplice meccanismo: da una parte l'acqua ossigenata agisce come ossidante, denaturando le proteine; dall'altra la formazione delle bollicine di ossigeno pulisce meccanicamente la ferita, eliminando eventuali batteri ivi depositati.
Come decolorante
[modifica | modifica wikitesto]In soluzione acquosa fino al 12% (40 volumi) è usato come decolorante per schiarire i capelli o i peli corporei, come sviluppatore nelle tinture a ossidazione, come smacchiatore del colore per capelli e come neutralizzante nelle permanenti (Regolamento 1223/2009 e s.m.i.; allegato III, n. 12)[13]. Inoltre, è usato al 35% in odontoiatria come sbiancante (uso strettamente medico).
Come propellente
[modifica | modifica wikitesto]In concentrazioni dall'85% al 98% trova impiego anche come propellente per razzi e siluri, sia come comburente per bruciare un opportuno combustibile, sia singolarmente. Quando viene usato da solo, è pompato in una camera di reazione rivestita internamente di argento che ne catalizza la decomposizione; la miscela di ossigeno e vapore acqueo ad alta pressione che si ottiene fornisce la spinta al razzo.
In fotografia
[modifica | modifica wikitesto]In fotografia si usa per aumentare il contrasto nelle cianotipie. Dopo l'esposizione ai raggi UV e lo sviluppo con acqua, si immerge la cianotipia per pochi secondi nell'acqua ossigenata in concentrazione intorno al 30% per dare una tonalità più ricca al colore blu. È necessario un successivo lavaggio di almeno dieci minuti. Immersioni più lunghe possono causare la scomparsa dell'immagine.
Pulizia e rinnovo delle plastiche ingiallite dal tempo e dalla luce solare
[modifica | modifica wikitesto]
È usato comunemente per la pulizia e il rinnovo dei colori delle parti in plastica, soprattutto acrilonitrile butadiene stirene, o ABS (ad esempio, i mattoncini LEGO), la cui superficie è andata incontro a ingiallimento; esistono vari metodi, anche in base al colore della plastica, che consistono nell’immersione in perossido di idrogeno, solitamente a 30 volumi, eventualmente attivato tramite luce UV, soprattutto per plastiche bianche, con tempi variabili in base alla potenza della fonte luminosa.
Note
[modifica | modifica wikitesto]- ^ scheda del perossido di idrogeno in soluzione al 35% su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ a b c Rolla, p. 291.
- ^ a b (EN) E.L. Gyenge e C.W. Oloman, Electrosynthesis of hydrogen peroxide in acidic solutions by mediated oxygen reduction in a three-phase (aqueous/organic/gaseous) system Part I: Emulsion structure, electrode kinetics and batch electrolysis, in Journal of Applied Electrochemistry, vol. 33, n. 8, 1º agosto 2003, pp. 655–663, DOI:10.1023/A:1025082709953. URL consultato il 12 agosto 2022 (archiviato il 12 maggio 2022).
- ^ (EN) Manman Jin, Zhenmei Guo e Xiaoping Ge, Tungsten-based organic mesoporous SBA-15 materials: characterization and catalytic properties in the oxidation of cyclopentene to glutaric acid with H2O2, in Reaction Kinetics, Mechanisms and Catalysis, vol. 125, n. 2, 1º dicembre 2018, pp. 1139–1157, DOI:10.1007/s11144-018-1486-x. URL consultato il 12 agosto 2022 (archiviato il 30 dicembre 2021).
- ^ (EN) Lulu Xie, Hongxia Wang e Bin Lu, Highly selective oxidation of styrene to benzaldehyde over Fe3O4 using H2O2 aqueous solution as oxidant, in Reaction Kinetics, Mechanisms and Catalysis, vol. 125, n. 2, 1º dicembre 2018, pp. 743–756, DOI:10.1007/s11144-018-1429-6. URL consultato il 12 agosto 2022 (archiviato il 30 dicembre 2021).
- ^ "Hydrogen peroxide bleaching of mechanical pulp fines" (Nordic Pulp and Paper Research Journal. Haugan, Marianne; Gregersen, Øyvind Weiby. 2006;Volume 21(1):105-110)
- ^ L. I. Csepei, Cs. Bolla, IS STARCH ONLY A VISUAL INDICATOR FOR IODINE IN THE BRIGGS-RAUSCHER OSCILLATING REACTION? (PDF), in Studia Universitatis Babes-Bolyai, Chemia, vol. 60, n. 2, pp. 187-199.
- ^ (EN) Itana Nuša Bubanja, Maja C. Pagnacco e Jelena P. Maksimović, Different influences of adrenaline on the Bray–Liebhafsky and Briggs–Rauscher iodate based oscillating reactions, in Reaction Kinetics, Mechanisms and Catalysis, vol. 123, n. 1, 1º febbraio 2018, pp. 47–59, DOI:10.1007/s11144-017-1305-9. URL consultato il 26 novembre 2019.
- ^ (EN) Samuel C. Perry, Dhananjai Pangotra e Luciana Vieira, Electrochemical synthesis of hydrogen peroxide from water and oxygen, in Nature Reviews Chemistry, vol. 3, n. 7, 2019-07, pp. 442–458, DOI:10.1038/s41570-019-0110-6. URL consultato il 26 novembre 2019.
- ^ Si ricorda in tal senso la morte di un bambino di 3 anni per aver ingerito del perossido di idrogeno al 40%. Vedi: Intossicazioni Acute: Veleni, Farmaci e Droghe p 94. Di Kent R. Olson. Springer, 1999. ISBN 978-88-470-0030-8
- ^ British national formulary, Guida all'uso dei farmaci 4 edizione p.553, Lavis, agenzia italiana del farmaco, 2007.
- ^ L'ulcera cutanea: approccio multidisciplinare alla diagnosi ed al trattamento. p. 405. M. Monti. Springer, 2000.ISBN 978-88-470-0072-8
- ^ Vedi anche formule quadro per notifica a CPNP: 4.1 - 2013; 11.8 - 2013; 11.9 - 2013; 11.13 - 2013; 11.17 - 2013; 11.18 - 2013; 12.13 - 2013; 12.14 - 2013; 12.17 - 2013
Bibliografia
[modifica | modifica wikitesto]- Luigi Rolla, Chimica e mineralogia. Per le Scuole superiori, 29ª ed., Dante Alighieri, 1987.
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «acqua ossigenata»
Wikizionario contiene il lemma di dizionario «acqua ossigenata» Wikimedia Commons contiene immagini o altri file su perossido di idrogeno
Wikimedia Commons contiene immagini o altri file su perossido di idrogeno
Collegamenti esterni
[modifica | modifica wikitesto]- acqua ossigenata, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- àcqua ossigenata, su sapere.it, De Agostini.
- (EN) hydrogen peroxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh85063431 · GND (DE) 4189281-1 · BNF (FR) cb119510333 (data) · J9U (EN, HE) 987007533739505171 · NDL (EN, JA) 00565090 |
|---|






