Glicolisi: differenze tra le versioni
→Fase di rendimento: ins. ref,s |
→Fase di rendimento: ins. ref.s |
||
| Riga 109: | Riga 109: | ||
|'''PGK''' |
|'''PGK''' |
||
|[[Transferasi]] |
|[[Transferasi]] |
||
|<small>La reazione media la conversione di [[Adenosindifosfato|ADP]] ad ATP, attraverso il trasferimento enzimatico di un gruppo fosfato presente sul glucide. È un esempio di [[fosforilazione a livello del substrato]].</small> |
|<small>La reazione media la conversione di [[Adenosindifosfato|ADP]] ad ATP, attraverso il trasferimento enzimatico di un gruppo fosfato presente sul glucide. È un esempio di [[fosforilazione a livello del substrato]].</small><ref name="Beutler-2007">{{Cita pubblicazione | cognome = Beutler | nome = E. | coauthors = | titolo = PGK deficiency. | rivista = Br J Haematol | volume = 136 | numero = 1 | pagine = 3-11 | mese = Jan | anno = 2007 | doi = 10.1111/j.1365-2141.2006.06351.x | id = PMID 17222195 }}</ref><ref name="Busque-1994">{{Cita pubblicazione | cognome = Busque | nome = L. | coauthors = DG. Gilliland | titolo = The PGK-PCR clonality assay (PPCA). | rivista = Methods Mol Biol | volume = 31 | numero = | pagine = 237-46 | mese = | anno = 1994 | doi = 10.1385/0-89603-258-2:237 | id = PMID 7921021 }}</ref><ref name="João-1993">{{Cita pubblicazione | cognome = João | nome = HC. | coauthors = RJ. Williams | titolo = The anatomy of a kinase and the control of phosphate transfer. | rivista = Eur J Biochem | volume = 216 | numero = 1 | pagine = 1-18 | mese = Aug | anno = 1993 | doi = | id = PMID 8365395 }}</ref> |
||
|- |
|- |
||
|[[#Reazione 8: fosfoglicerato mutasi|8]] |
|[[#Reazione 8: fosfoglicerato mutasi|8]] |
||
| Riga 125: | Riga 125: | ||
|'''ENO''' |
|'''ENO''' |
||
|[[Liasi]] |
|[[Liasi]] |
||
|<small>una molecola di H2O viene rimossa dalla posizione 2 per concentrare ulteriore energia chimica in prossimità del gruppo fosfato.</small><ref name="Puttick-2008">{{Cita pubblicazione | cognome = Puttick | nome = J. | coauthors = EN. Baker; LT. Delbaere | titolo = Histidine phosphorylation in biological systems. | rivista = Biochim Biophys Acta | volume = 1784 | numero = 1 | pagine = 100-5 | mese = Jan | anno = 2008 | doi = 10.1016/j.bbapap.2007.07.008 | id = PMID 17728195 }}</ref><ref name="Jedrzejas-2001">{{Cita pubblicazione | cognome = Jedrzejas | nome = MJ. | coauthors = P. Setlow | titolo = Comparison of the binuclear metalloenzymes diphosphoglycerate-independent phosphoglycerate mutase and alkaline phosphatase: their mechanism of catalysis via a phosphoserine intermediate. | rivista = Chem Rev | volume = 101 | numero = 3 | pagine = 607-18 | mese = Mar | anno = 2001 | doi = | id = PMID 11712498 }}</ref><ref name="Jedrzejas-2000">{{Cita pubblicazione | cognome = Jedrzejas | nome = MJ. | coauthors = | titolo = Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase. | rivista = Prog Biophys Mol Biol | volume = 73 | numero = 2-4 | pagine = 263-87 | mese = | anno = 2000 | doi = | id = PMID 10958932 }}</ref> |
|||
|<small>una molecola di H2O viene rimossa dalla posizione 2 per concentrare ulteriore energia chimica in prossimità del gruppo fosfato.</small> |
|||
|- |
|- |
||
|[[#Reazione 10: piruvato chinasi|10]] |
|[[#Reazione 10: piruvato chinasi|10]] |
||
| Riga 133: | Riga 133: | ||
|'''PK''' |
|'''PK''' |
||
|Transferasi |
|Transferasi |
||
|<small>Si tratta di un altro esempio di fosforilazione a livello del substrato, che converte una molecola di ADP in una di ATP, formando [[piruvato]] ('''Pyr''')</small>.<ref name="Lee-2008">{{Cita pubblicazione | cognome = Lee | nome = JC. | coauthors = | titolo = Modulation of allostery of pyruvate kinase by shifting of an ensemble of microstates. | rivista = Acta Biochim Biophys Sin (Shanghai) | volume = 40 | numero = 7 | pagine = 663-9 | mese = Jul | anno = 2008 | doi = | id = PMID 18604458 }}</ref><ref name="Roche-2007">{{Cita pubblicazione | cognome = Roche | nome = TE. | coauthors = Y. Hiromasa | titolo = Pyruvate dehydrogenase kinase regulatory mechanisms and inhibition in treating diabetes, heart ischemia, and cancer. | rivista = Cell Mol Life Sci | volume = 64 | numero = 7-8 | pagine = 830-49 | mese = Apr | anno = 2007 | doi = 10.1007/s00018-007-6380-z | id = PMID 17310282 }}</ref><ref name="Sugden-2006">{{Cita pubblicazione | cognome = Sugden | nome = MC. | coauthors = MJ. Holness | titolo = Mechanisms underlying regulation of the expression and activities of the mammalian pyruvate dehydrogenase kinases. | rivista = Arch Physiol Biochem | volume = 112 | numero = 3 | pagine = 139-49 | mese = Jul | anno = 2006 | doi = 10.1080/13813450600935263 | id = PMID 17132539 }}</ref> |
|||
|<small>Si tratta di un altro esempio di fosforilazione a livello del substrato, che converte una molecola di ADP in una di ATP, formando [[piruvato]] ('''Pyr''')</small>. |
|||
|- |
|- |
||
|} |
|} |
||
Versione delle 13:18, 13 ott 2010
La glicolìsi è un processo metabolico mediante il quale, in condizioni di anaerobiosi non stretta, una molecola di glucosio viene scissa in due molecole di piruvato al fine di generare molecole a più alta energia, come 2 molecole di ATP e 2 molecole di NADH per ogni molecola di glucosio utilizzata. Il termine deriva dal greco antico, "γλυκύς" (glykýs) che significa "dolce" e "λύσις" (lýsis) che significa "scissione".
La glicolisi è il mezzo per ottenere energia più sfruttato in natura, soprattutto grazie alla sua anaerobioticità, sebbene non sia il più efficiente.[1] Probabilmente esso si sviluppò con i primi procarioti[2][3] circa 3,5 miliardi di anni fa.[4][5]
In una prima fase del processo, composta da cinque passaggi, viene consumata energia per ottenere dal glucosio molecole di un derivato del glucosio a più alta energia (gliceraldeide-3-fosfato), che verranno poi trasformate nella fase successiva, composta di altri cinque passaggi, in molecole nettamente meno energetiche di piruvato, con produzione di energia superiore a quella consumata nella prima fase. Il processo nel suo insieme è quindi di tipo catabolico, cioè in cui molecole più complesse ed energetiche vengono trasformate in altre più semplici e meno energetiche, con accumulo di energia.
Le reazioni che compongono la glicolisi, ciascuna catalizzata da uno specifico enzima, avvengono nel citoplasma delle cellule; solo in alcuni protozoi[6] come i tripanosomi [7][8] e leishmanie[9] avvengono in un organulo apposito, chiamato glicosoma.[10][11]
La glicolisi è detta anche via di Embden-Meyerhof-Parnas, dai nomi di Gustav Embden,[12] Otto Meyerhof[13][14][15] e Jakub Parnas,[16][17][18] i tre biochimici che maggiormente contribuirono a chiarirne il meccanismo.
Scoperta della glicolisi
L'individuazione della via di degradazione dei glucidi fu uno dei primi grandi temi affrontati nell'Ottocento dalla nascente biochimica.[19][20][21] Si può dire che la disciplina si sia sviluppata di pari passo con la scoperta progressiva di dettagli sempre maggiori sulle fermentazioni, di cui la glicolisi è parte integrante.
I primi studi su questi processi furono avviati intorno al 1860, quando Louis Pasteur[22][23][24][25] individuò i microorganismi come responsabili delle fermentazioni.[26] Nel 1897 Hans e Eduard Buchner[27][28][29] scoprirono per puro caso che le fermentazioni possono avvenire anche solo in presenza di semplici estratti cellulari[30], smentendo il dogma ipotizzato da Pasteur, secondo cui i processi metabolici fossero possibili solo all'interno di una struttura vivente, come una cellula.[26]
Nel 1905 Arthur Harden[31][32][32] e William Young,[33][34] andando più nel dettaglio, individuarono le due frazioni subcellulari necessarie per lo svolgimento di una fermentazione: una frazione termosensibile ad alto peso molecolare (quella contenente gli enzimi) ed una non termosensibile a basso peso molecolare (contenente ADP, ATP, NAD+ e altri cofattori).
Nei primi decenni del Novecento si studiarono intensamente gli estratti cellulari di muscoli e lieviti, responsabili delle fermentazioni lattica ed alcolica, che si scoprì successivamente condividere la maggior parte degli enzimi e dei metaboliti. Le difficoltà maggiori in questi studi erano essenzialmente legate alla breve emivita degli intermedi metabolici, che impediva di analizzare il processo in maniera stabile. Il pathway, in ogni caso, fu completamente caratterizzato nel 1940, attraverso i contributi vari di Gustav Embden, Otto Meyerhof, Jakub Parnas, Carl Neuberg,[35][36][37] Otto Warburg[38][39][40], Gerty e Carl Cori.[41][42][43]
Cenni generali
La reazione completa della glicolisi è la seguente:
- Glucosio + 2 NAD+ + 2 ADP + 2 Pi → 2 NADH + 2 piruvato + 2 ATP + 2 H2O + 2 H+.
In tutti gli organismi che non prevedono ulteriori degradazioni del piruvato, il processo ha una resa energetica di due molecole di ATP per ogni molecola di glucosio (Glc) o per qualsiasi altro zucchero esoso degradabile da questa via metabolica. Il catabolismo glucidico degli organismi che svolgono comunemente le fermentazioni, come i lieviti, dunque, si ferma al piruvato (che solitamente viene interconvertito in altre forme senza che ciò comporti ulteriori guadagni energetici).
Per gli organismi superiori, come ad esempio i mammiferi, la glicolisi è invece solo il primo passaggio della degradazione degli zuccheri. Le due molecole di ATP da essa ottenute sono solo una piccola parte del totale delle molecole di ATP ottenibili a partire da una molecola di glucosio, che possono arrivare fino a 36/38. Le cellule in grado di svolgere i successivi pathway aerobici (come il ciclo di Krebs), dunque, sono in grado di processare il piruvato, ossidandolo fino ad ottenere anidride carbonica ed acqua. Anche in questi organismi, in ogni caso, la glicolisi può diventare l'unico pathway, senza che il piruvato sia ulteriormente ossidato. Ciò può avvenire in caso di sforzo intenso (soprattutto nei tessuti energeticamente più esigenti, come i muscoli): in questo caso, il piruvato viene convertito ad acido lattico per riconvertire il NADH a NAD+ e bilanciarne le concentrazioni cellulari.
La glicolisi può essere suddivisa in due fasi: la prima fase è detta fase di investimento, la seconda è la fase di rendimento.
Fase di investimento
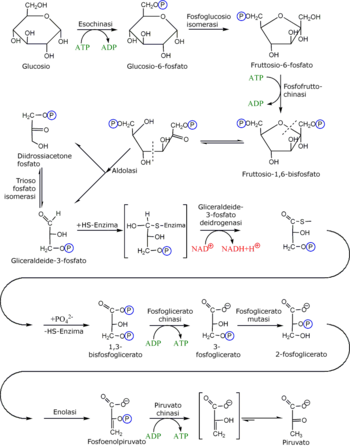
Nella fase di investimento, il glucosio viene fosforilato a glucosio-6-fosfato ed infine scisso in due molecole di gliceraldeide-3-fosfato; ciò avviene attraverso l'utilizzo di due molecole di ATP. I primi cinque passaggi della via metabolica, dunque, comportano un consumo netto di energia.
| Step | Substrato | Enzima | Classe dell'enzima | Descrizione | ||
|---|---|---|---|---|---|---|
| 1 | Glucosio | Glc | Esochinasi | HK | Transferasi | Questo step utilizza ATP per fosforilare il glucosio. Questa reazione presenta una ΔG molto bassa: per questo motivo, la reazione è irreversibile.[44] |
| 2 | Glucosio-6-fosfato | G6P | Fosfoglucosio isomerasi | PGI | Isomerasi | Il cambiamento di struttura è ottenuto attraverso una reazione redox, nella quale l'aldeide viene ridotta ad alcol ed il carbonio adiacente è ossidato a diventare un chetone. Sebbene la reazione non abbia una ΔG molto favorevole, è molto efficiente a causa delle basse concentrazioni di fruttosio-6-fosfato, metabolizzato molto velocemente nello step seguente (questo fenomeno è comprensibile per la legge di azione di massa).[45] |
| 3 | Fruttosio-6-fosfato | F6P | Fosfofruttochinasi | PFK-1 | Transferasi | In questo step c'è nuovamente dispendio di energia attraverso un'altra molecola di ATP. Tale spesa può essere giustificata in due modi: il processo glicolitico da qui in poi è irreversibile e l'energia fornita al glucide lo destabilizza.[46] |
| 4 | Fruttosio 1,6-bisfosfato | F1,6BP | Aldolasi | ALDO | Liasi | La molecola, destabilizzata dalla precedente reazione, è passibile di scissione da parte dell'aldolasi in due molecole glucidiche da tre atomi di carbonio: diidrossiacetone fosfato e gliceraldeide 3-fosfato.[47] |
| 5 | Diidrossiacetone fosfato | DHAP | Trioso fosfato isomerasi | TPI | Isomerasi | La trioso fosfato isomerasi converte rapidamente il DHAP in gliceraldeide 3-fosfato.[48] |
Fase di rendimento
Nella seconda fase, quella di rendimento, le due molecole di gliceraldeide-3-fosfato vengono trasformate in due molecole di piruvato con conseguente produzione di quattro molecole di ATP e due di NADH (per riduzione del NAD+), le quali permettono di rigenerare anche il pool di molecole riducenti presenti nella cellula. Questa seconda fase, dunque, vede un recupero di energia, che porta l'intero pathway glicolitico ad un guadagno netto di energia.
| Step | Substrato | Enzima | Classe dell'enzima | Descrizione | ||
|---|---|---|---|---|---|---|
| 6 | Gliceraldeide 3-fosfato | GADP | Gliceraldeide 3-fosfato deidrogenasi | GAP | Ossidoreduttasi | I triosi sono ossidati (attraverso il prelievo di un idrogeno) e addizionati di un fosfato inorganico. L'idrogeno viene utilizzato per ridurre due molecole di NAD+, che diventano NADH + H+.[49][50][51] |
| 7 | 1,3-bisfosfoglicerato | 1,3BPG | Fosfoglicerato chinasi | PGK | Transferasi | La reazione media la conversione di ADP ad ATP, attraverso il trasferimento enzimatico di un gruppo fosfato presente sul glucide. È un esempio di fosforilazione a livello del substrato.[52][53][54] |
| 8 | 3-fosfoglicerato | 3PG | Fosfoglicerato mutasi | PGAM | Isomerasi | La reazione media lo spostamento del gruppo fosfato dalla posizione 3 alla posizione 2 per disporre lo stesso in posizione più favorevole. |
| 9 | 2-fosfoglicerato | 2PG | Enolasi | ENO | Liasi | una molecola di H2O viene rimossa dalla posizione 2 per concentrare ulteriore energia chimica in prossimità del gruppo fosfato.[55][56][57] |
| 10 | Fosfoenolpiruvato | PEP | Piruvato chinasi | PK | Transferasi | Si tratta di un altro esempio di fosforilazione a livello del substrato, che converte una molecola di ADP in una di ATP, formando piruvato (Pyr).[58][59][60] |
Risultato netto della glicolisi
La produzione finale del piruvato è necessaria per il ciclo di Krebs (detto anche ciclo degli acidi tricarbossilici), dove vengono prodotti i coenzimi ridotti (NAD ridotto e FAD ridotto) che, riossidandosi nella catena respiratoria, produrranno molecole di ATP.
Il guadagno complessivo della glicolisi risulta essere, pertanto, di due molecole di ATP e due di NADH, come indica la già citata reazione complessiva:
- Glucosio + 2 NAD+ + 2 ADP + 2 Pi → 2 NADH + 2 piruvato + 2 ATP + 2 H2O + 2 H+
Tappe della glicolisi
Prima parte (Fase di investimento)
La prima parte della glicolisi consiste anzitutto nella conversione del glucosio in fruttosio 1,6-bisfosfato: tale conversione genera di fatto un intrappolamento della molecola glucidica nella cellula (il fosfato carica infatti la molecola, impedendole di attraversare la membrana cellulare). Il fruttosio 1,6-bisfosfato, oltre ad essere una molecola carica, è anche facilmente scindibile in due molecole più piccole da tre atomi di carbonio: queste due molecole saranno i substrati della seconda fase della via metabolica. I passaggi enzimatici della prima fase sono di seguito riportati.
Reazione 1: esochinasi

Il glucosio intracellulare viene fosforilato per azione dell'enzima esochinasi e trasformato in glucosio-6-fosfato con consumo di una molecola di ATP. Questo step è uno dei tre passaggi chiave dell'intero pathway, dal momento che la molecola di glucosio fosforilato, oltre a non poter più uscire dalla membrana cellulare, si destabilizza, diventando più prona a proseguire la via catabolica.
La esochinasi è un enzima la cui attività dipende dalla presenza di ioni magnesio. Uno ione magnesio bivalente è presente nel sito attivo dell'enzima ed agisce formando un complesso ternario esochinasi-ATP-Mg2+. Ma a differenza di altri enzimi specifici questo ha un'affinità anche per altri zuccheri, come il mannosio (la sua KM è di circa 10-6).[61]
Il glucosio-6-fosfato intracellulare può avere differenti destini. Infatti, nel fegato e nei muscoli può prendere la via della glicogenosintesi per sintetizzare glicogeno, rispettivamente epatico e muscolare. Inoltre circa il 3% del glucosio intracellulare viene ossidato nella via dei pentoso-fosfati che è principalmente preposta alla sintesi del NADPH (NAD-fosfato-ridotto) ed alla sintesi del ribosio-5-fosfato. Il NADPH viene utilizzato dalla cellula per i propri processi biosintetici; il ribosio-5-fosfato viene utilizzato per la sintesi di tutti i nucleotidi.
Reazione 2: fosfoglucosio isomerasi
 |
Il passaggio successivo della glicolisi consiste nella isomerizzazione del glucosio-6-fosfato a fruttosio-6-fosfato. L'enzima fosfoglucosio isomerasi (o fosfoglucoisomerasi), anch'esso Mg-dipendente, catalizza questa reazione di conversione di un glucide aldoso in un chetoso. Tale reazione, in realtà, richiede più passaggi intermedi di quanti si possano immaginare: l'enzima è infatti in grado di aprire la struttura ciclica del glucosio (anello a sei atomi di carbonio), isomerizzare la molecola e richiuderla nella struttura ciclica del fruttosio (anello a cinque termini). |
|
Reazione 3: fosfofruttochinasi
 |
In seguito all'isomerizzazione, il fruttosio 6-fosfato viene sottoposto ad un'altra fosforilazione. L'enzima fosfofruttochinasi1 catalizza tale reazione fino alla produzione di fruttosio-1,6-bisfosfato[62], trasferendo un fosfato dall'ATP alla posizione 1 della molecola di fruttosio. Anche questa reazione, a causa dell'idrolisi di ATP, non è reversibile. La fosfofruttochinasi è un enzima allosterico, Mg2+ dipendente.[61] Esso può essere inibito dall'ATP, dal citrato e dal suo prodotto, il fruttosio-1,6-bisfosfato. Viene invece attivato dall'ADP, dall'AMP e dal fruttosio-2,6-bisfosfato. Quest'ultima molecola viene ottenuta per fosforilazione del fruttosio-6-fosfato ad opera di un'altra fosfofruttochinasi, la fosfofruttochinasi 2. |
|
Reazione 4: aldolasi
 |
Il fruttosio-1,6-bisfosfato prodotto dal precedente step è, di fatto, la versione attivata vera e propria del glucosio, quindi la glicolisi può avviare la degradazione vera e propria, producendo due triosi aventi un fosfato ciascuno. La quarta reazione della glicolisi, catalizzata dall'enzima, Mg2+ dipendente,[61] aldolasi, consiste dunque nella scissione del fruttosio-1,6-bisfosfato in diidrossiacetone fosfato e gliceraldeide-3-fosfato. |
|
Reazione 5: trioso fosfato isomerasi
 |
L'aldolasi ha scisso l'esoso in due triosi diversi: dal momento che seguire due vie metaboliche differenti per entrambi le molecole ottenute sarebbe energeticamente molto dispendioso, l'evoluzione del pathway glicolitico ha selezionato un enzima in grado di rendere uniforme la successiva degradazione dei due triosi. La trioso fosfato isomerasi è infatti l'enzima deputato a convertire il diidrossiacetone fosfato in gliceraldeide-3-fosfato, il substrato unico del successivo step. L'enzima è infatti in grado di prelevare un H+ da un atomo di carbonio, spostandolo su un altro vicino: in questo modo il trioso passa dalla forma chetonica a quella aldeidica. Il ΔG° di reazione, in realtà, è spostato verso la formazione di diidrossiacetone fosfato ma, per la legge di azione di massa, l'equilibrio della reazione è spostato verso destra, dal momento che la concentrazione cellulare di gliceraldeide-3-fosfato è molto bassa (le percentuali risultanti sono 96% di DHAP, 4% di G3P). La gliceraldeide-3-fosfato, infatti, viene velocemente metabolizzata dallo step successivo della via metabolica. |
|
Seconda parte (Fase di rendimento)
Gli step precedenti della glicolisi hanno prodotto due molecole di gliceraldeide-3-fosfato, ma non hanno ancora ricavato alcun tipo di energia dal processo. Al contrario, fino ad ora sono state spese due molecole di ATP. Le reazioni della seconda fase permettono alla cellula di ricavare energia dalla degradazione della gliceraldeide-3-fosfato.
Reazione 6: gliceraldeide-3-fosfato deidrogenasi
 |
La gliceraldeide-3-fosfato viene convertita in 1,3-bisfosfoglicerato dalla gliceraldeide-3-fosfato deidrogenasi. Tale reazione consiste nella somma di due processi: l'ossidazione dell'aldeide ad acido carbossilico mediata dal coenzima NAD+ (che si riduce a NADH) e la fosforilazione, (cioè l'attacco di un gruppo fosfato) al gruppo carbossilico. La prima reazione è abbastanza favorita dal punto di vista termodinamico (ΔG° di circa -50 kJ mol-1), mentre la seconda è sfavorita, essendo il suo ΔG° di segno opposto. Se queste due reazioni avvenissero in semplice sequenza, la seconda avrebbe una energia di attivazione talmente alta da renderla di fatto impossibile. Queste due reazioni, in realtà, vengono accoppiate attraverso l'enzima gliceraldeide-3-fosfato deidrogenasi, che rende dunque la fosforilazione effettivamente possibile. Il potenziale di ossidazione viene conservato sotto forma di potenziale riducente presente sul NADH, il quale cederà i suoi elettroni alla catena respiratoria per la produzione di molecole di ATP. L'1,3-bifosfoglicerato è un composto ad altissima energia con un ΔG° di idrolisi di circa -49,4 KJ/mole. |
|
Reazione 7: fosfoglicerato chinasi
 |
La settima tappa della glicolisi consiste nell'inizio della vera e propria fase di recupero, che consiste nella produzione di ATP. Attraverso l'enzima, Mg2+ dipendente,[61] fosfoglicerato chinasi, infatti, l'1,3-bisfosfoglicerato cede un gruppo fosfato ad un ADP, che così viene ricaricato ad ATP. Questo genere di produzione di ATP è definita fosforilazione a livello del substrato, dal momento che la molecola donatrice, l'1,3-bisfosfoglicerato, è un substrato ad alto potenziale di trasferimento di un gruppo fosfato. Come avviene per la esochinasi, anche la fosforilazione di ADP deve avvenire lontano dall'ambiente acquoso. Per questo motivo la fosfoglicerato chinasi è dotata di una tasca in grado di riparare i substrati dall'ambiente esterno. |
|
Reazione 8: fosfoglicerato mutasi
 |
Le ultime tre reazioni della glicolisi consistono nella conversione del 3-fosfoglicerato in piruvato, attraverso una concomitante conversione di un'altra molecola di ADP in ATP. La prima reazione è un riarrangiamento. La posizione del gruppo fosfato viene cambiata dal carbonio in posizione 3 a quello in posizione 2, attraverso la catalisi della fosfoglicerato mutasi (come le altre mutasi, si tratta di un enzima coinvolto nel riarrangiamento interno delle molecole). La reazione, tuttavia, non consiste in un semplice spostamento. L'enzima, infatti, lavora innanzitutto come una fosfatasi, rimuovendo il fosfato in posizione 3 da una molecola di 2,3-difosfoglicerato e generando il prodotto 2-fosfoglicerato). Tale fosfato rimane legato ad un residuo di istidina dell'enzima e viene successivamente attaccato alla molecola di 3-fosfoglicerato (il substrato della reazione), che così rigenera il 2,3-difosfoglicerato. L'enzima, dunque, necessita di una notevole quantità di 2,3-difosfoglicerato perché il residuo di istidina, indispensabile per la reazione, sia sempre fosforilato. L'enzima coinvolto è anch'esso magnesio-dipendente. |
|
Reazione 9: enolasi
 |
La penultima reazione è essenzialmente una disidratazione del 2-fosfoglicerato che porta alla formazione di fosfoenolpiruvato, un composto ad alta energia, ed acqua. Questa disidratazione, catalizzata dall'enzima enolasi, innalza notevolmente il potenziale di trasferimento del gruppo fosfato. Se il ΔG°´ di idrolisi di un fosfato legato ad un alcol è infatti di circa - 13 kJ mol-1, quello del fosfoenolpiruvato raggiunge i - 62 kJ mol-1. Tale valore è dovuto alla forte instabilità della forma enolica della molecola, che cessa solo quando essa raggiunge una più stabile forma chetonica (ovvero il piruvato). L'enolasi è una liasi la cui attività è stimolata da manganese o da magnesio ed è inibita da uno ione fluoruro. |
|
Reazione 10: piruvato chinasi
 |
Nell'ultima tappa il fosfoenolpiruvato, ad opera della [[piruvato chinasi],] Mg2+ dipendente,[61] viene anzitutto idrolizzato in enolpiruvato. Il gruppo fosfato viene ceduto ad un ADP per formare ATP. L'energia necessaria alla produzione di ATP proviene dalla conversione dell'enolpiruvato in piruvato, reazione fortemente esoergonica. La forma enolica del piruvato possiede infatti un potenziale energetico alto ma è molto instabile, quindi tramite una tautomeria cheto-enolica, con la dislocazione degli elettroni dall'atomo di ossigeno all'atomo di carbonio, viene trasformato in piruvato. La piruvato chinasi è un enzima fortemente regolato: il controllo a valle garantisce che l'ATP venga prodotto solo in caso di effettivo bisogno. Il piruvato è il prodotto finale della glicolisi e, a seconda degli organismi e delle condizioni fisiologiche, può andare incontro a diversi destini, tra cui la sua trasformazione in acetil-CoA tramite la decarbossilazione ossidativa. |
|
Ingresso nel pathway di esosi alternativi al glucosio
Sebbene il glucosio sia il monosaccaride più utilizzato dalla glicolisi, anche altri zuccheri possono essere utilizzati dalla via metabolica. Si considerino, ad esempio, gli ingressi nella via glicolitica di altri due glucidi molto abbondanti negli alimenti: il fruttosio ed il galattosio.
Ingresso del fruttosio
La maggior parte del fruttosio ingerito con la dieta è metabolizzato a livello epatico, attraverso il cosiddetto pathway del fruttosio-1-fosfato. L'enzima fruttochinasi, infatti, fosforila il fruttosio, producendo una molecola di fruttosio-1-fosfato. Tale molecola è successivamente convertita in una di diidrossiacetone fosfato, un intermedio della glicolisi, ed una di gliceraldeide, attraverso una specifica aldolasi (la fruttosio-1-fosfato aldolasi). La gliceraldeide viene ulteriormente fosforilata da una chinasi (la trioso chinasi) a diventare gliceraldeide-3-fosfato, che può entrare nel pathway glicolitico assieme al diidrossiacetone fosfato.
Un'altra via per l'ingresso del fruttosio può essere la sua fosforilazione a fruttosio-6-fosfato attraverso l'enzima esochinasi. In ogni caso, l'affinità del glucosio per l'enzima è 20 volte maggiore del fruttosio. Nel fegato viene prodotta una ridottissima quantità di fruttosio-6-fosfato, perché il glucosio che vi si trova è molto più abbondante del fruttosio. Allo stesso modo, il glucosio viene immediatamente intrappolato anche nei muscoli, sempre attraverso la esochinasi. Per questi motivi, tessuti meno metabolicamente attivi come il tessuto adiposo si trovano a metabolizzare maggiormente il fruttosio, l'esoso a cui sono maggiormente esposti. La formazione di fruttosio-6-fosfato, non più inibito competitivamente dal glucosio, è così maggiormente favorita in questi tessuti.
Ingresso del galattosio
Non esistono pathway in grado di metabolizzare il galattosio, così la strategia cellulare per la sua degradazione consiste nella sua conversione a glucosio. La molecola viene più precisamente convertita in glucosio-6-fosfato, attraverso i quattro step del cosiddetto pathway di interconversione glucosio-galattosio.
- Nella prima reazione il galattosio viene convertito dall'enzima galattochinasi in galattosio-1-fosfato.
- Il galattosio-1-fosfato viene legato ad una molecola di uridina, a partire da una molecola di UDP-glucosio (UDP-glucose), un intermedio della sintesi del glicogeno. I prodotti di questa reazione sono il glucosio-1-fosfato ed una molecola di UDP-galattosio. Tale reazione è catalizzata dalla galattosio-1-fosfato uridil transferasi.
- Lo scheletro dell'UDP-galattosio è dunque epimerizzato a glucosio. La configurazione dell'ossidrile in posizione 4 viene invertita dall'enzima UDP-galattosio 4-epimerasi (noto anche come galattowaldenasi o semplicemente waldenasi, dal nome del chimico Paul Walden).
- Infine, il glucosio-1-fosfato prodotto dal galattosio è isomerizzato a glucosio-6-fosfato dalla fosfoglucomutasi, altro enzima utilizzato nella sintesi del glicogeno.
Occorre notare che non viene consumata alcuna molecola di UDP-glucosio nella conversione del galattosio a glucosio: essa viene semplicemente rigenerata a partire dall'UDP-galattosio attraverso la epimerasi.
Controllo della velocità di flusso
La velocità di flusso nel pathway glicolitico è in grado di adattarsi molto bene in risposta a stimoli provenienti dall'interno e dall'esterno della cellula. Essa è regolata per massimizzare la presenza di due metaboliti principali: l'ATP ed i mattoni fondamentali per le reazioni di biosintesi, come gli amminoacidi. Nella glicolisi, solo le reazioni catalizzate da esochinasi, fosfofruttochinasi e piruvato chinasi sono effettivamente irreversibili. Nelle comuni vie metaboliche, enzimi di questo tipo sono solitamente potenziali siti di controllo: in effetti, nella glicolisi il controllo del flusso è del tutto legato alla regolazione dell'attività di questi tre enzimi.
Esistono diversi modi per regolare l'attività di un enzima. Un meccanismo immediato di controllo è quello che avviene attraverso regolazione allosterica o attraverso modificazioni covalenti (come una fosforilazione). Una forma più lenta di controllo coinvolge invece direttamente l'espressione genica dei singoli enzimi del pathway.
Controllo dell'esochinasi
La esochinasi è inibita da elevate concentrazioni di glucosio-6-fosfato, il prodotto da essa generato in seguito alla fosforilazione del glucosio. Tale inibizione è necessaria per prevenire l'accumulo di questo metabolita nella cellula nei casi in cui la velocità di flusso complessiva del pathway è bassa. Il glucosio entrato nella cellula, infatti, fintantoché non viene processato dalla esochinasi, è libero di diffondere nuovamente verso il circolo sanguigno (rendendosi disponibile eventualmente ad altri distretti dell'organismo), a differenza di quanto avviene per il glucosio-6-fosfato, carico e dunque impossibilitato a passare la membrana. Un suo eccessivo accumulo, inoltre, causerebbe un elevato rigonfiamento della cellula per osmosi.
Nelle cellule epatiche, il glucosio-6-fosfato in eccesso viene accumulato come glicogeno. In queste cellule, come già detto, non è presente la comune esochinasi, ma la glucochinasi.[63] Essa non viene inibita dal G6P, dunque può continuare a produrlo liberamente, dal momento che l'eccesso viene indirizzato a diventare glicogeno. Questo meccanismo è fondamentale nei casi in cui la glicemia è alta[64] (ad esempio al termine di un pasto), ma anche quando la glicemia è molto bassa (a digiuno), dal momento che il glicogeno può essere nuovamente convertito a glucosio-6-fosfato entrando nella via glicolitica oppure tornando a glucosio (attraverso l'enzima glucosio-6-fosfatasi), che viene re-immesso nel circolo sanguigno.
Controllo della fosfofruttochinasi
La fosfofruttochinasi[65] è probabilmente il più importante sito di controllo del pathway, dal momento che si trova immediatamente a valle del punto di ingresso nella via metabolica degli esosi alternativi al glucosio (come fruttosio e galattosio).[66][67]
Alti livelli di ATP inibiscono la fosfofruttochinasi, riducendone l'affinità per il fruttosio-6-fosfato. Questo effetto viene raggiunto attraverso il legame dell'ATP a specifiche regioni di regolazione allosterica (distinte dai siti catalitici). L'AMP ha invece l'effetto opposto, attivando l'enzima. Per questo motivo, l'attività della fosfofruttochinasi è saldamente legata al bilancio cellulare di ATP/AMP, che può essere a buon ragione inteso come la riserva corrente di energia cellulare, a cui le vie energetiche come la glicolisi sono tenute ad adattarsi.
Dal momento che la glicolisi è anche una fonte di scheletri carboniosi per la biosintesi, un controllo a feedback negativo della glicolisi viene anche da molecole come il citrato: questa molecola, infatti, è in grado di aumentare l'effetto inibitorio esercitato dall'ATP sull'enzima. Il citrato, infatti, è un intermedio precoce del ciclo di Krebs: un alto livello di citrato, dunque, implica un'alta quantità cellulare di precursori biosintetici.
Anche i bassi livelli di pH inibiscono l'attività della fosfofruttochinasi, prevenendo così una eccessiva produzione di acido lattico, in grado di generare un crollo ulteriore del pH, condizione molto grave per l'organismo.
Il fruttosio 2,6-bisfosfato è infine un potente attivatore della fosfofruttochinasi (in particolare della fosfofruttochinasi-1). Tale molecola viene prodotta dalla fosforilazione del fruttosio-6-fosfato da parte della fosfofruttochinasi-2. Questo secondo enzima è inattivo qualora i livelli di cAMP siano alti, correlando così la via glicolitica al sistema ormonale. Sia il glucagone che l'adrenalina, infatti, generano alti livelli di cAMP e bassi di fruttosio 2,6-bisfosfato: ciò conduce nel fegato ad una elevata gluconeogenesi, in grado di rendere disponibile per l'organismo grandi quantità di glucosio.
Controllo della piruvato chinasi
La piruvato chinasi è l'enzima che catalizza la terza reazione irreversibile della via metabolica, che produce ATP e piruvato, l'intermedio metabolico centrale per una successiva ossidazione o per numerosi pathway anabolici. Esistono diverse isoforme dell'enzima nei mammiferi. Il tipo L è predominante nel fegato, il tipo M nel muscolo e nel cervello.
Entrambe legano il fosfoenolpiruvato cooperativamente. Il fruttosio-1,6-bisfosfato, il prodotto della precedente reazione irreversibile, è in grado di attivare entrambi gli isoenzimi. L'ATP invece, come avviene anche per la fosfofruttochinasi, inibisce allostericamente entrambe le isoforme, riducendo la velocità della glicolisi.[68] Anche l'alanina, prodotta in un solo passaggio a partire dal piruvato, inibisce allostericamente entrambe le isoforme (segnalando in questo caso l'abbondanza di amminoacidi per la sintesi proteica).
La regolazione delle due isoforme differisce invece a livello della loro suscettibilità alle modificazioni covalenti.[69] Le proprietà catalitiche del tipo L possono essere modulate anche da una fosforilazione reversibile. Se c'è una bassa glicemia, infatti, il glucagone, i glucocorticoidi e le catecolamine sono in grado di innalzare i livelli cellulari di cAMP, inducendo la fosforilazione della piruvato chinasi.[70] Questa fosforilazione, così come il controllo della fosfofruttochinasi legato al fruttosio-2,6-bisfosfato impedisce al fegato di consumare inutilmente glucosio, soprattutto se è necessario nei muscoli o nel cervello (nei quali infatti non si verifica alcuna inibizione della piruvato chinasi in caso di bassa glicemia).[71]
Aumento della glicolisi nei tumori
In condizioni anaerobiche, la glicolisi è l'unico meccanismo in grado di fornire rapidamente ATP (attraverso le fermentazioni tipiche dei batteri e dei lieviti anaerobici). In ogni caso, nell'uomo la glicolisi è accoppiata alla respirazione aerobica. In presenza di ossigeno, il mitocondrio internalizza il piruvato, ossidandolo ulteriormente ad ottenere CO2 e acqua. Per questo motivo, l'attività glicolitica nei mammiferi è minore di quella dei microrganismi anaerobici: il numero di molecole di ATP che possono essere ottenute dalla ossidazione completa del piruvato, infatti, è 18 volte maggiore di quello proveniente dalla sola glicolisi.
Le cellule tumorali possono presentare livelli di attività glicolitica[72] fino a 200 volte superiori a quelli dei tessuti sani, anche in presenza di grandi condizioni di ossigeno. Ciò può essere spiegato sia attraverso un elevato consumo locale di ossigeno, che ne genera concretamente una carenza nelle cellule tumorali,[73] con conseguente innalzamento dei livelli di glicolisi. Questo fenomeno, descritto per la prima volta nel 1930 da Otto Warburg:[74] per questo motivo viene ancora definito come effetto Warburg. L'interruttore glicolitico dell'effetto Warburg osservato nei tessuti maligni è attivato dal danno ossidativo mitocondriale e/o dall'attivazione di fattori di trascrizione redox-sensibili, che si traduce in un aumento della resistenza delle cellule agli ossidanti.[75]
In ogni caso, ciò è stato spiegato anche dalla presenza in quantità maggiori di una particolare forma di esochinasi legata ai mitocondri, che genera un aumento dell'attività glicolitica senza che l'ossigeno sia necessariamente consumato [76]; l'esochinasi e più in generale l'effetto Warburg potrebbe diventare un target per un'efficace terapia dei tumori.[77][78][79][80][81]
Recentemente è stato visto che nei soggetti diabetici v'è un aumento dell'incidenza dei tumori per un incremento della produzione di chetoni, che insieme al lattato si comportano da combustibile per le cellule tumorali e le metastasi per un effetto Warbur inverso.[82]
Il vantaggio biologico che le cellule tumorali acquisiscono con questo tipo di metabolismo non è del tutto chiaro, ma sembra che l'effetto Warburg serva in realtà tutte le cellule proliferanti come adattamento per agevolare la diffusione e l'incorporazione di sostanze nutritive nella biomassa (ad esempio, i nucleotidi, aminoacidi e lipidi) necessari per produrre una nuova cellula.[83]
Questo effetto ha delle conseguenze molto rilevanti in alcune applicazioni biomediche. L'elevata glicolisi delle cellule tumorali, infatti, può essere utilizzato come fattore diagnostico di un tumore, come fattore per la valutazione di efficacia del trattamento, nonché per una esatta localizzazione della massa tumorale attraverso tecniche di imaging[84] mediate da un radiotracciante per PET[85][86] come il fluorodesossiglucosio[87] (un substrato modificato della esochinasi).
Note
- ^ (lingua inglese.) F. Marini, [The story of oxygen (2)], in Chir Ital, vol. 37, n. 2, Apr 1985, pp. 129-38, PMID 4017137. Lingua sconosciuta: lingua inglese. (aiuto)
- ^ (EN) JF. Kasting, Mantle redox evolution and the oxidation state of the Archean atmosphere., in J Geol, vol. 101, n. 2, Mar 1993, pp. 245-57, PMID 11537741.
- ^ (lingua inglese.) RS. Ronimus, Distribution and phylogenies of enzymes of the Embden-Meyerhof-Parnas pathway from archaea and hyperthermophilic bacteria support a gluconeogenic origin of metabolism., in Archaea, vol. 1, n. 3, Oct 2003, pp. 199-221, PMID 15803666. Lingua sconosciuta: lingua inglese. (aiuto)
- ^ Romano AH, Conway T. (1996) Evolution of carbohydrate metabolic pathways. Res Microbiol. 147(6-7):448-55 PMID 9084754
- ^ (lingua inglese.) LA. Fothergill-Gilmore, Evolution of glycolysis., in Prog Biophys Mol Biol, vol. 59, n. 2, 1993, pp. 105-235, PMID 8426905. Lingua sconosciuta: lingua inglese. (aiuto)
- ^ W. de Souza, Special organelles of some pathogenic protozoa., in Parasitol Res, vol. 88, n. 12, Dec 2002, pp. 1013-25, DOI:10.1007/s00436-002-0696-2, PMID 12444449.
- ^ JR. Haanstra, Compartmentation prevents a lethal turbo-explosion of glycolysis in trypanosomes., in Proc Natl Acad Sci U S A, vol. 105, n. 46, Nov 2008, pp. 17718-23, DOI:10.1073/pnas.0806664105, PMID 19008351.
- ^ M. Parsons, Glycosomes: parasites and the divergence of peroxisomal purpose., in Mol Microbiol, vol. 53, n. 3, Aug 2004, pp. 717-24, DOI:10.1111/j.1365-2958.2004.04203.x, PMID 15255886.
- ^ JM. Silverman, Proteomic analysis of the secretome of Leishmania donovani., in Genome Biol, vol. 9, n. 2, 2008, pp. R35, DOI:10.1186/gb-2008-9-2-r35, PMID 18282296.
- ^ M. Parsons, Biogenesis and function of peroxisomes and glycosomes., in Mol Biochem Parasitol, vol. 115, n. 1, Jun 2001, pp. 19-28, PMID 11377736.
- ^ FR. Opperdoes, Compartmentation of carbohydrate metabolism in trypanosomes., in Annu Rev Microbiol, vol. 41, 1987, pp. 127-51, DOI:10.1146/annurev.mi.41.100187.001015, PMID 3120638.
- ^ F. Lipmann, Reminiscences of Embden's formulation of the Embden-Meyerhof cycle., in Mol Cell Biochem, vol. 6, n. 3, Mar 1975, pp. 171-5, PMID 165399.
- ^ N. Kresge, Otto Fritz Meyerhof and the elucidation of the glycolytic pathway., in J Biol Chem, vol. 280, n. 4, Jan 2005, pp. e3, PMID 15665335.
- ^ HG. Schweiger, Otto Meyerhof 1884-1951., in Eur J Cell Biol, vol. 35, n. 2, Nov 1984, pp. 147-8, PMID 6394328.
- ^ MA. Shampo, Otto Meyerhof--Nobel Prize for studies of muscle metabolism., in Mayo Clin Proc, vol. 74, n. 1, Jan 1999, p. 67, PMID 9987536.
- ^ AP. BADAWCZE, [Works of Jakub Karol Parnas presented during 1907-1939.], in Acta Biochim Pol, vol. 3, n. 1, 1956, pp. 3-39, PMID 13338986.
- ^ WS. Ostrowski, [Jakub Karol Parnas: his life and work], in Postepy Biochem, vol. 32, n. 3, 1986, pp. 247-60, PMID 3554189.
- ^ Z. Zielińska, Jakub Karol Parnas, 1884-1949., in Acta Physiol Pol, vol. 38, n. 2, pp. 91-9, PMID 3314349.
- ^ NG. Coley, Medical chemists and the origins of clinical chemistry in Britain (circa 1750-1850)., in Clin Chem, vol. 50, n. 5, May 2004, pp. 961-72, DOI:10.1373/clinchem.2003.029645, PMID 15105362.
- ^ N. Mani, The historical background of clinical chemistry., in J Clin Chem Clin Biochem, vol. 19, n. 6, Jun 1981, pp. 311-22, PMID 7024459.
- ^ J. Büttner, From chemistry of life to chemistry of disease: the rise of clinical biochemistry., in Clin Biochem, vol. 13, n. 5, Oct 1980, pp. 232-5, PMID 6780238.
- ^ :: Pasteur Foundation - The U.S. nonprofit affiliate of the Institut Pasteur ::, su pasteurfoundation.org. URL consultato l'11-10-2010.
- ^ LF. Haas, Louis Pasteur (1822-95)., in J Neurol Neurosurg Psychiatry, vol. 64, n. 3, Mar 1998, p. 330, PMID 9527143.
- ^ J. Joaquín Izquierdo, [A flash of genius and the work of Louis Pasteur (1822-1895)], in Gac Med Mex, vol. 106, n. 1, Jul 1973, pp. 79-80, PMID 4583346.
- ^ A. Martínez-Palomo, The science of Louis Pasteur: a reconsideration., in Q Rev Biol, vol. 76, n. 1, Mar 2001, pp. 37-45, PMID 11291570.
- ^ a b Oeuvres de Pasteur. Tome 2 / réunies par Pasteur Vallery-Ra... - Gallica, su gallica.bnf.fr. URL consultato l'11-10-2010.
- ^ L. Jaenicke, Centenary of the award of a Nobel prize to Eduard Buchner, the father of biochemistry in a test tube and thus of experimental molecular bioscience., in Angew Chem Int Ed Engl, vol. 46, n. 36, 2007, pp. 6776-82, DOI:10.1002/anie.200700390, PMID 17600804.
- ^ F. Kohl, [A milestone of biochemistry and enzyme research. 100 years ago the German physiologist and chemist Eduard Buchner demonstrated "cell-free fermentation" in yeast extracts], in Dtsch Med Wochenschr, vol. 123, n. 25-26, Jun 1998, pp. 814-7, DOI:10.1055/s-0029-1233241, PMID 9672490.
- ^ RA. Kyle, Eduard Buchner., in JAMA, vol. 245, n. 20, p. 2096, PMID 7014942.
- ^ Per estratto cellulare si intende la raccolta del citoplasma e di tutto il contenuto di una cellula in seguito alla sua lisi.
- ^ RE. Kohler, The background to Arthur Harden's discovery of cozymase., in Bull Hist Med, vol. 48, n. 1, 1974, pp. 22-40, PMID 4370723.
- ^ a b KL. Manchester, Arthur Harden: an unwitting pioneer of metabolic control analysis., in Trends Biochem Sci, vol. 25, n. 2, Feb 2000, pp. 89-92, PMID 10664590. Errore nelle note: Tag
<ref>non valido; il nome "Manchester-2000" è stato definito più volte con contenuti diversi - ^ Young, William John (1878 - 1942) Biographical Entry - Australian Dictionary of Biography Online, su adbonline.anu.edu.au. URL consultato l'11-10-2010.
- ^ Young, William John - Biographical entry - Encyclopedia of Australian Science, su eoas.info. URL consultato l'11-10-2010.
- ^ FF. NORD, Carl Neuberg; 1877-1956., in Adv Carbohydr Chem, vol. 13, 1958, pp. 1-7, PMID 13605967.
- ^ A. GOTTSCHALK, Prof. Carl Neuberg., in Nature, vol. 178, n. 4536, Oct 1956, pp. 722-3, PMID 13369516.
- ^ AL. GRAUER, [Carl Neuberg, 1877-1956.], in Enzymologia, vol. 18, n. 1, Jan 1957, pp. 1-2, PMID 13414707.
- ^ OH. Warburg, The classic: The chemical constitution of respiration ferment., in Clin Orthop Relat Res, vol. 468, n. 11, Nov 2010, pp. 2833-9, DOI:10.1007/s11999-010-1534-y, PMID 20809165.
- ^ O. Warburg, [Otto Warburg: a biographical essay (author's transl)], in Seikagaku, vol. 51, n. 3, Mar 1979, pp. 139-60, PMID 381542.
- ^ RA. Brand, Biographical sketch: Otto Heinrich Warburg, PhD, MD., in Clin Orthop Relat Res, vol. 468, n. 11, Nov 2010, pp. 2831-2, DOI:10.1007/s11999-010-1533-z, PMID 20737302.
- ^ FG. YOUNG, Gerty T. Cori., in Br Med J, vol. 2, n. 5054, Nov 1957, pp. 1183-4, PMID 13472084.
- ^ BA. HOUSSAY, Carl F. and Gerty T. Cori., in Biochim Biophys Acta, vol. 20, n. 1, Apr 1956, pp. 11-6, PMID 13315342.
- ^ RD. Simoni, Carbohydrate Metabolism: Glycogen Phosphorylase and the Work of Carl F. and Gerty T.Cori. 1928-1943., in J Biol Chem, vol. 277, n. 29, Jul 2002, pp. 18e, PMID 12118037.
- ^ Iynedjian PB, Molecular physiology of mammalian glucokinase, in Cell. Mol. Life Sci., vol. 66, n. 1, January 2009, pp. 27–42, DOI:10.1007/s00018-008-8322-9.
- ^ Yanagawa T, Funasaka T, Tsutsumi S, Hu H, Watanabe H, Raz A, Regulation of phosphoglucose isomerase/autocrine motility factor activities by the poly(ADP-ribose) polymerase family-14, in Cancer Res., vol. 67, n. 18, September 2007, pp. 8682–9, DOI:10.1158/0008-5472.CAN-07-1586.
- ^ Rider MH, Bertrand L, Vertommen D, Michels PA, Rousseau GG, Hue L, 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: head-to-head with a bifunctional enzyme that controls glycolysis, in Biochem. J., vol. 381, Pt 3, August 2004, pp. 561–79, DOI:10.1042/BJ20040752.
- ^ Kochman M, Dobryszycki P, Topography and conformational changes of fructose-1,6-bisphosphate aldolase, in Acta Biochim. Pol., vol. 38, n. 4, 1991, pp. 407–21.
- ^ Lee JC, Modulation of allostery of pyruvate kinase by shifting of an ensemble of microstates, in Acta Biochim. Biophys. Sin. (Shanghai), vol. 40, n. 7, July 2008, pp. 663–9.
- ^ MK. Kalyananda, Metabolism of L-glyceraldehyde 3-phosphate in Escherichia coli., in J Bacteriol, vol. 169, n. 6, Jun 1987, pp. 2488-93, PMID 3294792.
- ^ J. Jeffery, Kinetic aspects of soluble dehydrogenases requiring nicotinamide coenzymes., in Experientia Suppl, vol. 36, 1980, pp. 1-39, PMID 6987074.
- ^ FL. Crane, Dehydrogenases of the plasma membrane., in Subcell Biochem, vol. 6, 1979, pp. 345-99, PMID 377585.
- ^ E. Beutler, PGK deficiency., in Br J Haematol, vol. 136, n. 1, Jan 2007, pp. 3-11, DOI:10.1111/j.1365-2141.2006.06351.x, PMID 17222195.
- ^ L. Busque, The PGK-PCR clonality assay (PPCA)., in Methods Mol Biol, vol. 31, 1994, pp. 237-46, DOI:10.1385/0-89603-258-2:237, PMID 7921021.
- ^ HC. João, The anatomy of a kinase and the control of phosphate transfer., in Eur J Biochem, vol. 216, n. 1, Aug 1993, pp. 1-18, PMID 8365395.
- ^ J. Puttick, Histidine phosphorylation in biological systems., in Biochim Biophys Acta, vol. 1784, n. 1, Jan 2008, pp. 100-5, DOI:10.1016/j.bbapap.2007.07.008, PMID 17728195.
- ^ MJ. Jedrzejas, Comparison of the binuclear metalloenzymes diphosphoglycerate-independent phosphoglycerate mutase and alkaline phosphatase: their mechanism of catalysis via a phosphoserine intermediate., in Chem Rev, vol. 101, n. 3, Mar 2001, pp. 607-18, PMID 11712498.
- ^ MJ. Jedrzejas, Structure, function, and evolution of phosphoglycerate mutases: comparison with fructose-2,6-bisphosphatase, acid phosphatase, and alkaline phosphatase., in Prog Biophys Mol Biol, vol. 73, n. 2-4, 2000, pp. 263-87, PMID 10958932.
- ^ JC. Lee, Modulation of allostery of pyruvate kinase by shifting of an ensemble of microstates., in Acta Biochim Biophys Sin (Shanghai), vol. 40, n. 7, Jul 2008, pp. 663-9, PMID 18604458.
- ^ TE. Roche, Pyruvate dehydrogenase kinase regulatory mechanisms and inhibition in treating diabetes, heart ischemia, and cancer., in Cell Mol Life Sci, vol. 64, n. 7-8, Apr 2007, pp. 830-49, DOI:10.1007/s00018-007-6380-z, PMID 17310282.
- ^ MC. Sugden, Mechanisms underlying regulation of the expression and activities of the mammalian pyruvate dehydrogenase kinases., in Arch Physiol Biochem, vol. 112, n. 3, Jul 2006, pp. 139-49, DOI:10.1080/13813450600935263, PMID 17132539.
- ^ a b c d e L. Garfinkel, Magnesium regulation of the glycolytic pathway and the enzymes involved., in Magnesium, vol. 4, n. 2-3, 1985, pp. 60-72, PMID 2931560.
- ^ Il prefisso bis- si riferisce alla presenza di due gruppi fosfato in posizioni diverse; il prefisso di- (usato ad esempio per la molecola di ADP) è invece da evitare in questo caso, perché si riferisce alla presenza di due fosfati nella stessa posizione della molecola.
- ^ PB. Iynedjian, Molecular physiology of mammalian glucokinase., in Cell Mol Life Sci, vol. 66, n. 1, Jan 2009, pp. 27-42, DOI:10.1007/s00018-008-8322-9, PMID 18726182.
- ^ M. Pal, Recent advances in glucokinase activators for the treatment of type 2 diabetes., in Drug Discov Today, vol. 14, n. 15-16, Aug 2009, pp. 784-92, DOI:10.1016/j.drudis.2009.05.013, PMID 19520181.
- ^ JP. Bolaños, Glycolysis: a bioenergetic or a survival pathway?, in Trends Biochem Sci, vol. 35, n. 3, Mar 2010, pp. 145-9, DOI:10.1016/j.tibs.2009.10.006, PMID 20006513.
- ^ PA. Michels, Evolutionary analysis of fructose 2,6-bisphosphate metabolism., in IUBMB Life, vol. 58, n. 3, Mar 2006, pp. 133-41, DOI:10.1080/15216540600688280, PMID 16766380.
- ^ G. Wegener, Different modes of activating phosphofructokinase, a key regulatory enzyme of glycolysis, in working vertebrate muscle., in Biochem Soc Trans, vol. 30, n. 2, Apr 2002, pp. 264-70, DOI:10.1042/, PMID 12023862.
- ^ MS. Patel, Regulation of the pyruvate dehydrogenase complex., in Biochem Soc Trans, vol. 34, Pt 2, Apr 2006, pp. 217-22, DOI:10.1042/BST20060217, PMID 16545080.
- ^ MC. Sugden, Recent advances in mechanisms regulating glucose oxidation at the level of the pyruvate dehydrogenase complex by PDKs., in Am J Physiol Endocrinol Metab, vol. 284, n. 5, May 2003, pp. E855-62, DOI:10.1152/ajpendo.00526.2002, PMID 12676647.
- ^ (lingua inglese.) S. Jitrapakdee, Structure, function and regulation of pyruvate carboxylase., in Biochem J, 340 ( Pt 1), May 1999, pp. 1-16, PMID 10229653. Lingua sconosciuta: lingua inglese. (aiuto)
- ^ (lingua inglese.) T. Noguchi, [Regulation of pyruvate kinase gene expression and its clinical application], in Rinsho Byori, vol. 38, n. 8, Aug 1990, pp. 868-75, PMID 2232246. Lingua sconosciuta: lingua inglese. (aiuto)
- ^ CX. Bittner, High resolution measurement of the glycolytic rate., in Front Neuroenergetics, vol. 2, 2010, DOI:10.3389/fnene.2010.00026, PMID 20890447.
- ^ R. Diaz-Ruiz, The Warburg and Crabtree effects: On the origin of cancer cell energy metabolism and of yeast glucose repression., in Biochim Biophys Acta, Sep 2010, DOI:10.1016/j.bbabio.2010.08.010, PMID 20804724.
- ^ O. Warburg, THE METABOLISM OF TUMORS IN THE BODY., in J Gen Physiol, vol. 8, n. 6, Mar 1927, pp. 519-30, PMID 19872213.
- ^ G. Pani, Metastasis: cancer cell's escape from oxidative stress., in Cancer Metastasis Rev, vol. 29, n. 2, Jun 2010, pp. 351-78, DOI:10.1007/s10555-010-9225-4, PMID 20386957.
- ^ Bustamante and Pedersen, High Aerobic Glycolysis of Rat Hepatoma Cells in Culture: Role of Mitochondrial Hexokinase, PNAS, 2005, 74 (9): 3735
- ^ SP. Mathupala, Hexokinase-2 bound to mitochondria: cancer's stygian link to the "Warburg Effect" and a pivotal target for effective therapy., in Semin Cancer Biol, vol. 19, n. 1, Feb 2009, pp. 17-24, DOI:10.1016/j.semcancer.2008.11.006, PMID 19101634.
- ^ Z. Chen, The Warburg effect and its cancer therapeutic implications., in J Bioenerg Biomembr, vol. 39, n. 3, Jun 2007, pp. 267-74, DOI:10.1007/s10863-007-9086-x, PMID 17551814.
- ^ H. Pelicano, Glycolysis inhibition for anticancer treatment., in Oncogene, vol. 25, n. 34, Aug 2006, pp. 4633-46, DOI:10.1038/sj.onc.1209597, PMID 16892078.
- ^ N. Serkova, Detection of resistance to imatinib by metabolic profiling: clinical and drug development implications., in Am J Pharmacogenomics, vol. 5, n. 5, 2005, pp. 293-302, PMID 16196499.
- ^ RH. Xu, Inhibition of glycolysis in cancer cells: a novel strategy to overcome drug resistance associated with mitochondrial respiratory defect and hypoxia., in Cancer Res, vol. 65, n. 2, Jan 2005, pp. 613-21, PMID 15695406.
- ^ G. Bonuccelli, Ketones and lactate "fuel" tumor growth and metastasis: Evidence that epithelial cancer cells use oxidative mitochondrial metabolism., in Cell Cycle, vol. 9, n. 17, Sep 2010, pp. 3506-14, PMID 20818174.
- ^ MG. Vander Heiden, Understanding the Warburg effect: the metabolic requirements of cell proliferation., in Science, vol. 324, n. 5930, May 2009, pp. 1029-33, DOI:10.1126/science.1160809, PMID 19460998.
- ^ 64Cu-1,4,7,10-Tetraazacyclododecane-1,4,7-Tris-acetic acid-10-maleimidoethylacetamide-ACEQNPIYWARYADWLFTTPLLLLDLALLVDADEGTG -- Molecular Imaging and Contrast Agent Database (MICAD) -- NCBI Bookshelf, su ncbi.nlm.nih.gov. URL consultato il 12-10-2010.
- ^ IF. Robey, Regulation of the Warburg effect in early-passage breast cancer cells., in Neoplasia, vol. 10, n. 8, Aug 2008, pp. 745-56, PMID 18670636.
- ^ GJ. Kelloff, Progress and promise of FDG-PET imaging for cancer patient management and oncologic drug development., in Clin Cancer Res, vol. 11, n. 8, Apr 2005, pp. 2785-808, DOI:10.1158/1078-0432.CCR-04-2626, PMID 15837727.
- ^ E. Bustamante, High aerobic glycolysis of rat hepatoma cells in culture: role of mitochondrial hexokinase., in Proc Natl Acad Sci U S A, vol. 74, n. 9, Sep 1977, pp. 3735-9, PMID 198801.
Bibliografia
- V. Donald, Voet Judith G. e Pratt Charlotte W., Fondamenti di biochimica, Bologna, Zanichelli, 2001 ISBN 88-08-09151-1
- Nelson David L. e Cox Michael M., Principi di biochimica, Bologna, Zanichelli, 2002 ISBN 88-08-09035-3
- Berg Jeremy M., Tymoczko John L. e Stryer Lubert Biochimica, Bologna, Zanichelli, 2003 ISBN 88-08-07893-0
- RH Garret, CM Grisham Principi di Biochimica Padova, Ed. PICCIN, 2004 ISBN 88-299-1693-5
- J.W. Baynes e M.H. Dominiczak, Biochimica per le discipline biomediche, Casa Editrice Ambrosiana, 2006 ISBN 88-408-1353-5
Voci correlate
- Decarbossilazione ossidativa del piruvato
- Ciclo di Krebs
- Gluconeogenesi
- Glicogenosintesi
- Glicogenolisi
- Via dei pentoso fosfati
Altri progetti
 Wikiversità contiene risorse su glicolisi
Wikiversità contiene risorse su glicolisi Wikimedia Commons contiene immagini o altri file su glicolisi
Wikimedia Commons contiene immagini o altri file su glicolisi
