Octaossido di triuranio
| Octaossido di triuranio | |
|---|---|
 | |
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | U3O8 |
| Massa molecolare (u) | 842,08 |
| Aspetto | solido con colorazione da verde oliva a nero |
| Numero CAS | |
| Numero EINECS | 215-702-4 |
| PubChem | 11968241 |
| SMILES | [O].[O].[O].[O].[O].[O].[O].[O].[U].[U].[U] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 8,38 |
| Solubilità in acqua | insolubile |
| Temperatura di fusione | 1150 °C con decomposizione |
| Temperatura di ebollizione | 1300 °C (1573,15 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −3575 [1] |
| S0m(J·K−1mol−1) | 282 [1] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | 300 - 330 - 373 - 411 |
| Frasi S | 1/2-20/21-45-61 |
L'octaossido di triuranio (U3O8) è un ossido dell'uranio in cui quest'ultimo elemento è formalmente presente negli stati di ossidazione +4 e +6, quindi è idealmente rappresentabile come UO2·2UO3. Si presenta come un solido di colorazione che va dal verde oliva al nero, inodore. È una delle forme più popolari di yellowcake e viene spedita dalla fabbrica alle raffinerie in questa forma.
L'octaossido di triuranio ha una potenziale stabilità a lungo termine in un ambiente geologico e in natura è presente nella pechblenda. In presenza di ossigeno (O2), il diossido di uranio (UO2) si ossida a octaossido di triuranio, mentre il triossido di uranio (UO3) perde ossigeno a temperature superiori a 500 °C e si riduce a octaossido di triuranio. Il composto può essere prodotto mediante uno qualsiasi dei tre processi di conversione chimica primaria, che coinvolgono tetrafluoruro di uranio (UF4) o fluoruro di uranile (UO2F2) come intermedi. È generalmente considerata la forma più interessante ai fini dello smaltimento perché, in condizioni ambientali normali, l'octaossido di triuranio è una delle forme di uranio più cineticamente e termodinamicamente stabili. La sua densità delle particelle è 8,3 g cm-3.
L'octaossido di triuranio viene convertito in esafluoruro di uranio (UF6) ai fini dell'arricchimento dell'uranio.
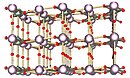
Struttura allo stato solido[modifica | modifica wikitesto]
Il solido è una struttura a strati in cui gli strati sono collegati da atomi di ossigeno; ogni strato contiene atomi di uranio che si trovano in diversi ambienti di coordinazione.
Studio sulla valenza di legame[modifica | modifica wikitesto]
Utilizzando una scatola 6Å x 6Å x 6Å con l'atomo di uranio al centro, il calcolo della valenza del legame è stato eseguito sia per U1 che per U2 nel solido. È stato trovato, utilizzando i parametri per U(VI), che gli stati di ossidazione calcolati per U1 e U2 sono 5,11 e 5,10. Utilizzando i parametri per U(IV), gli stati di ossidazione calcolati sono 5,78 e 5,77 rispettivamente per U1 e U2. Questi studi suggeriscono che tutti gli atomi di uranio hanno lo stesso stato di ossidazione, in modo che gli stati di ossidazione siano disordinati attraverso il reticolo.[senza fonte]
Note[modifica | modifica wikitesto]
- ^ a b (EN) Zumdahl, Steven S., Chemical Principles, 6ª ed., Houghton Mifflin Company, 2009, p. A23, ISBN 0-618-94690-X.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Octaossido di triuranio
Wikimedia Commons contiene immagini o altri file su Octaossido di triuranio