Cloruro di niobio(V)
| Cloruro di niobio(V) | |
|---|---|
 | |
 | |
| Nomi alternativi | |
| pentacloruro di niobio | |
| Caratteristiche generali | |
| Formula bruta o molecolare | NbCl5 |
| Massa molecolare (u) | 270,17 |
| Aspetto | solido giallo deliquescente |
| Numero CAS | |
| Numero EINECS | 233-059-8 |
| PubChem | 24818 |
| SMILES | Cl[Nb](Cl)(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,74 |
| Solubilità in acqua | si decompone |
| Temperatura di fusione | 205 °C (478 K) |
| Temperatura di ebollizione | 254 °C (527 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −797 |
| S0m(J·K−1mol−1) | 214 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 1400 ratto orale |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | 302, 314 |
| Consigli P | 260, 301+330+331, 303+361+353, 305+351+338, 405, 501 |
Il cloruro di niobio(V) o pentacloruro di niobio è il composto inorganico di formula NbCl5. In condizioni normali è un solido cristallino giallo deliquescente, che si idrolizza rapidamente a contatto con l'acqua. In questo composto il niobio è nello stato di ossidazione +5. Viene usato come precursore di altri composti di niobio.
Struttura[modifica | modifica wikitesto]

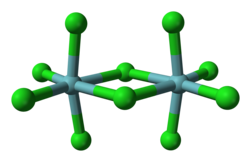
Allo stato solido la struttura è costituita da dimeri con ponti a cloro. Sono noti vari polimorfi.[1] Nella struttura cristallina del polimorfo α ogni centro di niobio è esacoordinato, con una geometria ottaedrica significativamente distorta. Sul piano equatoriale le distanze di legame niobio-cloro terminali sono di 225 pm, mentre quelle a ponte sono di 256 pm. Le distanze assiali niobio-cloro sono 229,2 pm, e gli assi sono inclinati all'indentro formando un angolo di 83,7° rispetto al piano equatoriale della molecola. L'angolo Nb–Cl–Nb del ponte è di 101,3°. La distanza Nb–Nb è 398,8 pm, troppo lunga perché sia possibile una qualche interazione tra i due metalli.[2] NbBr5, TaCl5 e TaBr5 sono isostrutturali con NbCl5; NbI5 e TaI5 hanno invece strutture differenti.
Allo stato gassoso NbCl5 è monomerico, con struttura di bipiramide trigonale e simmetria molecolare D3h.[3]
Sintesi[modifica | modifica wikitesto]

Industrialmente NbCl5 si ottiene per clorurazione diretta a 500-600 °C del niobio metallico o di leghe ferro/niobio (che possono contenere anche tantalio e altri metalli). NbCl5 viene isolato e purificato per distillazione.[4]
In laboratorio NbCl5 si prepara spesso dall'ossido Nb2O5; il problema principale è la reazione incompleta con formazione di ossialogenuri come NbOCl3. La conversione si può effettuare con cloruro di tionile.[5] NbCl5 si può preparare anche per clorurazione di Nb2O5 in presenza di carbone a 300 °C, ma anche in questo caso i prodotti possono contenere NbOCl3. Sono possibili anche altre procedure.[6] Alla fine NbCl5 si può purificare per sublimazione.[1]
Reattività[modifica | modifica wikitesto]
NbCl5 è un composto stabile, ma igroscopico e deliquescente. È un acido di Lewis forte, ma meno del corrispondente fluoruro NbF5. In acqua si idrolizza rapidamente formando l'ossido idrato e acido cloridrico. Si scioglie in solventi organici non coordinanti come etere e CCl4 mantenendo la struttura dimera. In solventi coordinanti forma addotti tipo NbCl5L e NbCl5L2. Con cloruri dei metalli alcalini (MCl) reagisce formando M+NbCl6–.[1][3]
Usi[modifica | modifica wikitesto]
NbCl5 è il precursore più usato per la sintesi di altri composti di niobio, tra i quali gli alcossidi, che trovano un utilizzo di nicchia nei processi sol-gel. In chimica organica è un acido di Lewis di uso specialistico, utile per attivare gli alcheni nella reazione carbonile-ene e nella reazione di Diels-Alder.
Indicazioni di sicurezza[modifica | modifica wikitesto]
NbCl5 è disponibile in commercio. Il composto è nocivo se ingerito, inalato o per contatto con la pelle. Per contatto provoca gravi ustioni cutanee e gravi lesioni agli occhi. Non ci sono dati che indichino proprietà cancerogene. Viene considerato poco pericoloso per le acque e l'ambiente.[7]
Note[modifica | modifica wikitesto]
- ^ a b c Cotton et al. 1999, p. 899.
- ^ Cotton et al. 1991
- ^ a b Hubert-Pfalzgraf 2006
- ^ Eckert 2002
- ^ Brown 1957
- ^ Brauer 1965, p. 1302.
- ^ Alfa Aesar, scheda di dati di sicurezza di NbCl5.
Bibliografia[modifica | modifica wikitesto]
- (EN) G. Brauer (a cura di), Handbook of Preparative Inorganic Chemistry, vol. 2, New York, Academic Press, 1965.
- D. Brown, Niobium(V) Chloride and Hexachloroniobates(V), in Inorg. Synth., vol. 9, 1957, pp. 88–92, DOI:10.1002/9780470132401.ch24.
- F. A. Cotton, P. A. Kibala, M. Matusz and R. B. W. Sandor, Structure of the second polymorph of niobium pentachloride, in Acta Cryst., C47, 1991, pp. 2435-2437, DOI:10.1107/S0108270191000239. URL consultato il 30 marzo 2012.
- (EN) F. A. Cotton, G. Wilkinson, C. A. Murillo e M. Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley-Interscience, 1999, ISBN 978-0-471-19957-1.
- (EN) J. Eckert, Niobium and Niobium Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a17_251.
- (EN) L. G. Hubert-Pfalzgraf, Niobium & Tantalum: Inorganic & Coordination Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia153, ISBN 978-0-470-86210-0.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Cloruro di niobio(V)
Wikimedia Commons contiene immagini o altri file su Cloruro di niobio(V)