Metionina: differenze tra le versioni
modifica nome IUPAC |
Ampliamento con parziale traduzione della voce http://en.wikipedia.org/wiki/Methionine |
||
| Riga 48: | Riga 48: | ||
È coinvolta nella sintesi della [[cisteina]], della [[carnitina]] e della [[taurina]] tramite il processo della ''trans-solforazione'', nella sintesi della [[lecitina]] e nella sintesi della [[fosfatidilcolina]] e di altri [[fosfolipidi]]. Un improprio metabolismo della metionina può condurre all'[[aterosclerosi]]. Sotto forma di [[S-adenosil metionina]] (SAM), è un agente metilante. La metilazione è un meccanismo di modificazione enzimatica utile a innescare il fenomeno della [[Chemiotassi|chemiotassi batterica]]: la proteina batterica che accetta gruppi metilici durante questo fenomeno fa parte di un sistema che consente ai batteri di nuotare in una soluzione verso una sostanza che li attrae, o di allontanarsi da repellenti chimici.<br />Infine la metionina è un agente [[chelante]]. La metionina è uno dei due amminoacidi che vengono codificati da un solo codone (AUG); l'altro è il [[triptofano]] (UGG). È anche un potente acidificante delle urine, utile per il controllo di batteri patogeni e inoltre di grande impiego per il trattamento di alcuni tipi di [[Calcolosi delle vie urinarie|calcoli renali e delle vie urinarie]]. |
È coinvolta nella sintesi della [[cisteina]], della [[carnitina]] e della [[taurina]] tramite il processo della ''trans-solforazione'', nella sintesi della [[lecitina]] e nella sintesi della [[fosfatidilcolina]] e di altri [[fosfolipidi]]. Un improprio metabolismo della metionina può condurre all'[[aterosclerosi]]. Sotto forma di [[S-adenosil metionina]] (SAM), è un agente metilante. La metilazione è un meccanismo di modificazione enzimatica utile a innescare il fenomeno della [[Chemiotassi|chemiotassi batterica]]: la proteina batterica che accetta gruppi metilici durante questo fenomeno fa parte di un sistema che consente ai batteri di nuotare in una soluzione verso una sostanza che li attrae, o di allontanarsi da repellenti chimici.<br />Infine la metionina è un agente [[chelante]]. La metionina è uno dei due amminoacidi che vengono codificati da un solo codone (AUG); l'altro è il [[triptofano]] (UGG). È anche un potente acidificante delle urine, utile per il controllo di batteri patogeni e inoltre di grande impiego per il trattamento di alcuni tipi di [[Calcolosi delle vie urinarie|calcoli renali e delle vie urinarie]]. |
||
La metionina è anche una parte importante dell'[[angiogenesi]], la crescita di nuovi vasi sanguigni. L'integrazione può giovare a coloro che soffrono di avvelenamento da rame.<ref>{{Cite web| url=http://www.webmd.com/vitamins-supplements/ingredientmono-42-methionine.aspx?activeingredientid=42& |title=Methionine |website=WebMD}}</ref> Il consumo eccessivo di metionina, il donatore del [[gruppo metilico]] nella [[metilazione del DNA]], è correlato alla crescita del cancro in numerosi studi.<ref name="Cavuoto_2012">{{Cite journal |vauthors=Cavuoto P, Fenech MF |year=2012 |title=A review of methionine dependency and the role of methionine restriction in cancer growth control and life-span extension |journal=Cancer Treatment Reviews |volume=38 |issue=6 |pages=726–736 |doi=10.1016/j.ctrv.2012.01.004 |pmid=22342103}}</ref><ref name="Cellarier_2003">{{Cite journal |vauthors=Cellarier E, Durando X, Vasson MP, Farges MC, Demiden A, Maurizis JC, Madelmont JC, Chollet P |year=2003 |title=Methionine dependency and cancer treatment |journal=Cancer Treatment Reviews |volume=29 |issue=6 |pages=489–499 |doi=10.1016/S0305-7372(03)00118-X |pmid=14585259}}</ref> La metionina fu isolata per la prima volta nel 1921 da John Howard Mueller.<ref>{{Cite web |url=http://www.nasonline.org/publications/biographical-memoirs/memoir-pdfs/mueller-john.pdf |title=A Biographical Memoir of John Howard Mueller |date=1987 |publisher=National Academy of Sciences |location=Washington D.C. |vauthors=Pappenheimer AM}}</ref> |
|||
== Dettagli == |
|||
La metionina (abbreviata in '''Met''' o '''M'''; codificata dal codone AUG) è un α-[[amminoacido]] utilizzato nella [[biosintesi]] delle [[proteina|proteine]]. Contiene un [[gruppo carbossilico]] (che è nella forma deprotonata −COO<sup>−</sup> in condizioni di [[pH]] biologico), un [[gruppo amminico]] (che è nella forma protonata {{chem|−NH|3|+}} |
|||
in condizioni di pH biologico) situato in posizione α rispetto al gruppo carbossilico, e una catena laterale ''S''-metil [[tioetere]], classificandolo come amminoacido alifatico non polare. |
|||
Nei geni nucleari degli [[eucarioti]] e in [[Archaea]], la metionina è codificata dal codone di inizio, il che significa che indica l'inizio della regione codificante ed è il primo amminoacido prodotto in un [[Peptide|polipeptide]] nascente durante la [[Traduzione (biologia)|traduzione]] dell'[[mRNA]].<ref>{{Cite journal |vauthors=Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM |date=December 2011 |title=Amino acids biosynthesis and nitrogen assimilation pathways: a great genomic deletion during eukaryotes evolution |journal=BMC Genomics |volume=12 Suppl 4 |issue=Suppl 4 |pages=S2 |doi=10.1186/1471-2164-12-S4-S2 |pmc=3287585 |pmid=22369087}}</ref> |
|||
==Derivati== |
|||
===''S''-adenosilmetionina=== |
|||
[[File:S-Adenosyl-L-methionin.svg|thumbnail|left|L'''S''-adenosilmetionina è un cofattore derivato dalla metionina.]] |
|||
{{Main|S-adenosil metionina}} |
|||
L'[[S-adenosil metionina|''S''-adenosilmetionina]] (abbreviata SAM) deriva dalla metionina ed è un cofattore che funge principalmente da donatore di [[metile]]; è composto da una molecola di adenosile (tramite il carbonio 5′) legata allo zolfo della metionina, ciò la rende un [[Solfonio|catione solfonio]] (cioè tre sostituenti e carica positiva). Lo zolfo agisce come un [[Teoria HSAB|acido di Lewis debole]] (cioè donatore/elettrofilo) che consente al gruppo ''S''-metile di essere trasferito ad un ossigeno, ad un azoto o ad un sistema aromatico, spesso con l'azione di cofattori come la [[cobalamina]] (vitamina B<sub>12</sub> nell'uomo). |
|||
==Metabolismo== |
|||
===Biosintesi=== |
|||
Essendo un aminoacido essenziale, la metionina non viene sintetizzata de novo negli esseri umani e negli animali, ma è necessario assumerla con la dieta, direttamente o attraverso proteine che la contengono. Nelle piante e in microrganismi viene sintetizzata. |
|||
===Catabolismo=== |
|||
[[File:Met pathway.svg|thumb|400px|Catabolismo della metionina]] |
|||
La metionina viene convertita in [[S-adenosil metionina|''S''-adenosilmetionina]] (SAM) da (1) metionina adenosiltransferasi. |
|||
SAM funge da donatore di metile in molte (2) reazioni [[metiltransferasi|metiltransferasiche]] e viene convertito in [[S-adenosil omocisteina|''S''-adenosilomocisteina]] (SAH). |
|||
(3) Adenosilomocisteinasi cisteina. |
|||
(5) La cistationina-β-sintasi (un enzima che richiede la forma attiva della [[vitamina B6]], il [[piridossal fosfato]]) combina l'omocisteina e la serina per produrre la [[cistationina]]. La cistationina viene poi scomposta in [[cisteina]] e α-chetobutirrato tramite (6) cistationina-γ-liasi. |
|||
(7) L'enzima α-chetoacido deidrogenasi converte l'α-chetobutirrato in [[propionil-CoA]], che viene metabolizzato in [[succinil-CoA]] tramite tre reazioni [[mitocondrio|mitocondriali]]. |
|||
====Rigenerazione==== |
|||
La metionina può essere rigenerata dall'omocisteina tramite (4) [[metionina sintasi]] in una reazione che richiede la [[vitamina B12|vitamina B<sub>12</sub>]] come cofattore. |
|||
==Note== |
==Note== |
||
| Riga 61: | Riga 94: | ||
== Collegamenti esterni == |
== Collegamenti esterni == |
||
{{Collegamenti esterni}} |
|||
{{Amminoacido}} |
{{Amminoacido}} |
||
Versione delle 21:58, 1 mar 2023
| Metionina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido 2S-ammino-4-(metilsolfanil)butanoico | |
| Abbreviazioni | |
| M MET | |
| Nomi alternativi | |
| L-metionina
L-Homo-S-metil-cisteina
| |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H11NO2S |
| Massa molecolare (u) | 149,21 |
| Aspetto | solido cristallino biancastro |
| Numero CAS | |
| Numero EINECS | 200-432-1 |
| PubChem | 876, 5255805 e 135373086 |
| DrugBank | DB13972 |
| SMILES | CSCCC(C(=O)O)N |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 293 K | pK1: 2,13 pK2: 9,28 |
| Punto isoelettrico | 5,74 |
| Solubilità in acqua | 48 g/l a 293 K |
| Temperatura di fusione | 280 °C (553 K) con decomposizione |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −577,5 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
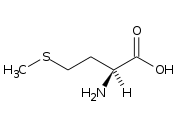
La metionina è un amminoacido apolare. La sua molecola è chirale.
L'enantiomero S della metionina è uno dei 20 amminoacidi ordinari; il suo gruppo laterale reca un gruppo metiltioetere, per cui la metionina è uno dei due amminoacidi che contengono zolfo; l'altro è la cisteina.
Negli esseri umani è essenziale, cioè deve essere assunta tramite l'alimentazione, dato che l'organismo umano non è in grado di sintetizzarla.
La metionina è l'amminoacido che occupa l'estremità N di tutte le proteine degli eucarioti e degli archeobatteri, in quanto corrisponde al codone AUG, che è il codone di inizio della traduzione, benché a volte possa essere rimossa una volta terminata la sintesi della proteina.
È coinvolta nella sintesi della cisteina, della carnitina e della taurina tramite il processo della trans-solforazione, nella sintesi della lecitina e nella sintesi della fosfatidilcolina e di altri fosfolipidi. Un improprio metabolismo della metionina può condurre all'aterosclerosi. Sotto forma di S-adenosil metionina (SAM), è un agente metilante. La metilazione è un meccanismo di modificazione enzimatica utile a innescare il fenomeno della chemiotassi batterica: la proteina batterica che accetta gruppi metilici durante questo fenomeno fa parte di un sistema che consente ai batteri di nuotare in una soluzione verso una sostanza che li attrae, o di allontanarsi da repellenti chimici.
Infine la metionina è un agente chelante. La metionina è uno dei due amminoacidi che vengono codificati da un solo codone (AUG); l'altro è il triptofano (UGG). È anche un potente acidificante delle urine, utile per il controllo di batteri patogeni e inoltre di grande impiego per il trattamento di alcuni tipi di calcoli renali e delle vie urinarie.
La metionina è anche una parte importante dell'angiogenesi, la crescita di nuovi vasi sanguigni. L'integrazione può giovare a coloro che soffrono di avvelenamento da rame.[2] Il consumo eccessivo di metionina, il donatore del gruppo metilico nella metilazione del DNA, è correlato alla crescita del cancro in numerosi studi.[3][4] La metionina fu isolata per la prima volta nel 1921 da John Howard Mueller.[5]
Dettagli
La metionina (abbreviata in Met o M; codificata dal codone AUG) è un α-amminoacido utilizzato nella biosintesi delle proteine. Contiene un gruppo carbossilico (che è nella forma deprotonata −COO− in condizioni di pH biologico), un gruppo amminico (che è nella forma protonata −NH+3 in condizioni di pH biologico) situato in posizione α rispetto al gruppo carbossilico, e una catena laterale S-metil tioetere, classificandolo come amminoacido alifatico non polare.
Nei geni nucleari degli eucarioti e in Archaea, la metionina è codificata dal codone di inizio, il che significa che indica l'inizio della regione codificante ed è il primo amminoacido prodotto in un polipeptide nascente durante la traduzione dell'mRNA.[6]
Derivati
S-adenosilmetionina
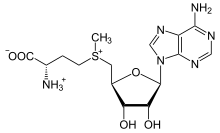
L'S-adenosilmetionina (abbreviata SAM) deriva dalla metionina ed è un cofattore che funge principalmente da donatore di metile; è composto da una molecola di adenosile (tramite il carbonio 5′) legata allo zolfo della metionina, ciò la rende un catione solfonio (cioè tre sostituenti e carica positiva). Lo zolfo agisce come un acido di Lewis debole (cioè donatore/elettrofilo) che consente al gruppo S-metile di essere trasferito ad un ossigeno, ad un azoto o ad un sistema aromatico, spesso con l'azione di cofattori come la cobalamina (vitamina B12 nell'uomo).
Metabolismo
Biosintesi
Essendo un aminoacido essenziale, la metionina non viene sintetizzata de novo negli esseri umani e negli animali, ma è necessario assumerla con la dieta, direttamente o attraverso proteine che la contengono. Nelle piante e in microrganismi viene sintetizzata.
Catabolismo

La metionina viene convertita in S-adenosilmetionina (SAM) da (1) metionina adenosiltransferasi.
SAM funge da donatore di metile in molte (2) reazioni metiltransferasiche e viene convertito in S-adenosilomocisteina (SAH).
(3) Adenosilomocisteinasi cisteina.
(5) La cistationina-β-sintasi (un enzima che richiede la forma attiva della vitamina B6, il piridossal fosfato) combina l'omocisteina e la serina per produrre la cistationina. La cistationina viene poi scomposta in cisteina e α-chetobutirrato tramite (6) cistationina-γ-liasi. (7) L'enzima α-chetoacido deidrogenasi converte l'α-chetobutirrato in propionil-CoA, che viene metabolizzato in succinil-CoA tramite tre reazioni mitocondriali.
Rigenerazione
La metionina può essere rigenerata dall'omocisteina tramite (4) metionina sintasi in una reazione che richiede la vitamina B12 come cofattore.
Note
- ^ scheda della metionina su IFA-GESTIS
- ^ Methionine, su webmd.com.
- ^ Cavuoto P, Fenech MF, A review of methionine dependency and the role of methionine restriction in cancer growth control and life-span extension, in Cancer Treatment Reviews, vol. 38, n. 6, 2012, pp. 726–736, DOI:10.1016/j.ctrv.2012.01.004.
- ^ Cellarier E, Durando X, Vasson MP, Farges MC, Demiden A, Maurizis JC, Madelmont JC, Chollet P, Methionine dependency and cancer treatment, in Cancer Treatment Reviews, vol. 29, n. 6, 2003, pp. 489–499, DOI:10.1016/S0305-7372(03)00118-X.
- ^ A Biographical Memoir of John Howard Mueller (PDF), su nasonline.org, National Academy of Sciences, 1987.
- ^ Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM, Amino acids biosynthesis and nitrogen assimilation pathways: a great genomic deletion during eukaryotes evolution, in BMC Genomics, 12 Suppl 4, Suppl 4, December 2011, pp. S2, DOI:10.1186/1471-2164-12-S4-S2.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su metionina
Wikimedia Commons contiene immagini o altri file su metionina
Collegamenti esterni
- (EN) methionine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 20748 · LCCN (EN) sh85084391 · BNF (FR) cb12152818d (data) · J9U (EN, HE) 987007529209605171 |
|---|