Cannabidiolo: differenze tra le versioni
Aggiungi 1 libro per la Wikipedia:Verificabilità (20220116sim)) #IABot (v2.0.8.6) (GreenC bot |
Nessun oggetto della modifica Etichetta: Editor wikitesto 2017 |
||
| Riga 1: | Riga 1: | ||
{{C|voce su sostanza attualmente oggetto di vasta campagna promozionale mediatica come integratore alimentare, utilizza una selezione di lavori di ricerca, per lo più non conclusivi ([[cherry picking]]?), per accreditare senza riserve proprietà terapeutiche che sono invece tuttora controverse; contiene affermazioni contraddittorie (ad esempio si legge nell'incipit che ''"è un promettente antipsicotico atipico"'' mentre poche righe sotto si legge che ''"il cannabidiolo non è psicoattivo"''). Occorre un'accurata revisione sulla base di fonti che siano consolidate e autorevoli, come [[meta-analisi]] e documenti ufficiali degli enti regolatori nazionali e internazionali, ad esempio [https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd]|medicina|gennaio 2022}} |
|||
{{Disclaimer|medico}} |
{{Disclaimer|medico}} |
||
{{Composto chimico |
{{Composto chimico |
||
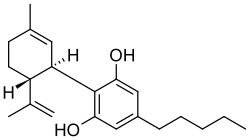
|immagine1_nome = Cannabidiol |
|immagine1_nome = Cannabidiol.svg |
||
|immagine1_dimensioni = |
|immagine1_dimensioni = 250px |
||
|immagine1_descrizione = Struttura |
|immagine1_descrizione = Struttura del cannabidiolo |
||
|immagine2_nome = CBD-3D-balls.png |
|immagine2_nome = CBD-3D-balls.png |
||
|immagine2_dimensioni = |
|immagine2_dimensioni = 250px |
||
|immagine2_descrizione = |
|immagine2_descrizione = Modello 3D della molecola |
||
|immagine3_nome = |
|||
|nome_IUPAC = 2-[(1''R'',6''R'')-3-metil-6-(prop-1-en-2-il)<br/>cicloes-2-enil]-5-pentilbenzen-1,3-diolo |
|||
|immagine3_dimensioni = |
|||
|immagine3_descrizione = |
|||
|immagine4_nome = |
|||
|immagine4_dimensioni = |
|||
|immagine4_descrizione = |
|||
|immagine5_nome = |
|||
|immagine5_dimensioni = |
|||
|immagine5_descrizione = |
|||
|nome_IUPAC = 2-[(1''R'',6''R'')-6-Isopropenil-3-metilcicloes-2-en-1-ul]-5-pentilbenzene-1,3-diolo |
|||
|abbreviazioni = CBD |
|||
|nomi_alternativi = |
|nomi_alternativi = |
||
|massa_molecolare = |
|||
CBD |
|||
|peso_formula = |
|||
|aspetto = |
|||
|numero_EINECS = |
|||
|densità_condensato = |
|||
|densità_g_l = |
|||
|densità_gas = |
|||
|prodotto_ionico = |
|||
|indice_di_rifrazione = |
|||
|Ka = |
|||
|Ka_temperatura = |
|||
|Kb = |
|||
|Kb_temperatura = |
|||
|punto_isoelettrico = |
|||
|solubilità_acqua = insolubile |
|||
|Ks = |
|||
|Ks_temperatura = |
|||
|temperatura_di_fusione = |
|||
|entalpia_di_fusione = |
|||
|entropia_di_fusione = |
|||
|temperatura_di_ebollizione = |
|||
|entalpia_di_ebollizione = |
|||
|entropia_di_ebollizione = |
|||
|punto_triplo = |
|||
|punto_critico = |
|||
|tensione_di_vapore = |
|||
|tensione_di_vapore_temperatura = |
|||
|sistema_cristallino = |
|||
|viscosità_cinematica = |
|||
|viscosità_cinematica_temperatura = |
|||
|viscosità_dinamica = |
|||
|viscosità_dinamica_temperatura = |
|||
|entalpia_standard_di_formazione = |
|||
|entropia_standard_di_formazione = |
|||
|capacità_termica = |
|||
|entalpia_standard_di_combustione = |
|||
|LD50 = 50 mg/kg nei topi intravena |
|||
|titolo_caratteristiche_generali = --- |
|titolo_caratteristiche_generali = --- |
||
|titolo_proprietà_chimico-fisiche = --- |
|||
|massa_molecolare = 314,46 g/mol |
|||
|titolo_proprietà_termochimiche = |
|||
}} |
|||
|energia_libera_standard_di_formazione = |
|||
|titolo_proprietà_tossicologiche = --- |
|||
}}'''Il cannabidiolo''' ( '''CBD''' ) è un composto chimico scoperto nella [[cannabis sativa|''Cannabis sativa'']] essiccata e nell'[[hashish]] nel 1940.<ref>{{Cita pubblicazione|nome=Roger|cognome=Adams|nome2=Madison|cognome2=Hunt|nome3=J. H.|cognome3=Clark|data=1940-01-01|titolo=Structure of Cannabidiol, a Product Isolated from the Marihuana Extract of Minnesota Wild Hemp. I|rivista=Journal of the American Chemical Society|volume=62|numero=1|pp=196–200|accesso=2022-01-18|doi=10.1021/ja01858a058|url=https://doi.org/10.1021/ja01858a058}}</ref><ref>{{Cita pubblicazione|nome=A.|cognome=Jacob|nome2=A. R.|cognome2=Todd|data=1940|titolo=119. Cannabis indica. Part II. Isolation of cannabidiol from Egyptian hashish. Observations on the structure of cannabinol|rivista=Journal of the Chemical Society (Resumed)|pp=649|accesso=2022-01-18|doi=10.1039/jr9400000649|url=http://dx.doi.org/10.1039/jr9400000649}}</ref> È uno dei 142 fitocannabinoidi identificati nelle piante di [[cannabis sativa|''Cannabis sativa'']].<ref>{{Cita libro|nome=Mahmoud A.|cognome=ElSohly|nome2=Waseem|cognome2=Gul|titolo=Constituents of Cannabis Sativa|url=http://dx.doi.org/10.1093/acprof:oso/9780199662685.003.0001|accesso=2022-01-19|data=2014-08-21|editore=Oxford University Press|pp=3–22}}</ref> Si trova anche nelle foglie della [[Cannabaceae|cannabacea]] filogeneticamente più vicina alla Cannabis sativa, il [[Humulus lupulus|luppolo]]<ref>{{Cita pubblicazione|nome=G. S.|cognome=Duraisamy|nome2=A. K.|cognome2=Mishra|nome3=T.|cognome3=Kocábek|data=2018-06-01|titolo=Activation of polyketide synthase gene promoter in Cannabis sativa by heterologous transcription factors derived from Humulus lupulus|rivista=Biologia plantarum|volume=62|numero=2|pp=250–260|accesso=2022-01-18|doi=10.1007/s10535-017-0766-z|url=http://bp.ueb.cas.cz/doi/10.1007/s10535-017-0766-z.html}}</ref><ref>{{Cita web|url=https://phytochem.nal.usda.gov/phytochem/chemicals/show/5238?et=|titolo=Dr. Duke's Phytochemical and Ethnobotanical Databases at NAL|sito=phytochem.nal.usda.gov|accesso=2022-01-18}}</ref> e può essere prodotto anche per sintesi chimica. Come [[Cannabinoidi|cannabinoide]] ricavato dalla Cannabis è oggetto di controversie sul suo utilizzo legale alla luce delle diverse interpretazioni e applicazioni dei [[Ufficio delle Nazioni Unite per il controllo della droga e la prevenzione del crimine#Trattati relativi alle droghe|trattati internazionali di controllo delle droghe]]. La progressiva e parziale liberalizzazione della Cannabis, agli inizi del XXI secolo ha consentito l'avvio di molte ricerche sui potenziali utilizzi farmacologici del CBD e, in alcuni paesi, la commercializzazione di prodotti caratterizzati dalla presenza del CBD. Il CBD non ha la stessa psicoattività del THC. A partire dal 2017, quando l'[[Organizzazione mondiale della sanità|OMS]] dichiarò che il CBD non era tra le [[Sostanza psicoattiva#Sostanze controllate|sostanze controllate]]<ref name=":8">{{Cita web|url=https://www.who.int/news-room/questions-and-answers/item/cannabidiol-(compound-of-cannabis)|titolo=Drugs (psychoactive): Cannabidiol (compound of cannabis)|sito=www.who.int|lingua=en|accesso=2022-01-19}}</ref>, la ricerca clinica sul CBD includeva studi relativi ad ansia, cognizione, disturbi del movimento e dolore, cancro ecc..; ma non ci sono prove di alta qualità sufficienti per dire che il cannabidiolo sia efficace per queste condizioni.<ref>{{Cita pubblicazione|nome=Nicola|cognome=Black|nome2=Emily|cognome2=Stockings|nome3=Gabrielle|cognome3=Campbell|data=2019-12|titolo=Cannabinoids for the treatment of mental disorders and symptoms of mental disorders: A systematic review and meta-analysis|rivista=The lancet. Psychiatry|volume=6|numero=12|pp=995–1010|accesso=2022-01-19|doi=10.1016/S2215-0366(19)30401-8|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6949116/}}</ref><ref>{{Cita pubblicazione|nome=Harrison J.|cognome=VanDolah|nome2=Brent A.|cognome2=Bauer|nome3=Karen F.|cognome3=Mauck|data=2019-09-01|titolo=Clinicians’ Guide to Cannabidiol and Hemp Oils|rivista=Mayo Clinic Proceedings|volume=94|numero=9|pp=1840–1851|lingua=English|accesso=2022-01-19|doi=10.1016/j.mayocp.2019.01.003|url=https://www.mayoclinicproceedings.org/article/S0025-6196(19)30007-2/abstract}}</ref><ref>{{Cita web|url=https://www.health.harvard.edu/newsletter_article/cbd-products-are-everywhere-but-do-they-work|titolo=CBD products are everywhere. But do they work?|sito=Harvard Health|data=2019-08-01|lingua=en|accesso=2022-01-19}}</ref> È stata invece riconosciuta da alcune autorità sanitarie l'efficacia di una farmaco basato sul CBD per alcune forme rare e gravi di epilessia.<ref>{{Cita web|url=https://www.fda.gov/news-events/press-announcements/fda-approves-first-drug-comprised-active-ingredient-derived-marijuana-treat-rare-severe-forms|titolo=FDA Approves First Drug Comprised of an Active Ingredient Derived from Marijuana to Treat Rare, Severe Forms of Epilepsy|autore=Office of the Commissioner|sito=FDA|data=2020-03-27|lingua=en|accesso=2022-01-19}}</ref><ref name=":1">{{Cita web|url=https://www.ema.europa.eu/en/medicines/human/EPAR/epidyolex|titolo=EMA: epidyolex}}</ref> |
|||
== Biosintesi == |
|||
Il '''cannabidiolo''' ('''CBD''') è un [[metabolita]] della ''[[Cannabis sativa]].'' Ha effetti rilassanti, [[anticonvulsivanti]], antidistonici, [[antiossidanti]], [[antinfiammatori]], favorisce il sonno ed è distensivo contro ansia<ref>{{Cita pubblicazione|autore=Gibson LP, Karoly HC, Ellingson JM, Klawitter J, Sempio C, Squeri JE, Bryan AD, Bidwell LC, Hutchison KE.|anno=2022|titolo=Effects of cannabidiol in cannabis flower: Implications for harm reduction|rivista=Addiction Biology|lingua=en|accesso=2022-01-04|doi=10.1111/adb.13092|url=https://onlinelibrary.wiley.com/doi/epdf/10.1111/adb.13092}}</ref> e panico. Si è rivelato inoltre in grado di ridurre la pressione endooculare ed è un promettente antipsicotico atipico.<ref>{{Cita web|url = http://www.medicalcannabis.it/mainpage.php?do=thc.htm|titolo = Cannabinoidi |accesso=25 marzo 2018|sito = |editore=Associazione Cannabis Terapeutica}}</ref><ref>{{cita pubblicazione |autore=Zuardi AW, Shirakawa I, Finkelfarb E, Karniol IG |titolo=Action of cannabidiol on the anxiety and other effects produced by delta 9-THC in normal subjects |rivista=Psychopharmacology |anno=1982 |volume=76 |pp=245-250 |url=https://archive.org/details/sim_psychopharmacology_1982-03_76_3/page/245|lingua=en}}</ref> |
|||
Il CBD è considerato un metabolita secondario della Cannabis sativa mentre in realtà è un artefatto che si forma per decarbossilazione non enzimatica del acido cannabidiolico (CBDa) durante l'[[Essiccazione di erbe|essiccazione]]. |
|||
Il percorso anabolico che porta alla formazione del CBD nella cannabis sativa è in gran parte in comune con quello del [[tetraidrocannabinolo]] (THC), il principale agente psicotropo della cannabis. |
|||
{|style="border:none; text-align:center; margin-left:auto; margin-right:auto;" |
|||
|+ |
|||
!Enzima |
|||
| |
|||
!Precursore, intermedio e reazione |
|||
|- |
|||
|style="background:#ffeeee"|3,5,7-triossododecanoil-CoA sintasi |
|||
| |
|||
|style="background:#eeeeee"|[[malonil-CoA]] |
|||
|- |
|||
| |
|||
|↘ |
|||
|↓ |
|||
|- |
|||
| |
|||
| |
|||
|style="background:#eeeeee"|3 malonil-[[Coenzima A|CoA]] + esanoil-CoA <=> 3 [[Coenzima A|CoA]] + 3,5,7-triossodecanoil-CoA + 3 [[Anidride carbonica|CO<sub>2</sub>]] |
|||
|- |
|||
| |
|||
| |
|||
|↓ |
|||
|- |
|||
|style="border:none; background:#ffeeee"|ciclasi dell'acido olivetolico |
|||
| |
|||
|style="background:#eeeeee"|3,5,7-triossodecanoil-CoA |
|||
|- |
|||
| |
|||
|↘ |
|||
|↓ |
|||
|- |
|||
| |
|||
| |
|||
|style="background:#eeeeee"|3,5,7-triossodecanoil-CoA <=> CoA + 2,4-diidrossi-6-pentilbenzoato |
|||
|- |
|||
| |
|||
| |
|||
|↓ |
|||
|- |
|||
|style="border:none; background:#ffeeee"|geranil-difosfato:olivetolato geraniltransferasi |
|||
| |
|||
|style="background:#eeeeee"|2,4-diidrossi-6-pentilbenzoato ([[acido olivetolico]]) |
|||
|- |
|||
| |
|||
|↘ |
|||
|↓ |
|||
|- |
|||
| |
|||
| |
|||
|style="background:#eeeeee"|Geranil difosfato + 2,4-diidrossi-6-pentilbenzoato <=> difosfato + cannabigerolato |
|||
|- |
|||
| |
|||
| |
|||
|↓ |
|||
|- |
|||
|style="border:none; background:#ffeeee"|sintasi dell'acido cannabidiolico |
|||
| |
|||
|style="background:#eeeeee"|Cannabigerolato |
|||
|- |
|||
| |
|||
|↘ |
|||
|↓ |
|||
|- |
|||
| |
|||
| |
|||
|style="background:#eeeeee"|Cannabigerolato + [[Ossigeno|O<sub>2</sub>]] <=> Acido cannabidiolico + [[Perossido di idrogeno|H<sub>2</sub>O<sub>2</sub>]] |
|||
|- |
|||
| |
|||
| |
|||
|↓ |
|||
|- |
|||
| |
|||
| |
|||
|style="background:#eeeeee"|Acido cannabidiolico |
|||
|- |
|||
| |
|||
| |
|||
|↓ |
|||
|- |
|||
| |
|||
| |
|||
|style="background:#eeeeee"|Acido cannabidiolico <=> Cannabidiolo + CO<sub>2</sub> |
|||
|- |
|||
| |
|||
| |
|||
|↓ |
|||
|- |
|||
| |
|||
| |
|||
|style="background:#eeeeee"|Cannabidiolo |
|||
|} |
|||
Il cannabigerolato è anche il precursore, attraverso una diversa reazione enzimatica, dell'acido tetraidrocannabinolico (THCa) da cui deriva il THC. |
|||
La decarbossilazione di CBDa e THCa avviene spontaneamente accelerata per azione della luce e/o del calore. CBDa e THCa provenendo dallo stesso intermedio sono complementari, pertanto nelle varietà di cannabis a basso tenore di THC il cannabidiolo è il principale cannabinoide estraibile al contrario delle varietà ad alto tenore di THC dove il THC è il cannabinoide principale. |
|||
== Reazioni == |
|||
Di particolare interesse per definire l'assetto legale della sostanza è la possibile ciclizzazione del cannabidiolo. |
|||
[[File:Intramolekulare cyklisierung von CBD zu Δ9-THC.png|700px|Possibile ciclizzazione intramolecolare del CBD]] |
|||
Il CBD ciclizza a Δ8- e Δ9-THC in presenza di [[Acido di Lewis|acidi di Lewis]]( ad es. Trifluoruro di boro dietiletere o donatori di protoni come l'[[acido p-toluensolfonico]]); con il Δ8-THC ciclizzato da acidi forti e il Δ9-THC ciclizzato da acidi deboli. <ref name=":2">{{Cita pubblicazione|nome=Roger|cognome=Adams|nome2=D. C.|cognome2=Pease|nome3=C. K.|cognome3=Cain|data=1940-09|titolo=Structure of Cannabidiol. VI. Isomerization of Cannabidiol to Tetrahydrocannabinol, a Physiologically Active Product. Conversion of Cannabidiol to Cannabinol1|rivista=Journal of the American Chemical Society|volume=62|numero=9|pp=2402–2405|accesso=2022-01-19|doi=10.1021/ja01866a040|url=http://dx.doi.org/10.1021/ja01866a040}}</ref> |
|||
Due studi in vitro avrebbero dimostrato che il CBD si converte in THC nei [[Succo gastrico|succhi gastrici]].<ref>{{Cita pubblicazione|nome=John|cognome=Merrick|nome2=Brian|cognome2=Lane|nome3=Terri|cognome3=Sebree|data=2016-12|titolo=Identification of Psychoactive Degradants of Cannabidiol in Simulated Gastric and Physiological Fluid|rivista=Cannabis and Cannabinoid Research|volume=1|numero=1|pp=102–112|accesso=2022-01-19|doi=10.1089/can.2015.0004|url=http://dx.doi.org/10.1089/can.2015.0004}}</ref><ref name=":3">{{Cita pubblicazione|nome=Kazuhito|cognome=Watanabe|nome2=Yuka|cognome2=Itokawa|nome3=Satoshi|cognome3=Yamaori|data=2007-03-20|titolo=Conversion of cannabidiol to Δ9-tetrahydrocannabinol and related cannabinoids in artificial gastric juice, and their pharmacological effects in mice|rivista=Forensic Toxicology|volume=25|numero=1|pp=16–21|accesso=2022-01-19|doi=10.1007/s11419-007-0021-y|url=http://dx.doi.org/10.1007/s11419-007-0021-y}}</ref> Il rateo di conversione rilevato sarebbe pari al 2,9%.<ref name=":3" /> La conversione in vivo non è stata dimostrata e l'assunzione orale di CBD non produrrebbe gli effetti del THC.<ref>{{Cita pubblicazione|nome=Gerhard|cognome=Nahler|nome2=Franjo|cognome2=Grotenhermen|nome3=Antonio Waldo|cognome3=Zuardi|data=2017-01|titolo=A Conversion of Oral Cannabidiol to Delta9-Tetrahydrocannabinol Seems Not to Occur in Humans|rivista=Cannabis and Cannabinoid Research|volume=2|numero=1|pp=81–86|accesso=2022-01-19|doi=10.1089/can.2017.0009|url=http://dx.doi.org/10.1089/can.2017.0009}}</ref><ref>{{Cita pubblicazione|nome=Paul|cognome=Consroe|nome2=Joan|cognome2=Laguna|nome3=James|cognome3=Allender|data=1991-11|titolo=Controlled clinical trial of cannabidiol in Huntington's disease|rivista=Pharmacology Biochemistry and Behavior|volume=40|numero=3|pp=701–708|accesso=2022-01-19|doi=10.1016/0091-3057(91)90386-g|url=http://dx.doi.org/10.1016/0091-3057(91)90386-g}}</ref><ref>{{Cita pubblicazione|nome=Franjo|cognome=Grotenhermen|nome2=Ethan|cognome2=Russo|nome3=Antonio Waldo|cognome3=Zuardi|data=2017-12|titolo=Even High Doses of Oral Cannabidiol Do Not Cause THC-Like Effects in Humans: Comment on Merrick et al. Cannabis and Cannabinoid Research 2016;1(1):102–112; DOI: 10.1089/can.2015.0004|rivista=Cannabis and Cannabinoid Research|volume=2|numero=1|pp=1–4|accesso=2022-01-19|doi=10.1089/can.2016.0036|url=http://dx.doi.org/10.1089/can.2016.0036}}</ref><ref>{{Cita pubblicazione|nome=Marcel O.|cognome=Bonn-Miller|nome2=Stan L.|cognome2=Banks|nome3=Terri|cognome3=Sebree|data=2017-01|titolo=Conversion of Cannabidiol Following Oral Administration: Authors' Response to Grotenhermen et al. DOI: 10.1089/can.2016.0036|rivista=Cannabis and Cannabinoid Research|volume=2|numero=1|pp=5–7|accesso=2022-01-19|doi=10.1089/can.2016.0038|url=http://dx.doi.org/10.1089/can.2016.0038}}</ref> |
|||
La ciclizzazione del CBD in THC avverrebbe anche per [[pirolisi]] ad alte temperature<ref>{{Cita pubblicazione|nome=Zsuzsanna|cognome=Czégény|nome2=Gréta|cognome2=Nagy|nome3=Bence|cognome3=Babinszki|data=2021-04-26|titolo=CBD, a precursor of THC in e-cigarettes|rivista=Scientific Reports|volume=11|pp=8951|accesso=2022-01-19|doi=10.1038/s41598-021-88389-z|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8076212/}}</ref> ma non quando viene bruciato.<ref>{{Cita pubblicazione|nome=William|cognome=Quarles|nome2=George|cognome2=Ellman|nome3=Reese|cognome3=Jones|data=1973-01-01|titolo=Toxicology of Marijuana: Conditions for Conversion of Cannabidioi to THC upon Smoking|rivista=Clinical Toxicology|volume=6|numero=2|pp=211–216|accesso=2022-01-19|doi=10.3109/15563657308990520|url=https://doi.org/10.3109/15563657308990520}}</ref> |
|||
La conversione del CBD in THC o in altri cannabonoidi psicotropi è oggetto di controversia scientifica.<ref>{{Cita pubblicazione|nome=Patricia|cognome=Golombek|nome2=Marco|cognome2=Müller|nome3=Ines|cognome3=Barthlott|data=2020-06-03|titolo=Conversion of Cannabidiol (CBD) into Psychotropic Cannabinoids Including Tetrahydrocannabinol (THC): A Controversy in the Scientific Literature|rivista=Toxics|volume=8|numero=2|pp=41|accesso=2022-01-19|doi=10.3390/toxics8020041|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7357058/}}</ref> |
|||
Sono stati identificati 7 [[Isomeria|isomeri]] e 60 stereoisomeri del CBD <ref name=":9">{{Cita pubblicazione|nome=Y.|cognome=Gaoni|nome2=R.|cognome2=Mechoulam|data=1966-01-01|titolo=Hashish—VII: The isomerization of cannabidiol to tetrahydrocannabinols|rivista=Tetrahedron|volume=22|numero=4|pp=1481–1488|lingua=en|accesso=2022-01-19|doi=10.1016/S0040-4020(01)99446-3|url=https://www.sciencedirect.com/science/article/pii/S0040402001994463}}</ref><ref name=":10">{{Cita web|url=https://www.acs.org/content/acs/en/molecule-of-the-week/archive/c/cannabidiol.html|titolo=Cannabidiol|sito=American Chemical Society|lingua=en|accesso=2022-01-19}}</ref> e lo stesso CBD è considerato in alcuni studi un isomero del THC.<ref name=":11">{{Cita web|url=https://www.who.int/medicines/access/controlled-substances/IsomersTHC.pdf|titolo=WHO: THC isomers}}</ref><ref name=":2" /> |
|||
In un ambiente fortemente basico in condizioni [[Ossidazione|ossidative]], anche esposto all'aria, il CBD viene prima idrossilato sull'[[Composti aromatici|anello aromatico]] e poi ossidato a [[Chinoni|idrossichinone]].<ref>{{Cita pubblicazione|nome=R.|cognome=Mechoulam|nome2=Z.|cognome2=Ben-Zvi|nome3=Y.|cognome3=Gaoni|data=1968-01-01|titolo=Hashish—XIII: On the nature of the beam test|rivista=Tetrahedron|volume=24|numero=16|pp=5615–5624|lingua=en|accesso=2022-01-19|doi=10.1016/0040-4020(68)88159-1|url=https://www.sciencedirect.com/science/article/pii/0040402068881591}}</ref> Se conservato a lungo in presenza di aria, si ossida a cannabinolo. |
|||
A differenza del [[THC]], altro principio attivo contenuto nella ''Cannabis'', il cannabidiolo non è psicoattivo, non crea assuefazione e possiede notevoli capacità rilassanti, antinfiammatorie e antidolorifiche. Il cannabidiolo è inoltre un antagonista, non specifico, dei [[Recettori cannabinoidi|recettori cannabinoidi CB1 e CB2]], dei [[recettori μ-oppioidi]] (MOR) e [[Recettori Δ-oppioidi|δ-oppioidi]] (DOR) e di altri neurotrasmettitori.<ref name="Kathmann2006">{{Cita pubblicazione |nome=Markus|cognome=Kathmann |data=febbraio 2006 |titolo=Cannabidiol is an allosteric modulator at mu- and delta-opioid receptors |rivista=Naunyn-Schmiedeberg's Archives of Pharmacology |volume=372 |numero=5 |pp=354–361 |accesso=10 maggio 2018 |doi=10.1007/s00210-006-0033-x |url=https://www.ncbi.nlm.nih.gov/pubmed/16489449 |nome2=Karsten |cognome2=Flau |nome3=Agnes |cognome3=Redmer |lingua=en}}</ref>[[File:CBD-Infused KickBack Cold Brew Coffee .jpg|miniatura|Infusi contenente CBD in un negozio di alimentari a [[Los Angeles]], in [[California]].]] |
|||
== Farmacologia == |
== Farmacologia == |
||
A tutto il 2020 solo 2 farmaci contenenti cannabidiolo, entrambi della ''GW pharmnaceutical'', sono stati messi in commercio nella UE: l'Epidiolex, contenente 100mg di cannabidiolo ogni [[Litro|mL]] di prodotto, come anti-convulsivo per trattare 2 forme rare di epilessia<ref name=":1" /> e il Sativex<ref>{{Cita web|url=https://www.ema.europa.eu/en/medicines/human/paediatric-investigation-plans/emea-000181-pip01-08-m03|titolo=EMA: Sativex}}</ref> ,contenente 2,7 [[Milligrammo|mg]] di delta-9-tetraidrocannabinolo (THC) e 2,5 mg di cannabidiolo (CBD) ogni 100 [[Microlitro|μL]] come antispatico per alleviare i sintomi in pazienti adulti affetti da spasticità da moderata a grave dovuta alla sclerosi multipla (SM) che non hanno manifestato una risposta adeguata ad altri medicinali. Di entrambi il meccanismo d'azione non è stato perfettamente compreso.<ref>{{Cita pubblicazione|autore=Pietro Brunetti e al.|anno=2020|titolo=Pharmacology and legal status |
|||
of cannabidiol|rivista=Ann Ist Super Sanità|volume=56|numero=3|pp=285-291|url=https://www.iss.it/documents/20126/0/ANN_20_03_06.pdf/3acb2b1a-4f97-edf6-41a7-46d709b24883?t=1599813689981}}</ref> Di altri farmaci sono in corso sperimentazioni cliniche. |
|||
{| class="wikitable floatright" |
|||
|+ tabella comparativa effetti del THC e del CBD <ref>{{Cita pubblicazione|nome=Zerrin|cognome=Atakan|data=2012-12|titolo=Cannabis, a complex plant: different compounds and different effects on individuals|rivista=Therapeutic Advances in Psychopharmacology|volume=2|numero=6|pp=241–254|accesso=2022-01-19|doi=10.1177/2045125312457586|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3736954/}}</ref> |
|||
!Effetto |
|||
!THC |
|||
!CBD |
|||
!Riferimenti |
|||
|- |
|||
| colspan="4" |'''''Effetti recettoriali/non recettoriali''''' |
|||
|- |
|||
|CB1 |
|||
| ++ |
|||
|± |
|||
|<ref name=":4">{{Cita pubblicazione|nome=M. H.|cognome=Rhee|nome2=Z.|cognome2=Vogel|nome3=J.|cognome3=Barg|data=1997-09-26|titolo=Cannabinol derivatives: binding to cannabinoid receptors and inhibition of adenylylcyclase|rivista=Journal of Medicinal Chemistry|volume=40|numero=20|pp=3228–3233|accesso=2022-01-19|doi=10.1021/jm970126f|url=https://pubmed.ncbi.nlm.nih.gov/9379442/}}</ref><ref>{{Cita pubblicazione|nome=H.|cognome=Iwamura|nome2=H.|cognome2=Suzuki|nome3=Y.|cognome3=Ueda|data=2001-02|titolo=In vitro and in vivo pharmacological characterization of JTE-907, a novel selective ligand for cannabinoid CB2 receptor|rivista=The Journal of Pharmacology and Experimental Therapeutics|volume=296|numero=2|pp=420–425|accesso=2022-01-19|url=https://pubmed.ncbi.nlm.nih.gov/11160626/}}</ref><ref name=":5">{{Cita pubblicazione|nome=Kazuhide|cognome=Hayakawa|nome2=Kenichi|cognome2=Mishima|nome3=Mai|cognome3=Hazekawa|data=2008-01-10|titolo=Cannabidiol potentiates pharmacological effects of Delta(9)-tetrahydrocannabinol via CB(1) receptor-dependent mechanism|rivista=Brain Research|volume=1188|pp=157–164|accesso=2022-01-19|doi=10.1016/j.brainres.2007.09.090|url=https://pubmed.ncbi.nlm.nih.gov/18021759/}}</ref> |
|||
|- |
|||
|CB2 |
|||
| + |
|||
|± |
|||
|<ref name=":4">{{Cita pubblicazione|nome=M. H.|cognome=Rhee|nome2=Z.|cognome2=Vogel|nome3=J.|cognome3=Barg|data=1997-09-26|titolo=Cannabinol derivatives: binding to cannabinoid receptors and inhibition of adenylylcyclase|rivista=Journal of Medicinal Chemistry|volume=40|numero=20|pp=3228–3233|accesso=2022-01-19|doi=10.1021/jm970126f|url=https://pubmed.ncbi.nlm.nih.gov/9379442/}}</ref><ref>{{Cita pubblicazione|nome=V. M.|cognome=Showalter|nome2=D. R.|cognome2=Compton|nome3=B. R.|cognome3=Martin|data=1996-09|titolo=Evaluation of binding in a transfected cell line expressing a peripheral cannabinoid receptor (CB2): identification of cannabinoid receptor subtype selective ligands|rivista=The Journal of Pharmacology and Experimental Therapeutics|volume=278|numero=3|pp=989–999|accesso=2022-01-19|url=https://pubmed.ncbi.nlm.nih.gov/8819477/}}</ref> |
|||
|- |
|||
|Antinfiammatorio |
|||
| + |
|||
| + |
|||
|<ref name=":6">{{Cita pubblicazione|nome=Ana|cognome=Juknat|nome2=Neta|cognome2=Rimmerman|nome3=Rivka|cognome3=Levy|data=2012-11|titolo=Cannabidiol affects the expression of genes involved in zinc homeostasis in BV-2 microglial cells|rivista=Neurochemistry International|volume=61|numero=6|pp=923–930|accesso=2022-01-19|doi=10.1016/j.neuint.2011.12.002|url=https://pubmed.ncbi.nlm.nih.gov/22178458/}}</ref> |
|||
|- |
|||
|Immunomodulante |
|||
| + |
|||
| + |
|||
|<ref>{{Cita pubblicazione|nome=Barbara|cognome=Costa|nome2=Anna Elisa|cognome2=Trovato|nome3=Francesca|cognome3=Comelli|data=2007-02-05|titolo=The non-psychoactive cannabis constituent cannabidiol is an orally effective therapeutic agent in rat chronic inflammatory and neuropathic pain|rivista=European Journal of Pharmacology|volume=556|numero=1-3|pp=75–83|accesso=2022-01-19|doi=10.1016/j.ejphar.2006.11.006|url=https://pubmed.ncbi.nlm.nih.gov/17157290/}}</ref> |
|||
|- |
|||
| colspan="4" |'''''Effetti sul SNC''''' |
|||
|- |
|||
|Anticonvulsivante |
|||
| + |
|||
| ++ |
|||
|<ref>{{Cita pubblicazione|nome=M. J.|cognome=Wallace|nome2=J. L.|cognome2=Wiley|nome3=B. R.|cognome3=Martin|data=2001-09-28|titolo=Assessment of the role of CB1 receptors in cannabinoid anticonvulsant effects|rivista=European Journal of Pharmacology|volume=428|numero=1|pp=51–57|accesso=2022-01-19|doi=10.1016/s0014-2999(01)01243-2|url=https://pubmed.ncbi.nlm.nih.gov/11779037/}}</ref> |
|||
|- |
|||
|Rilassante muscolare |
|||
| ++ |
|||
| + |
|||
|<ref>{{Cita pubblicazione|nome=Shaheen E|cognome=Lakhan|nome2=Marie|cognome2=Rowland|data=2009-12-04|titolo=Whole plant cannabis extracts in the treatment of spasticity in multiple sclerosis: a systematic review|rivista=BMC Neurology|volume=9|pp=59|accesso=2022-01-19|doi=10.1186/1471-2377-9-59|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2793241/}}</ref> |
|||
|- |
|||
|Ansiolitico |
|||
|± |
|||
| ++ |
|||
|<ref>{{Cita libro|nome=A.W.|cognome=Zuardi|nome2=J.A.|cognome2=de Souza Crippa|nome3=J.E.C.|cognome3=Hallak|titolo=The Anxiolytic Effects of Cannabidiol (CBD)|url=http://dx.doi.org/10.1016/b978-0-12-800756-3.00097-1|accesso=2022-01-19|data=2017|editore=Elsevier|pp=e131–e139}}</ref><ref>{{Cita pubblicazione|nome=José Alexandre|cognome=Crippa|nome2=Antonio Waldo|cognome2=Zuardi|nome3=Rocio|cognome3=Martín-Santos|data=2009-10|titolo=Cannabis and anxiety: a critical review of the evidence|rivista=Human Psychopharmacology|volume=24|numero=7|pp=515–523|accesso=2022-01-19|doi=10.1002/hup.1048|url=https://pubmed.ncbi.nlm.nih.gov/19693792/}}</ref> |
|||
|- |
|||
|Psicotropo |
|||
| ++ |
|||
|− |
|||
|<ref>{{Cita pubblicazione|data=2001|titolo=Handbook of Psychotropic Herbs: A Scientific Analysis of Herbal Remedies for Psychiatric Conditions by Ethan Russo. Haworth Herbal Press. NY, USA. ISBN 0-7890-0718-5, US$69.85 hardback. ISBN 0-7890-1088-7, US$29.95 softback.|rivista=Phytotherapy Research|volume=15|numero=7|pp=648–648|accesso=2022-01-19|doi=10.1002/ptr.1055|url=http://dx.doi.org/10.1002/ptr.1055}}</ref><ref>{{Cita pubblicazione|nome=Deepak Cyril|cognome=D'Souza|nome2=Edward|cognome2=Perry|nome3=Lisa|cognome3=MacDougall|data=2004-08|titolo=The psychotomimetic effects of intravenous delta-9-tetrahydrocannabinol in healthy individuals: implications for psychosis|rivista=Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology|volume=29|numero=8|pp=1558–1572|accesso=2022-01-19|doi=10.1038/sj.npp.1300496|url=https://pubmed.ncbi.nlm.nih.gov/15173844/}}</ref> |
|||
|- |
|||
|Antipsicotico |
|||
|− |
|||
| ++ |
|||
|<ref>{{Cita pubblicazione|nome=A. W.|cognome=Zuardi|nome2=S. L.|cognome2=Morais|nome3=F. S.|cognome3=Guimarães|data=1995-10|titolo=Antipsychotic effect of cannabidiol|rivista=The Journal of Clinical Psychiatry|volume=56|numero=10|pp=485–486|accesso=2022-01-19|url=https://pubmed.ncbi.nlm.nih.gov/7559378/}}</ref><ref>{{Cita pubblicazione|nome=Fabrício A.|cognome=Moreira|nome2=Francisco S.|cognome2=Guimarães|data=2005-04-11|titolo=Cannabidiol inhibits the hyperlocomotion induced by psychotomimetic drugs in mice|rivista=European Journal of Pharmacology|volume=512|numero=2-3|pp=199–205|accesso=2022-01-19|doi=10.1016/j.ejphar.2005.02.040|url=https://pubmed.ncbi.nlm.nih.gov/15840405/}}</ref> |
|||
|- |
|||
|Problemi di memoria a breve termine |
|||
| + |
|||
|− |
|||
|<ref name=":5">{{Cita pubblicazione|nome=Kazuhide|cognome=Hayakawa|nome2=Kenichi|cognome2=Mishima|nome3=Mai|cognome3=Hazekawa|data=2008-01-10|titolo=Cannabidiol potentiates pharmacological effects of Delta(9)-tetrahydrocannabinol via CB(1) receptor-dependent mechanism|rivista=Brain Research|volume=1188|pp=157–164|accesso=2022-01-19|doi=10.1016/j.brainres.2007.09.090|url=https://pubmed.ncbi.nlm.nih.gov/18021759/}}</ref><ref>{{Cita pubblicazione|nome=Celia J. A.|cognome=Morgan|nome2=Gráinne|cognome2=Schafer|nome3=Tom P.|cognome3=Freeman|data=2010-10|titolo=Impact of cannabidiol on the acute memory and psychotomimetic effects of smoked cannabis: naturalistic study: naturalistic study [corrected]|rivista=The British Journal of Psychiatry: The Journal of Mental Science|volume=197|numero=4|pp=285–290|accesso=2022-01-19|doi=10.1192/bjp.bp.110.077503|url=https://pubmed.ncbi.nlm.nih.gov/20884951/}}</ref> |
|||
|- |
|||
|Distorsione della percezione del tempo |
|||
| ++ |
|||
|− |
|||
|<ref>{{Cita pubblicazione|nome=I. G.|cognome=Karniol|nome2=E. A.|cognome2=Carlini|data=1973|titolo=Comparative studies in man and in laboratory animals on 8 - and 9 -trans-tetrahydrocannabinol|rivista=Pharmacology|volume=9|numero=2|pp=115–126|accesso=2022-01-19|doi=10.1159/000136375|url=https://pubmed.ncbi.nlm.nih.gov/4713005/}}</ref><ref>{{Cita pubblicazione|nome=Beth M.|cognome=Anderson|nome2=Matthew|cognome2=Rizzo|nome3=Robert I.|cognome3=Block|data=2010-12|titolo=Sex, Drugs, and Cognition: Effects of Marijuana|rivista=Journal of psychoactive drugs|volume=42|numero=4|pp=413–424|accesso=2022-01-19|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3089380/}}</ref> |
|||
|- |
|||
|Antiossidante neuroprotettivo |
|||
| + |
|||
| ++ |
|||
|<ref name=":6">{{Cita pubblicazione|nome=Ana|cognome=Juknat|nome2=Neta|cognome2=Rimmerman|nome3=Rivka|cognome3=Levy|data=2012-11|titolo=Cannabidiol affects the expression of genes involved in zinc homeostasis in BV-2 microglial cells|rivista=Neurochemistry International|volume=61|numero=6|pp=923–930|accesso=2022-01-19|doi=10.1016/j.neuint.2011.12.002|url=https://pubmed.ncbi.nlm.nih.gov/22178458/}}</ref> |
|||
|- |
|||
|Antiemetico |
|||
| ++ |
|||
| ++ |
|||
|<ref>{{Cita pubblicazione|nome=Linda A|cognome=Parker|nome2=Erin M|cognome2=Rock|nome3=Cheryl L|cognome3=Limebeer|data=2011-8|titolo=Regulation of nausea and vomiting by cannabinoids|rivista=British Journal of Pharmacology|volume=163|numero=7|pp=1411–1422|accesso=2022-01-19|doi=10.1111/j.1476-5381.2010.01176.x|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3165951/}}</ref> |
|||
|- |
|||
|Sedazione |
|||
| + |
|||
|− |
|||
|<ref>{{Cita pubblicazione|nome=Ethan B.|cognome=Russo|nome2=Geoffrey W.|cognome2=Guy|nome3=Philip J.|cognome3=Robson|data=2007-08|titolo=Cannabis, pain, and sleep: lessons from therapeutic clinical trials of Sativex, a cannabis-based medicine|rivista=Chemistry & Biodiversity|volume=4|numero=8|pp=1729–1743|accesso=2022-01-19|doi=10.1002/cbdv.200790150|url=https://pubmed.ncbi.nlm.nih.gov/17712817/}}</ref><ref>{{Cita pubblicazione|nome=Anthony N.|cognome=Nicholson|nome2=Claire|cognome2=Turner|nome3=Barbara M.|cognome3=Stone|data=2004-06|titolo=Effect of Delta-9-tetrahydrocannabinol and cannabidiol on nocturnal sleep and early-morning behavior in young adults|rivista=Journal of Clinical Psychopharmacology|volume=24|numero=3|pp=305–313|accesso=2022-01-19|doi=10.1097/01.jcp.0000125688.05091.8f|url=https://pubmed.ncbi.nlm.nih.gov/15118485/}}</ref> |
|||
|- |
|||
| colspan="4" |'''''Effetti cardiovascolari''''' |
|||
|- |
|||
|Bradicardia |
|||
|− |
|||
| + |
|||
|<ref>{{Cita pubblicazione|nome=N. L.|cognome=Benowitz|nome2=R. T.|cognome2=Jones|data=1981-08|titolo=Cardiovascular and metabolic considerations in prolonged cannabinoid administration in man|rivista=Journal of Clinical Pharmacology|volume=21|numero=S1|pp=214S–223S|accesso=2022-01-19|doi=10.1002/j.1552-4604.1981.tb02598.x|url=https://pubmed.ncbi.nlm.nih.gov/6271827/}}</ref> |
|||
|- |
|||
|Tachicardia |
|||
| + |
|||
|− |
|||
|<ref name=":7">{{Cita pubblicazione|nome=David A.|cognome=Gorelick|nome2=Stephen J.|cognome2=Heishman|data=2006|titolo=Methods for clinical research involving cannabis administration|rivista=Methods in Molecular Medicine|volume=123|pp=235–253|accesso=2022-01-19|doi=10.1385/1-59259-999-0:235|url=https://pubmed.ncbi.nlm.nih.gov/16506412/}}</ref> |
|||
|- |
|||
|Ipertensione |
|||
| + |
|||
|− |
|||
|<ref>{{Cita pubblicazione|nome=Sándor|cognome=Bátkai|nome2=Pál|cognome2=Pacher|nome3=Douglas|cognome3=Osei-Hyiaman|data=2004-10-05|titolo=Endocannabinoids Acting at Cannabinoid-1 Receptors Regulate Cardiovascular Function in Hypertension|rivista=Circulation|volume=110|numero=14|pp=1996–2002|accesso=2022-01-19|doi=10.1161/01.CIR.0000143230.23252.D2|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2756479/}}</ref> |
|||
|- |
|||
|Ipotensione |
|||
|− |
|||
| + |
|||
|<ref name=":7">{{Cita pubblicazione|nome=David A.|cognome=Gorelick|nome2=Stephen J.|cognome2=Heishman|data=2006|titolo=Methods for clinical research involving cannabis administration|rivista=Methods in Molecular Medicine|volume=123|pp=235–253|accesso=2022-01-19|doi=10.1385/1-59259-999-0:235|url=https://pubmed.ncbi.nlm.nih.gov/16506412/}}</ref> |
|||
|- |
|||
| colspan="4" |'''''Appetito/IG/metabolico''''' |
|||
|- |
|||
=== Farmacodinamica === |
|||
|Appetito |
|||
| + |
|||
|− |
|||
|<ref>{{Cita pubblicazione|nome=Roger G|cognome=Pertwee|data=2009-2|titolo=Emerging strategies for exploiting cannabinoid receptor agonists as medicines|rivista=British Journal of Pharmacology|volume=156|numero=3|pp=397–411|accesso=2022-01-19|doi=10.1111/j.1476-5381.2008.00048.x|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2697681/}}</ref> |
|||
|- |
|||
|Motilità gastrointestinale (rallentata) |
|||
| ++ |
|||
| + |
|||
|<ref>{{Cita pubblicazione|nome=V.|cognome=Di Marzo|nome2=F.|cognome2=Piscitelli|data=2011-05|titolo=Gut feelings about the endocannabinoid system|rivista=Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society|volume=23|numero=5|pp=391–398|accesso=2022-01-19|doi=10.1111/j.1365-2982.2011.01689.x|url=https://pubmed.ncbi.nlm.nih.gov/21481098/}}</ref> |
|||
|- |
|||
|Metabolici/diabete |
|||
| + |
|||
|− |
|||
|<ref>{{Cita pubblicazione|nome=Vincenzo|cognome=Di Marzo|nome2=Fabiana|cognome2=Piscitelli|nome3=Raphael|cognome3=Mechoulam|data=2011|titolo=Cannabinoids and endocannabinoids in metabolic disorders with focus on diabetes|rivista=Handbook of Experimental Pharmacology|numero=203|pp=75–104|accesso=2022-01-19|doi=10.1007/978-3-642-17214-4_4|url=https://pubmed.ncbi.nlm.nih.gov/21484568/}}</ref> |
|||
|- |
|||
| colspan="4" |'''''Anticarcinogenesi''''' |
|||
|- |
|||
|Glioma (apoptosi) |
|||
| + |
|||
| + |
|||
|<ref>{{Cita pubblicazione|nome=Sofía|cognome=Torres|nome2=Mar|cognome2=Lorente|nome3=Fátima|cognome3=Rodríguez-Fornés|data=2011-01|titolo=A combined preclinical therapy of cannabinoids and temozolomide against glioma|rivista=Molecular Cancer Therapeutics|volume=10|numero=1|pp=90–103|accesso=2022-01-19|doi=10.1158/1535-7163.MCT-10-0688|url=https://pubmed.ncbi.nlm.nih.gov/21220494/}}</ref> |
|||
|- |
|||
|Cancro ai polmoni |
|||
| + |
|||
| ++ |
|||
|<ref>{{Cita pubblicazione|nome=Andriani|cognome=Athanasiou|nome2=Anna B.|cognome2=Clarke|nome3=Amy E.|cognome3=Turner|data=2007-12-07|titolo=Cannabinoid receptor agonists are mitochondrial inhibitors: a unified hypothesis of how cannabinoids modulate mitochondrial function and induce cell death|rivista=Biochemical and Biophysical Research Communications|volume=364|numero=1|pp=131–137|accesso=2022-01-19|doi=10.1016/j.bbrc.2007.09.107|url=https://pubmed.ncbi.nlm.nih.gov/17931597/}}</ref> |
|||
|- |
|||
| colspan="4" |'''''Oftalmologico''''' |
|||
|- |
|||
|Pressione intraoculare (ridotta) |
|||
| ++ |
|||
| + |
|||
|<ref>{{Cita pubblicazione|nome=K.|cognome=Green|data=1998-11|titolo=Marijuana smoking vs cannabinoids for glaucoma therapy|rivista=Archives of Ophthalmology (Chicago, Ill.: 1960)|volume=116|numero=11|pp=1433–1437|accesso=2022-01-19|doi=10.1001/archopht.116.11.1433|url=https://pubmed.ncbi.nlm.nih.gov/9823341/}}</ref> |
|||
|} |
|||
==== CBD |
==== CBD verso THC ==== |
||
Il CBD non produce gli stessi effetti psicotropi del THC, anzi se somministrato contemporaneamente ne può attenuare alcuni. |
|||
Il CBD potenzia l'efficacia analgesica del [[Delta-9-Tetraidrocannabinolo|THC]] prolungandone la durata di azione (attivando la ''pathway'' serotoninergica a livello del [[rafe dorsale]]) e al tempo stesso ne riduce gli effetti collaterali su frequenza cardiaca, respirazione e temperatura corporea.<ref>{{cita pubblicazione|autore=Karniol IG, Shirakawa I, Kasinski N, Pfeferman A, Carlini EA.|anno=1975|titolo=Cannabidiol interferes with the effects of delta-9-tetrahydrocannbinol in man|rivista=European Journal of Pharmacology|volume=28|lingua=en|doi=10.1016/0014-2999(74)90129-0|pp=172-177}}</ref> |
|||
L'interazione tra CBD e THC è oggetto di studio e molte ricerche non conclusive sono state pubblicate. |
|||
In particolare il CBD interagisce come antagonista verso i recettori GPR55, verso i recettori vanilloidi TRPV1 e TRPV2 e come agonista verso i recettori per la serotonina 5-HT1a<ref name="Russo2005">{{cita pubblicazione|autore=Russo E., Burnett A.|anno=2005|titolo=Agonistic properties of cannabidiol at 5-HT1a receptors|rivista=Neurochemical Research|volume=30|lingua=en|url=https://link.springer.com/article/10.1007/s11064-005-6978-1|pp=1037-1043}}</ref><ref>{{cita pubblicazione|autore=Ning Qin, Michael P. Neeper, Yi Liu, Tasha L. Hutchinson|anno=2008|titolo=TRPV2 is activated by Cannabidiol and mediates CGRP release in cultured rat dorsal root ganglion neurons|rivista=The Journal of Neuroscience|volume=28|lingua=en|url=http://www.jneurosci.org/content/28/24/6231.long|pp=6231-6238}}</ref>. |
|||
Il CBD potenzierebbe l'efficacia analgesica del [[Delta-9-Tetraidrocannabinolo|THC]] prolungandone la durata di azione (attivando la ''pathway'' serotoninergica a livello del [[rafe dorsale]]) e al tempo stesso ne riduce gli effetti collaterali su frequenza cardiaca, respirazione e temperatura corporea.<ref>{{cita pubblicazione|autore=Karniol IG, Shirakawa I, Kasinski N, Pfeferman A, Carlini EA.|anno=1975|titolo=Cannabidiol interferes with the effects of delta-9-tetrahydrocannbinol in man|rivista=European Journal of Pharmacology|volume=28|pp=172-177|lingua=en|doi=10.1016/0014-2999(74)90129-0}}</ref> |
|||
Il cannabidiolo ha una bassa affinità con i [[Recettori dei rrt|recettori dei cannabinoidi CB<sub>1</sub> e CB<sub>2</sub>]] ma agisce come antagonista indiretto di questi recettori.<ref>{{Cita pubblicazione |nome=Raphael |cognome=Mechoulam |data=agosto 2007 |titolo=Cannabidiol--recent advances |rivista=Chemistry & Biodiversity |volume=4 |numero=8 |pp=1678–1692 |accesso=10 maggio 2018|doi=10.1002/cbdv.200790147|url=https://www.ncbi.nlm.nih.gov/pubmed/17712814 |nome2=Maximilian|cognome2=Peters|nome3=Eric|cognome3=Murillo-Rodriguez|lingua=en}}</ref><ref>{{Cita pubblicazione|nome=R G|cognome=Pertwee|data=2008-01|titolo=The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: Δ9-tetrahydrocannabinol, cannabidiol and Δ9-tetrahydrocannabivarin|rivista=British Journal of Pharmacology|volume=153|numero=2|pp=199–215|accesso=10 maggio 2018|doi=10.1038/sj.bjp.0707442|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2219532/}}</ref> Può potenziare gli effetti del THC aumentando la densità del recettore CB<sub>1</sub> o attraverso un altro meccanismo relazionato al recettore CB<sub>1</sub><sup>.</sup><ref>{{Cita pubblicazione |nome=Kazuhide |cognome=Hayakawa |data=10 gennaio 2008 |titolo=Cannabidiol potentiates pharmacological effects of Delta(9)-tetrahydrocannabinol via CB(1) receptor-dependent mechanism |rivista=Brain Research |volume=1188 |pp=157–164 |accesso=10 maggio 2018 |doi=10.1016/j.brainres.2007.09.090 |url=https://www.ncbi.nlm.nih.gov/pubmed/18021759 |nome2=Kenichi |cognome2=Mishima |nome3=Mai |cognome3=Hazekawa}}</ref><ref>{{Cita web|url=https://web.archive.org/web/20180325050400/https://negoziocbd.it/pages/cose-il-cbd|titolo=Cos'è il CBD|sito=NegozioCBD.it|lingua=it|accesso=10 maggio 2018}}</ref> Il cannabidiolo può inoltre estendere la durata degli effetti del THC inibendo il citocromo P450, e degli enzimi CYP3A e CYP2C.<ref>{{Cita news|lingua=en|url=http://www.alchimiaweb.com/blogen/cannabinoids-and-their-medicinal-properties/ |titolo=Cannabinoids and their medicinal properties - Alchimia blog |pubblicazione=Alchimia blog |data=25 agosto 2014|accesso=10 maggio 2018}}</ref> |
|||
In particolare il CBD interagisce come antagonista verso i recettori GPR55, verso i recettori vanilloidi TRPV1 e TRPV2 e come agonista verso i recettori per la serotonina 5-HT1a<ref name="Russo20052">{{cita pubblicazione|autore=Russo E., Burnett A.|anno=2005|titolo=Agonistic properties of cannabidiol at 5-HT1a receptors|rivista=Neurochemical Research|volume=30|pp=1037-1043|lingua=en|url=https://link.springer.com/article/10.1007/s11064-005-6978-1}}</ref><ref>{{cita pubblicazione|autore=Ning Qin, Michael P. Neeper, Yi Liu, Tasha L. Hutchinson|anno=2008|titolo=TRPV2 is activated by Cannabidiol and mediates CGRP release in cultured rat dorsal root ganglion neurons|rivista=The Journal of Neuroscience|volume=28|pp=6231-6238|lingua=en|url=http://www.jneurosci.org/content/28/24/6231.long}}</ref>. |
|||
Il cannabidiolo ha una bassa affinità con i [[Recettori dei rrt|recettori dei cannabinoidi CB<sub>1</sub> e CB<sub>2</sub>]] ma agisce come antagonista indiretto di questi recettori.<ref>{{Cita pubblicazione|nome=Raphael|cognome=Mechoulam|nome2=Maximilian|cognome2=Peters|nome3=Eric|cognome3=Murillo-Rodriguez|data=agosto 2007|titolo=Cannabidiol--recent advances|rivista=Chemistry & Biodiversity|volume=4|numero=8|pp=1678–1692|lingua=en|accesso=10 maggio 2018|doi=10.1002/cbdv.200790147|url=https://www.ncbi.nlm.nih.gov/pubmed/17712814}}</ref><ref>{{Cita pubblicazione|nome=R G|cognome=Pertwee|data=2008-01|titolo=The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: Δ9-tetrahydrocannabinol, cannabidiol and Δ9-tetrahydrocannabivarin|rivista=British Journal of Pharmacology|volume=153|numero=2|pp=199–215|accesso=10 maggio 2018|doi=10.1038/sj.bjp.0707442|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2219532/}}</ref><ref>{{Cita pubblicazione|nome=A|cognome=Thomas|nome2=G L|cognome2=Baillie|nome3=A M|cognome3=Phillips|data=2007-03|titolo=Cannabidiol displays unexpectedly high potency as an antagonist of CB1 and CB2 receptor agonists in vitro|rivista=British Journal of Pharmacology|volume=150|numero=5|pp=613–623|accesso=2022-01-19|doi=10.1038/sj.bjp.0707133|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2189767/}}</ref> Può potenziare alcuni degli effetti del THC aumentando la densità del recettore CB<sub>1</sub> o attraverso un altro meccanismo relazionato al recettore CB<sub>1</sub><sup>.</sup><ref>{{Cita pubblicazione|nome=Kazuhide|cognome=Hayakawa|nome2=Kenichi|cognome2=Mishima|nome3=Mai|cognome3=Hazekawa|data=10 gennaio 2008|titolo=Cannabidiol potentiates pharmacological effects of Delta(9)-tetrahydrocannabinol via CB(1) receptor-dependent mechanism|rivista=Brain Research|volume=1188|pp=157–164|accesso=10 maggio 2018|doi=10.1016/j.brainres.2007.09.090|url=https://www.ncbi.nlm.nih.gov/pubmed/18021759}}</ref><ref>{{Cita web|url=https://web.archive.org/web/20180325050400/https://negoziocbd.it/pages/cose-il-cbd|titolo=Cos'è il CBD|sito=NegozioCBD.it|lingua=it|accesso=10 maggio 2018}}</ref> Il cannabidiolo può inoltre estendere la durata degli effetti del THC inibendo il citocromo P450, e degli enzimi CYP3A e CYP2C.<ref>{{Cita news|lingua=en|url=http://www.alchimiaweb.com/blogen/cannabinoids-and-their-medicinal-properties/|titolo=Cannabinoids and their medicinal properties - Alchimia blog|pubblicazione=Alchimia blog|data=25 agosto 2014|accesso=10 maggio 2018}}</ref> |
|||
==== Effetti serotoninergici ==== |
==== Effetti serotoninergici ==== |
||
Il cannabidiolo può fungere inoltre da antagonista del GPR55, una [[Recettori accoppiati a proteine G|proteina accoppiata al recettore G]], un recettore dei cannabinoidi putativo ed è espressa nel [[Striato|nucleo caudato]] e nel [[Telencefalo|putamen del cervello]]. È stato anche osservato agire come un recettore parziale 5-HT1a,<ref name= |
Il cannabidiolo può fungere inoltre da antagonista del GPR55, una [[Recettori accoppiati a proteine G|proteina accoppiata al recettore G]], un recettore dei cannabinoidi putativo ed è espressa nel [[Striato|nucleo caudato]] e nel [[Telencefalo|putamen del cervello]]. È stato anche osservato agire come un recettore parziale 5-HT1a,<ref name="Russo20052" /> questa sua interazione può essere associata con gli effetti antidepressivi,<ref>{{Cita pubblicazione|nome=TV|cognome=Zanelati|nome2=C|cognome2=Biojone|nome3=FA|cognome3=Moreira|data=2010-1|titolo=Antidepressant-like effects of cannabidiol in mice: possible involvement of 5-HT1A receptors|rivista=British Journal of Pharmacology|volume=159|numero=1|pp=122–128|accesso=10 maggio 2018|doi=10.1111/j.1476-5381.2009.00521.x|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2823358/}}</ref><ref name="ncbi.nlm.nih.gov2">{{Cita pubblicazione|nome=Leonardo BM|cognome=Resstel|nome2=Rodrigo F|cognome2=Tavares|nome3=Sabrina FS|cognome3=Lisboa|data=2009-1|titolo=5-HT1A receptors are involved in the cannabidiol-induced attenuation of behavioural and cardiovascular responses to acute restraint stress in rats|rivista=British Journal of Pharmacology|volume=156|numero=1|pp=181–188|accesso=10 maggio 2018|doi=10.1111/j.1476-5381.2008.00046.x|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2697769/}}</ref> ansiolitici,<ref name="ncbi.nlm.nih.gov2" /><ref>{{Cita pubblicazione|nome=Alline Cristina|cognome=Campos|nome2=Francisco Silveira|cognome2=Guimarães|data=agosto 2008|titolo=Involvement of 5HT1A receptors in the anxiolytic-like effects of cannabidiol injected into the dorsolateral periaqueductal gray of rats|rivista=Psychopharmacology|volume=199|numero=2|pp=223–230|accesso=10 maggio 2018|doi=10.1007/s00213-008-1168-x|url=https://www.ncbi.nlm.nih.gov/pubmed/18446323}}</ref> e neuroprotettivi<ref>{{Cita pubblicazione|nome=Kenichi|cognome=Mishima|nome2=Kazuhide|cognome2=Hayakawa|nome3=Kohji|cognome3=Abe|data=maggio 2005|titolo=Cannabidiol prevents cerebral infarction via a serotonergic 5-hydroxytryptamine1A receptor-dependent mechanism|rivista=Stroke|volume=36|numero=5|pp=1077–1082|accesso=10 maggio 2018|doi=10.1161/01.STR.0000163083.59201.34|url=https://www.ncbi.nlm.nih.gov/pubmed/15845890}}</ref><ref>{{Cita pubblicazione|nome=Kazuhide|cognome=Hayakawa|nome2=Kenichi|cognome2=Mishima|nome3=Masanori|cognome3=Nozako|data=marzo 2007|titolo=Repeated treatment with cannabidiol but not Delta9-tetrahydrocannabinol has a neuroprotective effect without the development of tolerance|rivista=Neuropharmacology|volume=52|numero=4|pp=1079–1087|accesso=10 maggio 2018|doi=10.1016/j.neuropharm.2006.11.005|url=https://www.ncbi.nlm.nih.gov/pubmed/17320118}}</ref> del cannabidiolo. È inoltre un modulatore allosterico dei [[recettori μ-oppioidi]] e [[Recettori Δ-oppioidi|δ-oppioidi]].<ref name="Kathmann20062">{{Cita pubblicazione|nome=Markus|cognome=Kathmann|nome2=Karsten|cognome2=Flau|nome3=Agnes|cognome3=Redmer|data=febbraio 2006|titolo=Cannabidiol is an allosteric modulator at mu- and delta-opioid receptors|rivista=Naunyn-Schmiedeberg's Archives of Pharmacology|volume=372|numero=5|pp=354–361|lingua=en|accesso=10 maggio 2018|doi=10.1007/s00210-006-0033-x|url=https://www.ncbi.nlm.nih.gov/pubmed/16489449}}</ref> Gli effetti farmacologici del cannabidiolo sono stati inoltre attribuiti all’agonismo [[PPAR-γ]] ed al [[Trasduzione del segnale|rilascio di calcio intracellulare]].<ref name=":03">{{Cita pubblicazione|nome=Alline Cristina|cognome=Campos|nome2=Fabricio Araújo|cognome2=Moreira|nome3=Felipe Villela|cognome3=Gomes|data=5 dicembre 2012|titolo=Multiple mechanisms involved in the large-spectrum therapeutic potential of cannabidiol in psychiatric disorders|rivista=Philosophical Transactions of the Royal Society B: Biological Sciences|volume=367|numero=1607|pp=3364–3378|accesso=10 maggio 2018|doi=10.1098/rstb.2011.0389|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3481531/}}</ref> |
||
==== Altri effetti ==== |
==== Altri effetti ==== |
||
La ricerca suggerisce che il CBD può esercitare alcune delle sue azioni farmacologiche attraverso l'inibizione della ''[[FAAH|Fatty Acid Amide Hydrolase]]'' (FAAH), l'[[enzima]] responsabile dell'[[idrolisi]] dell'[[anandamide]], uno dei principali [[endocannabinoidi]] prodotti dal corpo.<ref name=": |
La ricerca suggerisce che il CBD può esercitare alcune delle sue azioni farmacologiche attraverso l'inibizione della ''[[FAAH|Fatty Acid Amide Hydrolase]]'' (FAAH), l'[[enzima]] responsabile dell'[[idrolisi]] dell'[[anandamide]], uno dei principali [[endocannabinoidi]] prodotti dal corpo.<ref name=":03" /> È stato anche ipotizzato che alcuni dei metaboliti del CBD possano avere effetti che contribuiscano all'attività biologica del CBD stesso.<ref>{{Cita pubblicazione|nome=István|cognome=Ujváry|nome2=Lumír|cognome2=Hanuš|data=1º marzo 2016|titolo=Human Metabolites of Cannabidiol: A Review on Their Formation, Biological Activity, and Relevance in Therapy|rivista=Cannabis and Cannabinoid Research|volume=1|numero=1|pp=90–101|accesso=10 maggio 2018|doi=10.1089/can.2015.0012|url=https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5576600/}}</ref> |
||
Recentemente, il cannabidiolo è stato identificato come un nuovo agonista inverso del [[GPR12]].<ref>{{Cita pubblicazione|nome=Kevin J.|cognome=Brown|nome2=Alyssa S.|cognome2=Laun|nome3=Zhao-Hui|cognome3=Song|data=11 04, 2017|titolo=Cannabidiol, a novel inverse agonist for GPR12|rivista=Biochemical and Biophysical Research Communications|volume=493|numero=1|pp=451–454|accesso=10 maggio 2018|doi=10.1016/j.bbrc.2017.09.001|url=https://www.ncbi.nlm.nih.gov/pubmed/28888984}}</ref> |
|||
Secondo una ricerca di laboratorio effettuata nel [[2007]] da un'équipe del California Pacific Medical Center Research Institute,<ref name=":12" /><ref name=":13" /> il cannabidiolo potrebbe essere in grado di bloccare il gene Id-1 che provoca la diffusione delle metastasi del cancro al seno, ma anche di altre forme tumorali. Un successivo studio condotto dall'[[Università di Rostock]], in [[Germania]], confermerebbe proprietà simili dei [[cannabinoidi]].<ref name=":14" /> |
|||
== Isomeri == |
|||
Sono stati identificati 7 [[Isomeria|isomeri]] e 60 stereoisomeri con i sostituti in posizione 1 e 5 del CBD <ref name=":9" /><ref name=":10" /> e lo stesso CBD è considerato in vari studi un isomero del THC.<ref name=":11" /><ref name=":2" /> Con "cannabidiolo" tipicamente ci si riferisce all'enantiomero naturale (-)-CBD mentre sull'enantiomero (+)CBD di sintesi sono stati prodotti meno studi. |
|||
È stato dimostrato che il (+)CBD ha una modesta affinità con i recettori CB1 e CB2, mentre il (-)CBD ed il (+)-CBD inibirebbero l'idrolisi dell'anandamide ed erano agonisti del recettore vanilloide 1 (VR1) responsabile dell'azione della [[Capsaicina|capsicina]]. <ref>{{Cita pubblicazione|nome=Tiziana|cognome=Bisogno|nome2=Lumír|cognome2=Hanuš|nome3=Luciano|cognome3=De Petrocellis|data=2001-10|titolo=Molecular targets for cannabidiol and its synthetic analogues: effect on vanilloid VR1 receptors and on the cellular uptake and enzymatic hydrolysis of anandamide|rivista=British Journal of Pharmacology|volume=134|numero=4|pp=845–852|accesso=2022-01-19|doi=10.1038/sj.bjp.0704327|url=http://dx.doi.org/10.1038/sj.bjp.0704327}}</ref>L'isomero (+)-CBD era maggiore attivo rispetto all'isomero (-)-CBD come agente anticonvulsivante in un attacco di topo modello.<ref>{{Cita pubblicazione|nome=Roberto|cognome=Leite|nome2=E.A.|cognome2=Carlini|nome3=N.|cognome3=Lander|data=1982|titolo=Anticonvulsant Effects of the (–) and (+)Isomers of Cannabidiol and Their Dimethylheptyl Homologs|rivista=Pharmacology|volume=24|numero=3|pp=141–146|accesso=2022-01-19|doi=10.1159/000137588|url=http://dx.doi.org/10.1159/000137588}}</ref> Tuttavia, ad oggi, non ci sono prove sostanziali per stabilire se è probabile che (+)-CBD causi effetti psicoattivi simili al THC |
|||
== Assetto legale == |
|||
{{Disclaimer|legge}} |
|||
La [[Convenzione unica sugli stupefacenti]] del 1961 ha inserito le sommità fiorite o fruttifere della pianta di cannabis e la resina , estratti e tinture ottenuti dalla cannabis tra gli [[Stupefacente|stupefacenti]] sottoposti alle massime restrizioni e controlli. In applicazione del trattato internazionale i 186 paesi sottoscrittori hanno legiferato imponendo restrizioni alla produzione, commercio ed utilizzo di tutte le sostanze classificate come stupefacenti. Anche il cannabidiolo estratto dalla cannabis , pur non essendo espressamente citato nelle liste delle sostanze controllate, è stato oggetto delle restrizioni legali che tra l'altro hanno prodotto ostacoli e ritardi anche alla ricerca scientifica. |
|||
La progressiva e parziale liberalizzazione nella produzione e commercializzazione della cannabis a basso tenore di THC ( < 0,2- 1% a seconda della legislazione ) , cannabis che tra l'altro ha normalmente un alto tenore di CBD, dopo oltre 50 anni dal trattato<ref>{{Cita libro|cognome=European Monitoring Centre for Drugs and Drug Addiction.|titolo=Low-THC cannabis products in Europe.|url=https://data.europa.eu/doi/10.2810/593551|accesso=2022-01-19|data=2020|editore=Publications Office|DOI=10.2810/593551}}</ref><ref>{{Cita web|url=https://www.emcdda.europa.eu/publications/technical-reports/monitoring-and-evaluating-changes-in-cannabis-policies-insights-from-the-americas_en|titolo=Monitoring and evaluating changes in cannabis policies: insights from the Americas {{!}} www.emcdda.europa.eu|sito=www.emcdda.europa.eu|lingua=en|accesso=2022-01-19}}</ref>, ha aperto le porte alla ricerca sul cannabidiolo ed al suo potenziale utilizzo farmacologico. Quando nel 2017 l'[[Organizzazione mondiale della sanità|OMS]] dichiarò che il CBD estratto dalla cannabis non era più tra le [[Sostanza psicoattiva#Sostanze controllate|sostanze controllate]]<ref name=":8" /> la sua produzione e fornitura non è stata più soggetta a severi controlli internazionali. Non essendoci più vincoli internazionali, lo ''status'' legale del cannabidiolo è diventato a totale discrezione di ogni paese, dove in molti casi non è stata promulgata nessuna norma specifica per regolamentarlo. Così a fronte di alcuni paesi dove produzione e commercio di cannabidiolo era ancora sottoposta alle leggi per il controllo delle droghe altri lo avevano liberalizzato.<ref>{{Cita web|url=https://www.emcdda.europa.eu/publications/topic-overviews/cannabis-policy/html|titolo=Cannabis policy: status and recent developments {{!}} www.emcdda.europa.eu|sito=www.emcdda.europa.eu|accesso=2022-01-19}}</ref> |
|||
Il CBD può essere utilizzato nelle formulazioni cosmetiche, dove sono stati attribuiti distinti nomi [[INCI]]: <small>CANNABIDIOL - DERIVED FROM EXTRACT OR TINCTURE OR RESIN OF CANNABIS</small> oppure <small>CANNABIDIOL - SYNTHETICALLY PRODUCED.</small> La sicurezza del prodotto cosmetico con CBD è regolata dalle leggi e regolamenti nazionali o sovranazionali sul cosmetico.<ref>{{Cita web|url=https://eur-lex.europa.eu/legal-content/IT/TXT/?uri=celex:32009R1223|titolo=EUR-Lex - 32009R1223 - EN - EUR-Lex|sito=eur-lex.europa.eu|lingua=en|accesso=2022-01-19}}</ref> |
|||
=== Unione Europea === |
|||
Nel 2020 la Corte di giustizia europea su un conflitto tra norme Ceche e Francesi ha sentenziato che:"Uno Stato membro non può vietare legalmente la commercializzazione del cannabidiolo (CBD) prodotto in un altro Stato membro quando viene estratto dalla Cannabis sativa nella sua interezza".<ref>{{Cita web|url=https://www.emcdda.europa.eu/news/2020/cannabidiol-cbd-is-not-considered-a-narcotic-drug-under-european-law_en|titolo=Cannabidiol (CBD) is not considered a ‘narcotic drug’ under European law {{!}} www.emcdda.europa.eu|sito=www.emcdda.europa.eu|accesso=2022-01-19}}</ref><ref>{{Cita web|url=https://curia.europa.eu/juris/document/document.jsf?text=&docid=233925&pageIndex=0&doclang=EN&mode=lst&dir=&occ=first&part=1&cid=17507020|titolo=CURIA - Documenti|sito=curia.europa.eu|accesso=2022-01-19}}</ref> Le norme che regolano produzione ed utilizzo del CBD nei paesi della UE non sono armonizzate. Infatti, lo ''status'' legale o amministrativo del CBD è responsabilità di ciascuno Stato membro dell'UE. Mentre i medicinali con CBD devono sottostare alla autorizzazione europea dell'EMA tutti gli estratti di Cannabis sativa L. e qualsiasi prodotto a cui sia aggiunto come ingrediente il CBD, ottenuto sinteticamente o meno, dovrebbero essere considerati "nuovi alimenti" (''novel food'') e a sottostare ai controlli e registrazioni dell'EFSA ai sensi del regolamento sui nuovi prodotti alimentari.<ref>{{Cita web|url=https://www.efsa.europa.eu/it/topics/topic/novel-food|titolo=Nuovi prodotti alimentari {{!}} EFSA|sito=www.efsa.europa.eu|lingua=it|accesso=2022-01-19}}</ref> A tutto il 2020 l'EFSA non ha prodotto una opinione scientifica sulla sicurezza del cannabidiolo come "nuovo alimento" e a dicembre del 2021 la Commissione Europea ha chiuso la procedura di richiesta di autorizzazione.<ref>{{Cita web|url=https://ec.europa.eu/food/safety/novel-food/decisions-terminating-procedure_en|titolo=Decisions terminating the procedure|sito=ec.europa.eu|lingua=en|accesso=2022-01-19}}</ref> |
|||
=== Stati Uniti d'America === |
|||
Recentemente, il cannabidiolo è stato identificato come un nuovo agonista inverso del [[GPR12]].<ref>{{Cita pubblicazione|nome=Kevin J.|cognome=Brown|data=11 04, 2017|titolo=Cannabidiol, a novel inverse agonist for GPR12|rivista=Biochemical and Biophysical Research Communications|volume=493|numero=1|pp=451–454|accesso=10 maggio 2018|doi=10.1016/j.bbrc.2017.09.001|url=https://www.ncbi.nlm.nih.gov/pubmed/28888984|nome2=Alyssa S.|cognome2=Laun|nome3=Zhao-Hui|cognome3=Song}}</ref> |
|||
A tutto il 2021 , il cannabidiolo estratto dalla cannabis rimane una sostanza controllata dalle leggi per il controllo delle droghe e non è approvato come farmaco da prescrizione o integratore alimentare né consentito per il commercio interstatale negli Stati Uniti.<ref>{{Cita web|url=https://www.health.harvard.edu/blog/cannabidiol-cbd-what-we-know-and-what-we-dont-2018082414476|titolo=Cannabidiol (CBD)-what we know and what we don't|autore=Peter Grinspoon MD|sito=Harvard Health|data=2018-08-24|lingua=en|accesso=2022-01-19}}</ref> Il CBD derivato dalla canapa (con 0,3% di THC o inferiore) è legale per la vendita come ingrediente cosmetico o per altri scopi non regolamentati dalla FDA, ma non può essere venduto ai sensi della legge federale come ingrediente di alimenti, integratori alimentari o Cibo per animali.<ref>{{Cita pubblicazione|nome=Office of the|cognome=Commissioner|data=2021-10-18|titolo=FDA Regulation of Cannabis and Cannabis-Derived Products, Including Cannabidiol (CBD)|rivista=FDA|lingua=en|accesso=2022-01-19|url=https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd}}</ref> È un malinteso comune che la disponibilità legale di vendere cannabis (che può contenere CBD)<ref>{{Cita web|url=https://www.brookings.edu/blog/fixgov/2018/12/14/the-farm-bill-hemp-and-cbd-explainer/|titolo=The Farm Bill, hemp legalization and the status of CBD: An explainer|autore=John Hudak|sito=Brookings|data=2018-12-14|lingua=en-US|accesso=2022-01-19}}</ref> ed estratti e derivati di canapa (compreso il CBD), renda il CBD legale per la vendita come integratore o medicinale. <ref>{{Cita pubblicazione|nome=Office of the|cognome=Commissioner|data=2021-10-18|titolo=FDA Regulation of Cannabis and Cannabis-Derived Products, Including Cannabidiol (CBD)|rivista=FDA|lingua=en|accesso=2022-01-19|url=https://www.fda.gov/news-events/public-health-focus/fda-regulation-cannabis-and-cannabis-derived-products-including-cannabidiol-cbd}}</ref> |
|||
Nel settembre 2018, in seguito alla sua approvazione da parte della FDA per rari tipi di epilessia infantile, il farmaco Epidiolex della GW Pharmaceuticals è stato classificato (dalla ''Drug Enforcement Administration'') come farmaco in tabella V per consentirne l'uso su prescrizione. A partire da ottobre 2020 la FDA ha incoraggiato i produttori a seguire le procedure per l'approvazione di farmaci che contengono CBD. <ref>{{Cita pubblicazione|nome=Office of the|cognome=Commissioner|data=2020-10-01|titolo=FDA and Cannabis: Research and Drug Approval Process|rivista=FDA|lingua=en|accesso=2022-01-19|url=https://www.fda.gov/news-events/public-health-focus/fda-and-cannabis-research-and-drug-approval-process}}</ref> |
|||
== Studi scientifici == |
|||
Secondo una ricerca di laboratorio effettuata nel [[2007]] da un'équipe del California Pacific Medical Center Research Institute,<ref>[http://www.repubblica.it/2007/11/sezioni/scienza_e_tecnologia/cannabis-tumore/cannabis-tumore/cannabis-tumore.html Studio Usa: il cannabidiolo blocca le metastasi] da [http://www.repubblica.it Repubblica.it]</ref><ref>{{Cita web|url=http://cancerres.aacrjournals.org/content/73/5/1559.long|titolo=Id-1 Is a Key Transcriptional Regulator of Glioblastoma Aggressiveness and a Novel Therapeutic Target|autore=Soroceanu L, Murase R, Limbad C, Singer E, Allison J, Adrados I, Kawamura R, Pakdel A, Fukuyo Y, Nguyen D, Khan S, Arauz R, Yount GL, Moore DH, Desprez PY, and McAllister SD|editore=Cancer Research|data=2013|accesso=13 marzo 2016}}</ref> il cannabidiolo potrebbe essere in grado di bloccare il gene Id-1 che provoca la diffusione delle metastasi del cancro al seno, ma anche di altre forme tumorali. Un successivo studio condotto dall'[[Università di Rostock]], in [[Germania]], confermerebbe proprietà simili dei [[cannabinoidi]].<ref>''[https://jnci.oxfordjournals.org/content/100/1/59 Inhibition of Cancer Cell Invasion by Cannabinoids via Increased Expression of Tissue Inhibitor of Matrix Metalloproteinases-1]'', dal ''Journal of the [[National Cancer Institute]]''</ref> |
|||
Alcuni stati hanno approvato leggi per consentire l'uso di prodotti a base di CBD con la raccomandazione di un medico (invece di una prescrizione) per il trattamento di determinate condizioni mediche. <ref>{{Cita web|url=https://www.ncsl.org/research/health/state-medical-marijuana-laws.aspx|titolo=State Medical Cannabis Laws|sito=www.ncsl.org|accesso=2022-01-19}}</ref> Questo si aggiunge ai 30 stati USA che hanno approvato leggi complete sulla cannabis medica, che consentono l'uso di prodotti a base di cannabis senza restrizioni sul contenuto di THC. Di questi 30 stati, otto hanno legalizzato l'uso e la vendita di prodotti a base di cannabis senza la necessità della raccomandazione di un medico. |
|||
== Status legale in tutti i paesi == |
|||
=== Unione europea === |
|||
Nel 2019, la [[Commissione europea]] ha annunciato che il CBD e altri cannabinoidi sarebbero stati classificati come "nuovi alimenti",<ref name="chu">{{cita web|titolo=Updated EC ruling for CBD classes supplement ingredient as Novel Food | editore=NutraIngredients.com, William Reed Business Media Ltd.|autore=Chu W |data=31 gennaio 2019 | url=https://www.nutraingredients.com/Article/2019/01/31/Updated-EFSA-ruling-for-CBD-classes-supplement-ingredient-as-Novel-Food |accesso=1º gennaio 2019}}</ref> il che significa che i prodotti a base di CBD avrebbero richiesto l'autorizzazione ai sensi del regolamento sui nuovi alimenti dell'UE, affermando che poiché "questo prodotto non è stato utilizzato come alimento o ingrediente alimentare prima del 15 maggio 1997, prima che possa essere immesso sul mercato nell'UE come alimento o ingrediente alimentare, è richiesta una valutazione della sicurezza ai sensi del regolamento sui nuovi alimenti." |
|||
I governi statali e locali possono anche regolamentare il cannabidiolo. Ad esempio, nel giugno 2019 il Dipartimento delle risorse agricole del Massachusetts ha emesso una regola che allinea le normative statali sul CBD alle normative della FDA. Ciò significa che sebbene la marijuana ricreativa sia legale nello stato, il CBD non può essere venduto legalmente negli alimenti o come integratore alimentare ai sensi della legge statale. <ref>{{Cita web|url=https://www.bostonglobe.com/news/marijuana/2019/07/01/massachusetts-says-hemp-derived-cbd-illegal-but-cbd-stores-are-still-everywhere/ARUjZw4yRGJr8WeWmNprkO/story.html|titolo=Massachusetts says hemp-derived CBD is illegal — but CBD stores are still everywhere - The Boston Globe|autore=Felicia Gans Globe Staff, July 1, 2019, 9:12 a m Share on Facebook Share on TwitterView Comments|sito=BostonGlobe.com|lingua=en-US|accesso=2022-01-19}}</ref> |
|||
Il cannabidiolo è elencato nella banca dati degli ingredienti cosmetici dell'UE (CosIng).<ref name="cos">{{cita web|url =http://ec.europa.eu/growth/tools-databases/cosing/index.cfm?fuseaction=search.details_v2&id=93486 |titolo=CosIng – Cosmetics – Cannabidiol|editore=European Commission |accesso=4 dicembre 2016}}</ref> Tuttavia, l'elenco di un ingrediente, assegnato con un nome INCI, in CosIng non significa che debba essere utilizzato in prodotti cosmetici o che sia approvato per tale uso.<ref name=cos/> |
|||
== Note == |
== Note == |
||
Versione delle 19:03, 19 gen 2022
| Cannabidiolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 2-[(1R,6R)-6-Isopropenil-3-metilcicloes-2-en-1-ul]-5-pentilbenzene-1,3-diolo | |
| Abbreviazioni | |
| CBD | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C21H30O2 |
| Numero CAS | |
| Numero EINECS | 689-176-3 |
| PubChem | 644019 |
| DrugBank | DB09061 |
| SMILES | CCCCCC1=CC(=C(C(=C1)O)C2C=C(CCC2C(=C)C)C)O |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | insolubile |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 50 mg/kg nei topi intravena |
| Indicazioni di sicurezza | |
Il cannabidiolo ( CBD ) è un composto chimico scoperto nella Cannabis sativa essiccata e nell'hashish nel 1940.[1][2] È uno dei 142 fitocannabinoidi identificati nelle piante di Cannabis sativa.[3] Si trova anche nelle foglie della cannabacea filogeneticamente più vicina alla Cannabis sativa, il luppolo[4][5] e può essere prodotto anche per sintesi chimica. Come cannabinoide ricavato dalla Cannabis è oggetto di controversie sul suo utilizzo legale alla luce delle diverse interpretazioni e applicazioni dei trattati internazionali di controllo delle droghe. La progressiva e parziale liberalizzazione della Cannabis, agli inizi del XXI secolo ha consentito l'avvio di molte ricerche sui potenziali utilizzi farmacologici del CBD e, in alcuni paesi, la commercializzazione di prodotti caratterizzati dalla presenza del CBD. Il CBD non ha la stessa psicoattività del THC. A partire dal 2017, quando l'OMS dichiarò che il CBD non era tra le sostanze controllate[6], la ricerca clinica sul CBD includeva studi relativi ad ansia, cognizione, disturbi del movimento e dolore, cancro ecc..; ma non ci sono prove di alta qualità sufficienti per dire che il cannabidiolo sia efficace per queste condizioni.[7][8][9] È stata invece riconosciuta da alcune autorità sanitarie l'efficacia di una farmaco basato sul CBD per alcune forme rare e gravi di epilessia.[10][11]
Biosintesi
Il CBD è considerato un metabolita secondario della Cannabis sativa mentre in realtà è un artefatto che si forma per decarbossilazione non enzimatica del acido cannabidiolico (CBDa) durante l'essiccazione.
Il percorso anabolico che porta alla formazione del CBD nella cannabis sativa è in gran parte in comune con quello del tetraidrocannabinolo (THC), il principale agente psicotropo della cannabis.
| Enzima | Precursore, intermedio e reazione | |
|---|---|---|
| 3,5,7-triossododecanoil-CoA sintasi | malonil-CoA | |
| ↘ | ↓ | |
| 3 malonil-CoA + esanoil-CoA <=> 3 CoA + 3,5,7-triossodecanoil-CoA + 3 CO2 | ||
| ↓ | ||
| ciclasi dell'acido olivetolico | 3,5,7-triossodecanoil-CoA | |
| ↘ | ↓ | |
| 3,5,7-triossodecanoil-CoA <=> CoA + 2,4-diidrossi-6-pentilbenzoato | ||
| ↓ | ||
| geranil-difosfato:olivetolato geraniltransferasi | 2,4-diidrossi-6-pentilbenzoato (acido olivetolico) | |
| ↘ | ↓ | |
| Geranil difosfato + 2,4-diidrossi-6-pentilbenzoato <=> difosfato + cannabigerolato | ||
| ↓ | ||
| sintasi dell'acido cannabidiolico | Cannabigerolato | |
| ↘ | ↓ | |
| Cannabigerolato + O2 <=> Acido cannabidiolico + H2O2 | ||
| ↓ | ||
| Acido cannabidiolico | ||
| ↓ | ||
| Acido cannabidiolico <=> Cannabidiolo + CO2 | ||
| ↓ | ||
| Cannabidiolo |
Il cannabigerolato è anche il precursore, attraverso una diversa reazione enzimatica, dell'acido tetraidrocannabinolico (THCa) da cui deriva il THC.
La decarbossilazione di CBDa e THCa avviene spontaneamente accelerata per azione della luce e/o del calore. CBDa e THCa provenendo dallo stesso intermedio sono complementari, pertanto nelle varietà di cannabis a basso tenore di THC il cannabidiolo è il principale cannabinoide estraibile al contrario delle varietà ad alto tenore di THC dove il THC è il cannabinoide principale.
Reazioni
Di particolare interesse per definire l'assetto legale della sostanza è la possibile ciclizzazione del cannabidiolo.

Il CBD ciclizza a Δ8- e Δ9-THC in presenza di acidi di Lewis( ad es. Trifluoruro di boro dietiletere o donatori di protoni come l'acido p-toluensolfonico); con il Δ8-THC ciclizzato da acidi forti e il Δ9-THC ciclizzato da acidi deboli. [12]
Due studi in vitro avrebbero dimostrato che il CBD si converte in THC nei succhi gastrici.[13][14] Il rateo di conversione rilevato sarebbe pari al 2,9%.[14] La conversione in vivo non è stata dimostrata e l'assunzione orale di CBD non produrrebbe gli effetti del THC.[15][16][17][18]
La ciclizzazione del CBD in THC avverrebbe anche per pirolisi ad alte temperature[19] ma non quando viene bruciato.[20]
La conversione del CBD in THC o in altri cannabonoidi psicotropi è oggetto di controversia scientifica.[21]
Sono stati identificati 7 isomeri e 60 stereoisomeri del CBD [22][23] e lo stesso CBD è considerato in alcuni studi un isomero del THC.[24][12]
In un ambiente fortemente basico in condizioni ossidative, anche esposto all'aria, il CBD viene prima idrossilato sull'anello aromatico e poi ossidato a idrossichinone.[25] Se conservato a lungo in presenza di aria, si ossida a cannabinolo.
Farmacologia
A tutto il 2020 solo 2 farmaci contenenti cannabidiolo, entrambi della GW pharmnaceutical, sono stati messi in commercio nella UE: l'Epidiolex, contenente 100mg di cannabidiolo ogni mL di prodotto, come anti-convulsivo per trattare 2 forme rare di epilessia[11] e il Sativex[26] ,contenente 2,7 mg di delta-9-tetraidrocannabinolo (THC) e 2,5 mg di cannabidiolo (CBD) ogni 100 μL come antispatico per alleviare i sintomi in pazienti adulti affetti da spasticità da moderata a grave dovuta alla sclerosi multipla (SM) che non hanno manifestato una risposta adeguata ad altri medicinali. Di entrambi il meccanismo d'azione non è stato perfettamente compreso.[27] Di altri farmaci sono in corso sperimentazioni cliniche.
| Effetto | THC | CBD | Riferimenti |
|---|---|---|---|
| Effetti recettoriali/non recettoriali | |||
| CB1 | ++ | ± | [29][30][31] |
| CB2 | + | ± | [29][32] |
| Antinfiammatorio | + | + | [33] |
| Immunomodulante | + | + | [34] |
| Effetti sul SNC | |||
| Anticonvulsivante | + | ++ | [35] |
| Rilassante muscolare | ++ | + | [36] |
| Ansiolitico | ± | ++ | [37][38] |
| Psicotropo | ++ | − | [39][40] |
| Antipsicotico | − | ++ | [41][42] |
| Problemi di memoria a breve termine | + | − | [31][43] |
| Distorsione della percezione del tempo | ++ | − | [44][45] |
| Antiossidante neuroprotettivo | + | ++ | [33] |
| Antiemetico | ++ | ++ | [46] |
| Sedazione | + | − | [47][48] |
| Effetti cardiovascolari | |||
| Bradicardia | − | + | [49] |
| Tachicardia | + | − | [50] |
| Ipertensione | + | − | [51] |
| Ipotensione | − | + | [50] |
| Appetito/IG/metabolico | |||
| Appetito | + | − | [52] |
| Motilità gastrointestinale (rallentata) | ++ | + | [53] |
| Metabolici/diabete | + | − | [54] |
| Anticarcinogenesi | |||
| Glioma (apoptosi) | + | + | [55] |
| Cancro ai polmoni | + | ++ | [56] |
| Oftalmologico | |||
| Pressione intraoculare (ridotta) | ++ | + | [57] |
CBD verso THC
Il CBD non produce gli stessi effetti psicotropi del THC, anzi se somministrato contemporaneamente ne può attenuare alcuni.
L'interazione tra CBD e THC è oggetto di studio e molte ricerche non conclusive sono state pubblicate.
Il CBD potenzierebbe l'efficacia analgesica del THC prolungandone la durata di azione (attivando la pathway serotoninergica a livello del rafe dorsale) e al tempo stesso ne riduce gli effetti collaterali su frequenza cardiaca, respirazione e temperatura corporea.[58]
In particolare il CBD interagisce come antagonista verso i recettori GPR55, verso i recettori vanilloidi TRPV1 e TRPV2 e come agonista verso i recettori per la serotonina 5-HT1a[59][60].
Il cannabidiolo ha una bassa affinità con i recettori dei cannabinoidi CB1 e CB2 ma agisce come antagonista indiretto di questi recettori.[61][62][63] Può potenziare alcuni degli effetti del THC aumentando la densità del recettore CB1 o attraverso un altro meccanismo relazionato al recettore CB1.[64][65] Il cannabidiolo può inoltre estendere la durata degli effetti del THC inibendo il citocromo P450, e degli enzimi CYP3A e CYP2C.[66]
Effetti serotoninergici
Il cannabidiolo può fungere inoltre da antagonista del GPR55, una proteina accoppiata al recettore G, un recettore dei cannabinoidi putativo ed è espressa nel nucleo caudato e nel putamen del cervello. È stato anche osservato agire come un recettore parziale 5-HT1a,[59] questa sua interazione può essere associata con gli effetti antidepressivi,[67][68] ansiolitici,[68][69] e neuroprotettivi[70][71] del cannabidiolo. È inoltre un modulatore allosterico dei recettori μ-oppioidi e δ-oppioidi.[72] Gli effetti farmacologici del cannabidiolo sono stati inoltre attribuiti all’agonismo PPAR-γ ed al rilascio di calcio intracellulare.[73]
Altri effetti
La ricerca suggerisce che il CBD può esercitare alcune delle sue azioni farmacologiche attraverso l'inibizione della Fatty Acid Amide Hydrolase (FAAH), l'enzima responsabile dell'idrolisi dell'anandamide, uno dei principali endocannabinoidi prodotti dal corpo.[73] È stato anche ipotizzato che alcuni dei metaboliti del CBD possano avere effetti che contribuiscano all'attività biologica del CBD stesso.[74]
Recentemente, il cannabidiolo è stato identificato come un nuovo agonista inverso del GPR12.[75]
Secondo una ricerca di laboratorio effettuata nel 2007 da un'équipe del California Pacific Medical Center Research Institute,[76][77] il cannabidiolo potrebbe essere in grado di bloccare il gene Id-1 che provoca la diffusione delle metastasi del cancro al seno, ma anche di altre forme tumorali. Un successivo studio condotto dall'Università di Rostock, in Germania, confermerebbe proprietà simili dei cannabinoidi.[78]
Isomeri
Sono stati identificati 7 isomeri e 60 stereoisomeri con i sostituti in posizione 1 e 5 del CBD [22][23] e lo stesso CBD è considerato in vari studi un isomero del THC.[24][12] Con "cannabidiolo" tipicamente ci si riferisce all'enantiomero naturale (-)-CBD mentre sull'enantiomero (+)CBD di sintesi sono stati prodotti meno studi.
È stato dimostrato che il (+)CBD ha una modesta affinità con i recettori CB1 e CB2, mentre il (-)CBD ed il (+)-CBD inibirebbero l'idrolisi dell'anandamide ed erano agonisti del recettore vanilloide 1 (VR1) responsabile dell'azione della capsicina. [79]L'isomero (+)-CBD era maggiore attivo rispetto all'isomero (-)-CBD come agente anticonvulsivante in un attacco di topo modello.[80] Tuttavia, ad oggi, non ci sono prove sostanziali per stabilire se è probabile che (+)-CBD causi effetti psicoattivi simili al THC
Assetto legale
La Convenzione unica sugli stupefacenti del 1961 ha inserito le sommità fiorite o fruttifere della pianta di cannabis e la resina , estratti e tinture ottenuti dalla cannabis tra gli stupefacenti sottoposti alle massime restrizioni e controlli. In applicazione del trattato internazionale i 186 paesi sottoscrittori hanno legiferato imponendo restrizioni alla produzione, commercio ed utilizzo di tutte le sostanze classificate come stupefacenti. Anche il cannabidiolo estratto dalla cannabis , pur non essendo espressamente citato nelle liste delle sostanze controllate, è stato oggetto delle restrizioni legali che tra l'altro hanno prodotto ostacoli e ritardi anche alla ricerca scientifica.
La progressiva e parziale liberalizzazione nella produzione e commercializzazione della cannabis a basso tenore di THC ( < 0,2- 1% a seconda della legislazione ) , cannabis che tra l'altro ha normalmente un alto tenore di CBD, dopo oltre 50 anni dal trattato[81][82], ha aperto le porte alla ricerca sul cannabidiolo ed al suo potenziale utilizzo farmacologico. Quando nel 2017 l'OMS dichiarò che il CBD estratto dalla cannabis non era più tra le sostanze controllate[6] la sua produzione e fornitura non è stata più soggetta a severi controlli internazionali. Non essendoci più vincoli internazionali, lo status legale del cannabidiolo è diventato a totale discrezione di ogni paese, dove in molti casi non è stata promulgata nessuna norma specifica per regolamentarlo. Così a fronte di alcuni paesi dove produzione e commercio di cannabidiolo era ancora sottoposta alle leggi per il controllo delle droghe altri lo avevano liberalizzato.[83]
Il CBD può essere utilizzato nelle formulazioni cosmetiche, dove sono stati attribuiti distinti nomi INCI: CANNABIDIOL - DERIVED FROM EXTRACT OR TINCTURE OR RESIN OF CANNABIS oppure CANNABIDIOL - SYNTHETICALLY PRODUCED. La sicurezza del prodotto cosmetico con CBD è regolata dalle leggi e regolamenti nazionali o sovranazionali sul cosmetico.[84]
Unione Europea
Nel 2020 la Corte di giustizia europea su un conflitto tra norme Ceche e Francesi ha sentenziato che:"Uno Stato membro non può vietare legalmente la commercializzazione del cannabidiolo (CBD) prodotto in un altro Stato membro quando viene estratto dalla Cannabis sativa nella sua interezza".[85][86] Le norme che regolano produzione ed utilizzo del CBD nei paesi della UE non sono armonizzate. Infatti, lo status legale o amministrativo del CBD è responsabilità di ciascuno Stato membro dell'UE. Mentre i medicinali con CBD devono sottostare alla autorizzazione europea dell'EMA tutti gli estratti di Cannabis sativa L. e qualsiasi prodotto a cui sia aggiunto come ingrediente il CBD, ottenuto sinteticamente o meno, dovrebbero essere considerati "nuovi alimenti" (novel food) e a sottostare ai controlli e registrazioni dell'EFSA ai sensi del regolamento sui nuovi prodotti alimentari.[87] A tutto il 2020 l'EFSA non ha prodotto una opinione scientifica sulla sicurezza del cannabidiolo come "nuovo alimento" e a dicembre del 2021 la Commissione Europea ha chiuso la procedura di richiesta di autorizzazione.[88]
Stati Uniti d'America
A tutto il 2021 , il cannabidiolo estratto dalla cannabis rimane una sostanza controllata dalle leggi per il controllo delle droghe e non è approvato come farmaco da prescrizione o integratore alimentare né consentito per il commercio interstatale negli Stati Uniti.[89] Il CBD derivato dalla canapa (con 0,3% di THC o inferiore) è legale per la vendita come ingrediente cosmetico o per altri scopi non regolamentati dalla FDA, ma non può essere venduto ai sensi della legge federale come ingrediente di alimenti, integratori alimentari o Cibo per animali.[90] È un malinteso comune che la disponibilità legale di vendere cannabis (che può contenere CBD)[91] ed estratti e derivati di canapa (compreso il CBD), renda il CBD legale per la vendita come integratore o medicinale. [92]
Nel settembre 2018, in seguito alla sua approvazione da parte della FDA per rari tipi di epilessia infantile, il farmaco Epidiolex della GW Pharmaceuticals è stato classificato (dalla Drug Enforcement Administration) come farmaco in tabella V per consentirne l'uso su prescrizione. A partire da ottobre 2020 la FDA ha incoraggiato i produttori a seguire le procedure per l'approvazione di farmaci che contengono CBD. [93]
Alcuni stati hanno approvato leggi per consentire l'uso di prodotti a base di CBD con la raccomandazione di un medico (invece di una prescrizione) per il trattamento di determinate condizioni mediche. [94] Questo si aggiunge ai 30 stati USA che hanno approvato leggi complete sulla cannabis medica, che consentono l'uso di prodotti a base di cannabis senza restrizioni sul contenuto di THC. Di questi 30 stati, otto hanno legalizzato l'uso e la vendita di prodotti a base di cannabis senza la necessità della raccomandazione di un medico.
I governi statali e locali possono anche regolamentare il cannabidiolo. Ad esempio, nel giugno 2019 il Dipartimento delle risorse agricole del Massachusetts ha emesso una regola che allinea le normative statali sul CBD alle normative della FDA. Ciò significa che sebbene la marijuana ricreativa sia legale nello stato, il CBD non può essere venduto legalmente negli alimenti o come integratore alimentare ai sensi della legge statale. [95]
Note
- ^ Roger Adams, Madison Hunt e J. H. Clark, Structure of Cannabidiol, a Product Isolated from the Marihuana Extract of Minnesota Wild Hemp. I, in Journal of the American Chemical Society, vol. 62, n. 1, 1º gennaio 1940, pp. 196–200, DOI:10.1021/ja01858a058. URL consultato il 18 gennaio 2022.
- ^ A. Jacob e A. R. Todd, 119. Cannabis indica. Part II. Isolation of cannabidiol from Egyptian hashish. Observations on the structure of cannabinol, in Journal of the Chemical Society (Resumed), 1940, pp. 649, DOI:10.1039/jr9400000649. URL consultato il 18 gennaio 2022.
- ^ Mahmoud A. ElSohly e Waseem Gul, Constituents of Cannabis Sativa, Oxford University Press, 21 agosto 2014, pp. 3–22. URL consultato il 19 gennaio 2022.
- ^ G. S. Duraisamy, A. K. Mishra e T. Kocábek, Activation of polyketide synthase gene promoter in Cannabis sativa by heterologous transcription factors derived from Humulus lupulus, in Biologia plantarum, vol. 62, n. 2, 1º giugno 2018, pp. 250–260, DOI:10.1007/s10535-017-0766-z. URL consultato il 18 gennaio 2022.
- ^ Dr. Duke's Phytochemical and Ethnobotanical Databases at NAL, su phytochem.nal.usda.gov. URL consultato il 18 gennaio 2022.
- ^ a b (EN) Drugs (psychoactive): Cannabidiol (compound of cannabis), su www.who.int. URL consultato il 19 gennaio 2022.
- ^ Nicola Black, Emily Stockings e Gabrielle Campbell, Cannabinoids for the treatment of mental disorders and symptoms of mental disorders: A systematic review and meta-analysis, in The lancet. Psychiatry, vol. 6, n. 12, 2019-12, pp. 995–1010, DOI:10.1016/S2215-0366(19)30401-8. URL consultato il 19 gennaio 2022.
- ^ (English) Harrison J. VanDolah, Brent A. Bauer e Karen F. Mauck, Clinicians’ Guide to Cannabidiol and Hemp Oils, in Mayo Clinic Proceedings, vol. 94, n. 9, 1º settembre 2019, pp. 1840–1851, DOI:10.1016/j.mayocp.2019.01.003. URL consultato il 19 gennaio 2022. Lingua sconosciuta: English (aiuto)
- ^ (EN) CBD products are everywhere. But do they work?, su Harvard Health, 1º agosto 2019. URL consultato il 19 gennaio 2022.
- ^ (EN) Office of the Commissioner, FDA Approves First Drug Comprised of an Active Ingredient Derived from Marijuana to Treat Rare, Severe Forms of Epilepsy, su FDA, 27 marzo 2020. URL consultato il 19 gennaio 2022.
- ^ a b EMA: epidyolex, su ema.europa.eu.
- ^ a b c Roger Adams, D. C. Pease e C. K. Cain, Structure of Cannabidiol. VI. Isomerization of Cannabidiol to Tetrahydrocannabinol, a Physiologically Active Product. Conversion of Cannabidiol to Cannabinol1, in Journal of the American Chemical Society, vol. 62, n. 9, 1940-09, pp. 2402–2405, DOI:10.1021/ja01866a040. URL consultato il 19 gennaio 2022.
- ^ John Merrick, Brian Lane e Terri Sebree, Identification of Psychoactive Degradants of Cannabidiol in Simulated Gastric and Physiological Fluid, in Cannabis and Cannabinoid Research, vol. 1, n. 1, 2016-12, pp. 102–112, DOI:10.1089/can.2015.0004. URL consultato il 19 gennaio 2022.
- ^ a b Kazuhito Watanabe, Yuka Itokawa e Satoshi Yamaori, Conversion of cannabidiol to Δ9-tetrahydrocannabinol and related cannabinoids in artificial gastric juice, and their pharmacological effects in mice, in Forensic Toxicology, vol. 25, n. 1, 20 marzo 2007, pp. 16–21, DOI:10.1007/s11419-007-0021-y. URL consultato il 19 gennaio 2022.
- ^ Gerhard Nahler, Franjo Grotenhermen e Antonio Waldo Zuardi, A Conversion of Oral Cannabidiol to Delta9-Tetrahydrocannabinol Seems Not to Occur in Humans, in Cannabis and Cannabinoid Research, vol. 2, n. 1, 2017-01, pp. 81–86, DOI:10.1089/can.2017.0009. URL consultato il 19 gennaio 2022.
- ^ Paul Consroe, Joan Laguna e James Allender, Controlled clinical trial of cannabidiol in Huntington's disease, in Pharmacology Biochemistry and Behavior, vol. 40, n. 3, 1991-11, pp. 701–708, DOI:10.1016/0091-3057(91)90386-g. URL consultato il 19 gennaio 2022.
- ^ Franjo Grotenhermen, Ethan Russo e Antonio Waldo Zuardi, Even High Doses of Oral Cannabidiol Do Not Cause THC-Like Effects in Humans: Comment on Merrick et al. Cannabis and Cannabinoid Research 2016;1(1):102–112; DOI: 10.1089/can.2015.0004, in Cannabis and Cannabinoid Research, vol. 2, n. 1, 2017-12, pp. 1–4, DOI:10.1089/can.2016.0036. URL consultato il 19 gennaio 2022.
- ^ Marcel O. Bonn-Miller, Stan L. Banks e Terri Sebree, Conversion of Cannabidiol Following Oral Administration: Authors' Response to Grotenhermen et al. DOI: 10.1089/can.2016.0036, in Cannabis and Cannabinoid Research, vol. 2, n. 1, 2017-01, pp. 5–7, DOI:10.1089/can.2016.0038. URL consultato il 19 gennaio 2022.
- ^ Zsuzsanna Czégény, Gréta Nagy e Bence Babinszki, CBD, a precursor of THC in e-cigarettes, in Scientific Reports, vol. 11, 26 aprile 2021, pp. 8951, DOI:10.1038/s41598-021-88389-z. URL consultato il 19 gennaio 2022.
- ^ William Quarles, George Ellman e Reese Jones, Toxicology of Marijuana: Conditions for Conversion of Cannabidioi to THC upon Smoking, in Clinical Toxicology, vol. 6, n. 2, 1º gennaio 1973, pp. 211–216, DOI:10.3109/15563657308990520. URL consultato il 19 gennaio 2022.
- ^ Patricia Golombek, Marco Müller e Ines Barthlott, Conversion of Cannabidiol (CBD) into Psychotropic Cannabinoids Including Tetrahydrocannabinol (THC): A Controversy in the Scientific Literature, in Toxics, vol. 8, n. 2, 3 giugno 2020, pp. 41, DOI:10.3390/toxics8020041. URL consultato il 19 gennaio 2022.
- ^ a b (EN) Y. Gaoni e R. Mechoulam, Hashish—VII: The isomerization of cannabidiol to tetrahydrocannabinols, in Tetrahedron, vol. 22, n. 4, 1º gennaio 1966, pp. 1481–1488, DOI:10.1016/S0040-4020(01)99446-3. URL consultato il 19 gennaio 2022.
- ^ a b (EN) Cannabidiol, su American Chemical Society. URL consultato il 19 gennaio 2022.
- ^ a b WHO: THC isomers (PDF), su who.int.
- ^ (EN) R. Mechoulam, Z. Ben-Zvi e Y. Gaoni, Hashish—XIII: On the nature of the beam test, in Tetrahedron, vol. 24, n. 16, 1º gennaio 1968, pp. 5615–5624, DOI:10.1016/0040-4020(68)88159-1. URL consultato il 19 gennaio 2022.
- ^ EMA: Sativex, su ema.europa.eu.
- ^ Pietro Brunetti e al., Pharmacology and legal status of cannabidiol, in Ann Ist Super Sanità, vol. 56, n. 3, 2020, pp. 285-291.
- ^ Zerrin Atakan, Cannabis, a complex plant: different compounds and different effects on individuals, in Therapeutic Advances in Psychopharmacology, vol. 2, n. 6, 2012-12, pp. 241–254, DOI:10.1177/2045125312457586. URL consultato il 19 gennaio 2022.
- ^ a b M. H. Rhee, Z. Vogel e J. Barg, Cannabinol derivatives: binding to cannabinoid receptors and inhibition of adenylylcyclase, in Journal of Medicinal Chemistry, vol. 40, n. 20, 26 settembre 1997, pp. 3228–3233, DOI:10.1021/jm970126f. URL consultato il 19 gennaio 2022.
- ^ H. Iwamura, H. Suzuki e Y. Ueda, In vitro and in vivo pharmacological characterization of JTE-907, a novel selective ligand for cannabinoid CB2 receptor, in The Journal of Pharmacology and Experimental Therapeutics, vol. 296, n. 2, 2001-02, pp. 420–425. URL consultato il 19 gennaio 2022.
- ^ a b Kazuhide Hayakawa, Kenichi Mishima e Mai Hazekawa, Cannabidiol potentiates pharmacological effects of Delta(9)-tetrahydrocannabinol via CB(1) receptor-dependent mechanism, in Brain Research, vol. 1188, 10 gennaio 2008, pp. 157–164, DOI:10.1016/j.brainres.2007.09.090. URL consultato il 19 gennaio 2022.
- ^ V. M. Showalter, D. R. Compton e B. R. Martin, Evaluation of binding in a transfected cell line expressing a peripheral cannabinoid receptor (CB2): identification of cannabinoid receptor subtype selective ligands, in The Journal of Pharmacology and Experimental Therapeutics, vol. 278, n. 3, 1996-09, pp. 989–999. URL consultato il 19 gennaio 2022.
- ^ a b Ana Juknat, Neta Rimmerman e Rivka Levy, Cannabidiol affects the expression of genes involved in zinc homeostasis in BV-2 microglial cells, in Neurochemistry International, vol. 61, n. 6, 2012-11, pp. 923–930, DOI:10.1016/j.neuint.2011.12.002. URL consultato il 19 gennaio 2022.
- ^ Barbara Costa, Anna Elisa Trovato e Francesca Comelli, The non-psychoactive cannabis constituent cannabidiol is an orally effective therapeutic agent in rat chronic inflammatory and neuropathic pain, in European Journal of Pharmacology, vol. 556, n. 1-3, 5 febbraio 2007, pp. 75–83, DOI:10.1016/j.ejphar.2006.11.006. URL consultato il 19 gennaio 2022.
- ^ M. J. Wallace, J. L. Wiley e B. R. Martin, Assessment of the role of CB1 receptors in cannabinoid anticonvulsant effects, in European Journal of Pharmacology, vol. 428, n. 1, 28 settembre 2001, pp. 51–57, DOI:10.1016/s0014-2999(01)01243-2. URL consultato il 19 gennaio 2022.
- ^ Shaheen E Lakhan e Marie Rowland, Whole plant cannabis extracts in the treatment of spasticity in multiple sclerosis: a systematic review, in BMC Neurology, vol. 9, 4 dicembre 2009, pp. 59, DOI:10.1186/1471-2377-9-59. URL consultato il 19 gennaio 2022.
- ^ A.W. Zuardi, J.A. de Souza Crippa e J.E.C. Hallak, The Anxiolytic Effects of Cannabidiol (CBD), Elsevier, 2017, pp. e131–e139. URL consultato il 19 gennaio 2022.
- ^ José Alexandre Crippa, Antonio Waldo Zuardi e Rocio Martín-Santos, Cannabis and anxiety: a critical review of the evidence, in Human Psychopharmacology, vol. 24, n. 7, 2009-10, pp. 515–523, DOI:10.1002/hup.1048. URL consultato il 19 gennaio 2022.
- ^ Handbook of Psychotropic Herbs: A Scientific Analysis of Herbal Remedies for Psychiatric Conditions by Ethan Russo. Haworth Herbal Press. NY, USA. ISBN 0-7890-0718-5, US$69.85 hardback. ISBN 0-7890-1088-7, US$29.95 softback., in Phytotherapy Research, vol. 15, n. 7, 2001, pp. 648–648, DOI:10.1002/ptr.1055. URL consultato il 19 gennaio 2022.
- ^ Deepak Cyril D'Souza, Edward Perry e Lisa MacDougall, The psychotomimetic effects of intravenous delta-9-tetrahydrocannabinol in healthy individuals: implications for psychosis, in Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology, vol. 29, n. 8, 2004-08, pp. 1558–1572, DOI:10.1038/sj.npp.1300496. URL consultato il 19 gennaio 2022.
- ^ A. W. Zuardi, S. L. Morais e F. S. Guimarães, Antipsychotic effect of cannabidiol, in The Journal of Clinical Psychiatry, vol. 56, n. 10, 1995-10, pp. 485–486. URL consultato il 19 gennaio 2022.
- ^ Fabrício A. Moreira e Francisco S. Guimarães, Cannabidiol inhibits the hyperlocomotion induced by psychotomimetic drugs in mice, in European Journal of Pharmacology, vol. 512, n. 2-3, 11 aprile 2005, pp. 199–205, DOI:10.1016/j.ejphar.2005.02.040. URL consultato il 19 gennaio 2022.
- ^ Celia J. A. Morgan, Gráinne Schafer e Tom P. Freeman, Impact of cannabidiol on the acute memory and psychotomimetic effects of smoked cannabis: naturalistic study: naturalistic study [corrected], in The British Journal of Psychiatry: The Journal of Mental Science, vol. 197, n. 4, 2010-10, pp. 285–290, DOI:10.1192/bjp.bp.110.077503. URL consultato il 19 gennaio 2022.
- ^ I. G. Karniol e E. A. Carlini, Comparative studies in man and in laboratory animals on 8 - and 9 -trans-tetrahydrocannabinol, in Pharmacology, vol. 9, n. 2, 1973, pp. 115–126, DOI:10.1159/000136375. URL consultato il 19 gennaio 2022.
- ^ Beth M. Anderson, Matthew Rizzo e Robert I. Block, Sex, Drugs, and Cognition: Effects of Marijuana, in Journal of psychoactive drugs, vol. 42, n. 4, 2010-12, pp. 413–424. URL consultato il 19 gennaio 2022.
- ^ Linda A Parker, Erin M Rock e Cheryl L Limebeer, Regulation of nausea and vomiting by cannabinoids, in British Journal of Pharmacology, vol. 163, n. 7, 2011-8, pp. 1411–1422, DOI:10.1111/j.1476-5381.2010.01176.x. URL consultato il 19 gennaio 2022.
- ^ Ethan B. Russo, Geoffrey W. Guy e Philip J. Robson, Cannabis, pain, and sleep: lessons from therapeutic clinical trials of Sativex, a cannabis-based medicine, in Chemistry & Biodiversity, vol. 4, n. 8, 2007-08, pp. 1729–1743, DOI:10.1002/cbdv.200790150. URL consultato il 19 gennaio 2022.
- ^ Anthony N. Nicholson, Claire Turner e Barbara M. Stone, Effect of Delta-9-tetrahydrocannabinol and cannabidiol on nocturnal sleep and early-morning behavior in young adults, in Journal of Clinical Psychopharmacology, vol. 24, n. 3, 2004-06, pp. 305–313, DOI:10.1097/01.jcp.0000125688.05091.8f. URL consultato il 19 gennaio 2022.
- ^ N. L. Benowitz e R. T. Jones, Cardiovascular and metabolic considerations in prolonged cannabinoid administration in man, in Journal of Clinical Pharmacology, vol. 21, S1, 1981-08, pp. 214S–223S, DOI:10.1002/j.1552-4604.1981.tb02598.x. URL consultato il 19 gennaio 2022.
- ^ a b David A. Gorelick e Stephen J. Heishman, Methods for clinical research involving cannabis administration, in Methods in Molecular Medicine, vol. 123, 2006, pp. 235–253, DOI:10.1385/1-59259-999-0:235. URL consultato il 19 gennaio 2022.
- ^ Sándor Bátkai, Pál Pacher e Douglas Osei-Hyiaman, Endocannabinoids Acting at Cannabinoid-1 Receptors Regulate Cardiovascular Function in Hypertension, in Circulation, vol. 110, n. 14, 5 ottobre 2004, pp. 1996–2002, DOI:10.1161/01.CIR.0000143230.23252.D2. URL consultato il 19 gennaio 2022.
- ^ Roger G Pertwee, Emerging strategies for exploiting cannabinoid receptor agonists as medicines, in British Journal of Pharmacology, vol. 156, n. 3, 2009-2, pp. 397–411, DOI:10.1111/j.1476-5381.2008.00048.x. URL consultato il 19 gennaio 2022.
- ^ V. Di Marzo e F. Piscitelli, Gut feelings about the endocannabinoid system, in Neurogastroenterology and Motility: The Official Journal of the European Gastrointestinal Motility Society, vol. 23, n. 5, 2011-05, pp. 391–398, DOI:10.1111/j.1365-2982.2011.01689.x. URL consultato il 19 gennaio 2022.
- ^ Vincenzo Di Marzo, Fabiana Piscitelli e Raphael Mechoulam, Cannabinoids and endocannabinoids in metabolic disorders with focus on diabetes, in Handbook of Experimental Pharmacology, n. 203, 2011, pp. 75–104, DOI:10.1007/978-3-642-17214-4_4. URL consultato il 19 gennaio 2022.
- ^ Sofía Torres, Mar Lorente e Fátima Rodríguez-Fornés, A combined preclinical therapy of cannabinoids and temozolomide against glioma, in Molecular Cancer Therapeutics, vol. 10, n. 1, 2011-01, pp. 90–103, DOI:10.1158/1535-7163.MCT-10-0688. URL consultato il 19 gennaio 2022.
- ^ Andriani Athanasiou, Anna B. Clarke e Amy E. Turner, Cannabinoid receptor agonists are mitochondrial inhibitors: a unified hypothesis of how cannabinoids modulate mitochondrial function and induce cell death, in Biochemical and Biophysical Research Communications, vol. 364, n. 1, 7 dicembre 2007, pp. 131–137, DOI:10.1016/j.bbrc.2007.09.107. URL consultato il 19 gennaio 2022.
- ^ K. Green, Marijuana smoking vs cannabinoids for glaucoma therapy, in Archives of Ophthalmology (Chicago, Ill.: 1960), vol. 116, n. 11, 1998-11, pp. 1433–1437, DOI:10.1001/archopht.116.11.1433. URL consultato il 19 gennaio 2022.
- ^ (EN) Karniol IG, Shirakawa I, Kasinski N, Pfeferman A, Carlini EA., Cannabidiol interferes with the effects of delta-9-tetrahydrocannbinol in man, in European Journal of Pharmacology, vol. 28, 1975, pp. 172-177, DOI:10.1016/0014-2999(74)90129-0.
- ^ a b (EN) Russo E., Burnett A., Agonistic properties of cannabidiol at 5-HT1a receptors, in Neurochemical Research, vol. 30, 2005, pp. 1037-1043.
- ^ (EN) Ning Qin, Michael P. Neeper, Yi Liu, Tasha L. Hutchinson, TRPV2 is activated by Cannabidiol and mediates CGRP release in cultured rat dorsal root ganglion neurons, in The Journal of Neuroscience, vol. 28, 2008, pp. 6231-6238.
- ^ (EN) Raphael Mechoulam, Maximilian Peters e Eric Murillo-Rodriguez, Cannabidiol--recent advances, in Chemistry & Biodiversity, vol. 4, n. 8, agosto 2007, pp. 1678–1692, DOI:10.1002/cbdv.200790147. URL consultato il 10 maggio 2018.
- ^ R G Pertwee, The diverse CB1 and CB2 receptor pharmacology of three plant cannabinoids: Δ9-tetrahydrocannabinol, cannabidiol and Δ9-tetrahydrocannabivarin, in British Journal of Pharmacology, vol. 153, n. 2, 2008-01, pp. 199–215, DOI:10.1038/sj.bjp.0707442. URL consultato il 10 maggio 2018.
- ^ A Thomas, G L Baillie e A M Phillips, Cannabidiol displays unexpectedly high potency as an antagonist of CB1 and CB2 receptor agonists in vitro, in British Journal of Pharmacology, vol. 150, n. 5, 2007-03, pp. 613–623, DOI:10.1038/sj.bjp.0707133. URL consultato il 19 gennaio 2022.
- ^ Kazuhide Hayakawa, Kenichi Mishima e Mai Hazekawa, Cannabidiol potentiates pharmacological effects of Delta(9)-tetrahydrocannabinol via CB(1) receptor-dependent mechanism, in Brain Research, vol. 1188, 10 gennaio 2008, pp. 157–164, DOI:10.1016/j.brainres.2007.09.090. URL consultato il 10 maggio 2018.
- ^ Cos'è il CBD, su NegozioCBD.it. URL consultato il 10 maggio 2018 (archiviato dall'url originale il 25 marzo 2018).
- ^ (EN) Cannabinoids and their medicinal properties - Alchimia blog, in Alchimia blog, 25 agosto 2014. URL consultato il 10 maggio 2018.
- ^ TV Zanelati, C Biojone e FA Moreira, Antidepressant-like effects of cannabidiol in mice: possible involvement of 5-HT1A receptors, in British Journal of Pharmacology, vol. 159, n. 1, 2010-1, pp. 122–128, DOI:10.1111/j.1476-5381.2009.00521.x. URL consultato il 10 maggio 2018.
- ^ a b Leonardo BM Resstel, Rodrigo F Tavares e Sabrina FS Lisboa, 5-HT1A receptors are involved in the cannabidiol-induced attenuation of behavioural and cardiovascular responses to acute restraint stress in rats, in British Journal of Pharmacology, vol. 156, n. 1, 2009-1, pp. 181–188, DOI:10.1111/j.1476-5381.2008.00046.x. URL consultato il 10 maggio 2018.
- ^ Alline Cristina Campos e Francisco Silveira Guimarães, Involvement of 5HT1A receptors in the anxiolytic-like effects of cannabidiol injected into the dorsolateral periaqueductal gray of rats, in Psychopharmacology, vol. 199, n. 2, agosto 2008, pp. 223–230, DOI:10.1007/s00213-008-1168-x. URL consultato il 10 maggio 2018.
- ^ Kenichi Mishima, Kazuhide Hayakawa e Kohji Abe, Cannabidiol prevents cerebral infarction via a serotonergic 5-hydroxytryptamine1A receptor-dependent mechanism, in Stroke, vol. 36, n. 5, maggio 2005, pp. 1077–1082, DOI:10.1161/01.STR.0000163083.59201.34. URL consultato il 10 maggio 2018.
- ^ Kazuhide Hayakawa, Kenichi Mishima e Masanori Nozako, Repeated treatment with cannabidiol but not Delta9-tetrahydrocannabinol has a neuroprotective effect without the development of tolerance, in Neuropharmacology, vol. 52, n. 4, marzo 2007, pp. 1079–1087, DOI:10.1016/j.neuropharm.2006.11.005. URL consultato il 10 maggio 2018.
- ^ (EN) Markus Kathmann, Karsten Flau e Agnes Redmer, Cannabidiol is an allosteric modulator at mu- and delta-opioid receptors, in Naunyn-Schmiedeberg's Archives of Pharmacology, vol. 372, n. 5, febbraio 2006, pp. 354–361, DOI:10.1007/s00210-006-0033-x. URL consultato il 10 maggio 2018.
- ^ a b Alline Cristina Campos, Fabricio Araújo Moreira e Felipe Villela Gomes, Multiple mechanisms involved in the large-spectrum therapeutic potential of cannabidiol in psychiatric disorders, in Philosophical Transactions of the Royal Society B: Biological Sciences, vol. 367, n. 1607, 5 dicembre 2012, pp. 3364–3378, DOI:10.1098/rstb.2011.0389. URL consultato il 10 maggio 2018.
- ^ István Ujváry e Lumír Hanuš, Human Metabolites of Cannabidiol: A Review on Their Formation, Biological Activity, and Relevance in Therapy, in Cannabis and Cannabinoid Research, vol. 1, n. 1, 1º marzo 2016, pp. 90–101, DOI:10.1089/can.2015.0012. URL consultato il 10 maggio 2018.
- ^ Kevin J. Brown, Alyssa S. Laun e Zhao-Hui Song, Cannabidiol, a novel inverse agonist for GPR12, in Biochemical and Biophysical Research Communications, vol. 493, n. 1, 11 04, 2017, pp. 451–454, DOI:10.1016/j.bbrc.2017.09.001. URL consultato il 10 maggio 2018.
- ^ Errore nelle note: Errore nell'uso del marcatore
<ref>: non è stato indicato alcun testo per il marcatore:12 - ^ Errore nelle note: Errore nell'uso del marcatore
<ref>: non è stato indicato alcun testo per il marcatore:13 - ^ Errore nelle note: Errore nell'uso del marcatore
<ref>: non è stato indicato alcun testo per il marcatore:14 - ^ Tiziana Bisogno, Lumír Hanuš e Luciano De Petrocellis, Molecular targets for cannabidiol and its synthetic analogues: effect on vanilloid VR1 receptors and on the cellular uptake and enzymatic hydrolysis of anandamide, in British Journal of Pharmacology, vol. 134, n. 4, 2001-10, pp. 845–852, DOI:10.1038/sj.bjp.0704327. URL consultato il 19 gennaio 2022.
- ^ Roberto Leite, E.A. Carlini e N. Lander, Anticonvulsant Effects of the (–) and (+)Isomers of Cannabidiol and Their Dimethylheptyl Homologs, in Pharmacology, vol. 24, n. 3, 1982, pp. 141–146, DOI:10.1159/000137588. URL consultato il 19 gennaio 2022.
- ^ European Monitoring Centre for Drugs and Drug Addiction., Low-THC cannabis products in Europe., Publications Office, 2020, DOI:10.2810/593551. URL consultato il 19 gennaio 2022.
- ^ (EN) Monitoring and evaluating changes in cannabis policies: insights from the Americas | www.emcdda.europa.eu, su www.emcdda.europa.eu. URL consultato il 19 gennaio 2022.
- ^ Cannabis policy: status and recent developments | www.emcdda.europa.eu, su www.emcdda.europa.eu. URL consultato il 19 gennaio 2022.
- ^ (EN) EUR-Lex - 32009R1223 - EN - EUR-Lex, su eur-lex.europa.eu. URL consultato il 19 gennaio 2022.
- ^ Cannabidiol (CBD) is not considered a ‘narcotic drug’ under European law | www.emcdda.europa.eu, su www.emcdda.europa.eu. URL consultato il 19 gennaio 2022.
- ^ CURIA - Documenti, su curia.europa.eu. URL consultato il 19 gennaio 2022.
- ^ Nuovi prodotti alimentari | EFSA, su www.efsa.europa.eu. URL consultato il 19 gennaio 2022.
- ^ (EN) Decisions terminating the procedure, su ec.europa.eu. URL consultato il 19 gennaio 2022.
- ^ (EN) Peter Grinspoon MD, Cannabidiol (CBD)-what we know and what we don't, su Harvard Health, 24 agosto 2018. URL consultato il 19 gennaio 2022.
- ^ (EN) Office of the Commissioner, FDA Regulation of Cannabis and Cannabis-Derived Products, Including Cannabidiol (CBD), in FDA, 18 ottobre 2021. URL consultato il 19 gennaio 2022.
- ^ (EN) John Hudak, The Farm Bill, hemp legalization and the status of CBD: An explainer, su Brookings, 14 dicembre 2018. URL consultato il 19 gennaio 2022.
- ^ (EN) Office of the Commissioner, FDA Regulation of Cannabis and Cannabis-Derived Products, Including Cannabidiol (CBD), in FDA, 18 ottobre 2021. URL consultato il 19 gennaio 2022.
- ^ (EN) Office of the Commissioner, FDA and Cannabis: Research and Drug Approval Process, in FDA, 1º ottobre 2020. URL consultato il 19 gennaio 2022.
- ^ State Medical Cannabis Laws, su www.ncsl.org. URL consultato il 19 gennaio 2022.
- ^ (EN) Felicia Gans Globe Staff, July 1, 2019, 9:12 a m Share on Facebook Share on TwitterView Comments, Massachusetts says hemp-derived CBD is illegal — but CBD stores are still everywhere - The Boston Globe, su BostonGlobe.com. URL consultato il 19 gennaio 2022.
Bibliografia
- Grotenhermen F, Russo E. Cannabis and cannabinoids. Pharmacology, Toxicology and Therapeutic potential. Binghamton, NY: Haworth Press 2002
- Joy, J.E. et al. Marijuana and Medicine: Assessing the Science Base Institute of Medicine, Karniol, 1999
- British Medical Association Staff Therapeuthic uses of Cannabis Gordon & Breach Science Pub, 1999
- Hollister LE, Gillespie BA. Interactions in man of delta-9-THC. II. Cannabinol and cannabidiol. Clinical Pharmacology and Therapeutics 1975; 18:80-83.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su cannabidiolo
Wikimedia Commons contiene immagini o altri file su cannabidiolo