Emicrania
| Emicrania | |
|---|---|
 | |
| Specialità | neurologia |
| Eziologia | ignoto e stress |
| Classificazione e risorse esterne (EN) | |
| ICD-10 | G43.9 |
| OMIM | 157300 e 157300 |
| MeSH | D008881 |
| MedlinePlus | 000709 |
| eMedicine | 1142556 |
L'emicrania è una patologia neurologica cronica caratterizzata da ricorrenti cefalee, da moderate a gravi, spesso in associazione con una serie di sintomi del sistema nervoso autonomo. La parola deriva dal greco antico ἡμικρανία?, hēmikranía ("dolore su un lato della testa[1]"), a sua volta da ἡμι-, hēmi- ("metà") e κρανίον, kraníon ("teschio")[2]
In genere il mal di testa è monolaterale (colpisce cioè solo una metà della testa) e a natura pulsante, con una durata che può variare da 2 a 72 ore. I sintomi associati possono includere nausea, vomito, fotofobia (aumento della sensibilità alla luce), fonofobia (aumento della sensibilità al suono) e il dolore generalmente si aggrava a seguito dell'attività fisica.[3] Fino a un terzo delle persone con emicrania sperimentano l'aura: un disturbo transitorio visivo, sensoriale, motorio o del linguaggio che precede di poco il verificarsi di un episodio di mal di testa.[3] Di tanto in tanto un'aura può verificarsi senza che venga seguita dall'emicrania.
Le emicranie si ritiene siano causate da un mix di fattori ambientali e genetici.[4] Circa due terzi dei pazienti appartengono a nuclei familiari in cui si erano manifestati altri casi della stessa patologia.[5] Le fluttuazioni dei livelli ormonali possono svolgere un ruolo e infatti l'emicrania colpisce più ragazzi che ragazze prima della pubertà, ma negli adulti le donne con emicrania sono più frequenti, da due a tre volte di più, rispetto agli uomini.[6][7] La predisposizione alle emicranie in genere diminuisce durante la gravidanza.[6] L'esatta eziologia e fisiopatologia dell'emicrania non è nota; tuttavia viene ritenuta spesso un disturbo di natura neurovascolare.[5] La teoria più accettata è correlata alla maggior eccitabilità della corteccia cerebrale e a un controllo anormale dei neuroni del dolore nel nucleo trigeminale del tronco cerebrale.[8]
Il trattamento iniziale raccomandato è spesso un analgesico (come l'ibuprofene e il paracetamolo) per il mal di testa, associato a un antiemetico per la nausea e si cerca di prevenire le situazioni ambientali scatenanti. Agenti specifici come i triptani o l'ergotamina possono essere utilizzati da persone che risultano resistenti agli analgesici. Circa il 15% della popolazione mondiale soffre, a un certo punto della sua vita, di emicrania.
Storia[modifica | modifica wikitesto]

Già nei documenti risalenti all'antico Egitto sono presenti riferimenti all'emicrania e alla nevralgia, pensando che fossero causati da demoni ed entità maligne.[9] Una prima descrizione coerente dell'emicrania è contenuta nel papiro Ebers, scritto intorno al 1500 a.C.[10]
Le prime descrizioni dell'emicrania si devono a Ippocrate (460 – 380 a.C.), che descrisse la forma con aura.[11]
Nel II secolo, Areteo di Cappadocia la chiamò heterocrania, ed egli stesso fu poi autore di una classificazione che fu importante per moltissimi anni.[12][13][14] In seguito il termine divenne ufficialmente «hemicrania» grazie a Galeno (129 – 216) che lo introdusse; egli attribuì le cause dell'emicrania agli umori (vapori) che si elevano dal fegato alla testa.[13][15] Galeno riteneva anche che il dolore provenisse dalle meningi e dai vasi sanguigni della testa.[11] Le emicranie sono stati divise nei due tipi ora utilizzati, emicrania con aura (emicrania ophthalmique) ed emicrania senza aura (emicrania vulgaire), nel 1887 da Louis Hyacinthe Thomas, un bibliotecario francese.[11]
Nel Medioevo Avicenna analizzò i sintomi e le origini del male attribuendoli allo stile di vita e ad alcuni eventi tipicamente femminili, come la menopausa e l'aborto.[16]
In seguito furono investigate le cause, dalle più spiritualistiche come quella proposta da Ildegarda di Bingen (1098-1179),[17] a quelle di Bright, che pensava fosse causata dall'umore melanconico.

La trapanazione del cranio, ovvero la perforazione del cranio, veniva praticata già nel 7000 a.C.[10] Alcuni sopravvissero a tale pratica, molti probabilmente morirono a causa delle infezioni.[18] Si riteneva che tale pratica favorisse la fuga degli spiriti maligni.[19] William Harvey, nel XVII secolo, consigliava la trapanazione come trattamento per l'emicrania.[20]
Nel XVII secolo Thomas Willis, seguito da Graham e Wolff[21], sostenne la teoria, ancora oggi ritenuta valida, dell'ipotesi vascolare che ha sostituito gli umori come causa possibile. Come si legge nei suoi lavori:
«Una circolazione troppo veloce del sangue nella testa che finisce con il ribollire e occludere il lume dei vasi in certi determinati punti particolarmente predisposti e vi si ristagna; se poi in quegli stessi punti il sangue arriva in quantità troppo copiosa i vasi si dilatano, le membrane si rigonfiano»
Per gran parte del Novecento gli scienziati hanno ritenuto plausibile la spiegazione della dilatazione e della tensione dei vasi sanguigni come causa del dolore e che questo fenomeno fosse preceduto da un calo di flusso e da un breve restringimento dei vasi. Attualmente i ricercatori propendono invece per una origine neurologica, localizzabile nella parte più antica del sistema nervoso, ossia il tronco encefalico.[22]
Epidemiologia[modifica | modifica wikitesto]

nessun dato
<45
45-65
65-85
85-105
105-125
125-145
145-165
165-185
185-205
205-225
225-245
>245
A livello mondiale, le emicranie colpiscono quasi il 15% della popolazione, circa un miliardo di individui.[23] È più comune nelle donne (19%) rispetto agli uomini (11%).[23]
Per quanto riguarda le etnie la caucasica è la più colpita, segue quella africana (4% delle donne e 2,2% degli uomini nel Benin[24]) e poi l'asiatica.[25]
Negli Stati Uniti d'America, circa il 6% degli uomini e il 18% delle donne sperimentano un episodio di emicrania, con una probabilità che succeda, nell'arco della vita, di circa il 18% e il 43% rispettivamente.[5] In Europa, l'emicrania colpisce tra il 12% e il 28% degli individui a un certo punto della loro vita, con circa il 6-15% degli uomini adulti e 14-35% delle donne adulte che la manifestano almeno una volta in un anno.[7]
I tassi di emicrania sono leggermente più bassi in Asia e in Africa rispetto ai paesi occidentali.[26][27] Le emicranie croniche si verificano tra il circa 1,4% e il 2,2% della popolazione.[28]
Queste cifre variano notevolmente con l'età: l'emicrania più comunemente inizia tra i 15 e i 24 anni di età e si verifica più frequentemente nelle donne tra i 35 e i 45 anni.[5] Nei bambini, circa l'1,7% al di sotto dei 7 anni e il 3,9% di quelli tra i 7 e 15 anni sperimentano emicranie, con la caratteristica di essere un po' più comune nei maschi prima della pubertà.[29] Durante l'adolescenza, l'emicrania diventa più comune tra le donne[29] e questo fenomeno persiste per tutta la durata della vita, essendo due volte più frequente tra le donne anziane rispetto ai maschi.[30] Nelle donne, l'emicrania senza aura è più comune dell'emicrania con aura, ma negli uomini le due tipologie si presentano con una frequenza sovrapponibile.[26]
Nel periodo premenopausale spesso peggiorano prima di diminuire in gravità.[30] Anche se i sintomi si risolvono in circa i due terzi delle persone anziane, in circa il 3 e il 10% di essi persistono.[31]
In Europa[modifica | modifica wikitesto]
Uno studio pubblicato nel 2010 che raccoglie la prevalenza delle varie forme di cefalea negli stati europei riporta i seguenti dati per l'emicrania:[32]
| Nazione | Anno | Uomini | Donne | Totale |
|---|---|---|---|---|
| 2003 | 6,1 | 13,8 | 10,2 | |
| 2001 | 13 | 20,2 | 16,7 | |
| 2006 | 13,9 | 24,3 | 19,1 | |
| 2005 | 6,3 | 15,7 | 11,2 | |
| 2009 | 5,3 | 15,6 | 10,6 | |
| 2009 | // | // | 15,6 | |
| 2003 | 7,6 | 18,3 | 14,3 | |
| 2006 | 17,5 | 28,4 | 23,0 | |
| 1999 | 13,3 | 33 | 23,2 | |
| 1995 | // | // | 8,8 | |
| 1994 | 8,0 | 17,0 | 12,0 | |
| 2006 | 2,4 | 5,5 | 4,0 | |
| 2005 | 9,3 | 29,3 | 19,9 | |
| 2000 | 2,7 | 6,9 | 9,6 |
Secondo i dati dell'Oms, l'emicrania è la patologia che causa maggiore disabilità nella fascia dai 20 ai 50 anni. In Italia, al 2023, colpisce 6 milioni di persone.[33]
Segni e sintomi[modifica | modifica wikitesto]
L'emicrania si presenta tipicamente con mal di testa auto-limitati, ricorrenti e associati con sintomi autonomici.[5][34] Circa il 15-30% delle persone con emicrania sperimenta l'emicrania associata ad aura[35][36] e coloro che hanno attacchi di emicrania con aura hanno anche spesso l'emicrania senza aura.[37] La gravità del dolore, la durata del mal di testa e la frequenza degli attacchi è variabile.[5] Un'emicrania che dura più di 72 ore viene definita come "stato di male emicranico".[38] Vi sono quattro fasi possibili durante un episodio di emicrania, anche se non tutte le fasi si presentano necessariamente:[3]
- la fase prodromica, che si verifica nelle ore o nei giorni antecedenti il mal di testa;
- l'aura, che precede immediatamente il mal di testa;
- la fase del dolore, nota anche come fase di cefalea;
- la fase postdromica, gli effetti sperimentati dopo la fine di un attacco di emicrania.
Fase prodromica[modifica | modifica wikitesto]
I sintomi prodromici o premonitori si verificano in circa il 60% dei casi di emicrania,[39][40] con un esordio che può variare da due ore a due giorni prima dell'inizio del dolore o dell'aura.[41] Questi sintomi possono includere una vasta gamma di fenomeni,[42] tra cui: alterazione dell'umore, irritabilità, depressione o euforia, stanchezza, voglia di certi cibi, rigidità muscolare (soprattutto nel collo), stitichezza o diarrea e ipersensibilità agli odori o ai rumori.[39] Ciò può verificarsi in persone con emicrania con aura o senza aura.[43]
Fase aura[modifica | modifica wikitesto]

L'aura è un fenomeno neurologico focale transitorio che si verifica prima o durante il mal di testa.[40] Esso appare gradualmente entro alcuni minuti e generalmente in meno di un'ora.[44] I sintomi sperimentati possono essere visivi, sensoriali o motori e molte persone ne provano più di uno.[45] Gli effetti visivi si verificano più frequentemente e si possono riscontrare in circa il 99% dei casi e in più del 50% dei casi essi non sono accompagnati da effetti sensoriali o motori.[45] I disturbi della visione spesso hanno la forma di uno scotoma scintillante (una zona di alterazione parziale nel campo visivo che sfarfalla e può interferire con la capacità di una persona di leggere o guidare).[40] Ciò spesso inizia nei pressi del centro della visione per poi spostarsi a zig-zag tanto da essere a volte descritte come linee che ricordano le fortificazioni o i muri di un castello.[45] Di solito le linee sono in bianco e nero, ma alcune persone vedono anche linee colorate.[45] Alcuni pazienti perdono parte del loro campo visivo, un fenomeno noto come emianopsia, mentre altri sperimentano semplici sfocature.[45]
Le aure sensoriali sono il secondo tipo più comune e si verificano nel 30-40% delle persone colpite da aurea.[45] Spesso tale condizione si manifesta come una sensazione di puntura di spilli su un braccio e che poi si diffonde nella zona del naso e della bocca sullo stesso lato.[45] Una parestesia solitamente si verifica dopo che il formicolio è passato, accompagnata da una perdita del senso della posizione.[45] Altri sintomi della fase di aura possono includere anche disturbi della parola o del linguaggio e altre manifestazioni meno comuni sempre legate al movimento.[45] I sintomi motori indicano che si tratta di una emicrania emiplegica e la debolezza muscolare spesso dura più di un'ora, a differenza delle altre aure.[45]
Un'aura si manifesta raramente senza essere seguita da un mal di testa[45] ma se si verifica essa prende il nome di "emicrania silente". Tuttavia, è difficile valutare la frequenza di tali casi, poiché i pazienti spesso non presentano sintomi tanto gravi da spingerli a farsi curare.
-
Caratteristico spettro di fortificazione
-
Scotoma negativo, perdita della capacità visiva discriminatoria in una zona definita del campo visivo.
-
Scotoma positivo, percezione di strutture alterate o supplementari in una zona definita del campo visivo.
-
Perdita completa di un emicampo visivo.
Fase del dolore[modifica | modifica wikitesto]
Generalmente il mal di testa è monolaterale, pulsante e con una intensità che va da moderata a grave.[44] Spesso viene aggravato dall'attività fisica.[3] In più del 40% dei casi però il dolore può essere bilaterale e spesso vi si associa anche il dolore al collo.[46] Il dolore bilaterale è particolarmente frequente in coloro che presentano emicrania senza aura.[40] Meno comunemente il dolore può verificarsi soprattutto nella parte posteriore o superiore della testa.[40] Il dolore di solito dura dalle 4 alle 72 ore negli adulti,[44] tuttavia nei bambini piccoli dura spesso meno di 1 ora.[47] La frequenza degli attacchi è variabile, da pochi in una vita a molti in una settimana, con una media di circa uno al mese.[24][48]
Il dolore è spesso accompagnato da nausea, vomito, sensibilità alla luce, sensibilità al suono, sensibilità agli odori, stanchezza e irritabilità.[40] In una emicrania basilare, una emicrania con sintomi neurologici legati al tronco cerebrale o con sintomi neurologici su entrambi i lati del corpo,[49] gli effetti comuni includono una sensazione di testa vuota e confusione.[40] La nausea si verifica in quasi il 90% delle persone e il vomito in circa un terzo.[50] Molti cercano una stanza buia e tranquilla.[50] Altri sintomi possono includere: visione offuscata, naso chiuso, diarrea, minzione frequente, pallore e sudorazione,[51] gonfiore o dolorabilità del cuoio capelluto possono verificarsi come può manifestarsi la rigidità del collo.[51] I sintomi associati sono meno comuni negli anziani.[31]
Fase postdromica[modifica | modifica wikitesto]
Gli effetti di emicrania possono persistere per alcuni giorni dopo che il mal di testa principale è finito. Questa è chiamata emicrania postdromica. Molti pazienti riportano una sensazione di dolore nella zona in cui vi era l'emicrania e qualche relazione alterata nel pensiero, per alcuni giorni dopo che il mal di testa è passato. Il paziente può sentirsi stanco e presentare dolore alla testa, difficoltà cognitive, sintomi gastrointestinali, cambiamenti dell'umore e debolezza.[52] Secondo una sintesi: "alcune persone si sentono insolitamente rinfrescate o euforiche dopo un attacco, mentre altre notano depressione e malessere".[53]
Eziologia[modifica | modifica wikitesto]
Le cause dell'emicrania sono sconosciute.[54] Tuttavia, si crede possano essere correlate a una serie di fattori ambientali e genetici.[4] I casi famigliari comprendono circa i due terzi[5] e raramente si verificano a causa di un singolo difetto genetico.[55] Mentre una volta l'emicrania era ritenuta essere più comune in quelli dotati di grande intelligenza, ciò oggi non sembra corrispondere al vero.[26] Un certo numero di condizioni psicologiche vengono associate, tra cui: depressione, ansia e disturbo bipolare così come lo sono molti eventi biologici o condizioni ambientali.[56]
Teoria genetica[modifica | modifica wikitesto]
Studi effettuati su gemelli indicano una possibile influenza genetica che varia dal 34% al 51% sulla probabilità di sviluppare emicrania.[4] Questa correlazione è più forte per l'emicrania con aura rispetto all'emicrania senza aura.[37] Un certo numero di varianti di geni specifici aumenta il rischio.[55]
Malattie monogeniche che provocano l'emicrania sono rare.[55] Una di questi è nota come emicrania emiplegica familiare, un tipo di emicrania con aura che viene ereditato in modo autosomico dominante.[57][58] Quattro geni hanno dimostrato di essere coinvolti in tale patologia.[59] Tre di questi sono coinvolti nel trasporto di ioni.[59] Il quarto è una proteina assonale associata al complesso di esocitosi.[59] Un altro disordine genetico associato con l'emicrania è la CADASIL o "arteriopatia cerebrale autosomica dominante con infarti sottocorticali e leucoencefalopatia".[40]
Teoria vascolare[modifica | modifica wikitesto]
In passato era l'ipotesi maggiormente esposta dagli studi clinici; si pensava che la causa fosse una vasodilatazione extracranica, dove tutte le manifestazioni venivano create dalla vasocostrizione. Per avvalorare tale tesi si sono eseguiti degli studi sulla velocità del sangue mostrando una lieve ipoperfusione che dura dalle 4 alle 6 ore, che non è però di entità tale da spiegarne i sintomi, ma solo alcune lievi manifestazioni accessorie. Tale alterazione comunque non si mostra in tutti i pazienti; in alcuni il flusso sanguigno a livello cerebrale è normale. I sintomi dunque possono essere spiegati solo in parte.[60] Ci sono tuttavia studi che hanno identificato anomalie strutturali ultramicroscopiche dell'entotelio e della tonaca muscolare dei vasi extracranici dei pazienti con emicrania cronica, in particolare a carico delle arterie temporale superficiale e occipitale.[61]
Teoria neurologica[modifica | modifica wikitesto]
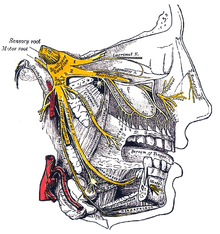
Per quanto riguarda l'aura, gli specialisti tendono a colpevolizzare una depressione corticale propagata, costituita da un'onda indotta dalle cellule nervose che si diffonde in una vasta zona della corteccia e che viene considerata la prima fase, detta di ipereccitabilità, del processo, durante la quale la zona necessita di un grande quantitativo di sangue, a cui ne segue un'altra fase chiamata di inibizione, nella quale i neuroni mantengono uno stato di quiete e quindi nella stessa zona, in questo caso, occorre molto meno sangue rispetto a prima. I ricercatori ritengono che questo repentino cambiamento nel flusso sanguigno preceda, abitualmente, il dolore al capo e che l'aura sia relazionata proprio alla depressione corticale propagata.[22]
Alcuni ricercatori ritengono che la depressione corticale propagata possa stimolare i nervi del trigemino, perché durante la fase di ipereccitabilità rilascia neurotrasmettitori, che con il loro ruolo di messaggeri, inducono il nervo del trigemino alla trasmissione dei segnali di dolore. Altri scienziati hanno individuato l'origine del dolore non tanto nella depressione corticale, quanto nel tronco encefalico, sede della percezione alla luce, ai rumori, della sensibilità al dolore e sito di transito delle informazioni dal corpo verso il cervello e viceversa.[22]
Alcuni studiosi hanno notato un assottigliamento della materia grigia nella zona del cervello che gestisce il dolore. Quest'assottigliamento varia a seconda dell'intensità e della frequenza degli attacchi. Altri studiosi, invece, notano un ispessimento della corteccia cerebrale nella zona occipitale che gestisce la vista. Per questo, in alcuni tipi d'emicrania si ha della cecità totale o parziale per un certo periodo di tempo.
Fattori scatenanti[modifica | modifica wikitesto]
L'emicrania può essere indotta anche da fattori scatenanti, che in alcuni casi sono stati ritenuti solo leggermente responsabili[5] mentre in altri fortemente responsabili.[62] Molte cause sono state etichettate come tali, tuttavia la forza e l'importanza di queste correlazioni sono incerte.[62][63] Un fattore scatenante può incorrere fino a 24 ore prima della comparsa dei sintomi.[5]
- Reazioni allergiche
- Luci intense, rumori, alcuni odori e profumi
- Stress fisico o psicologico
- Cambiamenti nelle abitudini del sonno
- Fumare o esposizione al fumo passivo
- Saltare un pasto
- Assunzione di alcol
- Fluttuazioni del ciclo mestruale, utilizzo di pillola anticoncezionale, periodi pre e post menopausa
- Episodio di cefalea tensiva
- Assunzione di cibi contenenti tiramina (vino rosso, formaggio stagionato, pesce affumicato, fegato di pollo, fichi e alcuni tipi di fagioli), glutammato monosodico (MSG) o nitrati (insaccati)
- Cibi come cioccolato, nocciole, arachidi (burro), avocado, banana, agrumi, cipolle, prodotti caseari, cibi fermentati o conservati
- Permanenza prolungata di fronte a monitor o televisori
Fisiologici[modifica | modifica wikitesto]
Fattori scatenanti comuni sono lo stress, la fame e la fatica (questi contribuiscono ugualmente al mal di testa di tipo tensivo).[62] Le emicranie hanno più probabilità di verificarsi durante le mestruazioni.[65] Altre influenze ormonali, come il menarca, l'uso di contraccettivi orali, la gravidanza, la premenopausa e la menopausa, possono anche svolgere un ruolo determinante.[66] Queste influenze ormonali sembrano essere più rilevanti nell'emicrania senza aura.[26] Le emicranie in genere non si verificano durante il secondo e terzo trimestre di gravidanza o dopo la menopausa.[40]
Alimentazione[modifica | modifica wikitesto]
Studi sui fattori dietetici hanno dimostrato che non vi sono prove che ne dimostrino e ne confutino l'esistenza.[67][68] Per quanto riguarda gli agenti specifici non sembra esservi la prova di un effetto della tiramina sull'emicrania.[69] Il glutammato monosodico è ritenuto essere un fattore alimentare,[70] ma sono necessarie ulteriori prove per descriverlo meglio.[71]
- Alimenti contenenti glutine

- Alcuni soggetti affetti da emicrania riferiscono di trarre giovamento riducendo l'assunzione di cibi contenenti glutine (alimenti contenenti farine di frumento, avena, orzo, segale, farro, spelta, kamut, triticale, monococco). In base a questi dati, uno studio ha dimostrato come la popolazione affetta da emicrania abbia una possibilità 10 volte maggiore rispetto alla popolazione sana di essere affetta da celiachia.[72] Un altro studio ha mostrato come 10 pazienti affetti da cefalea cronica resistente al trattamento fossero affetti da celiachia; tra questi, 9 decisero di sottoporsi a una dieta priva di glutine e in 7 si notò la completa remissione dalla sintomatologia emicranica.[73]
- Aspartame
- Benché vi siano numerose segnalazioni di attacchi emicranici connessi con l'uso di aspartame,[74][75][76] non vi sono ancora sufficienti prove sperimentali o cliniche in grado di confermare la correlazione.[68]
- Glutammato monosodico (MSG)
- La correlazione tra ingestione di alimenti contenenti glutammato monosodico ed episodi emicranici è nota da tempo.[77] Uno studio doppio-cieco, controllato con placebo, ha dimostrato come dosi di 2,5 grammi di MSG preso a stomaco vuoto siano in grado di scatenare una sintomatologia analoga a quella emicranica.[78][79] Tuttavia, un altro studio doppio cieco ha dimostrato l'assenza dei suddetti effetti per un dosaggio di 3,5 grammi di MSG associato a cibo.[80]
- Tiramina
- Benché la statunitense National Headache Foundation abbia formulato una lista specifica di tutti gli alimenti contenenti tiramina identificandoli come trigger[81] emicranici,[82] nel 2003 uno studio dimostrò l'assenza di diretta correlazione tra assunzione di tiramina e l'attacco emicranico.[83]
- Altri alimenti
- Molto spesso i soggetti affetti da emicrania identificano diversi cibi in grado di provocare l'episodio emicranico; tuttavia, non vi sono evidenze che dimostrino la necessità di seguire una dieta specifica.[68] L'abuso di alcol (soprattutto di vino rosso), il cioccolato, l'astinenza da caffeina, il saltare i pasti e la disidratazione possono precipitare l'emicrania.[84] Inoltre i fattori che possono far scatenare il dolore sono: stress, ansia, affaticamento, l'eccessivo sonno o l'assenza e le mestruazioni (definita per questo emicrania catameniale).[85]
Ambientali[modifica | modifica wikitesto]
Studi su potenziali fattori scatenanti ambientali, sia interni che esterni, hanno concluso che le prove a loro favore erano di scarsa qualità. Tuttavia la popolazione in generale sceglie di adottare misure preventive relative alla qualità dell'aria e all'illuminazione.[86]
Fisiopatologia[modifica | modifica wikitesto]

Le emicranie sono da ritenersi un disturbo neurovascolare[5] con prove a sostegno che suoi meccanismi inizino all'interno del cervello e quindi si diffondano ai vasi sanguigni.[87] Alcuni ricercatori ritengono che la fisiologia neuronale svolga un ruolo maggiore,[88] mentre altri sostengono che i maggiori responsabili siano i vasi sanguigni.[89] Si ritiene che alti livelli del neurotrasmettitore serotonina possano esserne una causa.[87]
Aura[modifica | modifica wikitesto]
La depressione corticale propagata è una ondata di attività neuronale seguita da un periodo di inattività che si riscontra in coloro che sperimentano l'emicrania con aura.[90] Vi sono un certo numero di spiegazioni per la manifestazione, compresa l'attivazione dei recettori NMDA che permettono al calcio di entrare nella cellula.[90] Dopo l'ondata di attività del flusso sanguigno verso la corteccia cerebrale, la zona interessata sperimenta una diminuzione di attività per un tempo che può andare da due a sei ore.[90] Si ritiene che quando la depolarizzazione viaggia lungo il lato inferiore del cervello, i nervi del senso del dolore, presenti nella testa e nel collo, siano attivati.[90]
Dolore[modifica | modifica wikitesto]
L'esatto meccanismo del dolore alla testa durante un attacco di emicrania è sconosciuto.[91] Alcune prove evidenziano un ruolo primario delle strutture del sistema nervoso centrale (come il tronco cerebrale e il diencefalo)[92] mentre altri dati supportano l'attivazione del periferico (quale, ad esempio, i nervi sensoriali che circondano i vasi sanguigni della testa e del collo).[91] I vasi potenziali candidati includono: arterie durali, arterie piali e arterie extracraniche quali quelle del cuoio capelluto.[91] Il ruolo della vasodilatazione delle arterie extracranica, in particolare, si crede possa essere significativo.[93]
Diagnosi[modifica | modifica wikitesto]
La diagnosi di emicrania si basa su segni e sintomi.[5] Esami di imaging biomedico sono occasionalmente eseguiti per escludere altre cause del mal di testa.[5] Si ritiene che in un numero considerevole di persone la condizione non venga diagnosticata.[5]
La diagnosi di emicrania senza aura, secondo l'International Headache Society, può essere fatta in base ai seguenti criteri, i "criteri 5, 4, 3, 2, 1":[3]
- cinque o più attacchi; per l'emicrania con aura, due attacchi sono sufficienti per la diagnosi,
- quattro ore di durata per tre giorni,
- due o più dei seguenti elementi:
- dolore unilaterale (che colpisce la metà della testa),
- dolore pulsante,
- intensità del dolore da moderato a grave,
- aggravamento causato da attività fisica di routine,
- uno o più dei seguenti segni:
Se qualcuno sperimenta due dei seguenti elementi: fotofobia, nausea o incapacità di lavorare o studiare per un giorno, la diagnosi è più probabile.[94] In coloro con quattro su cinque dei seguenti aspetti: mal di testa pulsante, durata da 4 a 72 ore, dolore su un lato della testa, nausea o sintomi che interferiscono con la vita della persona; la probabilità di diagnosticare l'emicrania è del 92%.[36] In quelli con meno di tre di questi sintomi la probabilità è invece del 17%.[36]
L'ecodoppler transcranico permette di evidenziare la presenza di bolle di aria nelle arterie cerebrali. Non sono del tutto noti i meccanismi di interazione fra cuore e cervello, in particolare fra forame ovale cardiaco pervio e emicrania con aura[95][96], tuttavia da una review sistematica è emersa una significativa correlazione fra le due condizioni cliniche, dal punto di vista sia funzionale, sia anatomico.[97]
Classificazione[modifica | modifica wikitesto]
Le emicranie sono state classificate complessivamente nel 1988.[37] L'International Headache Society nel 2004 ha aggiornato la classificazione delle cefalee.[3] Secondo questa classificazione, le emicranie sono cefalee primarie insieme, tra le altre, alla cefalea di tipo tensivo e alla cefalea a grappolo.[59]
Le emicranie sono divisi in sette sottoclassi (alcuni dei quali comprendere ulteriori suddivisioni).
- L'emicrania senza aura o "emicrania comune" comporta che l'emicrania non sia accompagnata da una aura.
- L'emicrania con aura o "emicrania classica" di solito comporta emicranie accompagnate da aura. Meno comunemente, una aura può avvenire senza un mal di testa, o con un mal di testa non emicranico. Le altre due tipologie sono l'emicrania emiplegica familiare e l'emicrania emiplegica sporadica, in cui una persona ha l'emicrania con aura e debolezza motoria. Se un parente stretto ha avuto la stessa condizione, l'emicrania si chiama "familiare", altrimenti si chiama "sporadica". Un'altra varietà è l'emicrania di tipo basilare, in cui il mal di testa e l'aura sono accompagnate da difficoltà di parola, acufene o una serie di altri sintomi correlati al tronco cerebrale ma senza debolezza motoria. Si ritiene che questo tipo sia dovuto a spasmi dell'arteria basilare, l'arteria che alimenta, appunto, il tronco cerebrale.[49]
- Sindromi periodiche dell'infanzia che possono esser possibili precursori comuni dell'emicrania includono: vomito ciclico (occasionali e intensi periodi di vomito), emicrania addominale (dolore addominale, di solito accompagnato da nausea) e vertigine parossistica benigna dell'infanzia (attacchi occasionali di vertigini).
- L'emicrania oftalmica comporta un'emicrania accompagnata da disturbi visivi o addirittura da cecità temporanea a un occhio.
- Le complicanze dell'emicrania comprendono l'emicrania e/o le aure che sono insolitamente lunghe o insolitamente frequenti o associate a una lesione cerebrale.
- Una probabile emicrania descrive le condizioni che hanno alcune caratteristiche in comune con l'emicrania, ma dove non vi sono prove sufficienti per diagnosticarla con certezza.
- L'emicrania cronica è una complicanza dell'emicrania ed è un mal di testa che soddisfa i criteri diagnostici per l'emicrania e si verifica per un intervallo di tempo maggiore.[98]
Emicrania addominale[modifica | modifica wikitesto]
La diagnosi di emicrania addominale è controversa.[99] Alcune evidenze indicano che gli episodi ricorrenti di dolore addominale in assenza di un mal di testa possono essere classificate come un tipo di emicrania[99][100] o almeno come un precursore dell'emicrania.[37] Questi episodi di dolore possono o non possono seguire una emicrania e durano da minuti a ore.[99] Spesso si verificano in coloro che hanno una storia personale o familiare di emicrania tipica.[99] Altre sindromi che si ritiene possano essere precursori includono: sindrome del vomito ciclico e vertigine parossistica benigna dell'infanzia.[37]
La diagnosi differenziale[modifica | modifica wikitesto]
Esistono altre condizioni mediche che possono causare sintomi simili a un attacco di emicrania.[36]
- L'emorragia subaracnoidea ha un esordio molto più veloce e si manifesta inizialmente con un forte episodio di cefalea.
- La cefalea a grappolo, confondibile per via del dolore unilaterale e periodicale, si differenzia per la durata degli stessi attacchi (molto più breve) e per l'età di prima manifestazione (più adulta).
- L'arterite temporale può essere sospetta se l'età di manifestazione della cefalea è nei soggetti anziani, ma la VES risulta alterata, al contrario che in casi di emicrania.
- La sinusite porta a una cefalea che si manifesta in modo molto simile a quella dell'emicrania, anche se alcune manifestazioni tipiche, come febbre e rinorrea, la differenziano.
- L'ictus cerebrale.
- Il glaucoma acuto è associato a problemi di visione.
- La meningite è associata a febbre.
- La cefalea di tipo tensivo si verifica in genere da entrambe le parti, ma non è martellante e generalmente risulta meno invalidante.
Qualora si sospettino queste patologie può essere necessario procedere ad accertamenti diagnostici come la tomografia computerizzata o la risonanza magnetica.[101]
Prevenzione[modifica | modifica wikitesto]
I trattamenti preventivi per l'emicrania sono: farmaci, integratori alimentari, modifiche nello stile di vita e la chirurgia. La prevenzione è raccomandata in coloro che hanno mal di testa per più di due giorni alla settimana, non possono tollerare i farmaci usati per il trattamento di attacchi acuti o in coloro con attacchi gravi che non sono facilmente controllati.[36]
L'obiettivo è di ridurre la frequenza, il dolore, e/o la durata dell'emicrania e di aumentare l'efficacia della terapia.[102] Un altro motivo per effettuare la prevenzione è di evitare l'emicrania da abuso di farmaci. Questo è un problema comune e può portare a sviluppare cefalea cronica quotidiana.[103][104]
Trattamento farmacologico[modifica | modifica wikitesto]
I farmaci preventivi contro l'emicrania sono considerati efficaci se riducono la frequenza o la gravità degli attacchi di almeno il 50%.[105] Gli studi sono abbastanza coerenti nel consigliare il topiramato, il valproato, il propranololo e il metoprololo.[106] Il timololo è efficace anche per la prevenzione dell'emicrania e nel ridurre la frequenza e la gravità degli attacchi e la gravità, mentre il frovatriptan è efficace per la prevenzione dell'emicrania mestruale.[106]
L'amitriptilina e la venlafaxina sono anch'esse efficaci.[107] Secondo una review sistematica, gli ACE-inibitore e l'antagonista del recettore per l'angiotensina II possono ridurre gli attacchi.[108] La tossina botulinica è stata trovata essere utile in coloro che lamentano emicrania cronica, ma non in quelli con emicrania episodica.[109]
Riassumendo, i farmaci a scopo preventivo, con la loro posologia, possono essere:
- amitriptilina, in monosomministrazione serale di 25–100 mg, indicata qualora coesista una cefalea tensiva, depressione, ansia, insonnia, controindicata nei soggetti con glaucoma e iperplasia prostatica,
- betabloccanti, quali propranololo, metoprololo, atenololo, indicati qualora coesistano ipertensione e tachicardia, controindicati nella depressione, nell'asma in acuzie,
- antistaminici, quali la flunarizina (5–10 mg) e la cinarizina (75–150 mg), indicati qualora coesistano ansia ed insonnia e controindicati in casi di depressione ed obesità,
- acido valproico, da 500 a 1500 mg, richiede dosaggio plasmatico, indicato in pazienti resistenti a terapie tradizionali, controindicato in soggetti con diatesi emorragica e problemi epatici,
- topiramato,[110][111] 200–400 mg.
Terapie alternative[modifica | modifica wikitesto]
Petasites hybridus (farfaraccio) estratto di radice si è dimostrato efficace nella prevenzione dell'emicrania.[112]
Mentre l'agopuntura può risultare efficace, "la vera" agopuntura non fornisce migliori risultati dell'"agopuntura sham", una pratica in cui gli aghi vengono inseriti in modo casuale.[113] Entrambe possono essere più efficaci delle cure di routine, con meno effetti avversi rispetto ai farmaci preventivi.[74] La manipolazione chiropratica, la fisioterapia, i massaggi e il relax potrebbero essere efficaci come il propranololo o il topiramato nella prevenzione del mal di testa, tuttavia gli studi al riguardo hanno presentato dei problemi metodologici.[114]
Dimostrazioni a sostegno della manipolazione vertebrale sono scarse e insufficienti per consigliarne il ricorso.[115] Vi è qualche evidenza sperimentale di beneficio con il magnesio,[116] con il coenzima Q (10),[116] con la riboflavina,[116] con la vitamina B[117] e con il Partenio anche se i dati sono limitati e vi è la necessità di ulteriori studi migliori per raggiungere conclusioni definitive.[118] Tra le medicine alternative, il farfaraccio ha la migliore evidenza per sostenerne il suo uso.[119]
Dispositivi e chirurgia[modifica | modifica wikitesto]
Dispositivi medici, come il biofeedback e i neurostimolatori, presentano alcuni vantaggi nella prevenzione dell'emicrania, soprattutto quando i farmaci comuni sono controindicati o in caso di un loro uso eccessivo. Il biofeedback aiuta le persone a essere consapevoli di alcuni parametri fisiologici in modo da controllarli e cercare di rilassarsi. Ciò può risultare efficace per il trattamento dell'emicrania.[120][121] La neurostimolazione usa neurostimolatori impiantabili simili a pacemaker per il trattamento dell'emicrania cronica non gestibile con risultati, per i casi gravi, incoraggianti.[122][123] Il ricorso alla chirurgia comporta la decompressione di alcuni nervi intorno alla testa e al collo; essa può essere un'opzione in alcune persone che non migliorano con il trattamento farmacologico.[124]
Gestione[modifica | modifica wikitesto]
Vi sono tre aspetti principali riguardo al trattamento dell'emicrania: evitare che si instauri, il controllo dei sintomi acuti e la prevenzione farmacologica.[5] I farmaci sono più efficaci se usati precedentemente a un attacco.[5] L'uso frequente di farmaci può causare emicrania da uso eccessivo di farmaci, in cui il mal di testa diventa più grave e più frequente.[3] Ciò può avvenire soprattutto con i triptani, l'ergotamina e gli analgesici narcotici.[3]
Analgesici[modifica | modifica wikitesto]

Il trattamento iniziale raccomandato a coloro che soffrono di sintomi che vanno da lievi a moderati è rappresentato dall'assunzione di semplici analgesici come i farmaci anti-infiammatori non steroidei (FANS) o la combinazione di paracetamolo, acido acetilsalicilico e caffeina.[36] Un certo numero di FANS vantano l'esistenza di prove che ne sostengono il loro utilizzo. L'ibuprofene è stato trovato in grado di fornire un efficace sollievo dal dolore in circa la metà delle persone[125] e anche il diclofenac è stato trovato efficace.[126]
L'aspirina può alleviare il dolore di un'emicrania classificata come da moderata a grave, con una efficacia simile al sumatriptan.[127] Il ketorolac è disponibile in una formulazione endovenosa.[36] Il paracetamolo (noto anche come acetaminofene), da solo o in combinazione con il metoclopramide, è un altro farmaco efficace con un basso rischio di effetti avversi.[128] Durante la gravidanza, il paracetamolo e la metoclopramide sono considerati sicuri come lo sono i FANS fino al terzo trimestre di gestazione.[36]
Tra questi trovano impiego:
- acido acetilsalicilico,[129] 500–1000 mg
- naprossene,[130] 550–1100 mg
- ibuprofene,[131] 600–1200 mg
- paracetamolo,[132] 500–1000 mg
- formulazioni che comprendano paracetamolo, acido acetilsalicilico e caffeina,[133]
- diclofenac,[134] 50–100 mg
- ketoprofene,[135] 50 mg.
Triptani[modifica | modifica wikitesto]
Triptani, come il sumatriptan, sono efficaci sia per il dolore che per la nausea, in più del 75% delle persone.[5][136] Essi sono i trattamenti inizialmente raccomandati per coloro che presentano un dolore da moderato a grave o per quelli con sintomi più lievi che non rispondono agli analgesici semplici.[36] Le diverse forme disponibili includono quella orale, quella iniettabile, gli spray nasali e le compresse di dissoluzione orale.[5]
In generale, tutti i triptani sembrano ugualmente efficaci, con effetti collaterali simili. Tuttavia, gli individui possono rispondere meglio a quelli specifici.[36] La maggior parte degli effetti indesiderati sono lievi, come le vampate di calore. Tuttavia, si sono registrati rari casi di ischemia miocardica.[5] Essi sono pertanto non raccomandati per le persone con malattie cardiovascolari,[36] che hanno avuto un ictus o che presentano emicranie non accompagnate da problemi neurologici.[137] Inoltre, i triptani devono essere prescritti con cautela in coloro con fattori di rischio per malattie vascolari.[137]
Anche se storicamente non sono raccomandati nei pazienti con emicrania basilare, non vi è alcuna prova specifica di danni derivanti dal loro uso in questa popolazione che giustifichino l'adozione di questa cautela.[49] Essi non creano dipendenza, ma possono causare mal di testa da uso eccessivo di farmaci, se usati più di 10 giorni al mese.[138]
I triptani esplicano la loro azione attraverso la stimolazione dei recettori serotoninergici 5-HT1B e 5-HT1D. Tra questi, i più frequentemente usati sono
- Sumatriptan,[130][139] iniezioni sottocutanee da 6 mg o spray nasali da 20 mg
- Rizatriptan,[140][141] compresse orosolubili da 10 mg
- Zolmitriptan,[142] compresse orosolubili da 2.5 mg
Benché questi farmaci siano rapidi ed efficaci presentano alcuni tipici effetti collaterali quali arrossamento della cute, parestesie (soprattutto il sumatriptan) e senso di costrizione toracica. Nella fase acuta possono inoltre essere utili alcuni presidi farmacologici atti a prevenire il vomito e limitare la nausea, quali la proclorperazina[143] e la metoclopramide.[144]
Ergotamina[modifica | modifica wikitesto]
L'ergotamina e la diidroergotamina sono i farmaci più vecchi che vengono ancora prescritti per l'emicrania.[5] Essi sembrano ugualmente efficaci rispetto ai triptani,[145] sono meno costosi[146] e gli effetti negativi sono solitamente benigni.[147] Nei casi più debilitanti, essi sembrano essere l'opzione di trattamento più efficace.[147]
Altro[modifica | modifica wikitesto]
L'assunzione di metoclopramide per via endovenosa o la lidocaina intranasale sono altre opzioni possibili.[36] Il metoclopramide è il trattamento raccomandato per coloro che si presentano al pronto soccorso.[36] Una singola dose di desametasone per via endovenosa, quando aggiunta alla terapia standard di un attacco di emicrania, è associata a una diminuzione del 26% nella cefalea ricorrente nelle seguenti 72 ore.[148] La manipolazione spinale per il trattamento di un attacco di emicrania non è supportata da prove.[149] Si consiglia di non ricorrere a oppioidi e barbiturici.[36]
Prognosi[modifica | modifica wikitesto]
La prognosi a lungo termine per le persone con emicrania è variabile.[34] La maggior parte degli individui che ne soffre sperimenta periodi di perdita di capacità produttive,[5] tuttavia in genere la condizione è considerata fondamentalmente benigna[34] e non è associata a un aumento del rischio di morte.[150] Vi sono quattro principali scenari della malattia: sintomi che si risolvono completamente, sintomi che continuano ma vanno incontro a un graduale miglioramento, sintomi che continuano con la stessa frequenza e gravità o attacchi che possono peggiorare e diventare più frequenti.[34]
L'emicrania con aura sembra essere un fattore di rischio per l'ictus ischemico[151] raddoppiandone la probabilità di insorgenza.[152] Essere un adolescente, essere una donna, utilizzare un contraccettivo ormonale e fumare aumentano ulteriormente questo rischio.[151] Sembra che vi sia anche una correlazione con la dissecazione dell'arteria vertebrale.[153] L'emicrania senza aura non sembra essere un fattore di rischio per tali gravi patologie.[154] La correlazione con le malattie cardiache è inconcludente con un unico studio che la supporta.[151] Nel complesso però la semplice emicrania non sembra aumentare il rischio di morte per ictus o malattie cardiache.[150] La terapia preventiva dell'emicrania nei pazienti con emicrania con aura può prevenire gli ictus associati.[155]
Società e cultura[modifica | modifica wikitesto]
Le emicranie costituiscono una significativa causa sia di spese mediche che di perdita di produttività. È stato stimato che esse rappresentino il disturbo neurologico più costoso nella Comunità europea, con una spesa stimata maggiore di € 27 000 000 000 all'anno.[156] Negli Stati Uniti i costi diretti sono stati stimati in 17 miliardi di dollari;[157] quasi un decimo di questa cifra è dovuto all'acquisto dei triptani.[157] I costi indiretti ammontano a circa 15 miliardi di dollari, di cui la perdita di produttività è il maggiore componente.[157] Gli impatti negativi si hanno frequentemente anche a livello famigliare.[156]
Ricerca[modifica | modifica wikitesto]
È stato identificato un ruolo del peptide correlato al gene della calcitonina (CGRPs) nella patogenesi del dolore associato all'emicrania.[36] Gli antagonisti del recettore CGRP, come l'olcegepant e il telcagepant, sono stati studiati in vitro e in studi clinici per il trattamento dell'emicrania.[158] Nel 2011, tuttavia, Merck ha interrotto gli studi clinici di fase III per il proprio farmaco sperimentale telcagepant.[159][160] Anche la stimolazione magnetica transcranica si è dimostrata come una terapia promettente.[36]
Note[modifica | modifica wikitesto]
- ^ (EN) Henry Liddell e Robert Scott, ἡμικρανία, in A Greek-English Lexicon, 1940.
- ^ Kenneth Anderson, Lois E. Anderson e Walter D. Glanze, Mosby's Medical, Nursing, and Allied Health Dictionary, 4ª ed., Mosby, 1994, p. 998, ISBN 978-0-8151-6111-0.
- ^ a b c d e f g h Headache Classification Subcommittee of the International Headache Society, The International Classification of Headache Disorders: 2nd edition, in Cephalalgia, vol. 24, Suppl 1, 2004, pp. 9-160, DOI:10.1111/j.1468-2982.2004.00653.x, PMID 14979299. (PDF) come PDF
- ^ a b c M Piane, Lulli, P; Farinelli, I; Simeoni, S; De Filippis, S; Patacchioli, FR; Martelletti, P, Genetics of migraine and pharmacogenomics: some considerations, in The journal of headache and pain, vol. 8, n. 6, dicembre 2007, pp. 334-339, DOI:10.1007/s10194-007-0427-2, PMC 2779399, PMID 18058067.
- ^ a b c d e f g h i j k l m n o p q r s t Bartleson JD, Cutrer FM, Migraine update. Diagnosis and treatment, in Minn Med, vol. 93, n. 5, maggio 2010, pp. 36-41, PMID 20572569.
- ^ a b Lay CL, Broner SW, Migraine in women, in Neurologic Clinics, vol. 27, n. 2, maggio 2009, pp. 503-511, DOI:10.1016/j.ncl.2009.01.002, PMID 19289228.
- ^ a b Stovner LJ, Zwart JA, Hagen K, Terwindt GM, Pascual J, Epidemiology of headache in Europe, in European Journal of Neurology, vol. 13, n. 4, aprile 2006, pp. 333-345, DOI:10.1111/j.1468-1331.2006.01184.x, PMID 16643310.
- ^ Dodick DW, Gargus JJ, Why migraines strike, in Sci. Am., vol. 299, n. 2, agosto 2008, pp. 56-63, Bibcode:2008SciAm.299b..56D, DOI:10.1038/scientificamerican0808-56, PMID 18666680.
- ^ Karenberg A., Leitz C., Headache in magical and medical papyri of ancient Egypt, in Cephalalgia., vol. 21, novembre 2001, pp. 911-6.
- ^ a b Neil Miller, Walsh and Hoyt's clinical neuro-ophthalmology., 6ª ed., Philadelphia, Pa., Lippincott Williams & Wilkins, 2005, p. 1275, ISBN 978-0-7817-4811-7.
- ^ a b c David Borsook, The migraine, brain: imaging, structure, and function, New York, Oxford University Press, 2012, pp. 3-11, ISBN 978-0-19-975456-4.
- ^ Gennaro Bussone, Vincenzo Bonavita, Le cefalee: manuale teorico-pratico p.4, Springer, 2007, ISBN 978-88-470-0753-6.
- ^ a b Steven D. Waldman, Pain management, 2ª ed., Philadelphia, PA, Elsevier/Saunders, 2011, pp. 2122-2124, ISBN 978-1-4377-3603-8.
- ^ Koehler PJ,, van de Wiel TW., Aretaeus on migraine and headache., in J Hist Neurosci., vol. 10, 2001, pp. 253-61.
- ^ Mauro Pini, Aspetti psicopatologici delle cefalee primarie. Teorie, metodi e risultati della ricerca p. 15, FrancoAngeli, 2006, ISBN 978-88-464-7795-8.
- ^ Abokrysha N., Ibn Sina (Avicenna) on pathogenesis of migraine compared with the recent theories., in Headache., vol. 49, 2009, pp. 923-927.
- ^ Sabina Flanagan, Hildegard of Bingen, 1098-1179: a visionary life, 2ª ed., Routledge, 1998, pp. 191-196, ISBN 978-0-415-18551-6.
- ^ Margaret Cox, Simon Mays, Human osteology: in archaeology and forensic science, Repr., Cambridge, Cambridge University Press, 2002, p. 345, ISBN 978-0-521-69146-8.
- ^ Chaim Colen, Neurosurgery, Colen Publishing, 2008, p. 1, ISBN 978-1-935345-03-9.
- ^ Britt Talley Daniel, Migraine, Bloomington, IN, AuthorHouse, 2010, p. 101, ISBN 978-1-4490-6962-9.
- ^ (EN) Graham JR, Wolff HG, Mechanism of migraine headache and action of ergotamine tartrate, in Arch Neurol Psychiatry, vol. 4, n. 39, aprile 1938, pp. 737-763, DOI:10.1001/archneurpsyc.1938.02270040093005.
- ^ a b c David W. Dodick e J. Jay Gargus, Perché colpisce l'emicrania, su "Le Scienze (Scientific American)", n. 482, ottobre 2008, pp. 76-83.
- ^ a b T Vos, AD Flaxman, M Naghavi, R Lozano, C Michaud, M Ezzati, K Shibuya, JA Salomon e S Abdalla, Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010, in Lancet, vol. 380, n. 9859, 15 dicembre 2012, pp. 2163-2196, DOI:10.1016/S0140-6736(12)61729-2, PMID 23245607.
- ^ a b Houinato D., Adoukonou T., Ntsiba F., Adjien C., Avode D.G., Preux P.M., Prevalence of migraine in a rural community in south Benin., in Cephalalgia., marzo 2009, pp. ..
- ^ Stewart WF, Lipton R.B. Liberman J., Variation in migraine prevalence by race, in Neurology, vol. 47, luglio 1996, pp. 52-59.
- ^ a b c d The Headaches, pp. 246-47
- ^ Wang SJ, Epidemiology of migraine and other types of headache in Asia, in Curr Neurol Neurosci Rep, vol. 3, n. 2, 2003, pp. 104-108, DOI:10.1007/s11910-003-0060-7, PMID 12583837.
- ^ JL Natoli, Manack, A; Dean, B; Butler, Q; Turkel, CC; Stovner, L; Lipton, RB, Global prevalence of chronic migraine: a systematic review, in Cephalalgia : an international journal of headache, vol. 30, n. 5, maggio 2010, pp. 599-609, DOI:10.1111/j.1468-2982.2009.01941.x, PMID 19614702.
- ^ a b AD Hershey, Current approaches to the diagnosis and management of pediatric migraine, in Lancet neurology, vol. 9, n. 2, febbraio 2010, pp. 190-204, DOI:10.1016/S1474-4422(09)70303-5, PMID 20129168.
- ^ a b RE Nappi, Sances, G; Detaddei, S; Ornati, A; Chiovato, L; Polatti, F, Hormonal management of migraine at menopause, in Menopause international, vol. 15, n. 2, 2009 Jun, pp. 82-86, DOI:10.1258/mi.2009.009022, PMID 19465675.
- ^ a b Joseph I. Sirven, Barbara L. Malamut, Clinical neurology of the older adult, 2ª ed., Philadelphia, Wolters Kluwer Health/Lippincott Williams & Wilkins, 2008, p. 197, ISBN 978-0-7817-6947-1.
- ^ Stovner LJ, Andree C., Prevalence of headache in Europe: a review for the Eurolight project. (PDF), in J Headache Pain, 16 maggio 2010, DOI:10.1007/s10194-010-0217-0, PMID 20473702. URL consultato il 1º settembre 2021 (archiviato dall'url originale il 12 maggio 2016).
- ^ Emicrania, se la conosci...la curi, in Orizzonte Salute, n. 31, Teva Pharmaceutical Industries, Ottobre/Dicembre 2023, p. 12.
- ^ a b c d ME Bigal, Lipton, RB, The prognosis of migraine, in Current Opinion in Neurology, vol. 21, n. 3, giugno 2008, pp. 301-308, DOI:10.1097/WCO.0b013e328300c6f5, PMID 18451714.
- ^ Sharon A. Gutman, Quick reference neuroscience for rehabilitation professionals : the essential neurologic principles underlying rehabilitation practice, 2ª ed., Thorofare, NJ, SLACK, 2008, p. 231, ISBN 978-1-55642-800-5.
- ^ a b c d e f g h i j k l m n o p B Gilmore, Michael, M, Treatment of acute migraine headache, in American family physician, vol. 83, n. 3, 1º febbraio 2011, pp. 271-280, PMID 21302868.
- ^ a b c d e The Headaches, Pg 232-233
- ^ Olesen, 512, 2006.
- ^ a b [edited by] D. Joanne Lynn, Herbert B. Newton, Alexander D. Rae-Grant, The 5-minute neurology consult, Philadelphia, Lippincott Williams & Wilkins, 2004, p. 26, ISBN 978-0-683-30723-8.
- ^ a b c d e f g h i Roger P. Simon, David A. Greenberg e Michael J. Aminoff, Clinical Neurology, 7ª ed., New York, Lange Medical Books/McGraw-Hill, 2009, pp. 85-88, ISBN 978-0-07-166433-2.
- ^ MG Buzzi, Cologno, D; Formisano, R; Rossi, P, Prodromes and the early phase of the migraine attack: therapeutic relevance, in Functional neurology, vol. 20, n. 4, ottobre-dicembre 2005, pp. 179-183, PMID 16483458.
- ^ P Rossi, Ambrosini, A; Buzzi, MG, Prodromes and predictors of migraine attack, in Functional neurology, vol. 20, n. 4, ottobre-dicembre 2005, pp. 185-191, PMID 16483459.
- ^ Allan H. Ropper e Martin A. Samuels, Adams and Victor's Principles of Neurology, 9ª ed., New York, McGraw-Hill Medical, 2009, pp. Capitolo 10, ISBN 978-0-07-149992-7.
- ^ a b c Tintinalli, Judith E., Emergency Medicine: A Comprehensive Study Guide (Emergency Medicine (Tintinalli)), New York, McGraw-Hill Companies, 2010, pp. 1116-1117, ISBN 0-07-148480-9.
- ^ a b c d e f g h i j k The Headaches, pp.407-19
- ^ edited by Stewart J. Tepper, Deborah E. Tepper, The Cleveland Clinic manual of headache therapy, New York, Springer, 1º gennaio 2011, p. 6, ISBN 978-1-4614-0178-0.
- ^ ME Bigal, Arruda, MA, Migraine in the pediatric population – evolving concepts, in Headache, vol. 50, n. 7, luglio 2010, pp. 1130-1143, DOI:10.1111/j.1526-4610.2010.01717.x, PMID 20572878.
- ^ edited by Stephen D. Silberstein, Richard B. Lipton, Donald J. Dalessio, Wolff's headache and other head pain, 7ª ed., Oxford, Oxford University Press, 2001, p. 122, ISBN 978-0-19-513518-3.
- ^ a b c RG Kaniecki, Basilar-type migraine, in Current pain and headache reports, vol. 13, n. 3, giugno 2009, pp. 217-20, DOI:10.1007/s11916-009-0036-7, PMID 19457282.
- ^ a b edited by Robert P. Lisak ... [et al.] ; foreword by John Walton, International neurology : a clinical approach, Chichester, UK, Wiley-Blackwell, 2009, p. 670, ISBN 978-1-4051-5738-4.
- ^ a b edited by Joel S. Glaser; with 20 contributors, Neuro-ophthalmology, 3ª ed., Philadelphia, Lippincott Williams & Wilkins, 1999, p. 555, ISBN 978-0-7817-1729-8.
- ^ Kelman L, The postdrome of the acute migraine attack, in Cephalalgia, vol. 26, n. 2, febbraio 2006, pp. 214-220, DOI:10.1111/j.1468-2982.2005.01026.x, PMID 16426278.
- ^ Halpern, Audrey L.; Silberstein, Stephen D., Capitolo 9: Migraine and Epilepsy, in Kaplan PW, Fisher RS (a cura di), Imitators of Epilepsy, 2ª ed., New York, Demos Medical, 2005, ISBN 1-888799-83-8.
- ^ Robbins MS, Lipton RB, The epidemiology of primary headache disorders, in Semin Neurol, vol. 30, n. 2, aprile 2010, pp. 107-119, DOI:10.1055/s-0030-1249220, PMID 20352581.
- ^ a b c The Headaches, pp. 238-40
- ^ M Schürks, Genetics of migraine in the age of genome-wide association studies, in The journal of headache and pain, vol. 13, n. 1, gennaio 2012, pp. 1-9, DOI:10.1007/s10194-011-0399-0, PMC 3253157, PMID 22072275.
- ^ B de Vries, Frants, RR; Ferrari, MD; van den Maagdenberg, AM, Molecular genetics of migraine, in Human Genetics, vol. 126, n. 1, luglio 2009, pp. 115-132, DOI:10.1007/s00439-009-0684-z, PMID 19455354.
- ^ P Montagna, Migraine genetics, in Expert Review of Neurotherapeutics, vol. 8, n. 9, settembre 2008, pp. 1321-1330, DOI:10.1586/14737175.8.9.1321, PMID 18759544.
- ^ a b c d A Ducros, [Genetics of migraine.], in Revue neurologique, vol. 169, n. 5, 22 aprile 2013, pp. 360-371, DOI:10.1016/j.neurol.2012.11.010, PMID 23618705.
- ^ Stephen L. Hauser, Harrison: Neurologia clinica p. 60, Casarile (Milano), McGraw-Hill, 2007, ISBN 978-88-386-3923-4.
- ^ K Cortese, E Tagliatti, MC Gagliani, M Frascio, D Zarcone e E Raposio, Ultrastructural imaging reveals vascular remodeling in migraine patients, in Histochem Cell Biol, 2022, DOI:10.1007/s00418-021-02066-w.
- ^ a b c Levy D, Strassman AM, Burstein R, A critical view on the role of migraine triggers in the genesis of migraine pain, in Headache, vol. 49, n. 6, giugno 2009, pp. 953-957, DOI:10.1111/j.1526-4610.2009.01444.x, PMID 19545256.
- ^ Martin PR, Behavioral management of migraine headache triggers: learning to cope with triggers, in Curr Pain Headache Rep, vol. 14, n. 3, giugno 2010, pp. 221-227, DOI:10.1007/s11916-010-0112-z, PMID 20425190.
- ^ MedlinePlus medical encyclopedia D Kantor, MedlinePlus Medical Encyclopedia: Migraine, su nlm.nih.gov, 21 novembre 2006. URL consultato il 4 aprile 2008.
- ^ EA MacGregor, Prevention and treatment of menstrual migraine, in Drugs, vol. 70, n. 14, 1º ottobre 2010, pp. 1799-1818, DOI:10.2165/11538090-000000000-00000, PMID 20836574.
- ^ CL Lay, Broner, SW, Migraine in women, in Neurologic Clinics, vol. 27, n. 2, maggio 2009, pp. 503-511, DOI:10.1016/j.ncl.2009.01.002, PMID 19289228.
- ^ FC Rockett, de Oliveira, VR; Castro, K; Chaves, ML; Perla Ada, S; Perry, ID, Dietary aspects of migraine trigger factors, in Nutrition Reviews, vol. 70, n. 6, giugno 2012, pp. 337-356, DOI:10.1111/j.1753-4887.2012.00468.x, PMID 22646127.
- ^ a b c (DE) Holzhammer J, Wöber C, [Alimentary trigger factors that provoke migraine and tension-type headache], in Schmerz, vol. 20, n. 2, aprile 2006, pp. 151-159, DOI:10.1007/s00482-005-0390-2, PMID 15806385.
- ^ Jansen SC, van Dusseldorp M, Bottema KC, Dubois AE, Intolerance to dietary biogenic amines: a review, in Annals of Allergy, Asthma & Immunology, vol. 91, n. 3, settembre 2003, pp. 233-240; quiz 241-2, 296, DOI:10.1016/S1081-1206(10)63523-5, PMID 14533654. URL consultato il 9 luglio 2010 (archiviato dall'url originale il 26 febbraio 2007).
- ^ Sun-Edelstein C, Mauskop A, Foods and supplements in the management of migraine headaches, in The Clinical Journal of Pain, vol. 25, n. 5, giugno 2009, pp. 446-452, DOI:10.1097/AJP.0b013e31819a6f65, PMID 19454881.
- ^ Freeman M, Reconsidering the effects of monosodium glutamate: a literature review, in J Am Acad Nurse Pract, vol. 18, n. 10, ottobre 2006, pp. 482-486, DOI:10.1111/j.1745-7599.2006.00160.x, PMID 16999713.
- ^ link title Migraine Linked to Celiac Disease
- ^ Migraine Headaches: Gluten Triggers Severe Headaches in Sensitive Individuals
- ^ a b Sun-Edelstein C, Mauskop A., Foods and supplements in the management of migraine headaches., in Clin J Pain, vol. 25, n. 5, giugno 2009, pp. 446-52, PMID 19454881.
- ^ Lipton RB, Newman LC, Cohen JS, Solomon S., Aspartame as a dietary trigger of headache, in Headache, vol. 29, n. 2, febbraio 1989, pp. 90-2, PMID 2708042.
- ^ Millichap JG, Yee MM, The diet factor in pediatric and adolescent migraine., in Pediatr Neurol, vol. 28, n. 1, gennaio 2003, pp. 9-15, PMID 12657413.
- ^ Sun-Edelstein C, Mauskop A, Foods and supplements in the management of migraine headaches, in The Clinical Journal of Pain, vol. 25, n. 5, giugno 2009, pp. 446-52, DOI:10.1097/AJP.0b013e31819a6f65, PMID 19454881.
- ^ Yang WH, Drouin MA, Herbert M, Mao Y, Karsh J, The monosodium glutamate symptom complex: assessment in a double-blind, placebo-controlled, randomized study, in The Journal of Allergy and Clinical Immunology, vol. 99, 6 Pt 1, giugno 1997, pp. 757-62, DOI:10.1016/S0091-6749(97)80008-5, PMID 9215242.
- ^ Millichap JG, Yee MM, The diet factor in pediatric and adolescent migraine, in Pediatric Neurology, vol. 28, n. 1, gennaio 2003, pp. 9-15, DOI:10.1016/S0887-8994(02)00466-6, PMID 12657413.
- ^ Tarasoff L, Kelly MF, Monosodium L-glutamate: a double-blind study and review, in Food and Chemical Toxicology, vol. 31, n. 12, dicembre 1993, pp. 1019-35, DOI:10.1016/0278-6915(93)90012-N, PMID 8282275.
- ^ Un evento, una condizione o un alimento in grado di scatenare l'attacco emicranico.
- ^ Low Tyramine Headache Diet (PDF), su headaches.org, National Headache Foundation, 2004. URL consultato il 4 aprile 2008 (archiviato dall'url originale il 1º ottobre 2008).
- ^ Jansen SC, van Dusseldorp M, Bottema KC, Dubois AE, Intolerance to dietary biogenic amines: a review, in Annals of Allergy, Asthma & Immunology, vol. 91, n. 3, settembre 2003, pp. 233-40; quiz 241-2, 296, PMID 14533654. URL consultato il 9 luglio 2010 (archiviato dall'url originale il 26 febbraio 2007).
- ^ Health Central: Dehydration as a migraine trigger, su healthcentral.com. URL consultato il 24 giugno 2010.
- ^ Karl E, Giorgio Ivani, Head Thomas C., Terapia del dolore nel bambino p. 218, SEE Editrice Firenze, 2008, ISBN 978-88-8465-022-1.
- ^ Friedman DI, De ver Dye T, Migraine and the environment, in Headache, vol. 49, n. 6, giugno 2009, pp. 941-952, DOI:10.1111/j.1526-4610.2009.01443.x, PMID 19545255.
- ^ a b The Headaches Chp. 29, Pg. 276
- ^ PJ Goadsby, The vascular theory of migraine – a great story wrecked by the facts, in Brain : a journal of neurology, vol. 132, Pt 1, gennaio 2009, pp. 6-7, DOI:10.1093/brain/awn321, PMID 19098031.
- ^ KC Brennan, Charles, A, An update on the blood vessel in migraine, in Current Opinion in Neurology, vol. 23, n. 3, giugno 2010, pp. 266-274, DOI:10.1097/WCO.0b013e32833821c1, PMID 20216215.
- ^ a b c d The Headaches, Chp. 28, pp. 269-72
- ^ a b c J Olesen, Burstein, R; Ashina, M; Tfelt-Hansen, P, Origin of pain in migraine: evidence for peripheral sensitization, in Lancet neurology, vol. 8, n. 7, luglio 2009, pp. 679-690, DOI:10.1016/S1474-4422(09)70090-0, PMID 19539239.
- ^ S Akerman, Holland, PR; Goadsby, PJ, Diencephalic and brainstem mechanisms in migraine, in Nature Reviews Neuroscience, vol. 12, n. 10, 20 settembre 2011, pp. 570-584, DOI:10.1038/nrn3057, PMID 21931334.
- ^ E Shevel, The extracranial vascular theory of migraine – a great story confirmed by the facts, in Headache, vol. 51, n. 3, marzo 2011, pp. 409-417, DOI:10.1111/j.1526-4610.2011.01844.x, PMID 21352215.
- ^ G Cousins, Hijazze, S; Van de Laar, FA; Fahey, T, Diagnostic accuracy of the ID Migraine: a systematic review and meta-analysis, in Headache, vol. 51, n. 7, 2011 Jul–Aug, pp. 1140-1148, DOI:10.1111/j.1526-4610.2011.01916.x, PMID 21649653.
- ^ R. Dobson, Nearly half of patients with migraine with aura are found to have a heart defect, study finds, in BMJ, vol. 331, n. 800, settembre 2005, p. 924, DOI:10.1136/bmj.331.7520.800-d.
- ^ Markus Schwerzmann, Bernhard Meier, Impact of Percutaneous Patent Foramen Ovale Closure on Migraine Course, in Interv Cardiol, vol. 5, n. 2, 2013, pp. 177-187.
- ^ G. Rigatelli, Migraine and patent foramen ovale: connecting flight or one-way ticket?, in Expert Rev Neurother, vol. 8, n. 9, settembre 2008, pp. 1331-7, DOI:10.1586/14737175.8.9.1331, PMID 18759545.
- ^ A Negro, Rocchietti-March, M; Fiorillo, M; Martelletti, P, Chronic migraine: current concepts and ongoing treatments, in European review for medical and pharmacological sciences, vol. 15, n. 12, dicembre 2011, pp. 1401-1420, PMID 22288302.
- ^ a b c d Robert A. Davidoff, Migraine : manifestations, pathogenesis, and management, 2ª ed., Oxford, Oxford Univ. Press, 2002, p. 81, ISBN 978-0-19-513705-7.
- ^ G Russell, Abu-Arafeh, I, Symon, DN, Abdominal migraine: evidence for existence and treatment options, in Paediatric drugs, vol. 4, n. 1, 2002, pp. 1-8, PMID 11817981.
- ^ Karl E. Misulis, Head Thomas C., Neurologia di Netter p. 273, Milano, Elsevier Masson, 2008, ISBN 978-88-214-3041-1.
- ^ Modi S, Lowder DM, Medications for migraine prophylaxis, in American Family Physician, vol. 73, n. 1, gennaio 2006, pp. 72-78, PMID 16417067.
- ^ Diener HC, Limmroth V, Medication-overuse headache: a worldwide problem, in Lancet Neurology, vol. 3, n. 8, agosto 2004, pp. 475-483, DOI:10.1016/S1474-4422(04)00824-5, PMID 15261608.
- ^ Guenther Fritsche e Hans-Christoph Diener, Medication overuse headaches – what is new?, in Expert Opinion on Drug Safety, vol. 1, n. 4, 2002, pp. 331-338, DOI:10.1517/14740338.1.4.331, PMID 12904133.
- ^ Kaniecki R, Lucas S., Treatment of primary headache: preventive treatment of migraine, in Standards of care for headache diagnosis and treatment, Chicago, National Headache Foundation, 2004, pp. 40-52.
- ^ a b E Loder, Burch, R; Rizzoli, P, The 2012 AHS/AAN guidelines for prevention of episodic migraine: a summary and comparison with other recent clinical practice guidelines, in Headache, vol. 52, n. 6, giugno 2012, pp. 930-945, DOI:10.1111/j.1526-4610.2012.02185.x, PMID 22671714.
- ^ SD Silberstein, Holland, S; Freitag, F; Dodick, DW; Argoff, C; Ashman, E; Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society, Evidence-based guideline update: pharmacologic treatment for episodic migraine prevention in adults: report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society, in Neurology, vol. 78, n. 17, 24 aprile 2012, pp. 1337-1345, DOI:10.1212/WNL.0b013e3182535d20, PMC 3335452, PMID 22529202.
- ^ Shamliyan TA, Choi JY, Ramakrishnan R, Miller JB, Wang SY, Taylor FR et al., Preventive pharmacologic treatments for episodic migraine in adults., in J Gen Intern Med, vol. 28, n. 9, 2013, pp. 1225-1237, DOI:10.1007/s11606-013-2433-1, PMC PMC3744311, PMID 23592242.
- ^ Jackson JL, Kuriyama A, Hayashino Y, Botulinum toxin A for prophylactic treatment of migraine and tension headaches in adults: a meta-analysis, in JAMA, vol. 307, n. 16, aprile 2012, pp. 1736-1745, DOI:10.1001/jama.2012.505, PMID 22535858.
- ^ Malessa R, Gendolla A, Steinberg B, Schmitt L, Bornhoevd K, Djelani M, Schäuble B, Prevention of episodic migraine with topiramate: a prospective 24-week, open-label, flexible-dose clinical trial with optional 24 weeks follow-up in a community setting., in Curr Med Res Opin, vol. 26, n. 5, maggio 2010, pp. 1119-29, PMID 20464578.
- ^ Dodick DW, Freitag F, Banks J, Saper J, Xiang J, Rupnow M, Biondi D, Greenberg SJ, Hulihan J, Topiramate versus amitriptyline in migraine prevention: a 26-week, multicenter, randomized, double-blind, double-dummy, parallel-group noninferiority trial in adult migraineurs, in Clin Ther, vol. 31, n. 3, marzo 2009, pp. 542-59, PMID 19393844.
- ^ Pringsheim T, Davenport W, Mackie G, et al., Canadian Headache Society guideline for migraine prophylaxis, in Can J Neurol Sci., vol. 39, 2 Suppl 2, marzo 2012, pp. S1-59, PMID 22683887.
- ^ K Linde, G Allais, B Brinkhaus, E Manheimer, A Vickers e AR White, Acupuncture for migraine prophylaxis, in Klaus Linde (a cura di), Cochrane Database of Systematic Reviews (Online), n. 1, 2009, pp. CD001218, DOI:10.1002/14651858.CD001218.pub2, PMC 3099267, PMID 19160193.
- ^ Aleksander Chaibi, Peter J. Tuchin e Michael Bjørn Russell, Manual therapies for migraine: A systematic review, in The Journal of Headache and Pain, vol. 12, n. 2, 2011, pp. 127-133, DOI:10.1007/s10194-011-0296-6, PMC 3072494, PMID 21298314.
- ^ P Posadzki, Ernst, E, Spinal manipulations for the treatment of migraine: a systematic review of randomized clinical trials, in Cephalalgia : an international journal of headache, vol. 31, n. 8, 2011 Jun, pp. 964-970, DOI:10.1177/0333102411405226, PMID 21511952.
- ^ a b c N.N. Bray, A.A. Heath e J Militello, Migraine: Burden of disease, treatment, and prevention, in Osteopathic Family Physician, vol. 5, n. 3, maggio 2013, pp. 116-122, DOI:10.1016/j.osfp.2013.01.004.
- ^ A Bianchi, S Salomone, F Caraci, V Pizza, R Bernardini e C Damato, Role of Magnesium, Coenzyme Q10, Riboflavin, and Vitamin B12 in Migraine Prophylaxis, in Vitamins & Hormones Volume 69, Vitamins and hormones, Vitamins & Hormones, vol. 69, 2004, pp. 297-312, DOI:10.1016/S0083-6729(04)69011-X, ISBN 978-0-12-709869-2, PMID 15196887.
- ^ Juanita Rios e Megan M. Passe, Evidence-Based Use of Botanicals, Minerals, and Vitamins in the Prophylactic Treatment of Migraines, in Journal of the American Academy of Nurse Practitioners, vol. 16, n. 6, 2004, pp. 251-256, DOI:10.1111/j.1745-7599.2004.tb00447.x, PMID 15264611.
- ^ S Holland, Silberstein, SD; Freitag, F; Dodick, DW; Argoff, C; Ashman, E; Quality Standards Subcommittee of the American Academy of Neurology and the American Headache, Society, Evidence-based guideline update: NSAIDs and other complementary treatments for episodic migraine prevention in adults: report of the Quality Standards Subcommittee of the American Academy of Neurology and the American Headache Society, in Neurology, vol. 78, n. 17, 24 aprile 2012, pp. 1346-1353, DOI:10.1212/WNL.0b013e3182535d0c, PMC 3335449, PMID 22529203.
- ^ Yvonne Nestoriuc e Alexandra Martin, Efficacy of biofeedback for migraine: A meta-analysis, in Pain, vol. 128, n. 1-2, 2007, pp. 111-127, DOI:10.1016/j.pain.2006.09.007, PMID 17084028.
- ^ Y Nestoriuc, A Martin, W Rief e F Andrasik, Biofeedback treatment for headache disorders: A comprehensive efficacy review, in Applied psychophysiology and biofeedback, vol. 33, n. 3, 2008, pp. 125-140, DOI:10.1007/s10484-008-9060-3, PMID 18726688.
- ^ J Schoenen, M Allena e D Magis, Neurostimulation therapy in intractable headaches, in Handbook of clinical neurology / edited by P.J. Vinken and G.W. Bruyn, Handbook of Clinical Neurology, vol. 97, 2010, pp. 443-450, DOI:10.1016/S0072-9752(10)97037-1, ISBN 978-0-444-52139-2, PMID 20816443.
- ^ KL Reed, SB Black, 2nd Banta Cj e KR Will, Combined occipital and supraorbital neurostimulation for the treatment of chronic migraine headaches: Initial experience, in Cephalalgia, vol. 30, n. 3, 2010, pp. 260-271, DOI:10.1111/j.1468-2982.2009.01996.x, PMID 19732075.
- ^ TA Kung, Guyuron, B, Cederna, PS, Migraine surgery: a plastic surgery solution for refractory migraine headache, in Plastic and reconstructive surgery, vol. 127, n. 1, gennaio 2011, pp. 181-189, DOI:10.1097/PRS.0b013e3181f95a01, PMID 20871488.
- ^ Rabbie R, Derry S, Moore RA, McQuay HJ, Ibuprofen with or without an antiemetic for acute migraine headaches in adults, in Maura Moore (a cura di), Cochrane Database Syst Rev, vol. 10, n. 10, 2010, pp. CD008039, DOI:10.1002/14651858.CD008039.pub2, PMID 20927770.
- ^ Derry S, Rabbie R, Moore RA, Diclofenac with or without an antiemetic for acute migraine headaches in adults, in Maura Moore (a cura di), Cochrane Database Syst Rev, vol. 2, 2012, pp. CD008783, DOI:10.1002/14651858.CD008783.pub2, PMID 22336852.
- ^ Kirthi V, Derry S, Moore RA, McQuay HJ, Aspirin with or without an antiemetic for acute migraine headaches in adults, in Maura Moore (a cura di), Cochrane Database Syst Rev, vol. 4, n. 4, 2010, pp. CD008041, DOI:10.1002/14651858.CD008041.pub2, PMID 20393963.
- ^ Derry S, Moore RA, McQuay HJ, Paracetamol (acetaminophen) with or without an antiemetic for acute migraine headaches in adults, in Maura Moore (a cura di), Cochrane Database Syst Rev, vol. 11, n. 11, 2010, pp. CD008040, DOI:10.1002/14651858.CD008040.pub2, PMID 21069700.
- ^ Kirthi V, Derry S, Moore RA, McQuay HJ, Aspirin with or without an antiemetic for acute migraine headaches in adults, in Cochrane Database Syst Rev, vol. 4, 2010, pp. CD008041, DOI:10.1002/14651858.CD008041.pub2, PMID 20393963.
- ^ a b Brandes JL, Kudrow D, Stark SR, et al., Sumatriptan-naproxen for acute treatment of migraine: a randomized trial, in JAMA, vol. 297, n. 13, aprile 2007, pp. 1443-54, DOI:10.1001/jama.297.13.1443, PMID 17405970.
- ^ J. Goldstein et al, Acetaminophen, aspirin, and caffeine in combination versus ibuprofen for acute migraine: results from a multicenter, double-blind, randomized, parallel-group, single-dose, placebo-controlled study., in Headache, vol. 46, 2006, pp. 444-453, PMID 16618262.
- ^ Lipton RB, Baggish JS, Stewart WF, Codispoti JR, Fu M, Efficacy and safety of acetaminophen in the treatment of migraine: results of a randomized, double-blind, placebo-controlled, population-based study, in Archives of Internal Medicine, vol. 160, n. 22, 2000, pp. 3486-92, DOI:10.1001/archinte.160.22.3486, PMID 11112243.
- ^ Diener HC, Pfaffenrath V, Pageler L, Peil H, Aicher B, The fixed combination of acetylsalicylic acid, paracetamol and caffeine is more effective than single substances and dual combination for the treatment of headache: a multicentre, randomized, double-blind, single-dose, placebo-controlled parallel group study, in Cephalalgia, vol. 25, n. 10, ottobre 2005, pp. 776-87, DOI:10.1111/j.1468-2982.2005.00948.x, PMID 16162254. URL consultato il 1º settembre 2021 (archiviato dall'url originale il 19 aprile 2016).
- ^ Diener HC, Montagna P, Gács G, Lyczak P, Schumann G, Zöller B, Mulder LJ, Siegel J, Edson K., Efficacy and tolerability of diclofenac potassium sachets in migraine: a randomized, double-blind, cross-over study in comparison with diclofenac potassium tablets and placebo., in Cephalalgia, vol. 26, n. 5, maggio 2006, pp. 537-47, PMID 16674762.
- ^ Dib M, Massiou H, Weber M, Henry P, Garcia-Acosta S, Bousser MG, Efficacy of oral ketoprofen in acute migraine: a double-blind randomized clinical trial, in Neurology, vol. 58, n. 11, 11 giugno 2002, pp. 1660-5, PMID 12058095.
- ^ Johnston MM, Rapoport AM, Triptans for the management of migraine, in Drugs, vol. 70, n. 12, agosto 2010, pp. 1505-1518, DOI:10.2165/11537990-000000000-00000, PMID 20687618.
- ^ a b Generic migraine drug could relieve your pain and save you money, su Best Buy Drugs, Consumer Reports.
- ^ S. J. Tepper Stewart J. e Deborah E. Tepper, Breaking the cycle of medication overuse headache, in Cleveland Clinic Journal of Medicine, vol. 77, n. 4, aprile 2010, pp. 236-242, DOI:10.3949/ccjm.77a.09147, PMID 20360117.
- ^ Pierce MW., Transdermal delivery of sumatriptan for the treatment of acute migraine., in Neurotherapeutics, vol. 7, n. 2, aprile 2010, pp. 159-63, PMID 20430314.
- ^ Göbel H., Efficacy and tolerability of rizatriptan 10 mg compared with sumatriptan 100 mg: an evidence-based analysis, in Expert Rev Neurother, vol. 10, n. 4, aprile 2010, pp. 499-506, PMID 20367203.
- ^ Amoozegar F, Pringsheim T., Rizatriptan for the acute treatment of migraine: Consistency, preference, satisfaction, and quality of life., vol. 3, 3 novembre 2009, pp. 251-8, PMID 19936168.
- ^ Goadsby PJ, Massiou H, Pascual J, Diener HC, Dahlöf CG, Mateos V, Dowson AJ, Raets I, Cunha L, Färkkilä M, Manzoni GC., Almotriptan and zolmitriptan in the acute treatment of migraine., in Acta Neurol Scand, vol. 115, n. 1, gennaio 2007, pp. 34-40, PMID 17156263.
- ^ Sharma S, Prasad A, Nehru R, Anand KS, Rishi RK, Chaturvedi S, Bapna JS, Sharma DR., Efficacy and tolerability of prochlorperazine buccal tablets in treatment of acute migraine, in Headache, vol. 42, n. 9, ottobre 2002, pp. 896-902, PMID 12390617.
- ^ Azzopardi TD, Brooks NA., Oral metoclopramide as an adjunct to analgesics for the outpatient treatment of acute migraine., in Ann Pharmacother, vol. 42, n. 3, marzo 2008 Mar, pp. 397-402, PMID 18285561.
- ^ NE Kelley, Tepper, DE, Rescue therapy for acute migraine, part 1: triptans, dihydroergotamine, and magnesium, in Headache, vol. 52, n. 1, gennaio 2012, pp. 114-128, DOI:10.1111/j.1526-4610.2011.02062.x, PMID 22211870.
- ^ Olesen, 516, 2006.
- ^ a b JA Morren, Galvez-Jimenez, N, Where is dihydroergotamine mesylate in the changing landscape of migraine therapy?, in Expert opinion on pharmacotherapy, vol. 11, n. 18, dicembre 2010, pp. 3085-3093, DOI:10.1517/14656566.2010.533839, PMID 21080856.
- ^ Colman I, Friedman BW, Brown MD, G. D Innes, E. Grafstein, T. E Roberts e B. H Rowe, Parenteral dexamethasone for acute severe migraine headache: meta-analysis of randomised controlled trials for preventing recurrence, in BMJ, vol. 336, n. 7657, giugno 2008, pp. 1359-1361, DOI:10.1136/bmj.39566.806725.BE, PMC 2427093, PMID 18541610.
- ^ P Posadzki, Ernst, E, Spinal manipulations for the treatment of migraine: a systematic review of randomized clinical trials, in Cephalalgia : an international journal of headache, vol. 31, n. 8, giugno 2011, pp. 964-970, DOI:10.1177/0333102411405226, PMID 21511952.
- ^ a b M Schürks, Rist, PM; Shapiro, RE; Kurth, T, Migraine and mortality: a systematic review and meta-analysis, in Cephalalgia : an international journal of headache, vol. 31, n. 12, settembre 2011, pp. 1301-1314, DOI:10.1177/0333102411415879, PMC 3175288, PMID 21803936.
- ^ a b c M Schürks, Rist, PM; Bigal, ME; Buring, JE; Lipton, RB; Kurth, T, Migraine and cardiovascular disease: systematic review and meta-analysis, in BMJ (Clinical research ed.), vol. 339, 27 ottobre 2009, pp. b3914, DOI:10.1136/bmj.b3914, PMC 2768778, PMID 19861375.
- ^ T Kurth, Chabriat, H; Bousser, MG, Migraine and stroke: a complex association with clinical implications, in Lancet neurology, vol. 11, n. 1, gennaio 2012, pp. 92-100, DOI:10.1016/S1474-4422(11)70266-6, PMID 22172624.
- ^ PM Rist, Diener, HC; Kurth, T; Schürks, M, Migraine, migraine aura, and cervical artery dissection: a systematic review and meta-analysis, in Cephalalgia : an international journal of headache, vol. 31, n. 8, giugno 2011, pp. 886-896, DOI:10.1177/0333102411401634, PMC 3303220, PMID 21511950.
- ^ T Kurth, The association of migraine with ischemic stroke, in Current neurology and neuroscience reports, vol. 10, n. 2, marzo 2010, pp. 133-139, DOI:10.1007/s11910-010-0098-2, PMID 20425238.
- ^ J Weinberger, Stroke and migraine, in Current cardiology reports, vol. 9, n. 1, marzo 2007, pp. 13-19, DOI:10.1007/s11886-007-0004-y, PMID 17362679.
- ^ a b LJ Stovner, Andrée, C; Eurolight Steering, Committee, Impact of headache in Europe: a review for the Eurolight project, in The journal of headache and pain, vol. 9, n. 3, giugno 2008, pp. 139-146, DOI:10.1007/s10194-008-0038-6, PMC 2386850, PMID 18418547.
- ^ a b c FS Mennini, Gitto, L; Martelletti, P, Improving care through health economics analyses: cost of illness and headache, in The journal of headache and pain, vol. 9, n. 4, agosto 2008, pp. 199-206, DOI:10.1007/s10194-008-0051-9, PMC 3451939, PMID 18604472.
- ^ Tepper SJ, Stillman MJ, Clinical and preclinical rationale for CGRP-receptor antagonists in the treatment of migraine, in Headache, vol. 48, n. 8, settembre 2008, pp. 1259-1268, DOI:10.1111/j.1526-4610.2008.01214.x, PMID 18808506.
- ^ Merck & Co., Inc., SEC Annual Report, Fiscal Year Ending Dec 31, 2011 (PDF), su merck.com, SEC, 28 febbraio 2012, p. 65. URL consultato il 21 maggio 2012 (archiviato dall'url originale il 27 agosto 2013).
- ^ (EN) Position Emission Tomography Study of Brain CGRP Receptors After MK-0974 Administration (MK-0974-067 AM1), su clinicaltrials.gov. URL consultato il 26 ottobre 2013.
Bibliografia[modifica | modifica wikitesto]
Specifica[modifica | modifica wikitesto]
- (EN) David Borsook, The migraine brain: imaging, structure, and function, New York, Oxford University Press, 2012, ISBN 978-0-19-975456-4.
- (EN) edited by Stewart J. Tepper, Deborah E. Tepper, The Cleveland Clinic manual of headache therapy, New York, Springer, 2011, ISBN 978-1-4614-0178-0.
- Pini Luigi A, Sarchielli Paola, Zanchini Giorgio, Trattato italiano delle cefalee, Torino, Centro scientifico editore, 2010, ISBN 978-88-7640-644-7.
- Gennaro Bussone, Gerardo Casucci, Fabio Frediani, Gian Camillo Manzoni, Vincenzo Bonavita, Le cefalee: manuale teorico-pratico, Cremona-Segrate, Springer, 2008, ISBN 978-88-470-0753-6.
- (EN) Jes Olesen, Peer Tfelt-Hansen, K. Michael A. Welch, Peter J. Goadsby, Nabih M. Ramadan, The headaches, 3ª ed., Filadelfia, Lippincott Williams & Wilkins, 2006, p. 516, ISBN 978-0-7817-5400-2.
- Mauro Pini, Titolo Aspetti psicopatologici delle cefalee primarie. Teorie, metodi e risultati della ricerca, FrancoAngeli, 2006, ISBN 978-88-464-7795-8.
- Giuseppe Nappi, Gian Camillo Manzoni, Manuale delle cefalee, Milano, Masson, 2005, ISBN 88-214-2738-2.
- Marcello Fanciullani, Massimo Alessandri, Cefalee primarie: moderni aspetti di diagnosi e cura, Firenze, Società editrice europea, 2003, ISBN 88-8465-035-6.
- (EN) Robert A. Davidoff, Migraine: manifestations, pathogenesis, and management, 2ª ed., Oxford [u.a.], Oxford Univ. Press, 2002, ISBN 978-0-19-513705-7.
Neurologia[modifica | modifica wikitesto]
- (EN) Allan H. Ropper, Martin A. Samuels, Adams and Victor's principles of neurology, 9ª ed., New York, McGraw-Hill Medical, 2009, ISBN 978-0-07-149992-7.
- (EN) Roger P. Simon, David A. Greenberg, Michael J. Aminoff, Clinical neurology, 7ª ed., New York, N.Y, Lange Medical Books/McGraw-Hill, 2009, ISBN 978-0-07-166433-2.
- (EN) Sharon A. Gutman, Quick reference neuroscience for rehabilitation professionals: the essential neurologic principles underlying rehabilitation practice, 2ª ed., Thorofare, NJ, SLACK, 2008, ISBN 978-1-55642-800-5.
- Karl E. Misulis, Head Thomas C., Neurologia di Netter, Milano, Elsevier Masson, 2008, ISBN 978-88-214-3041-1.
- (EN) Joseph I. Sirven, Barbara L., Clinical neurology of the older adult, 2ª ed., Filadelfia, Wolters Kluwer Health/Lippincott Williams & Wilkins, 2008, ISBN 978-0-7817-6947-1.
- (EN) Chaim Colen, Neurosurgery, Colen Publishing, 2008, ISBN 978-1-935345-03-9.
- B. Bergamasco, R. Mutani, La neurologia di Bergamini, Torino, Cortina, 2007, ISBN 88-8239-120-5.
- Stephen L. Hauser, Harrison: Neurologia clinica p. 60, Casarile (Milano), McGraw-Hill, 2007, ISBN 978-88-386-3923-4.
- Allan H. Ropper, Robert H. Brown, Adams & Victor - Principi di neurologia, Milano - New York, McGraw-Hill Companies, 2006, ISBN 88-386-3909-4.
- (EN) Neil Miller, Walsh and Hoyt's clinical neuro-ophthalmology, 6ª ed., Filadelfia, Pa., Lippincott Williams & Wilkins, 2005, ISBN 978-0-7817-4811-7.
- (EN) D. Joanne Lynn, Herbert B. Newton, Alexander D., The 5-minute neurology consult, Filadelfia, Lippincott Williams & Wilkins, 2004, ISBN 978-0-683-30723-8.
- C. Loeb, E. Favale, Neurologia di Fazio Loeb, Roma, Società Editrice Universo, 2003, ISBN 88-87753-73-3.
- (EN) Stephen D. Silberstein, Richard B. Lipton, Donald J., Wolff's headache and other head pain, 7ª ed., Oxford, Oxford University Press, 2001, ISBN 978-0-19-513518-3.
Farmacologia[modifica | modifica wikitesto]
- British National Formulary, Guida all'uso dei farmaci 4 edizione, Lavis, Agenzia Italiana del Farmaco, 2007. ISBN non esistente
- Brunton, Lazo, Parker, Goodman & Gilman - Le basi farmacologiche della terapia 11/ed, McGraw Hill, 2006, ISBN 978-88-386-3911-1.
- Bertram G. Katzung, Farmacologia generale e clinica, Padova, Piccin, 2006, ISBN 88-299-1804-0.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni sull'emicrania
Wikiquote contiene citazioni sull'emicrania Wikizionario contiene il lemma di dizionario «emicrania»
Wikizionario contiene il lemma di dizionario «emicrania» Wikimedia Commons contiene immagini o altri file sull'emicrania
Wikimedia Commons contiene immagini o altri file sull'emicrania
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) William B. Young, migraine, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 42284 · LCCN (EN) sh85085064 · GND (DE) 4039179-6 · BNF (FR) cb119323583 (data) · J9U (EN, HE) 987007533693905171 · NSK (HR) 000103641 · NDL (EN, JA) 01217244 |
|---|




