Pentacloroetano
| pentacloroetano | |
|---|---|
 | |
| Nome IUPAC | |
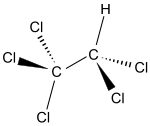
| 1,1,1,2,2-pentacloroetano[1][2][3] | |
| Nomi alternativi | |
| Pentalino, Pentacloruro di etano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2HCl5 |
| Massa molecolare (u) | 202.09[4] |
| Aspetto | liquido incolore, odore dolciastro, simile al cloroformio |
| Numero CAS | Immagine_3D |
| Numero EINECS | 200-925-1 |
| PubChem | 6419 |
| SMILES | C(C(Cl)(Cl)Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1.68 |
| Solubilità in acqua | 0.05% (20 °C) |
| Temperatura di fusione | -29 °C |
| Temperatura di ebollizione | 162 °C |
| Tensione di vapore (Pa) a 295 K | 3 mmHg (20 °C) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 302 - 351 - 372 - 411 |
| Consigli P | 201 - 273 - 301+312+330 - 308+313 |
Il Pentacloroetano è un composto chimico infiammabile e tossico formato da cloro, idrogeno e carbonio. Appartiene alla classe dei composti organici detti alogenuri alchilici. Uno dei 9 cloroetani, cioè derivati dell'etano in cui cinque dei sei idrogeni sono sostituiti da cloro.
È insolubile in acqua e più denso. È tossico per inalazione e ingestione e può irritare la pelle e gli occhi. Viene utilizzato principalmente come solvente per olio e grasso, nella pulizia dei metalli e nella separazione del carbone dalle impurità.
Sintesi
[modifica | modifica wikitesto]Poiché il tetracloroetilene è prodotto in modo più economico dal processo di clorinolisi (una reazione chimica simile all'idrolisi dove il cloro svolge il ruolo dell'acqua), la produzione industriale di pentacloroetano è poco importante e attualmente non è praticamente prodotta, anche per i suoi effetti tossici. Se necessario, la sintesi può essere eseguita con diversi processi:
- Ossiclorurazione dell'etilene, ottenendo, oltre al pentacloroetano, idrocarburi clorurati.
- Clorurazione di un cloroetano, il CHCl2CHCl2, sotto radiazione ultravioletta, o tricloroetilene a 70 °C in presenza di cloruro ferrico, zolfo o radiazione ultravioletta.
- Può essere prodotto con buone rese anche mediante clorurazione del tricloroetilene, ottenuta in un processo a due fasi che prevede la clorurazione dell'acetilene per ottenere il tetracloroetano, e la rimozione del cloruro di idrogeno tramite l'azione di un base.
Impatto ambientale
[modifica | modifica wikitesto]A causa del suo impatto ambientale, il pentacloroetano non viene commercializzato né importato in molti paesi, inclusi gli Stati Uniti. Tuttavia, questo composto può essere rilasciato nell'ambiente come prodotto della combustione del PVC. Se rilasciato in terreno umido, è da moderatamente ad altamente mobile e può subire una lenta idrolisi chimica. Il pentacloroetano può volatilizzarsi lentamente sulle superfici asciutte del suolo. Se rilasciato in acqua, la volatilità è un meccanismo di rimozione importante, se non dominante (emivita di 5 ore in un fiume).
Questo composto ha anche il potenziale di ossidarsi in presenza di luce per formare il fosgene e il cloruro di tricloroacetile. L'idrolisi chimica non sembra essere ecologicamente importante. Se rilasciato nell'atmosfera, si prevede che sia quasi completamente in fase vapore. Può verificarsi un leggero assorbimento di pentacloroetano nei solidi sospesi o sedimentati. A causa della sua persistenza nell'atmosfera, possono verificarsi processi di trasporto a lungo raggio.
Cloroetani
[modifica | modifica wikitesto]Riportiamo i 6 cloroetani e i loro 3 isomeri di struttura
- Cloroetano
- 1,1-dicloroetano
- 1,2-dicloroetano (isomero)
- 1,1,1-tricloroetano
- 1,1,2-tricloroetano (isomero)
- 1,1,1,2-tetracloroetano
- 1,1,2,2-tetracloroetano (isomero)
- Pentacloroetano
- Esacloroetano
Note
[modifica | modifica wikitesto]- ^ (EN) Panico R., Powell W. H. e Richer J. C. (a cura di), A Guide to IUPAC Nomenclature of Organic Compounds, Hoboken (New Jersey, USA), IUPAC/Blackwell Science, 1993, ISBN 0-632-03488-2.
- ^ (EN) PubChem Compound, Pentachloroethane - Compound Summary, su pubchem.ncbi.nlm.nih.gov, National Center for Biotechnology Information, 27 Marzo 2005. URL consultato il 7 Maggio 2021.
- ^ (EN) Chemical Entities of Biological Interest, CHEBI:76287 - pentachloroethane, su ebi.ac.uk, EBI (UK), 14-01-2009. URL consultato il 07-05-2021.
- ^ (EN) IUPAC Commission on Isotopic Abundances and Atomic Weights., Atomic weights of the elements 2017, su Queen Mary University of London.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Pentacloroetano
Wikimedia Commons contiene immagini o altri file su Pentacloroetano

