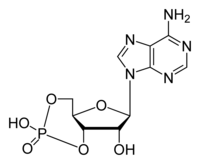
Adenosina monofosfato ciclico
| Adenosina monofosfato ciclico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Adenosina monofosfato ciclico (cAMP) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H12N5O6P |
| Massa molecolare (u) | 329.21 |
| Numero CAS | |
| Numero EINECS | 200-492-9 |
| PubChem | 6076 |
| DrugBank | DB02527 |
| SMILES | C1C2C(C(C(O2)N3C=NC4=C3N=CN=C4N)O)OP(=O)(O1)O |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 260 °C (533 K) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
L'adenosina monofosfato ciclico (AMP ciclico o cAMP) è un metabolita delle cellule prodotto grazie all'enzima adenilato ciclasi a partire dall'ATP. È un importante "secondo messaggero" coinvolto nei meccanismi di trasduzione del segnale all'interno delle cellule viventi in risposta a vari stimoli, come quelli indotti dagli ormoni glucagone o adrenalina, che non sono in grado di attraversare la membrana cellulare. La sua principale funzione consiste nell'attivazione di protein chinasi A (PKA) per regolare il passaggio transmembrana di calcio attraverso i canali ionici oppure tramite cascata, porta all'aumento del glucosio disponibile come conseguenza di una degradazione del glicogeno.
Sintesi e degradazione di cAMP[modifica | modifica wikitesto]
Il cAMP è sintetizzato dall'ATP dall'enzima adenilato ciclasi. La adenilato ciclasi è localizzata presso le membrane cellulari ed è attivato da mediatori tra cui glucagone, adrenalina e dopamina attraverso una proteina G. La adenilato ciclasi epatica risponde più efficacemente al glucagone, mentre quella del muscolo risponde maggiormente all'adrenalina.
L'enzima fosfodiesterasi catalizza la degradazione di cAMP ad AMP. Tale enzima è inibito da alte concentrazioni di caffeina: il ben noto effetto stimolatorio di questa molecola, infatti, è strettamente legato agli alti livelli di cAMP che è in grado di preservare.
Attivazione di processi cellulari[modifica | modifica wikitesto]
Il cAMP interagisce con diverse protein chinasi. In particolare, è in grado di attivare la PKA (Protein Kinase A, anche nota come protein chinasi cAMP-dipendente). Tale enzima è normalmente inattivo, nella forma tetramerica composta da due subunità catalitiche e due regolatorie (C2R2). Le subunità regolatorie sono in grado di inibire la catalisi. cAMP è in grado di legare le subunità R. Se questo avviene, esse si dissociano dalle C, che diventano così attive e in grado di fosforilare gli specifici substrati. Attraverso tale enzima, dunque, il cAMP è in grado di controllare numerosi processi cellulari, come la glicogenolisi e la lipolisi.
Ruolo di cAMP in altri organismi[modifica | modifica wikitesto]

Nei batteri, il livello di cAMP varia a seconda del terreno di crescita. In particolare, si registrano basse concentrazioni di cAMP se la fonte primaria di carbonio presente è il glucosio. Ciò è dovuto a un meccanismo che accoppia il trasporto intercellulare del glucosio con l'inibizione della adenilato ciclasi. Nei batteri il fattore di trascrizione CRP (o CAP) può attivare la trascrizione solo in complesso con cAMP. Il complesso CRP-cAMP, che si forma solo in carenza di glucosio, aumenta l'espressione di un gran numero di geni, inclusi alcuni in grado di attivare vie metaboliche di reperimento di carbonio alternative a quella del glucosio.
In Dictyostelium discoideum, un'ameba, i movimenti chemiotattici sono coordinati da ondate periodiche di cAMP, che si propagano attraverso la cellula.
Effetto della caffeina sull'cAMP[modifica | modifica wikitesto]
La caffeina, la sostanza alcaloide contenuta nei chicchi di caffè, presenta tra i diversi effetti metabolici la capacità di aumentare la concentrazione dell'AMP ciclico. Le conseguenze dell'uso di questo alcaloide sono del tutto a favore dell'attività dell'adenilato ciclasi, enzima adibito alla attivazione dell'cAMP a partire da una molecola di adenosin trifosfato (ATP). La caffeina quindi promuove tutte quelle serie di reazioni che si verificano a seguito del legame che si instaura tra l'adrenalina e il glucagone con i loro recettori transmembrana, rispettivamente a livello muscolare e a livello epatico, favorendo l'attivazione, a seguito di una cascata enzimatica, dell'enzima glicogeno fosforilasi che passa dalla sua forma inattiva (b) alla sua forma attiva (a). Il ruolo della caffeina è quindi quello di promuovere la via della glicogenolisi, nonché la degradazione della riserva di glucosio, sotto forma di glicogeno, negli organismi animali.
Note[modifica | modifica wikitesto]
- ^ Sigma Aldrich; rev. del 30.11.2011
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Adenosina monofosfato ciclico
Wikimedia Commons contiene immagini o altri file su Adenosina monofosfato ciclico
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) cyclic 3′,5′-adenosine monophosphate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.

