Emorragia subaracnoidea: differenze tra le versioni
+img |
Amplio voce (traduzione da en wiki) |
||
| Riga 1: | Riga 1: | ||
{{Infobox Malattia |
|||
{{S|medicina}} |
|||
|Nome= Emorragia subaracnoidea |
|||
[[File:SubarachnoidP.png|thumb|Immagine [[Tomografia computerizzata|TC]] di una emorragia subaracnoidea.]] |
|||
|Immagine=SubarachnoidP.png |
|||
|Didascalia=TAC del cervello mostra emorragia subaracnoidea come area bianca al centro e si estende nei [[Solco (neuroanatomia)|solchi]] ai lati (contrassegnata dalla freccia) |
|||
|ICD9={{ICD9|430}}, {{ICD9|852.0}}-{{ICD9|852.1}} |
|||
|ICD10={{ICD10|I|60||i|60}}, {{ICD10|P|10|3|p|10}}, {{ICD10|S|06|6|s|00}} |
|||
}} |
|||
Per '''emorragia subaracnoidea''' (detta anche '''ESA''') si intende un sanguinamento che |
Per '''emorragia subaracnoidea''' (detta anche '''ESA''') si intende un sanguinamento che ha luogo nell'area compresa tra l'[[aracnoide]] e la [[pia madre]], membrane che circondano il cervello. Il termine è talvolta utilizzato come sinonimo di [[emorragia cerebrale]]. Essa talvolta si può manifestare in maniera spontanea, generalmente per la rottura di un [[aneurisma]] cerebrale o può essere una conseguenza di un [[trauma cranico]]. |
||
I sintomi di emorragia subaracnoidea includono un forte [[cefalea|mal di testa]] con una rapida insorgenza ("cefalea a rombo di tuono"), [[vomito]], confusione o un abbassamento del livello di [[Stato di coscienza|coscienza]] e, talvolta, [[convulsioni]]. <ref name=vanGijn/> La [[diagnosi]] viene generalmente confermata grazie ad un esame [[Tomografia computerizzata|TC]] alla testa o occasionalmente con una [[puntura lombare]]. Il trattamento è prevalentemente [[neurochirurgia|neurochirurgico]] o di [[radiologia interventistica]] associati ad altri interventi atti a prevenire recidive o complicanze. La chirurgia per aneurismi è stata introdotto nel [[1930]], ma a partire dal [[1990]] molti aneurismi vengono trattati con una procedura meno invasiva, chiamata ''[[Guglielmi Detachable Coil]]'' che viene effettuata grazie a particolari strumenti inseriti attraverso [[vaso sanguigno|vasi sanguigni]] di grandi dimensioni<ref name=vanGijn>{{cite journal |author=van Gijn J, Kerr RS, Rinkel GJ |title=Subarachnoid haemorrhage |journal=Lancet |volume=369 |issue=9558 |pages=306–18 |year=2007 |pmid=17258671 |doi=10.1016/S0140-6736(07)60153-6}}</ref>. |
|||
Le cause più comuni sono: |
|||
L' ESA è una forma di [[ictus]] e comprende l' 1-7% di tutti gli ictus<ref name=Feigin05/>. Si tratta di una emergenza medica e può portare alla morte o gravi [[disabilità]], se non riconosciuta e trattata in una fase precoce. Circa la metà di tutti i casi di ESA risultano essere mortali, il 10-15% di essi prima ancora di raggiungere un ospedale,<ref name=vanGijn/> i pazienti sopravvissuti spesso presentano danni neurologici o cognitivi<ref name=Suarez>{{cite journal |author=Suarez JI, Tarr RW, Selman WR |title=Aneurysmal subarachnoid hemorrhage |journal=New England Journal of Medicine |volume=354 |issue=4 |pages=387–96 |year=2006 |month=January |pmid=16436770 |doi=10.1056/NEJMra052732}}</ref>. |
|||
* [[Trauma cranico]] |
|||
* Rottura di [[aneurisma]], generalmente di tipo sacciforme o "a bacca" |
|||
* Rottura di malformazione arterovenosa |
|||
* Discrasie ematiche come [[leucemia]], [[anemia aplastica]], [[porpora trombocitopenica]], complicanze della terapia anticoagulante, [[emofilia]], [[ipofibrinogemia]], [[iperfibrinolisi]] |
|||
* [[Vasculite|Vasculiti]] |
|||
* Neoplasie endocraniche primarie o secondarie |
|||
* Abuso di sostanze tossiche ([[anfetamine]], [[cocaina]]) |
|||
* Trombosi dei seni della dura madre |
|||
== Segni e sintomi == |
|||
Ma si può verificare anche in casi di |
|||
* Gravidanza |
|||
* Uso di contraccettivi orali |
|||
* Panirradiazione |
|||
* Folgorazione |
|||
* Strangolamento |
|||
* Colpo di calore |
|||
Il classico sintomo di emorragia subaracnoidea è un "mal di testa a rombo di tuono" (descritto anche "come essere preso a calci in testa ",<ref name="oxford">{{cite book | last=Longmore | first=Murray | coauthors=Ian Wilkinson, Tom Turmezei, Chee Kay Cheung | title=Oxford Handbook of Clinical Medicine, 7th edition | publisher=Oxford University Press | year=2007 | pages=841 | isbn=0-19-856837-1 }}</ref> o "il mal di testa più forte mai provato") che si sviluppa in pochi secondi o minuti. Spesso il dolore viene percepito come una pulsazione verso l'[[occipitale|occipite]] (parte posteriore della testa)<ref name="oxford2">{{cite book | last=Ramrakha | first=Punit | coauthors=Kevin Moore | title=Oxford Handbook of Acute Medicine, 2nd edition | publisher=Oxford University Press | year=2007 | pages=466–470 | isbn=0-19-852072-6 }}</ref>. Circa un terzo dei malati non presentano altri sintomi,<ref name=vanGijn/> vomito può essere presente, e 1 su 14 hanno convulsioni. <ref name=vanGijn/> La confusione, la diminuzione del livello di coscienza o lo stato di [[coma]] possono presentarsi, come la rigidità del collo e altri sintomi del [[meningismo]] <ref name=vanGijn/>. La rigidità del collo solitamente si presenta sei ore dopo l'insorgenza iniziale di ESA<ref name=OTV3>{{cite book |title=Oxford Textbook of Medicine, Fourth Edition, Volume 3 |last=Warrell |first=David A |coauthors=Timothy M. Cox, ''et al.'' |year=2003 |publisher=Oxford |isbn=0-19-857013-9 |pages=1032–1034}}</ref>. La dilatazione isolata di una [[pupilla]] e la perdita del [[riflesso]] pupillare alla luce può riflettere un'[[ernia cerebrale]] avvenuta a seguito di un aumento della [[pressione intracranica]] (pressione all'interno del cranio) <ref name=vanGijn/>. L'emorragia intraoculare (sanguinamento del bulbo oculare) può verificarsi in risposta alla pressione elevata, questa è nota come [[sindrome di Terson]] (si verifica nel 3-13% dei casi) ed è comune nei casi più gravi di ESA<ref name=mccarron>{{cite journal |author=McCarron MO, Alberts MJ, McCarron P |title=A systematic review of Terson's syndrome: Frequency and prognosis after subarachnoid haemorrhage |journal=Journal of Neurology, Neurosurgery, and Psychiatry |volume=75 |issue=3 |pages=491–3 |year=2004 |pmid=14966173 |pmc=1738971 |url=http://jnnp.bmj.com/cgi/content/full/75/3/491 |doi=10.1136/jnnp.2003.016816}}</ref>. |
|||
Si verifica soprattutto nelle donne nella V decade di vita. Si manifesta con dolore improvviso, estremamente acuto (definito generalmente come "il peggior mal di testa mai avuto") a cui segue, rapidamente, perdita della coscienza. Può seguire un ritorno alla coscienza nel giro di alcuni minuti. Circa in un terzo dei casi, la rottura avviene in concomitanza con un rialzo pressorio (sforzo fisico o rapporto sessuale). Il 25-50% muore al primo episodio, ma, in chi sopravvive c'è generalmente miglioramento delle funzioni; tuttavia, le recidive sono molto frequenti e tendono ad aggravarsi progressivamente. |
|||
Anomalie ai movimenti oculari (occhi che guardano verso il basso e verso l'esterno e incapacità di sollevare la palpebra sullo stesso lato) o paralisi (perdita di sensibilità) possono indicare una emorragia della arteria comunicante posteriore. <ref name=vanGijn/><ref name=oxford2/> Le convulsioni sono più comuni, se l'emorragia è conseguenza di un aneurisma, altrimenti è difficile determinare il luogo e l'origine dell' emorragia dai sintomi<ref name=vanGijn/><ref name=oxford2/> |
|||
Come conseguenza dell'emorragia, l'organismo produce grandi quantità di [[adrenalina]] e ormoni simili. Questo porta ad un forte aumento della [[pressione sanguigna]], il cuore è notevolmente sotto sforzo, si può verificare un [[edema polmonare]] (accumulo di liquido nei polmoni), [[aritmia cardiaca|aritmie cardiache]] (irregolarità nel [[battito cardiaco]] e ritmo), alterazioni dell'[[elettrocardiogramma]] (nel 27% dei casi)<ref name="OHA">{{cite book | last=Allman | first=Keith G. | coauthors=Iain H. Wilson | title=Oxford Handbook of Anaesthesia, 2nd edition | publisher=Oxford University Press | year=2006 | pages=408–409 | isbn=0198566090 }}</ref> e l'[[arresto cardiaco]] (nel 3% dei casi) si può verificare rapidamente dopo l'insorgenza dell'emorragia. <ref name=vanGijn/><ref>{{cite journal |author=Banki NM, Kopelnik A, Dae MW, ''et al.'' |title=Acute neurocardiogenic injury after subarachnoid hemorrhage |journal=Circulation |volume=112 |issue=21 |pages=3314–9 |year=2005 |pmid=16286583 |doi=10.1161/CIRCULATIONAHA.105.558239 | url=http://circ.ahajournals.org/cgi/content/full/112/21/3314}}</ref> |
|||
L'emorragia subaracnoidea può pertanto verificarsi in soggetti che hanno subito un trauma cranico. I sintomi possono includere mal di testa, diminuzione del livello di coscienza e [[emiparesi]] (debolezza di un lato del corpo). L' ESA è un evento frequente nel danno cerebrale traumatico e porta ad una [[prognosi]] infausta se è associata a un peggioramento del livello di coscienza<ref>{{cite journal |author=Servadei F, Murray GD, Teasdale GM, ''et al.'' |title=Traumatic subarachnoid hemorrhage: demographic and clinical study of 750 patients from the European brain injury consortium survey of head injuries |journal=Neurosurgery |volume=50 |issue=2 |pages=261–7; discussion 267–9 |year=2002 |month=February |pmid=11844260 |doi=10.1097/00006123-200202000-00006}}</ref>. |
|||
==Cause== |
|||
Nell' 85% dei casi di emorragia subaracnoidea spontanea la causa è la rottura di un aneurisma cerebrale: una debolezza nella parete di una delle arterie del cervello che si ingrossa fino a rompersi. Gli aneurismi tendono ad essere situati nel [[circolo di Willis]] o nelle sue vicinanze. Mentre la maggior parte dei casi di ESA sono dovute al sanguinamento di piccoli aneurismi. Aneurismi più grandi (che sono meno diffusi) hanno maggiori probabilità di rottura. <ref name=vanGijn/>. |
|||
Nel 15-20% dei casi di ESA spontanea, l'aneurisma non viene identificato dal primo [[angiografia|angiogramma]]<ref name="Rinkel93">{{cite journal |author=Rinkel GJ, van Gijn J, Wijdicks EF |title=Subarachnoid hemorrhage without detectable aneurysm. A review of the causes |journal=Stroke |volume=24 |issue=9 |pages=1403–9 |date=1 September 1993|pmid=8362440 | url=http://stroke.ahajournals.org/cgi/reprint/24/9/1403 | format=PDF }}</ref>. Circa la metà di questi sono attribuiti a emorragia perimesencefalica in cui la presenza di sangue è limitata agli spazi subaracnoidei di tutto il [[mesencefalo]].<ref name=vanGijn/> I restanti aneurismi sono dovuti ad altre malattie che interessano il sistema circolatorio, come malformazioni artero-venose, disturbi dei [[Vaso sanguigno|vasi sanguigni]] nel [[midollo spinale]] e sanguinamento presente in vari [[tumore|tumori]]<ref name=vanGijn/>.L'abuso di [[cocaina]] e l'[[anemia falciforme]] (di solito nei bambini) e, raramente, la terapia anticoagulante e l'[[apoplessia pituitaria]] possono dar luogo a ESA<ref name=OTV3/><ref name="Rinkel93"/>. |
|||
Sanguinamenti subaracnoidei possono essere rilevati grazie all'esame TC nel 60% delle persone con [[trauma cranico]].<ref name="Armin06">{{cite journal |author=Armin SS, Colohan AR, Zhang JH |title=Traumatic subarachnoid hemorrhage: Our current understanding and its evolution over the past half century |journal=Neurological Research |volume=28 |issue=4 |pages=445–52 |year=2006 |month=June |pmid=16759448 |doi=10.1179/016164106X115053}}</ref> Le emorragie subaracnoide traumatiche si verificano solitamente nei pressi del sito di una [[frattura]] del [[cranio]] o di contusione intracerebrale<ref name="Rinkel93"/>. |
|||
== Diagnosi== |
|||
===Imaging=== |
|||
[[File:Aneurysma A cerebri media.jpg|thumb|left|L'aneurisma dell'arteria cerebrale media in [[tomografia computerizzata]], ricostruzione [[3D]] (rendering volumetrico).]] |
|||
I passi iniziali per la valutazione di un paziente con una sospetta emorragia subaracnoidea sono ottenere la sua storia medica e l'esecuzione di un esame fisico, questi sono volti a determinare se i sintomi sono dovuti a una emorragia subaracnoidea o ad altra causa. La diagnosi non può, tuttavia, essere fatta solo su basi cliniche; Pertanto l'imaging diagnostico è eseguito per confermare o escludere la presenza di una sanguinamento. L'esame di elezione è la [[tomografia computerizzata]] (TC) del cervello. Questo esame permette di identificare correttamente oltre il 95% dei casi, soprattutto se effettuato entro il primo giorno dopo l'esordio del sanguinamento. La [[risonanza magnetica]] (MRI) può essere più sensibile della TC dopo diversi giorni dall'insorgenza<ref name=vanGijn/>. |
|||
===Puntura lombare=== |
|||
La [[puntura lombare]], in cui il [[liquido cerebrospinale]] viene rimosso con un ago, mostra le prove di emorragia nel 3% delle persone in cui la TC è risultata normale. Pertanto la puntura lombare è considerata obbligatoria nel caso di pazienti in cui sussiste un forte sospetto di di emorragia subaracnoidea nonostante l'imaging risulti negativo.<ref name=vanGijn/> Almeno tre provette di liquido cerebrospinale vengono<ref name=OTV3/>. Se un elevato numero di [[globulo rosso|globuli rossi]] è ugualmente presente in tutte le provette, si può diagnosticare una emorragia subaracnoidea. Se il numero di cellule è minore in almeno una delle fiale è più probabile che ciò si sia verificato a causa di danni a un piccolo vaso sanguigno nel corso del procedimento.<ref name=Suarez/> Il campione di liquor viene poi esaminato per [[xanthochromia]]. Più sensibile è la [[spettrofotometria]] (misurando l'assorbimento di particolari lunghezze d'onda della luce) per la rilevazione di [[bilirubina]], un prodotto di degradazione dell'[[emoglobina]] dei globuli rossi.<ref name=vanGijn/> [13] Xanthochromia e spettrofotometria rimangono procedure affidabili per rilevare ESA dopo alcuni giorni dall'inizio del mal di testa.[13] Un intervallo di almeno 12 ore è necessario tra l'insorgenza del mal di testa e l'analisi della bilirubina, poichè ci vogliono diverse ore perchè l'emoglobina dai globuli rossi possa essere metabolizzata. <ref name=vanGijn/> [13] |
|||
[[File:Thisisspinaltap.jpg|thumb|Una puntura lombare in corso. Una vasta area sulla schiena è stato lavata con un [[disinfettante]] a base di [[iodio]] lasciando colorazione bruna.]] |
|||
Mentre solo il 10% di persone ricoverate al pronto soccorso con un mal di testa a "rombo di tuono" sono realmente affetti da una emorragia subaracnoidea, altre possibili cause possono essere considerate: [[meningite]], emorragia emicrania, trombosi venosa, ecc..<ref name="oxford"/><ref name="Teunissen96">{{cite journal |author=Teunissen LL, Rinkel GJ, Algra A, van Gijn J |title=Risk factors for subarachnoid hemorrhage: a systematic review |journal=Stroke |volume=27 |issue=3 |pages=544–9 |date=1 March 1996|pmid=8610327 |url=http://stroke.ahajournals.org/cgi/content/full/27/3/544 }}</ref>. Non è insolito per l'ESA essere inizialmente diagnosticata erroneamente come una forte emicrania o cefalea, ciò può portare ad un ritardo nell'esecuzione di una TC. In uno studio del 2004 si è visto che questo si è verificato nel 12% dei casi e in particolare in persone che avevano piccole emorragie e nessun deterioramento nel loro stato mentale. Il ritardo nella diagnosi ha portato ad un peggioramento del decorso.[15] In alcuni pazienti il mal di testa si è risolto spontaneamente senza la presentazione di altri sintomi. Questo tipo di mal di testa è indicato come "mal di testa sentinella", perché si presume essere determinato da un piccolo sanguinamento (un "sanguinamento di avvertimento") da un aneurisma.<ref name=Suarez/> |
|||
===Angiografia=== |
|||
Dopo la conferma di una emorragia subaracnoidea è necessario determinare la sua origine. Se si ritiene che l'emorragia abbia avuto origine da un aneurisma (come determinato apparentemente dalla TC), la scelta è tra l'[[angiografia cerebrale]] (iniettando [[mezzo di contrasto|radio-contrasto]] attraverso un [[catetere]] nelle arterie del cervello) e l'angiografia TC (i vasi sanguigni vengono visualizzati grazie ad un mezzo di contrasto durante una scansione TC). Il cateterismo cardiaco offre poi la possibilità di effettuare un avvolgimento di aneurisma (vedi sotto).<ref name=vanGijn/> <ref name=Suarez/> |
|||
===ECG=== |
|||
[[File:CNSinjury.JPG|thumb|Cambiamenti ECG simili a quelle di un STEMI in una donna che aveva una lesione acuta del [[sistema nervoso centrale]] dovuta a un'emorragia subaracnoidea.]] |
|||
Alterazioni elettrocardiografiche sono comuni nel 40-70% dei casi di emorragia subaracnoidea. Essi possono includere un prolungamento dell'intervallo QT, onde Q, sopralivellamento del tratto ST e aritmie cardiache.<ref>{{cite journal |author=Nguyen H, Zaroff JG |title=Neurogenic stunned myocardium |journal=Curr Neurol Neurosci Rep |volume=9 |issue=6 |pages=486–91 |year=2009 |month=November |pmid=19818236 |doi= 10.1007/s11910-009-0071-0|url=}}</ref> |
|||
==Classificazione== |
|||
Ci sono diverse scale di valutazione disponibili per le emorragie subaracnoide. La [[Glasgow Coma Scale]] è utilizzata per la valutazione obbiettiva dello stato di coscienza. Tre scale di punteggi specializzate sono utilizzate per valutarla e in ciascuna, un numero maggiore è associato ad una prognosi peggiore<ref>{{cite journal |author=Rosen D, Macdonald R |title=Subarachnoid hemorrhage grading scales: A systematic review |journal=Neurocritical Care |volume=2 |issue=2 |pages=110–8 |year=2005 |pmid=16159052 |doi=10.1385/NCC:2:2:110}}</ref>. Queste scale sono state derivate retrospettivamente dalle caratteristiche dei pazienti e dal loro decorso clinico. |
|||
La prima scala di gravità, come descritta da Hunt e Hess nel 1968<ref name="H&H">{{cite journal |author=Hunt W, Hess R |title=Surgical risk as related to time of intervention in the repair of intracranial aneurysms |journal=Journal of Neurosurgery |volume=28 |issue=1 |pages=14–20 |year=1968 |pmid=5635959 |doi=10.3171/jns.1968.28.1.0014}}</ref>: |
|||
{| class="wikitable" style = "width:75%; font-size:85%; margin-left:15px; text-align:center" |
|||
!width="50"| Grado |
|||
! Segni e sintomi |
|||
! Sopravvivenza |
|||
|- |
|||
! 1 |
|||
| align="left" | Asintomatico o lieve rigidità al collo e dolore alla testa |
|||
|- |
|||
!2 |
|||
| align="left"| Mal di testa da moderato a severo, rigidità al collo. Nessun deficit neurologico tranne paralisi dei nervi cranici || 60% |
|||
|- |
|||
!3 |
|||
|align="left"| [[Sonnolenza]], minimi deficit radiologici || 50% |
|||
|- |
|||
!4 |
|||
| align="left"| Da moderata a severa emiparesi, possibile postura scorretta, disturbi delle funzioni vegetative || 20% |
|||
|- |
|||
!5 |
|||
| align="left" | [[Coma]] profondo || 10% |
|||
|- |
|||
|} |
|||
Il grado di Fisher classificatore emorragia subaracnoidea la comparsa sulla TC.<ref name="Fisher">{{cite journal |author=Fisher C, Kistler J, Davis J |title=Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning |journal=Neurosurgery |volume=6 |issue=1 |pages=1–9 |year=1980 |pmid=7354892 |doi=10.1097/00006123-198001000-00001}}</ref> Questa scala è stata modificata da Claassen e collaboratori, comprendendo il rischio additivo dalla grandezza dell'emorragia intraventricolare<ref name="Claassen">{{cite journal |author=Claassen J, Bernardini GL, Kreiter K, ''et al.'' |title=Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: the Fisher scale revisited |journal=Stroke |volume=32 |issue=9 |pages=2012–20 |year=2001 |month=September |pmid=11546890 |url=http://stroke.ahajournals.org/cgi/content/full/32/9/2012 |doi=10.1161/hs0901.095677}}</ref>. |
|||
{| class="wikitable" style = "width:75%; font-size:85%; margin-left:15px; text-align:center" |
|||
!width="50"| Grade |
|||
! Apparenza dell'emorragia |
|||
|- |
|||
! 1 |
|||
| align="left" |Non evidente |
|||
|- |
|||
!2 |
|||
| align="left"| Meno di 1 [[millimetro|mm]] di spessore |
|||
|- |
|||
!3 |
|||
|align="left"| Più di 1 millimetro di spessore |
|||
|- |
|||
!4 |
|||
| align="left"| Qualsiasi spessore con emorragia intraventricolare o estensione [[parenchima|parenchimale]] |
|||
|- |
|||
|} |
|||
La Federazione Mondiale di neurochirurghi (WFNS) classificazione utilizza il punteggio del coma di Glasgow (GCS) e deficit neurologico focale di valutare la gravità dei sintomi<ref name="WorldFed">{{cite journal |author=Teasdale G, Drake C, Hunt W, Kassell N, Sano K, Pertuiset B, De Villiers J |title=A universal subarachnoid hemorrhage scale: Report of a committee of the World Federation of Neurosurgical Societies |journal=Journal of Neurology, Neurosurgery, and Psychiatry |volume=51 |issue=11 |pages=1457 |year=1988 |pmid=3236024 | pmc=1032822 |doi=10.1136/jnnp.51.11.1457}}</ref>. |
|||
{| class="wikitable" style = "width:75%; font-size:85%; margin-left:15px; text-align:center" |
|||
!width="50"| Grade |
|||
! GCS |
|||
! Deficit neurologico focale |
|||
|- |
|||
! 1 |
|||
| 15 || Assente |
|||
|- |
|||
! 2 |
|||
| 13–14 || Assente |
|||
|- |
|||
! 3 |
|||
| 13–14 || Presente |
|||
|- |
|||
! 4 |
|||
| 7–12 || Presente o assente |
|||
|- |
|||
! 5 |
|||
| <7 || Presente o assente |
|||
|- |
|||
|} |
|||
Uno schema di classificazione globale è stato suggerito da Ogilvy e Carter per predire l'esito e la terapia.<ref name="pmid9588539">{{cite journal |author=Ogilvy CS, Carter BS |title=A proposed comprehensive grading system to predict outcome for surgical management of intracranial aneurysms |journal=Neurosurgery |volume=42 |issue=5 |pages=959–68; discussion 968–70 |year=1998 |month=May |pmid=9588539 |doi=10.1097/00006123-199805000-00001}}</ref> Il sistema consiste di cinque gradi e si assegna un punto per la presenza o meno di ciascuno dei cinque fattori<ref name="pmid9588539"/>: |
|||
* Età superiore a 50 |
|||
* Hunt e Hess di grado 4 o 5 |
|||
* Scala Fisher di 3 o 4 |
|||
* Dimensioni dell'aneurisma maggiore di 10 mm |
|||
* Aneurismi a circolazione posteriore 25 mm o più |
|||
== Screening e prevenzione == |
|||
[[File:Arteries beneath brain Gray closer.jpg|thumb|Le arterie del cervello, visto da sotto. Immagine originaria di Gray's Anatomy, 1918.]] |
|||
Lo [[screening]] per aneurisma non viene eseguito a livello di popolazione in generale, poichè i casi sono relativamente rari. Se un individuo ha due o più [[parentela|parenti]] di primo che hanno sofferto di emorragia subaracnoidea aneurismatica lo screening può presentarsi utile<ref name=vanGijn/> <ref name=WhiteWardlaw>{{cite journal |author=White PM, Wardlaw JM |title=Unruptured intracranial aneurysms |journal=Journal of Neuroradiology |volume=30 |issue=5 |pages=336–50 |year=2003 |month=December |pmid=14752379 |url=http://www.em-consulte.com/article/126528}}</ref>. |
|||
Nel 8% dei pazienti affetti da [[malattia policistica renale autosomica dominante]] (ADPKD), una [[malattia ereditaria]] che colpisce il [[rene]], risultano casi di aneurismi celebrali, ma spesso di piccola entità per cui è improbabile la rottura. In questo caso lo screening è consigliato solo in famiglie con ADPKD dove un membro ha subito una rottura di aneurisma<ref>{{cite journal |author=Gibbs GF, Huston J, Qian Q, ''et al.'' |title=Follow-up of intracranial aneurysms in autosomal-dominant polycystic kidney disease |journal=Kidney International |volume=65 |issue=5 |pages=1621–7 |year=2004 |month=May |pmid=15086900 |doi=10.1111/j.1523-1755.2004.00572.x}}</ref>. |
|||
Un aneurisma può essere rilevato non intenzionalmente durante lo studio di immagini del cervello eseguite per altri motivi, in questo caso la scelta se intervenire o meno può essere difficoltosa in quanto il trattamento può essere associato a importanti complicanze. Uno studio internazionale sugli aneurismi intracranici non rotti ha fornito dei dati sulle varie [[prognosi]]. Esso ha dimostrato che coloro che avevano precedentemente sofferto di rottura di aneurismi avevano più probabilità di rottura, mentre chi non aveva mai sperimentato sanguinamenti a presenta aneurismi di piccole dimensioni (inferiori ai 10 mm) i rischi dell'intervento chirurgico erano superiori alle probabilità del verificarsi di una rottura<ref name=WhiteWardlaw/> . Sulla base di questo studio, oggigiorno, l'intervento preventivo è consigliato solo se il paziente ha una ragionevole [[aspettativa di vita]] e presenta una aneurisma altamente suscettibile a rottura<ref name=WhiteWardlaw/> . Allo stesso tempo vi sono limitate evidenze che il trattamento endovascolare degli aneurismi non rotti sia in realtà benefico<ref>{{cite journal |author=Naggara ON, White PM, Guilbert F, Roy D, Weill A, Raymond J |title=Endovascular treatment of intracranial unruptured aneurysms: systematic review and meta-analysis of the literature on safety and efficacy |journal=Radiology |volume=256 |issue=3 |pages=887–97 |year=2010 |month=September |pmid=20634431 |doi=10.1148/radiol.10091982}}</ref>. |
|||
==Trattamento== |
|||
[[File:Coiled PCA residual aneurysm arteriogram.JPG|thumb|left|L'arteriogramma mostra un aneurisma parzialmente arrotolato (indicato da frecce gialle) dell'arteria cerebrale posteriore di una sacca aneurismatica residua. Il paziente era una donna di 34 anni, inizialmente curata per una emorragia subaracnoidea.]] |
|||
Il trattamento dell'emorragia subaracnoidea coinvolge le misure di gestione generale per la stabilizzazione del paziente mentre vengono effettuate indagini specifiche e trattamenti. Quest'ultimi includono la prevenzione di un possibile risanguinamento grazie all'eliminazione della fonte di sanguinamento, la prevenzione di un fenomeno conosciuto come vasospasmo e dalla prevenzione e dal trattamento delle possibili complicanze<ref name=vanGijn/>. |
|||
=== Misure generali === |
|||
Stabilizzare il paziente è la prima priorità. Per quelli che presentano un livello ridotto di coscienza può rendersi necessario procedere ad [[intubazione]] e alla [[ventilazione artificiale]]. La [[pressione arteriosa]], la [[frequenza cardiaca]], la [[frequenza respiratoria]] e la valutazione della [[Glasgow Coma Scale]] sono parametri che devono essere controllati frequentemente. Una volta che la diagnosi viene confermata, la terapia deve essere impostata precocemente. La nutrizione del paziente rappresenta un'ulteriore priorità e viene effettuata o mediante l'applicazione di un [[Sonda gastrica|sondino naso gastrico]] o tramite [[via parenterale]]. L'[[analgesia]] (controllo del dolore) viene limitata il più possibile, in quanto la [[sedazione]] può incidere sullo stato mentale e interferire con la capacità di controllare quindi il livello di coscienza. La [[trombosi venosa profonda]] è impedita facendo indossare al paziente le calze a compressione o presidi simili<ref name=vanGijn/>. Un [[cateterismo|catetere]] [[vescica]] viene generalmente inserito per controllare l'equilibrio dei fluidi. Le [[benzodiazepina|benzodiazepine]] possono essere somministrate per alleviare lo [[stress]]<ref name=OTV3/>. Farmaci [[antiemetico|antiemetici]] dovrebbe essere date alle persone sveglie<ref name="oxford2"/>. |
|||
=== Prevenzione del risanguinamento=== |
|||
I pazienti le cui immagini TC mostrano un grosso ematoma, depressione del livello di coscienza o sintomi neurologici focali possono beneficiare di una urgente rimozione chirurgica del sangue o di una occlusione del sito di sanguinamento. Gli altri pazienti vengono di solito sottoposti a un angiogramma transfemorale o a [[angiografia]] TC. E' difficile prevedere chi soffrirà di un risanguinamento, ma questo può accadere in qualsiasi momento e ciò porta generalmente ad una prognosi infausta. Dopo che sono passate le prime 24 ore, il rischio di risanguinamento rimane circa il 40% nelle successive quattro settimane, questo suggerisce che gli interventi dovrebbero essere rivolti a ridurre questo rischio precocemente<ref name=vanGijn/>. |
|||
Se un aneurisma cerebrale viene identificato grazie ad angiografia, due interventi possono essere effettuati per ridurre il rischio di sanguinamento: Il ''clipping''<ref name=Dandy1938>{{cite journal |author=Dandy WE |title=Intracranial aneurysm of the internal carotid artery: Cured by operation |journal=Annals of Surgery |volume=107 |issue=5 |pages=654–9 |year=1938 |pmid=17857170 |doi=10.1097/00000658-193805000-00003 | pmc=1386933}}</ref> e l'avvolgimento<ref name=Guiglielmi1991>{{cite journal |author=Guglielmi G, Viñuela F, Dion J, Duckwiler G |title=Electrothrombosis of saccular aneurysms via endovascular approach. Part 2: Preliminary clinical experience |journal=Journal of Neurosurgery |volume=75 |issue=1 |pages=8–14 |year=1991 |pmid=2045924 |doi=10.3171/jns.1991.75.1.0008}}</ref>. Il ''clipping'' richiede una [[craniotomia]] (apertura del cranio) per individuare l'[[aneurisma]], seguita dal posizionamento di una [[Clip (chirurgia)|clip]] attorno al collo dell'aneurisma. |
|||
L'avvolgimento viene effettuato attraverso i grandi vasi sanguigni: un [[catetere]] viene inserito nell'[[arteria femorale]] all'[[inguine]] e viene fatto avanzare attraverso l'[[aorta]] verso le arterie che alimentano il cervello (entrambe le [[arteria carotidea|arterie carotidee]] e [[arteria vertebrale|vertebrali]]). Quando l'aneurisma è stato localizzato, fili di [[platino]] vengono rilasciate nell'aneurisma che causano un [[coagulazione|coagulo]] di sangue che lo blocca<ref>{{cita web|url=http://www.news-medical.net/news/2006/05/31/16/Italian.aspx|titolo=Aneurismi Clipping o avvolgimento - studio|accesso=4 giugno 2011}}</ref>. |
|||
La decisione su quale trattamento eseguire, viene in genere fatta da un team multidisciplinare composto da un [[Neuroradiologia|neuroradiologo]], [[neurochirurgia|neurochirurgo]] e spesso altri professionisti della salute<ref name=vanGijn/>. |
|||
{| align=center |
|||
|+ '''Reperti chirurgici in "clippaggio"''' |
|||
|[[file:HirnAneurysma.jpg|thumb|300px|Aneurisma (freccia)]] |
|||
|[[file:HirnAneurysmaClip.jpg|thumb|300px|Stato dell'aneurisma dopo il "clippaggio"]] |
|||
|} |
|||
In generale, la decisione tra il clippaggio e l'avvolgimento viene effettuato sulla base della posizione dell'aneurisma, la sua dimensione e la condizione del paziente. Gli aneurismi dell'arteria cerebrale media e le sue diramazioni sono difficili da raggiungere con l'angiografia e tendono ad essere suscettibili di ''clipping''. Quelli dell'arteria basilare e dell'arteria cerebrale posteriore sono difficili da raggiungere chirurgicamente e sono più accessibili per la gestione endovascolare<ref name=ISAT2005>{{cite journal |author=Molyneux AJ, Kerr RS, Yu LM, ''et al.'' |title=International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: A randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion |journal=Lancet |volume=366 |issue=9488 |pages=809–17 |year=2005 |pmid=16139655 |doi=10.1016/S0140-6736(05)67214-5}}</ref>. |
|||
Questi approcci sono basati sull'esperienza e l'unico [[studio clinico]] controllato e randomizzato di confronto diretto tra le diverse modalità è stato eseguito su pazienti con piccoli aneurismi (meno di 10 mm) dell'[[arteria cerebrale anteriore]] e dell'[[arteria comunicante anteriore]] che costituiscono solo il circa 20% di tutti i pazienti con emorragia subaracnoidea aneurismatica<ref name=ISAT2005/><ref>{{cite journal |author=van der Schaaf I, Algra A, Wermer M, ''et al.'' |title=Endovascular coiling versus neurosurgical clipping for patients with aneurysmal subarachnoid haemorrhage |journal=Cochrane Database of Systematic Reviews (Online) |issue=4 |pages=CD003085 |year=2005 |pmid=16235314 |doi=10.1002/14651858.CD003085.pub2 |url=http://mrw.interscience.wiley.com/cochrane/clsysrev/articles/CD003085/frame.html}}</ref>. Questo studio, l'''International Subarachnoid Aneurysm Trial'' (ISAT), ha mostrato che in questo gruppo la probabilità di morte o di perdita dell'autosufficenza è stata ridotta (7,4% di riduzione del rischio assoluto, il 23,5% di riduzione del [[rischio relativo]]) se l'avvolgimento endovascolare è stato utilizzato in contrapposizione alla tecnica chirurgia<ref name=ISAT2005/>. Il principale svantaggio dell'avvolgimento è la possibilità che l'aneurisma si ripeta, questo rischio è molto piccolo nell'approccio chirurgico. Nello studio ISAT per l' 8,3% dei pazienti si è reso necessario un ulteriore trattamento a lungo termine. Quindi, le persone che hanno avuto un avvolgimento devono essere seguiti per molti anni tramite angiografia per scongiurare il ripetersi di aneurismi o per identificarli precocemente<ref>{{cite journal |author=Campi A, Ramzi N, Molyneux AJ, ''et al.'' |title=Retreatment of ruptured cerebral aneurysms in patients randomized by coiling or clipping in the International Subarachnoid Aneurysm Trial (ISAT) |journal=Stroke |volume=38 |issue=5 |pages=1538–44 |year=2007 |pmid=17395870 |doi=10.1161/STROKEAHA.106.466987 |url=http://stroke.ahajournals.org/cgi/content/full/38/5/1538}}</ref>. |
|||
===Vasospasmo=== |
|||
Il vasospasmo, in cui i vasi sanguigni si restringono e limitano il flusso di sangue, è una grave complicanza di ESA. Infatti esso può causare lesioni [[ischemia|ischemiche]] cerebrali e danni permanenti al cervello dovuti alla mancanza di [[ossigeno]]. Può risultare fatale se grave. L'ischemia ritardata è caratterizzata da nuovi sintomi neurologici e può essere confermato dal [[ecodoppler]] transcranico o tramite angiografia cerebrale. Circa un terzo di tutte le persone ricoverate con emorragia subaracnoidea presentano un'ischemia da vasospasmo e la metà di questi soffrono di danni permanenti a causa di essa<ref name=CochraneNimo>{{cite journal |author=Dorhout Mees S, Rinkel G, Feigin V, ''et al.'' |title=Calcium antagonists for aneurysmal subarachnoid haemorrhage |journal=Cochrane Database of Systematic Reviews (Online) |issue=3 |pages=CD000277 |year=2007 |pmid=17636626 |doi=10.1002/14651858.CD000277.pub3}}</ref>. E' possibile seguire su schermo lo sviluppo di vasospasmo grazie all'ecodoppler transcranico ogni 24-48 ore. Una velocità del flusso sanguigno di più di 120 centimetri al secondo è indicativa di vasospasmo<ref name=Suarez/>. |
|||
L'uso dei calcio-antagonisti, in grado di prevenire lo spasmo dei vasi sanguigni impedendo al [[calcio]] di entrare nelle [[cellule]] [[tessuto muscolare liscio|muscolari lisce]], è stato proposto per la prevenzione del vasospasmo.<ref name="Armin06"/> La somministrazione di [[nimodipina]] (calcio-antagonista) per via orale migliora i risultati, se somministrata tra il quarto giorno e il ventunesimo dopo l'emorragia, anche se essa non riduce significativamente la quantità di vasospasmo rilevato su angiografia<ref name=Allen>{{cite journal |doi=10.1056/NEJM198303173081103 |author=Allen GS, Ahn HS, Preziosi TJ, ''et al.'' |title=Cerebral arterial spasm: A controlled trial of nimodipine in patients with subarachnoid hemorrhage |journal=New England Journal of Medicine |volume=308 |issue=11 |pages=619–24 |year=1983 |pmid=6338383}}</ref>. In una emorragia subaracnoidea traumatica la nimodipina non incide sull'esito a lungo termine e non è quindi raccomandata<ref>{{cite journal |author=Vergouwen MD, Vermeulen M, Roos YB |title=Effect of nimodipine on outcome in patients with traumatic subarachnoid haemorrhage: A systematic review |journal=Lancet Neurology |volume=5 |issue=12 |pages=1029–32 |year=2006 |month=December |pmid=17110283 |doi=10.1016/S1474-4422(06)70582-8}}</ref>. Altri farmaci bloccanti dei canali del calcio e [[solfato di magnesio]] sono stati studiati ma non sono attualmente raccomandati né vi è alcuna prova che dimostra vantaggi se la nimodipina viene somministrato per via endovenosa<ref name=CochraneNimo/>. |
|||
Un protocollo denominato ''triple H'' è spesso usato come misura per il trattamento di vasospasmo, consiglia l'utilizzo di fluidi per via endovenosa al fine di raggiungere uno stato di [[ipertensione]] (pressione alta), [[ipervolemia]] (eccesso di liquidi in circolazione) e emodiluizione (lieve diluizione del sangue)<ref name=Kassell>{{cite journal |author=Kassell NF, Peerless SJ, Durward QJ, Beck DW, Drake CG, Adams HP |title=Treatment of ischemic deficits from vasospasm with intravascular volume expansion and induced arterial hypertension |journal=Neurosurgery |volume=11 |issue=3 |pages=337–43 |year=1982 |month=September |pmid=7133349 |doi=10.1097/00006123-198209000-00001}}</ref>. Nessuno studio finora ha dimostrato i vantaggi di questo approccio<ref>{{cite journal |author=Sen J, Belli A, Albon H, Morgan L, Petzold A, Kitchen N |title=Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage |journal=Lancet Neurology |volume=2 |issue=10 |pages=614–21 |year=2003 |month=October |pmid=14505583 |doi=10.1016/S1474-4422(03)00531-3}}</ref>. |
|||
Se i sintomi di ischemia da vasospasmo non migliorano con il trattamento medico, l'angiografia può essere tentata per identificare i siti di vasospasmo al fine di somministrare farmaci vasodilatatori (farmaci che rilassano la parete dei vasi sanguigni) direttamente nell'arteria. L'[[angioplastica]] (apertura della zona ristretta mediante un palloncino) può quindi essere eseguita<ref name=Suarez/>. |
|||
===Altre complicazioni=== |
|||
L'[[idrocefalo]] (ostruzione del flusso del [[liquido cerebrospinale]]) può essere una complicanza dell'ESA sia a breve e lungo termine. Viene rilevato mediante TAC osservando l'allargamento del ventricolo laterale. Se il livello di coscienza è diminuito, il drenaggio dei liquidi in eccesso è effettuato tramite puntura lombare, tramite drenaggio extraventricolare (un dispositivo temporaneo inserito nel ventricolo) o saltuariamente con uno [[Shunt (medicina)|shunt]] permanente<ref name=vanGijn/><ref name=Suarez/>. Il trattamento corretto dell'idrocefalo può portare ad un miglioramento enorme nella condizione di un paziente.<ref name="oxford2"/> |
|||
Fluttuazioni della pressione sanguigna e disturbi [[elettrolita|elettrolitici]], così come la [[polmonite]] e lo [[scompenso cardiaco]], sono complicanze che si riscontrano nella metà delle persone ricoverate con ESA e che possono peggiorare la prognosi<ref name=vanGijn/>. Questi eventi possono verificarsi durante il ricovero ospedaliero in circa un terzo dei casi<ref name=Suarez/>. Molti ritengono che i pazienti potrebbero beneficiare di prevenzione con [[Anticonvulsivante|farmaci antiepilettici]]<ref name=Suarez/>. Anche se questo è largamente praticato<ref name="pmid17695377">{{cite journal |author=Rosengart AJ, Huo JD, Tolentino J, ''et al.'' |title=Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs |journal=Journal of Neurosurgery |volume=107 |issue=2 |pages=253–60 |year=2007 |month=August |pmid=17695377 |doi=10.3171/JNS-07/08/0253}}</ref>, non esistono alcune buone prove che ne giustifichino l'uso<ref name="pmid16424735">{{cite journal |author=Naval NS, Stevens RD, Mirski MA, Bhardwaj A |title=Controversies in the management of aneurysmal subarachnoid hemorrhage |journal=Critical Care Medicine |volume=34 |issue=2 |pages=511–24 |year=2006 |month=February |pmid=16424735 | doi=10.1097/01.CCM.0000198331.45998.85}}</ref><ref name="pmid17763834">{{cite journal |author=Liu KC, Bhardwaj A |title=Use of prophylactic anticonvulsants in neurologic critical care: a critical appraisal |journal=Neurocritical Care |volume=7 |issue=2 |pages=175–84 |year=2007 |pmid=17763834 |doi=10.1007/s12028-007-0061-5}}</ref>. In alcuni studi, l'uso di questi farmaci è stato associato ad una prognosi peggiore, questo potrebbe essere perché effettivamente sono causa di un danno o perché essi sono usati più frequentemente nelle persone con una prognosi peggiore<ref name="prognostic">{{cite journal |author=Rosengart AJ, Schultheiss KE, Tolentino J, Macdonald RL |title=Prognostic factors for outcome in patients with aneurysmal subarachnoid hemorrhage |journal=Stroke |volume=38 |issue=8 |pages=2315–21 |year=2007 |month=August |pmid=17569871 |doi=10.1161/STROKEAHA.107.484360 | url=http://stroke.ahajournals.org/cgi/content/full/38/8/2315}}</ref><ref name="pmid15662039">{{cite journal |author=Naidech AM, Kreiter KT, Janjua N, ''et al.'' |title=Phenytoin exposure is associated with functional and cognitive disability after subarachnoid hemorrhage |journal=Stroke |volume=36 |issue=3 |pages=583–7 |year=2005 |month=March |pmid=15662039 |doi=10.1161/01.STR.0000141936.36596.1e |url=http://stroke.ahajournals.org/cgi/content/full/36/3/583}}</ref> Nei pazienti affetti affetti da emorragia subaracnoidea vi è inoltre la possibilità di un'emorragia gastrica a causa da [[ulcera gastrica|ulcera]] da stress<ref>{{cite book |title=Neurology and Neurosurgery Illustrated |last=Lindsay |first=Kenneth W |coauthors=Ian Bone, Robin Callander |year=1993 |publisher=Churchill Livingstone |location=United States |isbn=0-443-04345-0}}</ref>. |
|||
== Prognosi== |
|||
===Morbilità e la mortalità=== |
|||
[[File:SAH1.JPG|thumb|left|Emmoragia subaracnoidea.]] |
|||
L'ESA è spesso associato ad una prognosi infausta<ref name=Feigin05>{{cite journal |author=Feigin VL, Rinkel GJ, Lawes CM, ''et al.'' |title=Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies |journal=Stroke |volume=36 |issue=12 |pages=2773–80 |year=2005 |pmid=16282541 |doi=10.1161/01.STR.0000190838.02954.e8 |url=http://stroke.ahajournals.org/cgi/content/full/36/12/2773}}</ref> . Il [[tasso di mortalità]] per l'ESA risulta essere tra il 40 e il 50% <ref name="Teunissen96"/> ma la tendenze per la sopravvivenza è in miglioramento. <ref name=vanGijn/> Dei sopravvissuti, più di un quarto presenta notevoli restrizioni nel proprio stile di vita e meno di un quinto non hanno sintomi residui di sorta [29]. Il ritardo nella diagnosi di emorragie subaracnoidea minori (confondendo il mal di testa improvviso per l'emicrania) contribuisce ad prognosi negativa. [15] Fattori clinici trovati al momento del ricovero, come [[ipertensione]] [[sistole|sistolica]], malattie del [[fegato]], [[infarto|inferti]] precedenti, età, influiscono negativamente sul decorso della malattia.<ref name="prognostic"/> I fattori che portano ad un peggioramento della prognosi durante la degenza, comprendono: insorgenze di ischemie da vasospasmo, sviluppo di ematoma intracerebrale o di emorragia intraventricolare (sanguinamento nel ventricolo del cervello) e presenza di [[febbre]]<ref name="prognostic"/>. |
|||
La prognosi di trauma cranico è influenzata in gran parte dalla posizione e dalla quantità di emorragia subaracnoidea presente<ref name="Armin06"/> Risulta tuttavia difficile isolare gli effetti dell'ESA dagli altri aspetti del danno cerebrale traumatico. Non è noto se la presenza di sangue subaracnoideo peggiora effettivamente la prognosi o se è semplicemente un segno dell'essersi verificato un trauma significativo.<ref name="Armin06"/> Tuttavia, oltre il 90% delle persone con emorragia subaracnoidea traumatica e un punteggio [[Glasgow Coma Scale]] di 12 hanno un buon risultato.<ref name="Armin06"/> |
|||
Esistono anche alcune prove modeste che fattori genetici possano influenzare la prognosi di ESA. Ad esempio, due copie di ApoE4 (una variante di un [[gene]] che codifica la [[apolipoproteina E]], che giova inoltre un ruolo importante nella [[malattia di Alzheimer]]) sembra poter aumentare il rischio di ischemia e quindi un esito peggiore<ref name="pmid17709709">{{cite journal |author=Lanterna LA, Ruigrok Y, Alexander S, ''et al.'' |title=Meta-analysis of APOE genotype and subarachnoid hemorrhage: clinical outcome and delayed ischemia |journal=Neurology |volume=69 |issue=8 |pages=766–75 |year=2007 |month=August |pmid=17709709 |doi=10.1212/01.wnl.0000267640.03300.6b}}</ref>. La comparsa di [[iperglicemia]] (zuccheri nel sangue alti) dopo un episodio di emorragia subaracnoidea conferisce un rischio più elevato di risultati negativi<ref>{{cite journal |author=Kruyt ND, Biessels GJ, de Haan RJ, ''et al.'' |title=Hyperglycemia and clinical outcome in aneurysmal subarachnoid hemorrhage: a meta-analysis |journal=Stroke |volume=40 |issue=6 |pages=e424–30 |year=2009 |month=June |pmid=19390078 |doi=10.1161/STROKEAHA.108.529974}}</ref>. |
|||
===I risultati nel lungo termine=== |
|||
Sintomi neurocognitivi, come come l'[[affaticamento]], disturbi dell'[[Disturbi dell'umore|umore]] e altri sintomi correlati sono sequele comuni. Anche in coloro che hanno compiuto un buon recupero neurologico, [[ansia]], [[depressione]], [[disturbo post traumatico da stress]] e deficit cognitivi possono presentarsi frequentemente. Il 46% delle persone che hanno sofferto un'emorragia subaracnoidea hanno deficit cognitivi che influenzano la qualità della loro vita<ref name=Suarez/>. Oltre il 60% lamenta frequenti mal di testa [48]. L'emorragia subaracnoidea aneurismatica può causare danni all'[[ipotalamo]] e alla [[ghiandola pituitaria]], due aree del cervello che giocano un ruolo centrale nella regolazione della produzione ormonale. Più di un quarto di persone con una precedente ESA può sviluppare ipopituitarismo (carenze in uno o più degli ormoni ipotalamo-ipofisi come l'[[Somatotropina|ormone della crescita]], l'[[Ormone luteinizzante|ormone luteinizzante]] o l'[[Ormone follicolo-stimolante|ormone follicolo-stimolante]])<ref>{{cite journal |author=Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A |title=Hypothalamopituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review |journal=Journal of the American Medical Association |volume=298 |issue=12 |pages=1429–38 |year=2007 |month=September |pmid=17895459 |doi=10.1001/jama.298.12.1429 |url=http://jama.ama-assn.org/cgi/content/full/298/12/1429}}</ref>. |
|||
== Epidemiologia== |
|||
[[File:SAH incidence graph.svg|thumb|Numero medio di persone con ESA per 100.000 persone-anno, suddivisi per età<ref name=DeRooij2007/>.]] |
|||
Secondo una revisione di 51 studi provenienti da 21 paesi, l'incidenza media di emorragia subaracnoidea è di 1,9 per 100.000 individui ogni anno. Studi condotti in [[Giappone]] e [[Finlandia]] mostrano tassi più elevati in quei paesi (22,7 e 19,7, rispettivamente), per ragioni che non appaiono del tutto giustificabili. Sud e Centro America, al contrario, hanno in media un tasso di 4,2 per 100.000<ref name=DeRooij2007>{{cite journal |author=de Rooij NK, Linn FH, van der Plas JA, Algra A, Rinkel GJ |title=Incidence of subarachnoid haemorrhage: A systematic review with emphasis on region, age, gender and time trends |journal=Journal of Neurology, Neurosurgery, and Psychiatry |volume=78 |issue=12 |pages=1365–72 |year=2007 |month=December |pmid=17470467 |doi=10.1136/jnnp.2007.117655}}</ref>. |
|||
Anche se il gruppo di persone a rischio di emorragia subaracnoidea risulta essere più giovane rispetto alla popolazione colpita da [[ictus]]<ref name=Feigin05/>, il rischio tende ad aumentare con l'età. I giovani sono molto meno a rischio rispetto alle persone di mezza età ([[rischio relativo]] 0,1, o 10%) di subire un'emorragia subaracnoidea<ref name=DeRooij2007/>. Il rischio continua ad aumentare con l'età ed è il 60% più alto nei pazienti molto anziani (85 anni) rispetto che in quelli tra i 45 e i 55<ref name=DeRooij2007/>. Il rischio di emorragia subaracnoidea è circa il 25% più elevato nelle donne sopra i 55 anni rispetto agli uomini della stessa età, probabilmente riflettendo i cambiamenti [[ormone|ormonali]] che risultano dalla menopausa, come la diminuzione dei livelli di [[estrogeni]]<ref name=DeRooij2007/>. |
|||
La genetica può avere un ruolo nella predisposizione di un individuo alla ESA. Il rischio aumenta da tre a cinque volte nei parenti di primo grado di persone che hanno sofferto di un'emorragia subaracnoidea<ref name="oxford"/>. Tuttavia, i fattori dello stile di vita risultano essere più importanti nel determinare il rischio complessivo.<ref name=Feigin05/> . Questi fattori di rischio sono: [[tabagismo|fumo]], [[ipertensione]] e [[alcolismo|eccessiva assunzione di alcool]]<ref name="Teunissen96"/>. Essere stato un fumatore conferisce un rischio raddoppiato di soffrire di ESA.<ref name=Feigin05/>Alcuni altri aumenti di rischio di però incerto significato sono attribuibili all' [[caucasico|etnia caucasica]], alla [[terapia ormonale sostitutiva]], al [[diabete mellito]] e a livelli elevati di [[colesterolo]].<ref name=Feigin05/> Circa il 4% di sanguinamenti aneurismatica si verificano dopo un [[rapporto sessuale]] e il 10% delle persone con ESA si sono chinati o hanno sollevato oggetti pesanti all'inizio dell'esordio dei sintomi<ref name="oxford2"/>. |
|||
Complessivamente, circa l'1% di tutte le persone hanno avuto uno o più aneurismi cerebrali. La maggior parte di questi, tuttavia, sono piccoli e di difficile rottura<ref name=ISUIA>{{cite journal |author=International Study of Unruptured Intracranial Aneurysms Investigators |title=Unruptured intracranial aneurysms—risk of rupture and risks of surgical intervention |journal=New England Journal of Medicine |volume=339 |issue=24 |pages=1725–33 |year=1998 |month=December |pmid=9867550 | url=http://content.nejm.org/cgi/content/full/339/24/1725 |doi=10.1056/NEJM199812103392401}}</ref>. |
|||
==Storia== |
|||
Mentre il quadro medico clinico di emorragia subaracnoidea può essere stato riconosciuto da [[Ippocrate di Coo|Ippocrate]], l'esistenza di aneurismi cerebrali e il fatto che possano rompersi non è stata stabilita fino al [[XVIII secolo]].<ref name=Longstreth>{{cite journal |author=Longstreth WT, Koepsell TD, Yerby MS, van Belle G |title=Risk factors for subarachnoid hemorrhage |journal=Stroke |volume=16 |issue=3 |pages=377–85 |year=1985 |pmid=3890278 |url=http://stroke.ahajournals.org/cgi/reprint/16/3/377.pdf|format=PDF}}</ref> I sintomi associati sono stati descritti più dettagliatamente nel [[1886]] a [[Edimburgo]] da [[Byrom Bramwell]].<ref>{{cite journal| author=Bramwell B | title=Spontaneous meningeal haemorrhage | journal=Edinburgh Medical Journal | year=1886 | volume=32 | pages=101}}</ref> Nel [[1924]], a [[Londra]], il [[neurologo]] [[Sir Charles P. Symonds]] (1890-1978) ha fornito un resoconto completo di tutti i principali sintomi di emorragia subaracnoidea, e ha coniato il termine "emorragia subaracnoidea spontanea."<ref name=Longstreth/><ref>{{cite journal | author=Symonds CP | title=Spontaneous subarachnoid hemorrhage | journal=Quarterly Journal of Medicine | year=1924 | volume=18 | pages=93–122 | doi=10.1093/qjmed/os-118.69.93}}</ref><ref name=Todd>{{cite journal |author=Todd NV, Howie JE, Miller JD |title=Norman Dott's contribution to aneurysm surgery |journal=Journal of Neurology, Neurosurgery, and Psychiatry |volume=53 |issue=6 |pages=455–8 |year=1990 |month=June |pmid=2199609 | pmc=1014202 |doi=10.1136/jnnp.53.6.455}}</ref> Symonds ha poi descritto l'uso della puntura lombare e della xanthochromia nella diagnosi<ref>{{cite journal | author=Symonds CP | title=Spontaneous sub-arachnoid hæmorrhage | journal=Proceedings of the Royal Society of Medicine | year=1924 | volume=17 | pages=39–52 | pmc=2201441 | pmid=19983808 | issue=Neurol Sect}}</ref>. |
|||
Il primo intervento chirurgico è stato effettuato da [[Norman]], che fu allievo di [[Harvey Cushing]]. Egli ha introdotto l'involucro degli aneurismi nel [[1930]], ed è stato un pioniere nell'uso dell' [[Angiografia|angiogramma]]<ref name=Todd/>. Il neurochirurgo statunitense [[Walter Dandy]], lavorando a [[Baltimora]], è stato il primo ad introdurre le clip nel [[1938]]<ref name=Dandy1938/> . La [[microchirurgia]] è stato applicata al trattamento dell'aneurisma a partire dal [[1972]] al fine di migliorarne ulteriormente i risultati.<ref>{{cite journal |author=Krayenbühl HA, Yaşargil MG, Flamm ES, Tew JM |title=Microsurgical treatment of intracranial saccular aneurysms |journal=Journal of Neurosurgery |volume=37 |issue=6 |pages=678–86 |year=1972 |month=December |pmid=4654697 |doi=10.3171/jns.1972.37.6.0678}}</ref> Nel [[1983]], il neurochirurgo russo [[Zubkov]] con i suoi colleghi ha riportato il primo utilizzo di angioplastica transluminale di vasospasmo dopo una emorragia subaracnoidea aneurismatica.<ref>{{cite journal |author=Zubkov IuN, Nikiforov BM, Shustin VA |title=1st attempt at dilating spastic cerebral arteries in the acute stage of rupture of arterial aneurysms |journal=Zh Vopr Neirokhir Im N N Burdenko |volume=5 |issue= 5|pages=17–23 |year=1983 |month=Sep-Oct |pmid=6228084 |doi=}}</ref><ref>{{cite journal |author=Zubkov YN, Nikiforov BM, Shustin VA |title=Balloon catheter technique for dilatation of constricted cerebral arteries after aneurysmal SAH |journal=Acta Neurochir (Wien) |volume=70 |issue=1-2 |pages=65–79 |year=1984 |month=Sep-Oct |pmid=6234754 |doi=10.1007/BF01406044}}</ref> L'italiano [[Guido Guglielmi]] ha presentato il suo trattamento endovascolare a bobina nel [[1991]]<ref name=Guiglielmi1991/><ref>{{cite journal |author=Strother CM |title=Historical perspective. Electrothrombosis of saccular aneurysms via endovascular approach: part 1 and part 2 |journal=AJNR. American Journal of Neuroradiology |volume=22 |issue=5 |pages=1010–2 |date=1 May 2001|pmid=11337350 |url=http://www.ajnr.org/cgi/content/full/22/5/1011 }}</ref>. |
|||
==Note== |
|||
{{references|2}} |
|||
==Altri progetti== |
|||
{{interprogetto|commons=Category:Subarachnoid hemorrhage}} |
|||
== Collegamenti esterni == |
== Collegamenti esterni == |
||
Versione delle 19:22, 4 giu 2011
Per emorragia subaracnoidea (detta anche ESA) si intende un sanguinamento che ha luogo nell'area compresa tra l'aracnoide e la pia madre, membrane che circondano il cervello. Il termine è talvolta utilizzato come sinonimo di emorragia cerebrale. Essa talvolta si può manifestare in maniera spontanea, generalmente per la rottura di un aneurisma cerebrale o può essere una conseguenza di un trauma cranico.
I sintomi di emorragia subaracnoidea includono un forte mal di testa con una rapida insorgenza ("cefalea a rombo di tuono"), vomito, confusione o un abbassamento del livello di coscienza e, talvolta, convulsioni. [1] La diagnosi viene generalmente confermata grazie ad un esame TC alla testa o occasionalmente con una puntura lombare. Il trattamento è prevalentemente neurochirurgico o di radiologia interventistica associati ad altri interventi atti a prevenire recidive o complicanze. La chirurgia per aneurismi è stata introdotto nel 1930, ma a partire dal 1990 molti aneurismi vengono trattati con una procedura meno invasiva, chiamata Guglielmi Detachable Coil che viene effettuata grazie a particolari strumenti inseriti attraverso vasi sanguigni di grandi dimensioni[1].
L' ESA è una forma di ictus e comprende l' 1-7% di tutti gli ictus[2]. Si tratta di una emergenza medica e può portare alla morte o gravi disabilità, se non riconosciuta e trattata in una fase precoce. Circa la metà di tutti i casi di ESA risultano essere mortali, il 10-15% di essi prima ancora di raggiungere un ospedale,[1] i pazienti sopravvissuti spesso presentano danni neurologici o cognitivi[3].
Segni e sintomi
Il classico sintomo di emorragia subaracnoidea è un "mal di testa a rombo di tuono" (descritto anche "come essere preso a calci in testa ",[4] o "il mal di testa più forte mai provato") che si sviluppa in pochi secondi o minuti. Spesso il dolore viene percepito come una pulsazione verso l'occipite (parte posteriore della testa)[5]. Circa un terzo dei malati non presentano altri sintomi,[1] vomito può essere presente, e 1 su 14 hanno convulsioni. [1] La confusione, la diminuzione del livello di coscienza o lo stato di coma possono presentarsi, come la rigidità del collo e altri sintomi del meningismo [1]. La rigidità del collo solitamente si presenta sei ore dopo l'insorgenza iniziale di ESA[6]. La dilatazione isolata di una pupilla e la perdita del riflesso pupillare alla luce può riflettere un'ernia cerebrale avvenuta a seguito di un aumento della pressione intracranica (pressione all'interno del cranio) [1]. L'emorragia intraoculare (sanguinamento del bulbo oculare) può verificarsi in risposta alla pressione elevata, questa è nota come sindrome di Terson (si verifica nel 3-13% dei casi) ed è comune nei casi più gravi di ESA[7].
Anomalie ai movimenti oculari (occhi che guardano verso il basso e verso l'esterno e incapacità di sollevare la palpebra sullo stesso lato) o paralisi (perdita di sensibilità) possono indicare una emorragia della arteria comunicante posteriore. [1][5] Le convulsioni sono più comuni, se l'emorragia è conseguenza di un aneurisma, altrimenti è difficile determinare il luogo e l'origine dell' emorragia dai sintomi[1][5]
Come conseguenza dell'emorragia, l'organismo produce grandi quantità di adrenalina e ormoni simili. Questo porta ad un forte aumento della pressione sanguigna, il cuore è notevolmente sotto sforzo, si può verificare un edema polmonare (accumulo di liquido nei polmoni), aritmie cardiache (irregolarità nel battito cardiaco e ritmo), alterazioni dell'elettrocardiogramma (nel 27% dei casi)[8] e l'arresto cardiaco (nel 3% dei casi) si può verificare rapidamente dopo l'insorgenza dell'emorragia. [1][9]
L'emorragia subaracnoidea può pertanto verificarsi in soggetti che hanno subito un trauma cranico. I sintomi possono includere mal di testa, diminuzione del livello di coscienza e emiparesi (debolezza di un lato del corpo). L' ESA è un evento frequente nel danno cerebrale traumatico e porta ad una prognosi infausta se è associata a un peggioramento del livello di coscienza[10].
Cause
Nell' 85% dei casi di emorragia subaracnoidea spontanea la causa è la rottura di un aneurisma cerebrale: una debolezza nella parete di una delle arterie del cervello che si ingrossa fino a rompersi. Gli aneurismi tendono ad essere situati nel circolo di Willis o nelle sue vicinanze. Mentre la maggior parte dei casi di ESA sono dovute al sanguinamento di piccoli aneurismi. Aneurismi più grandi (che sono meno diffusi) hanno maggiori probabilità di rottura. [1].
Nel 15-20% dei casi di ESA spontanea, l'aneurisma non viene identificato dal primo angiogramma[11]. Circa la metà di questi sono attribuiti a emorragia perimesencefalica in cui la presenza di sangue è limitata agli spazi subaracnoidei di tutto il mesencefalo.[1] I restanti aneurismi sono dovuti ad altre malattie che interessano il sistema circolatorio, come malformazioni artero-venose, disturbi dei vasi sanguigni nel midollo spinale e sanguinamento presente in vari tumori[1].L'abuso di cocaina e l'anemia falciforme (di solito nei bambini) e, raramente, la terapia anticoagulante e l'apoplessia pituitaria possono dar luogo a ESA[6][11].
Sanguinamenti subaracnoidei possono essere rilevati grazie all'esame TC nel 60% delle persone con trauma cranico.[12] Le emorragie subaracnoide traumatiche si verificano solitamente nei pressi del sito di una frattura del cranio o di contusione intracerebrale[11].
Diagnosi
Imaging
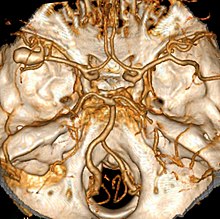
I passi iniziali per la valutazione di un paziente con una sospetta emorragia subaracnoidea sono ottenere la sua storia medica e l'esecuzione di un esame fisico, questi sono volti a determinare se i sintomi sono dovuti a una emorragia subaracnoidea o ad altra causa. La diagnosi non può, tuttavia, essere fatta solo su basi cliniche; Pertanto l'imaging diagnostico è eseguito per confermare o escludere la presenza di una sanguinamento. L'esame di elezione è la tomografia computerizzata (TC) del cervello. Questo esame permette di identificare correttamente oltre il 95% dei casi, soprattutto se effettuato entro il primo giorno dopo l'esordio del sanguinamento. La risonanza magnetica (MRI) può essere più sensibile della TC dopo diversi giorni dall'insorgenza[1].
Puntura lombare
La puntura lombare, in cui il liquido cerebrospinale viene rimosso con un ago, mostra le prove di emorragia nel 3% delle persone in cui la TC è risultata normale. Pertanto la puntura lombare è considerata obbligatoria nel caso di pazienti in cui sussiste un forte sospetto di di emorragia subaracnoidea nonostante l'imaging risulti negativo.[1] Almeno tre provette di liquido cerebrospinale vengono[6]. Se un elevato numero di globuli rossi è ugualmente presente in tutte le provette, si può diagnosticare una emorragia subaracnoidea. Se il numero di cellule è minore in almeno una delle fiale è più probabile che ciò si sia verificato a causa di danni a un piccolo vaso sanguigno nel corso del procedimento.[3] Il campione di liquor viene poi esaminato per xanthochromia. Più sensibile è la spettrofotometria (misurando l'assorbimento di particolari lunghezze d'onda della luce) per la rilevazione di bilirubina, un prodotto di degradazione dell'emoglobina dei globuli rossi.[1] [13] Xanthochromia e spettrofotometria rimangono procedure affidabili per rilevare ESA dopo alcuni giorni dall'inizio del mal di testa.[13] Un intervallo di almeno 12 ore è necessario tra l'insorgenza del mal di testa e l'analisi della bilirubina, poichè ci vogliono diverse ore perchè l'emoglobina dai globuli rossi possa essere metabolizzata. [1] [13]

Mentre solo il 10% di persone ricoverate al pronto soccorso con un mal di testa a "rombo di tuono" sono realmente affetti da una emorragia subaracnoidea, altre possibili cause possono essere considerate: meningite, emorragia emicrania, trombosi venosa, ecc..[4][13]. Non è insolito per l'ESA essere inizialmente diagnosticata erroneamente come una forte emicrania o cefalea, ciò può portare ad un ritardo nell'esecuzione di una TC. In uno studio del 2004 si è visto che questo si è verificato nel 12% dei casi e in particolare in persone che avevano piccole emorragie e nessun deterioramento nel loro stato mentale. Il ritardo nella diagnosi ha portato ad un peggioramento del decorso.[15] In alcuni pazienti il mal di testa si è risolto spontaneamente senza la presentazione di altri sintomi. Questo tipo di mal di testa è indicato come "mal di testa sentinella", perché si presume essere determinato da un piccolo sanguinamento (un "sanguinamento di avvertimento") da un aneurisma.[3]
Angiografia
Dopo la conferma di una emorragia subaracnoidea è necessario determinare la sua origine. Se si ritiene che l'emorragia abbia avuto origine da un aneurisma (come determinato apparentemente dalla TC), la scelta è tra l'angiografia cerebrale (iniettando radio-contrasto attraverso un catetere nelle arterie del cervello) e l'angiografia TC (i vasi sanguigni vengono visualizzati grazie ad un mezzo di contrasto durante una scansione TC). Il cateterismo cardiaco offre poi la possibilità di effettuare un avvolgimento di aneurisma (vedi sotto).[1] [3]
ECG

Alterazioni elettrocardiografiche sono comuni nel 40-70% dei casi di emorragia subaracnoidea. Essi possono includere un prolungamento dell'intervallo QT, onde Q, sopralivellamento del tratto ST e aritmie cardiache.[14]
Classificazione
Ci sono diverse scale di valutazione disponibili per le emorragie subaracnoide. La Glasgow Coma Scale è utilizzata per la valutazione obbiettiva dello stato di coscienza. Tre scale di punteggi specializzate sono utilizzate per valutarla e in ciascuna, un numero maggiore è associato ad una prognosi peggiore[15]. Queste scale sono state derivate retrospettivamente dalle caratteristiche dei pazienti e dal loro decorso clinico.
La prima scala di gravità, come descritta da Hunt e Hess nel 1968[16]:
| Grado | Segni e sintomi | Sopravvivenza |
|---|---|---|
| 1 | Asintomatico o lieve rigidità al collo e dolore alla testa | |
| 2 | Mal di testa da moderato a severo, rigidità al collo. Nessun deficit neurologico tranne paralisi dei nervi cranici | 60% |
| 3 | Sonnolenza, minimi deficit radiologici | 50% |
| 4 | Da moderata a severa emiparesi, possibile postura scorretta, disturbi delle funzioni vegetative | 20% |
| 5 | Coma profondo | 10% |
Il grado di Fisher classificatore emorragia subaracnoidea la comparsa sulla TC.[17] Questa scala è stata modificata da Claassen e collaboratori, comprendendo il rischio additivo dalla grandezza dell'emorragia intraventricolare[18].
| Grade | Apparenza dell'emorragia |
|---|---|
| 1 | Non evidente |
| 2 | Meno di 1 mm di spessore |
| 3 | Più di 1 millimetro di spessore |
| 4 | Qualsiasi spessore con emorragia intraventricolare o estensione parenchimale |
La Federazione Mondiale di neurochirurghi (WFNS) classificazione utilizza il punteggio del coma di Glasgow (GCS) e deficit neurologico focale di valutare la gravità dei sintomi[19].
| Grade | GCS | Deficit neurologico focale |
|---|---|---|
| 1 | 15 | Assente |
| 2 | 13–14 | Assente |
| 3 | 13–14 | Presente |
| 4 | 7–12 | Presente o assente |
| 5 | <7 | Presente o assente |
Uno schema di classificazione globale è stato suggerito da Ogilvy e Carter per predire l'esito e la terapia.[20] Il sistema consiste di cinque gradi e si assegna un punto per la presenza o meno di ciascuno dei cinque fattori[20]:
- Età superiore a 50
- Hunt e Hess di grado 4 o 5
- Scala Fisher di 3 o 4
- Dimensioni dell'aneurisma maggiore di 10 mm
- Aneurismi a circolazione posteriore 25 mm o più
Screening e prevenzione
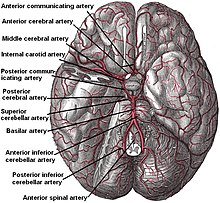
Lo screening per aneurisma non viene eseguito a livello di popolazione in generale, poichè i casi sono relativamente rari. Se un individuo ha due o più parenti di primo che hanno sofferto di emorragia subaracnoidea aneurismatica lo screening può presentarsi utile[1] [21].
Nel 8% dei pazienti affetti da malattia policistica renale autosomica dominante (ADPKD), una malattia ereditaria che colpisce il rene, risultano casi di aneurismi celebrali, ma spesso di piccola entità per cui è improbabile la rottura. In questo caso lo screening è consigliato solo in famiglie con ADPKD dove un membro ha subito una rottura di aneurisma[22].
Un aneurisma può essere rilevato non intenzionalmente durante lo studio di immagini del cervello eseguite per altri motivi, in questo caso la scelta se intervenire o meno può essere difficoltosa in quanto il trattamento può essere associato a importanti complicanze. Uno studio internazionale sugli aneurismi intracranici non rotti ha fornito dei dati sulle varie prognosi. Esso ha dimostrato che coloro che avevano precedentemente sofferto di rottura di aneurismi avevano più probabilità di rottura, mentre chi non aveva mai sperimentato sanguinamenti a presenta aneurismi di piccole dimensioni (inferiori ai 10 mm) i rischi dell'intervento chirurgico erano superiori alle probabilità del verificarsi di una rottura[21] . Sulla base di questo studio, oggigiorno, l'intervento preventivo è consigliato solo se il paziente ha una ragionevole aspettativa di vita e presenta una aneurisma altamente suscettibile a rottura[21] . Allo stesso tempo vi sono limitate evidenze che il trattamento endovascolare degli aneurismi non rotti sia in realtà benefico[23].
Trattamento

Il trattamento dell'emorragia subaracnoidea coinvolge le misure di gestione generale per la stabilizzazione del paziente mentre vengono effettuate indagini specifiche e trattamenti. Quest'ultimi includono la prevenzione di un possibile risanguinamento grazie all'eliminazione della fonte di sanguinamento, la prevenzione di un fenomeno conosciuto come vasospasmo e dalla prevenzione e dal trattamento delle possibili complicanze[1].
Misure generali
Stabilizzare il paziente è la prima priorità. Per quelli che presentano un livello ridotto di coscienza può rendersi necessario procedere ad intubazione e alla ventilazione artificiale. La pressione arteriosa, la frequenza cardiaca, la frequenza respiratoria e la valutazione della Glasgow Coma Scale sono parametri che devono essere controllati frequentemente. Una volta che la diagnosi viene confermata, la terapia deve essere impostata precocemente. La nutrizione del paziente rappresenta un'ulteriore priorità e viene effettuata o mediante l'applicazione di un sondino naso gastrico o tramite via parenterale. L'analgesia (controllo del dolore) viene limitata il più possibile, in quanto la sedazione può incidere sullo stato mentale e interferire con la capacità di controllare quindi il livello di coscienza. La trombosi venosa profonda è impedita facendo indossare al paziente le calze a compressione o presidi simili[1]. Un catetere vescica viene generalmente inserito per controllare l'equilibrio dei fluidi. Le benzodiazepine possono essere somministrate per alleviare lo stress[6]. Farmaci antiemetici dovrebbe essere date alle persone sveglie[5].
Prevenzione del risanguinamento
I pazienti le cui immagini TC mostrano un grosso ematoma, depressione del livello di coscienza o sintomi neurologici focali possono beneficiare di una urgente rimozione chirurgica del sangue o di una occlusione del sito di sanguinamento. Gli altri pazienti vengono di solito sottoposti a un angiogramma transfemorale o a angiografia TC. E' difficile prevedere chi soffrirà di un risanguinamento, ma questo può accadere in qualsiasi momento e ciò porta generalmente ad una prognosi infausta. Dopo che sono passate le prime 24 ore, il rischio di risanguinamento rimane circa il 40% nelle successive quattro settimane, questo suggerisce che gli interventi dovrebbero essere rivolti a ridurre questo rischio precocemente[1].
Se un aneurisma cerebrale viene identificato grazie ad angiografia, due interventi possono essere effettuati per ridurre il rischio di sanguinamento: Il clipping[24] e l'avvolgimento[25]. Il clipping richiede una craniotomia (apertura del cranio) per individuare l'aneurisma, seguita dal posizionamento di una clip attorno al collo dell'aneurisma.
L'avvolgimento viene effettuato attraverso i grandi vasi sanguigni: un catetere viene inserito nell'arteria femorale all'inguine e viene fatto avanzare attraverso l'aorta verso le arterie che alimentano il cervello (entrambe le arterie carotidee e vertebrali). Quando l'aneurisma è stato localizzato, fili di platino vengono rilasciate nell'aneurisma che causano un coagulo di sangue che lo blocca[26].
La decisione su quale trattamento eseguire, viene in genere fatta da un team multidisciplinare composto da un neuroradiologo, neurochirurgo e spesso altri professionisti della salute[1].
 |
 |
In generale, la decisione tra il clippaggio e l'avvolgimento viene effettuato sulla base della posizione dell'aneurisma, la sua dimensione e la condizione del paziente. Gli aneurismi dell'arteria cerebrale media e le sue diramazioni sono difficili da raggiungere con l'angiografia e tendono ad essere suscettibili di clipping. Quelli dell'arteria basilare e dell'arteria cerebrale posteriore sono difficili da raggiungere chirurgicamente e sono più accessibili per la gestione endovascolare[27].
Questi approcci sono basati sull'esperienza e l'unico studio clinico controllato e randomizzato di confronto diretto tra le diverse modalità è stato eseguito su pazienti con piccoli aneurismi (meno di 10 mm) dell'arteria cerebrale anteriore e dell'arteria comunicante anteriore che costituiscono solo il circa 20% di tutti i pazienti con emorragia subaracnoidea aneurismatica[27][28]. Questo studio, l'International Subarachnoid Aneurysm Trial (ISAT), ha mostrato che in questo gruppo la probabilità di morte o di perdita dell'autosufficenza è stata ridotta (7,4% di riduzione del rischio assoluto, il 23,5% di riduzione del rischio relativo) se l'avvolgimento endovascolare è stato utilizzato in contrapposizione alla tecnica chirurgia[27]. Il principale svantaggio dell'avvolgimento è la possibilità che l'aneurisma si ripeta, questo rischio è molto piccolo nell'approccio chirurgico. Nello studio ISAT per l' 8,3% dei pazienti si è reso necessario un ulteriore trattamento a lungo termine. Quindi, le persone che hanno avuto un avvolgimento devono essere seguiti per molti anni tramite angiografia per scongiurare il ripetersi di aneurismi o per identificarli precocemente[29].
Vasospasmo
Il vasospasmo, in cui i vasi sanguigni si restringono e limitano il flusso di sangue, è una grave complicanza di ESA. Infatti esso può causare lesioni ischemiche cerebrali e danni permanenti al cervello dovuti alla mancanza di ossigeno. Può risultare fatale se grave. L'ischemia ritardata è caratterizzata da nuovi sintomi neurologici e può essere confermato dal ecodoppler transcranico o tramite angiografia cerebrale. Circa un terzo di tutte le persone ricoverate con emorragia subaracnoidea presentano un'ischemia da vasospasmo e la metà di questi soffrono di danni permanenti a causa di essa[30]. E' possibile seguire su schermo lo sviluppo di vasospasmo grazie all'ecodoppler transcranico ogni 24-48 ore. Una velocità del flusso sanguigno di più di 120 centimetri al secondo è indicativa di vasospasmo[3].
L'uso dei calcio-antagonisti, in grado di prevenire lo spasmo dei vasi sanguigni impedendo al calcio di entrare nelle cellule muscolari lisce, è stato proposto per la prevenzione del vasospasmo.[12] La somministrazione di nimodipina (calcio-antagonista) per via orale migliora i risultati, se somministrata tra il quarto giorno e il ventunesimo dopo l'emorragia, anche se essa non riduce significativamente la quantità di vasospasmo rilevato su angiografia[31]. In una emorragia subaracnoidea traumatica la nimodipina non incide sull'esito a lungo termine e non è quindi raccomandata[32]. Altri farmaci bloccanti dei canali del calcio e solfato di magnesio sono stati studiati ma non sono attualmente raccomandati né vi è alcuna prova che dimostra vantaggi se la nimodipina viene somministrato per via endovenosa[30].
Un protocollo denominato triple H è spesso usato come misura per il trattamento di vasospasmo, consiglia l'utilizzo di fluidi per via endovenosa al fine di raggiungere uno stato di ipertensione (pressione alta), ipervolemia (eccesso di liquidi in circolazione) e emodiluizione (lieve diluizione del sangue)[33]. Nessuno studio finora ha dimostrato i vantaggi di questo approccio[34].
Se i sintomi di ischemia da vasospasmo non migliorano con il trattamento medico, l'angiografia può essere tentata per identificare i siti di vasospasmo al fine di somministrare farmaci vasodilatatori (farmaci che rilassano la parete dei vasi sanguigni) direttamente nell'arteria. L'angioplastica (apertura della zona ristretta mediante un palloncino) può quindi essere eseguita[3].
Altre complicazioni
L'idrocefalo (ostruzione del flusso del liquido cerebrospinale) può essere una complicanza dell'ESA sia a breve e lungo termine. Viene rilevato mediante TAC osservando l'allargamento del ventricolo laterale. Se il livello di coscienza è diminuito, il drenaggio dei liquidi in eccesso è effettuato tramite puntura lombare, tramite drenaggio extraventricolare (un dispositivo temporaneo inserito nel ventricolo) o saltuariamente con uno shunt permanente[1][3]. Il trattamento corretto dell'idrocefalo può portare ad un miglioramento enorme nella condizione di un paziente.[5]
Fluttuazioni della pressione sanguigna e disturbi elettrolitici, così come la polmonite e lo scompenso cardiaco, sono complicanze che si riscontrano nella metà delle persone ricoverate con ESA e che possono peggiorare la prognosi[1]. Questi eventi possono verificarsi durante il ricovero ospedaliero in circa un terzo dei casi[3]. Molti ritengono che i pazienti potrebbero beneficiare di prevenzione con farmaci antiepilettici[3]. Anche se questo è largamente praticato[35], non esistono alcune buone prove che ne giustifichino l'uso[36][37]. In alcuni studi, l'uso di questi farmaci è stato associato ad una prognosi peggiore, questo potrebbe essere perché effettivamente sono causa di un danno o perché essi sono usati più frequentemente nelle persone con una prognosi peggiore[38][39] Nei pazienti affetti affetti da emorragia subaracnoidea vi è inoltre la possibilità di un'emorragia gastrica a causa da ulcera da stress[40].
Prognosi
Morbilità e la mortalità

L'ESA è spesso associato ad una prognosi infausta[2] . Il tasso di mortalità per l'ESA risulta essere tra il 40 e il 50% [13] ma la tendenze per la sopravvivenza è in miglioramento. [1] Dei sopravvissuti, più di un quarto presenta notevoli restrizioni nel proprio stile di vita e meno di un quinto non hanno sintomi residui di sorta [29]. Il ritardo nella diagnosi di emorragie subaracnoidea minori (confondendo il mal di testa improvviso per l'emicrania) contribuisce ad prognosi negativa. [15] Fattori clinici trovati al momento del ricovero, come ipertensione sistolica, malattie del fegato, inferti precedenti, età, influiscono negativamente sul decorso della malattia.[38] I fattori che portano ad un peggioramento della prognosi durante la degenza, comprendono: insorgenze di ischemie da vasospasmo, sviluppo di ematoma intracerebrale o di emorragia intraventricolare (sanguinamento nel ventricolo del cervello) e presenza di febbre[38].
La prognosi di trauma cranico è influenzata in gran parte dalla posizione e dalla quantità di emorragia subaracnoidea presente[12] Risulta tuttavia difficile isolare gli effetti dell'ESA dagli altri aspetti del danno cerebrale traumatico. Non è noto se la presenza di sangue subaracnoideo peggiora effettivamente la prognosi o se è semplicemente un segno dell'essersi verificato un trauma significativo.[12] Tuttavia, oltre il 90% delle persone con emorragia subaracnoidea traumatica e un punteggio Glasgow Coma Scale di 12 hanno un buon risultato.[12]
Esistono anche alcune prove modeste che fattori genetici possano influenzare la prognosi di ESA. Ad esempio, due copie di ApoE4 (una variante di un gene che codifica la apolipoproteina E, che giova inoltre un ruolo importante nella malattia di Alzheimer) sembra poter aumentare il rischio di ischemia e quindi un esito peggiore[41]. La comparsa di iperglicemia (zuccheri nel sangue alti) dopo un episodio di emorragia subaracnoidea conferisce un rischio più elevato di risultati negativi[42].
I risultati nel lungo termine
Sintomi neurocognitivi, come come l'affaticamento, disturbi dell'umore e altri sintomi correlati sono sequele comuni. Anche in coloro che hanno compiuto un buon recupero neurologico, ansia, depressione, disturbo post traumatico da stress e deficit cognitivi possono presentarsi frequentemente. Il 46% delle persone che hanno sofferto un'emorragia subaracnoidea hanno deficit cognitivi che influenzano la qualità della loro vita[3]. Oltre il 60% lamenta frequenti mal di testa [48]. L'emorragia subaracnoidea aneurismatica può causare danni all'ipotalamo e alla ghiandola pituitaria, due aree del cervello che giocano un ruolo centrale nella regolazione della produzione ormonale. Più di un quarto di persone con una precedente ESA può sviluppare ipopituitarismo (carenze in uno o più degli ormoni ipotalamo-ipofisi come l'ormone della crescita, l'ormone luteinizzante o l'ormone follicolo-stimolante)[43].
Epidemiologia

Secondo una revisione di 51 studi provenienti da 21 paesi, l'incidenza media di emorragia subaracnoidea è di 1,9 per 100.000 individui ogni anno. Studi condotti in Giappone e Finlandia mostrano tassi più elevati in quei paesi (22,7 e 19,7, rispettivamente), per ragioni che non appaiono del tutto giustificabili. Sud e Centro America, al contrario, hanno in media un tasso di 4,2 per 100.000[44].
Anche se il gruppo di persone a rischio di emorragia subaracnoidea risulta essere più giovane rispetto alla popolazione colpita da ictus[2], il rischio tende ad aumentare con l'età. I giovani sono molto meno a rischio rispetto alle persone di mezza età (rischio relativo 0,1, o 10%) di subire un'emorragia subaracnoidea[44]. Il rischio continua ad aumentare con l'età ed è il 60% più alto nei pazienti molto anziani (85 anni) rispetto che in quelli tra i 45 e i 55[44]. Il rischio di emorragia subaracnoidea è circa il 25% più elevato nelle donne sopra i 55 anni rispetto agli uomini della stessa età, probabilmente riflettendo i cambiamenti ormonali che risultano dalla menopausa, come la diminuzione dei livelli di estrogeni[44].
La genetica può avere un ruolo nella predisposizione di un individuo alla ESA. Il rischio aumenta da tre a cinque volte nei parenti di primo grado di persone che hanno sofferto di un'emorragia subaracnoidea[4]. Tuttavia, i fattori dello stile di vita risultano essere più importanti nel determinare il rischio complessivo.[2] . Questi fattori di rischio sono: fumo, ipertensione e eccessiva assunzione di alcool[13]. Essere stato un fumatore conferisce un rischio raddoppiato di soffrire di ESA.[2]Alcuni altri aumenti di rischio di però incerto significato sono attribuibili all' etnia caucasica, alla terapia ormonale sostitutiva, al diabete mellito e a livelli elevati di colesterolo.[2] Circa il 4% di sanguinamenti aneurismatica si verificano dopo un rapporto sessuale e il 10% delle persone con ESA si sono chinati o hanno sollevato oggetti pesanti all'inizio dell'esordio dei sintomi[5].
Complessivamente, circa l'1% di tutte le persone hanno avuto uno o più aneurismi cerebrali. La maggior parte di questi, tuttavia, sono piccoli e di difficile rottura[45].
Storia
Mentre il quadro medico clinico di emorragia subaracnoidea può essere stato riconosciuto da Ippocrate, l'esistenza di aneurismi cerebrali e il fatto che possano rompersi non è stata stabilita fino al XVIII secolo.[46] I sintomi associati sono stati descritti più dettagliatamente nel 1886 a Edimburgo da Byrom Bramwell.[47] Nel 1924, a Londra, il neurologo Sir Charles P. Symonds (1890-1978) ha fornito un resoconto completo di tutti i principali sintomi di emorragia subaracnoidea, e ha coniato il termine "emorragia subaracnoidea spontanea."[46][48][49] Symonds ha poi descritto l'uso della puntura lombare e della xanthochromia nella diagnosi[50].
Il primo intervento chirurgico è stato effettuato da Norman, che fu allievo di Harvey Cushing. Egli ha introdotto l'involucro degli aneurismi nel 1930, ed è stato un pioniere nell'uso dell' angiogramma[49]. Il neurochirurgo statunitense Walter Dandy, lavorando a Baltimora, è stato il primo ad introdurre le clip nel 1938[24] . La microchirurgia è stato applicata al trattamento dell'aneurisma a partire dal 1972 al fine di migliorarne ulteriormente i risultati.[51] Nel 1983, il neurochirurgo russo Zubkov con i suoi colleghi ha riportato il primo utilizzo di angioplastica transluminale di vasospasmo dopo una emorragia subaracnoidea aneurismatica.[52][53] L'italiano Guido Guglielmi ha presentato il suo trattamento endovascolare a bobina nel 1991[25][54].
Note
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z van Gijn J, Kerr RS, Rinkel GJ, Subarachnoid haemorrhage, in Lancet, vol. 369, n. 9558, 2007, pp. 306–18, DOI:10.1016/S0140-6736(07)60153-6.
- ^ a b c d e f Feigin VL, Rinkel GJ, Lawes CM, et al., Risk factors for subarachnoid hemorrhage: an updated systematic review of epidemiological studies, in Stroke, vol. 36, n. 12, 2005, pp. 2773–80, DOI:10.1161/01.STR.0000190838.02954.e8.
- ^ a b c d e f g h i j Suarez JI, Tarr RW, Selman WR, Aneurysmal subarachnoid hemorrhage, in New England Journal of Medicine, vol. 354, n. 4, January 2006, pp. 387–96, DOI:10.1056/NEJMra052732.
- ^ a b c Murray Longmore, Ian Wilkinson, Tom Turmezei, Chee Kay Cheung, Oxford Handbook of Clinical Medicine, 7th edition, Oxford University Press, 2007, p. 841, ISBN 0-19-856837-1.
- ^ a b c d e f Punit Ramrakha, Kevin Moore, Oxford Handbook of Acute Medicine, 2nd edition, Oxford University Press, 2007, pp. 466–470, ISBN 0-19-852072-6
ISBNnon valido (aiuto). - ^ a b c d David A Warrell, Timothy M. Cox, et al., Oxford Textbook of Medicine, Fourth Edition, Volume 3, Oxford, 2003, pp. 1032–1034, ISBN 0-19-857013-9.
- ^ McCarron MO, Alberts MJ, McCarron P, A systematic review of Terson's syndrome: Frequency and prognosis after subarachnoid haemorrhage, in Journal of Neurology, Neurosurgery, and Psychiatry, vol. 75, n. 3, 2004, pp. 491–3, DOI:10.1136/jnnp.2003.016816.
- ^ Keith G. Allman, Iain H. Wilson, Oxford Handbook of Anaesthesia, 2nd edition, Oxford University Press, 2006, pp. 408–409, ISBN 0198566090
ISBNnon valido (aiuto). - ^ Banki NM, Kopelnik A, Dae MW, et al., Acute neurocardiogenic injury after subarachnoid hemorrhage, in Circulation, vol. 112, n. 21, 2005, pp. 3314–9, DOI:10.1161/CIRCULATIONAHA.105.558239.
- ^ Servadei F, Murray GD, Teasdale GM, et al., Traumatic subarachnoid hemorrhage: demographic and clinical study of 750 patients from the European brain injury consortium survey of head injuries, in Neurosurgery, vol. 50, n. 2, February 2002, pp. 261–7; discussion 267–9, DOI:10.1097/00006123-200202000-00006.
- ^ a b c Rinkel GJ, van Gijn J, Wijdicks EF, Subarachnoid hemorrhage without detectable aneurysm. A review of the causes, in Stroke, vol. 24, n. 9, 1º September 1993, pp. 1403–9.
- ^ a b c d e Armin SS, Colohan AR, Zhang JH, Traumatic subarachnoid hemorrhage: Our current understanding and its evolution over the past half century, in Neurological Research, vol. 28, n. 4, June 2006, pp. 445–52, DOI:10.1179/016164106X115053.
- ^ a b c Teunissen LL, Rinkel GJ, Algra A, van Gijn J, Risk factors for subarachnoid hemorrhage: a systematic review, in Stroke, vol. 27, n. 3, 1º March 1996, pp. 544–9.
- ^ Nguyen H, Zaroff JG, Neurogenic stunned myocardium, in Curr Neurol Neurosci Rep, vol. 9, n. 6, November 2009, pp. 486–91, DOI:10.1007/s11910-009-0071-0.
- ^ Rosen D, Macdonald R, Subarachnoid hemorrhage grading scales: A systematic review, in Neurocritical Care, vol. 2, n. 2, 2005, pp. 110–8, DOI:10.1385/NCC:2:2:110.
- ^ Hunt W, Hess R, Surgical risk as related to time of intervention in the repair of intracranial aneurysms, in Journal of Neurosurgery, vol. 28, n. 1, 1968, pp. 14–20, DOI:10.3171/jns.1968.28.1.0014.
- ^ Fisher C, Kistler J, Davis J, Relation of cerebral vasospasm to subarachnoid hemorrhage visualized by computerized tomographic scanning, in Neurosurgery, vol. 6, n. 1, 1980, pp. 1–9, DOI:10.1097/00006123-198001000-00001.
- ^ Claassen J, Bernardini GL, Kreiter K, et al., Effect of cisternal and ventricular blood on risk of delayed cerebral ischemia after subarachnoid hemorrhage: the Fisher scale revisited, in Stroke, vol. 32, n. 9, September 2001, pp. 2012–20, DOI:10.1161/hs0901.095677.
- ^ Teasdale G, Drake C, Hunt W, Kassell N, Sano K, Pertuiset B, De Villiers J, A universal subarachnoid hemorrhage scale: Report of a committee of the World Federation of Neurosurgical Societies, in Journal of Neurology, Neurosurgery, and Psychiatry, vol. 51, n. 11, 1988, p. 1457, DOI:10.1136/jnnp.51.11.1457.
- ^ a b Ogilvy CS, Carter BS, A proposed comprehensive grading system to predict outcome for surgical management of intracranial aneurysms, in Neurosurgery, vol. 42, n. 5, May 1998, pp. 959–68; discussion 968–70, DOI:10.1097/00006123-199805000-00001.
- ^ a b c White PM, Wardlaw JM, Unruptured intracranial aneurysms, in Journal of Neuroradiology, vol. 30, n. 5, December 2003, pp. 336–50.
- ^ Gibbs GF, Huston J, Qian Q, et al., Follow-up of intracranial aneurysms in autosomal-dominant polycystic kidney disease, in Kidney International, vol. 65, n. 5, May 2004, pp. 1621–7, DOI:10.1111/j.1523-1755.2004.00572.x.
- ^ Naggara ON, White PM, Guilbert F, Roy D, Weill A, Raymond J, Endovascular treatment of intracranial unruptured aneurysms: systematic review and meta-analysis of the literature on safety and efficacy, in Radiology, vol. 256, n. 3, September 2010, pp. 887–97, DOI:10.1148/radiol.10091982.
- ^ a b Dandy WE, Intracranial aneurysm of the internal carotid artery: Cured by operation, in Annals of Surgery, vol. 107, n. 5, 1938, pp. 654–9, DOI:10.1097/00000658-193805000-00003.
- ^ a b Guglielmi G, Viñuela F, Dion J, Duckwiler G, Electrothrombosis of saccular aneurysms via endovascular approach. Part 2: Preliminary clinical experience, in Journal of Neurosurgery, vol. 75, n. 1, 1991, pp. 8–14, DOI:10.3171/jns.1991.75.1.0008.
- ^ Aneurismi Clipping o avvolgimento - studio, su news-medical.net. URL consultato il 4 giugno 2011.
- ^ a b c Molyneux AJ, Kerr RS, Yu LM, et al., International subarachnoid aneurysm trial (ISAT) of neurosurgical clipping versus endovascular coiling in 2143 patients with ruptured intracranial aneurysms: A randomised comparison of effects on survival, dependency, seizures, rebleeding, subgroups, and aneurysm occlusion, in Lancet, vol. 366, n. 9488, 2005, pp. 809–17, DOI:10.1016/S0140-6736(05)67214-5.
- ^ van der Schaaf I, Algra A, Wermer M, et al., Endovascular coiling versus neurosurgical clipping for patients with aneurysmal subarachnoid haemorrhage, in Cochrane Database of Systematic Reviews (Online), n. 4, 2005, pp. CD003085, DOI:10.1002/14651858.CD003085.pub2.
- ^ Campi A, Ramzi N, Molyneux AJ, et al., Retreatment of ruptured cerebral aneurysms in patients randomized by coiling or clipping in the International Subarachnoid Aneurysm Trial (ISAT), in Stroke, vol. 38, n. 5, 2007, pp. 1538–44, DOI:10.1161/STROKEAHA.106.466987.
- ^ a b Dorhout Mees S, Rinkel G, Feigin V, et al., Calcium antagonists for aneurysmal subarachnoid haemorrhage, in Cochrane Database of Systematic Reviews (Online), n. 3, 2007, pp. CD000277, DOI:10.1002/14651858.CD000277.pub3.
- ^ Allen GS, Ahn HS, Preziosi TJ, et al., Cerebral arterial spasm: A controlled trial of nimodipine in patients with subarachnoid hemorrhage, in New England Journal of Medicine, vol. 308, n. 11, 1983, pp. 619–24, DOI:10.1056/NEJM198303173081103.
- ^ Vergouwen MD, Vermeulen M, Roos YB, Effect of nimodipine on outcome in patients with traumatic subarachnoid haemorrhage: A systematic review, in Lancet Neurology, vol. 5, n. 12, December 2006, pp. 1029–32, DOI:10.1016/S1474-4422(06)70582-8.
- ^ Kassell NF, Peerless SJ, Durward QJ, Beck DW, Drake CG, Adams HP, Treatment of ischemic deficits from vasospasm with intravascular volume expansion and induced arterial hypertension, in Neurosurgery, vol. 11, n. 3, September 1982, pp. 337–43, DOI:10.1097/00006123-198209000-00001.
- ^ Sen J, Belli A, Albon H, Morgan L, Petzold A, Kitchen N, Triple-H therapy in the management of aneurysmal subarachnoid haemorrhage, in Lancet Neurology, vol. 2, n. 10, October 2003, pp. 614–21, DOI:10.1016/S1474-4422(03)00531-3.
- ^ Rosengart AJ, Huo JD, Tolentino J, et al., Outcome in patients with subarachnoid hemorrhage treated with antiepileptic drugs, in Journal of Neurosurgery, vol. 107, n. 2, August 2007, pp. 253–60, DOI:10.3171/JNS-07/08/0253.
- ^ Naval NS, Stevens RD, Mirski MA, Bhardwaj A, Controversies in the management of aneurysmal subarachnoid hemorrhage, in Critical Care Medicine, vol. 34, n. 2, February 2006, pp. 511–24, DOI:10.1097/01.CCM.0000198331.45998.85.
- ^ Liu KC, Bhardwaj A, Use of prophylactic anticonvulsants in neurologic critical care: a critical appraisal, in Neurocritical Care, vol. 7, n. 2, 2007, pp. 175–84, DOI:10.1007/s12028-007-0061-5.
- ^ a b c Rosengart AJ, Schultheiss KE, Tolentino J, Macdonald RL, Prognostic factors for outcome in patients with aneurysmal subarachnoid hemorrhage, in Stroke, vol. 38, n. 8, August 2007, pp. 2315–21, DOI:10.1161/STROKEAHA.107.484360.
- ^ Naidech AM, Kreiter KT, Janjua N, et al., Phenytoin exposure is associated with functional and cognitive disability after subarachnoid hemorrhage, in Stroke, vol. 36, n. 3, March 2005, pp. 583–7, DOI:10.1161/01.STR.0000141936.36596.1e.
- ^ Kenneth W Lindsay, Ian Bone, Robin Callander, Neurology and Neurosurgery Illustrated, United States, Churchill Livingstone, 1993, ISBN 0-443-04345-0.
- ^ Lanterna LA, Ruigrok Y, Alexander S, et al., Meta-analysis of APOE genotype and subarachnoid hemorrhage: clinical outcome and delayed ischemia, in Neurology, vol. 69, n. 8, August 2007, pp. 766–75, DOI:10.1212/01.wnl.0000267640.03300.6b.
- ^ Kruyt ND, Biessels GJ, de Haan RJ, et al., Hyperglycemia and clinical outcome in aneurysmal subarachnoid hemorrhage: a meta-analysis, in Stroke, vol. 40, n. 6, June 2009, pp. e424–30, DOI:10.1161/STROKEAHA.108.529974.
- ^ Schneider HJ, Kreitschmann-Andermahr I, Ghigo E, Stalla GK, Agha A, Hypothalamopituitary dysfunction following traumatic brain injury and aneurysmal subarachnoid hemorrhage: a systematic review, in Journal of the American Medical Association, vol. 298, n. 12, September 2007, pp. 1429–38, DOI:10.1001/jama.298.12.1429.
- ^ a b c d e de Rooij NK, Linn FH, van der Plas JA, Algra A, Rinkel GJ, Incidence of subarachnoid haemorrhage: A systematic review with emphasis on region, age, gender and time trends, in Journal of Neurology, Neurosurgery, and Psychiatry, vol. 78, n. 12, December 2007, pp. 1365–72, DOI:10.1136/jnnp.2007.117655.
- ^ International Study of Unruptured Intracranial Aneurysms Investigators, Unruptured intracranial aneurysms—risk of rupture and risks of surgical intervention, in New England Journal of Medicine, vol. 339, n. 24, December 1998, pp. 1725–33, DOI:10.1056/NEJM199812103392401.
- ^ a b Longstreth WT, Koepsell TD, Yerby MS, van Belle G, Risk factors for subarachnoid hemorrhage (PDF), in Stroke, vol. 16, n. 3, 1985, pp. 377–85.
- ^ Bramwell B, Spontaneous meningeal haemorrhage, in Edinburgh Medical Journal, vol. 32, 1886, p. 101.
- ^ Symonds CP, Spontaneous subarachnoid hemorrhage, in Quarterly Journal of Medicine, vol. 18, 1924, pp. 93–122, DOI:10.1093/qjmed/os-118.69.93.
- ^ a b Todd NV, Howie JE, Miller JD, Norman Dott's contribution to aneurysm surgery, in Journal of Neurology, Neurosurgery, and Psychiatry, vol. 53, n. 6, June 1990, pp. 455–8, DOI:10.1136/jnnp.53.6.455.
- ^ Symonds CP, Spontaneous sub-arachnoid hæmorrhage, in Proceedings of the Royal Society of Medicine, vol. 17, Neurol Sect, 1924, pp. 39–52.
- ^ Krayenbühl HA, Yaşargil MG, Flamm ES, Tew JM, Microsurgical treatment of intracranial saccular aneurysms, in Journal of Neurosurgery, vol. 37, n. 6, December 1972, pp. 678–86, DOI:10.3171/jns.1972.37.6.0678.
- ^ Zubkov IuN, Nikiforov BM, Shustin VA, 1st attempt at dilating spastic cerebral arteries in the acute stage of rupture of arterial aneurysms, in Zh Vopr Neirokhir Im N N Burdenko, vol. 5, n. 5, Sep-Oct 1983, pp. 17–23.
- ^ Zubkov YN, Nikiforov BM, Shustin VA, Balloon catheter technique for dilatation of constricted cerebral arteries after aneurysmal SAH, in Acta Neurochir (Wien), vol. 70, n. 1-2, Sep-Oct 1984, pp. 65–79, DOI:10.1007/BF01406044.
- ^ Strother CM, Historical perspective. Electrothrombosis of saccular aneurysms via endovascular approach: part 1 and part 2, in AJNR. American Journal of Neuroradiology, vol. 22, n. 5, 1º May 2001, pp. 1010–2.
Altri progetti
 Wikimedia Commons contiene immagini o altri file su emorragia subaracnoidea
Wikimedia Commons contiene immagini o altri file su emorragia subaracnoidea