Ioni metallici in soluzione acquosa
Uno ione metallico in soluzione acquosa o più semplicemente un acquoione è un catione disciolto in acqua, con formula generale [M(H2O)n]z+. Il numero di solvatazione n si può determinare sperimentalmente e può variare da 4 a 9 (e oltre). Ad esempio n è 4 per Li+ e Be2+, 6 per gli elementi dei periodi 3 e 4 della tavola periodica, e 8 o 9 per lantanoidi e attinoidi. La forza del legame tra il catione metallico e le molecole d'acqua nella prima sfera di solvatazione cresce al crescere della densità di carica positiva del catione, e quindi aumenta al crescere della carica elettrica z sul metallo, e diminuisce al crescere del suo raggio r. Gli acquoioni possono dar luogo a reazioni di idrolisi. Per la maggior parte degli acquoioni il logaritmo della prima costante di idrolisi è proporzionale a z2/r. L'acquoione interagisce via legame a idrogeno con le altre molecole d'acqua presenti nella seconda sfera di solvatazione. Le molecole di acqua della prima sfera di solvatazione si scambiano con quelle presenti nella seconda sfera di solvatazione e nel resto della soluzione. Il tempo di residenza di una molecola d'acqua nella prima sfera di solvatazione è molto variabile a seconda dello ione metallico e può variare da circa 100 picosecondi a più di 200 anni.
Introduzione[modifica | modifica wikitesto]
Elementi metallici o semimetallici Li Be Na Mg Al K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Cs Ba La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po Fr Ra Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr Rf Db Sg Bh Hs Mt Ds Rg Cn Nh Fl Mc Lv Ts Og
La maggior parte degli elementi chimici sono metallici, e nello stato di ossidazione +1, +2 o +3 in acqua formano acquoioni semplici di formula [M(H2O)n]z+. (La tabella comprende anche i semimetalli germanio e antimonio, dato che formano acquoioni in modo analogo ai metalli. Riguardo agli elementi transuranici da bohrio a tennesso, la loro chimica in soluzione acquosa non è nota, ma si prevede che il loro comportamento sia metallico. Per quanto concerne l'oganesson, i pareri sul suo possibile comportamento metallico sono discordi.) Quando lo stato di ossidazione diventa maggiore di +3 gli acquoioni semplici reagiscono dissociando protoni in modo da ridurre la carica positiva eccessiva, e così formano complessi contenenti sia molecole d'acqua che ioni idrossido o ossido; un esempio è la specie di vanadio(IV), [VO(H2O)5]2+. Nei più alti stati di ossidazione vengono dissociati tutti i protoni e si conoscono solo ossoanioni come la specie di manganese(VII), MnO4–.[1]


In soluzione acquosa le molecole d'acqua direttamente legate allo ione metallico fanno parte alla prima sfera di coordinazione, nota anche come prima sfera di solvatazione o prima sfera di idratazione. Il legame tra queste molecole d'acqua e lo ione metallico è detto legame di coordinazione: l'ossigeno mette a disposizione una coppia di elettroni per formare il legame. Ogni molecola di acqua coordinata può essere connessa via legame a idrogeno ad altre molecole d'acqua esterne, che formano la seconda sfera di coordinazione, detta anche seconda sfera di solvatazione. Per cationi di carica 1+ o 2+ la seconda sfera di solvatazione non è un'entità così ben definita. In soluzione diluita la seconda sfera di solvatazione sfuma verso il corpo della soluzione, dove l'arrangiamento delle molecole di acqua è dato da un reticolo irregolare di legami a idrogeno tra le varie molecole.[2] Ioni di carica 3+ hanno una carica abbastanza elevata da polarizzare le molecole d'acqua nella prima sfera di solvatazione, in modo che i legami a idrogeno con le molecole della seconda sfera di solvatazione sono abbastanza forti da formare un'entità più stabile.[3]
La forza del legame metallo-ossigeno (M–O) può essere stimata in vari modi. La misura più affidabile si ottiene dall'entalpia di idratazione, anche se la sua determinazione è basata indirettamente su misurazioni sperimentali. La scala dei valori si basa su uno zero scelto arbitrariamente, ma ciò non influisce sulle differenze tra i valori di due metalli. Altre misure si basano sulla frequenza di vibrazione M–O e sulla lunghezza del legame M–O. La forza del legame M–O tende ad aumentare con la carica e a diminuire all'aumentare della dimensione dello ione metallico. In effetti esiste una correlazione lineare molto buona tra l'entalpia di idratazione e il rapporto tra la carica al quadrato e il raggio dello ione, z 2/ r.[4] Per gli ioni in soluzione il "raggio ionico efficace" di Shannon è la misura più utilizzata.[5]
Le molecole d'acqua possono scambiarsi tra la prima e la seconda sfera di solvatazione (e il resto della soluzione). A seconda del metallo e del suo stato di ossidazione la velocità di scambio varia moltissimo. Gli acquoioni in soluzione sono sempre accompagnati da anioni solvatati, ma sulla solvatazione degli anioni si sa molto meno rispetto alla solvatazione dei cationi.[6]
La comprensione della natura degli acquoioni è aiutata da informazioni sul comportamento di cationi solvatati in solventi misti[7] e non acquosi, come ad esempio ammoniaca liquida, metanolo, dimetilformammide e dimetilsolfossido.[8][9]
Presenza in natura[modifica | modifica wikitesto]
La maggior parte delle acque di origine naturale contiene acquoioni. Nell'acqua di mare i principali acquoioni presenti sono quelli di Na+, K+, Mg2+ e Ca2+.
Acquoioni nell'acqua di mare (Salinità = 3,5 %) Ione Concentrazione
(mol·kg−1)Na+ 0,469 K+ 0,0102 Mg2+ 0,0528 Ca2+ 0,0103
L'acqua di mare contiene acquoioni di molti altri elementi in concentrazioni che variano da 1 × 10−3 a 1 × 10−9 g/L.[10] L'acqua potabile e l'acqua minerale contengono normalmente ioni magnesio e calcio che sono responsabili rispettivamente della durezza permanente e temporanea. Il sangue contiene concentrazioni di sodio, potassio, magnesio e calcio simili a quelle dell'acqua di mare, e contiene inoltre concentrazioni inferiori di elementi essenziali come ferro e zinco. Gli sport drink sono formulati in modo da essere isotonici e contengono anche i minerali che vengono persi con la sudorazione.
Metodi sperimentali[modifica | modifica wikitesto]
A seconda della tecnica sperimentale utilizzata si riescono ad avere informazioni diverse sulla natura degli acquoioni in soluzione. Alcuni metodi forniscono informazioni sul solo catione, altri metodi danno informazioni che dipendono sia dal catione che dall'anione. Alcuni metodi danno informazioni di tipo statico, registrando la media delle proprietà in un certo istante, mentre altri metodi forniscono informazioni anche sulla dinamica dei processi in soluzione.
Risonanza magnetica nucleare (RMN)[modifica | modifica wikitesto]
Quando la velocità di scambio delle molecole d'acqua attorno a uno ione [M(H2O)n]z+ è lenta nella scala dei tempi delle misure di risonanza magnetica nucleare, si ottengono picchi distinti per le molecole d'acqua nella prima sfera di solvatazione e per le altre molecole d'acqua esterne. Il numero di solvatazione n si ottiene allora come rapporto delle aree dei rispettivi picchi. Le molecole d'acqua presenti nella seconda sfera di solvatazione si scambiano rapidamente con le molecole del solvente, dando luogo a piccole variazioni dello spostamento chimico delle molecole di acqua non coordinate rispetto all'acqua solvente. Lo svantaggio principale di questo metodo è la necessità di usare soluzioni piuttosto concentrate, con il rischio di avere formazione di coppie ioniche con l'anione.
Numeri di solvatazione determinati tramite RMN[11] ione n nucleo Be2+ 4 1H 17O Mg2+ 6 1H Zn2+ 6 1H Al3+ 6 1H 17O Ga3+ 6 1H 17O In3+ 6 1H Fe2+ 6 17O Co2+ 6 1H Ni2+ 6 1H 17O Th4+ 9 1H
Diffrazione dei raggi X[modifica | modifica wikitesto]
In una soluzione contenente acquoioni non c'è l'ordine a lungo raggio presente in un cristallo che contenga gli stessi ioni, ma esiste comunque un ordine a corto raggio. La diffrazione dei raggi X di una soluzione fornisce una funzione di distribuzione radiale dalla quale si può derivare il numero di coordinazione dello ione metallico e la distanza metallo-ossigeno. Per acquoioni di carica elevata si possono ottenere informazioni anche sulla seconda sfera di solvatazione.[12][13]
Questa tecnica richiede l'uso di soluzioni relativamente concentrate. I raggi X sono dispersi dagli elettroni, e quindi il potere di dispersione aumenta con il numero atomico. Di conseguenza gli atomi di idrogeno risultano pressoché invisibili nelle misure a raggi X.
La tecnica di diffrazione dei raggi X a largo angolo (WAXD) è stata usata per caratterizzare la seconda sfera di solvatazione in ioni trivalenti come Cr3+ e Rh3+. Si è trovato che la seconda sfera di solvatazione di Cr3+ contiene 13 ± 1 molecole situate ad una distanza media di 402 ± 20 pm dal metallo centrale. Questo implica che ogni molecola d'acqua della prima sfera di solvatazione è legata tramite legame a idrogeno a due molecole della seconda sfera.[14]
Diffrazione neutronica[modifica | modifica wikitesto]
Anche la diffrazione neutronica fornisce una funzione di distribuzione radiale. A differenza dalla diffrazione dei raggi X, i neutroni sono dispersi dai nuclei e non ci sono relazioni con il numero atomico.[15] Tuttavia si può sfruttare il fatto che la dispersione dei neutroni è fortemente dipendente dal particolare isotopo di un dato elemento. In un esperimento classico, sono state effettuate misurazioni su quattro soluzioni di cloruro di nichel contenenti varie combinazioni degli isotopi 58Ni, 60Ni, 35Cl e 37Cl per ottenere una descrizione dettagliata della solvatazione di catione e anione.[16] I dati raccolti per vari sali mostrano una certa dipendenza dalla concentrazione della soluzione.
Numero di solvatazione del catione determinata tramite diffrazione neutronica[17] Catione Anione Concentrazione(a)
(mol·kg−1)Numero di
solvatazioneLi+ Cl− 27,77 2,3 (2)(b) 9,95 3,0 (5) 3,57 5,5 (3) Ca2+ Cl− 4,49 6,4 (3) 2,80 7,2 (2) 1,0 10,0 (6) Ni2+ Cl− 3,05 5,8 (2) 0,85 6,6 (5) 0,46 6,8 (8) 0,086 6,8 (8) Ni2+ ClO−4 3,80 5,8 (2) Cu2+ ClO−4 2,00 4,9 (3) Fe3+ NO−3 2,0 5,0 (2) Nd3+ Cl− 2,85 8,5 (2) Dy3+ Cl− 2,38 7,4 (5)
- Note: (a) moli di soluto per kg di solvente; (b) i numeri fra parentesi sono le deviazioni standard sull'ultima cifra significativa del valore dato.
La maggior parte di questi dati si riferisce a soluzioni concentrate contenenti pochissime molecole d'acqua che non siano nella prima sfera di idratazione del catione o dell'anione; ciò può giustificare alcune variazioni del numero di solvatazione al variare della concentrazione anche se non ci sono coppie ioniche a contatto.
Il numero di solvatazione misurato è mediato nel tempo su tutta la soluzione. Quando il numero è frazionario ci sono due o più specie in equilibrio tra loro, ciascuna con un numero di solvatazione intero. Questo ragionamento si applica anche ai numeri di solvatazione interi, entro l'errore sperimentale. Ad esempio, il numero di solvatazione 5,5 per una delle soluzioni di cloruro di litio si può interpretare con la presenza di due diversi acquoioni con concentrazioni simili:
- [Li(H2O)6]+ ⇄ [Li(H2O)5]+ + H2O
Un'altra possibilità è la formazione di una coppia ionica dovuta all'interazione del catione solvatato con un anione, evento molto probabile quando si esaminano soluzioni concentrate. Ad esempio, il numero di solvatazione 3 per una delle soluzioni di cloruro di litio potrebbe derivare dall'equilibrio
- [Li(H2O)4]+ + Cl− ⇄ [Li(H2O)3Cl] + H2O
completamente spostato a destra a favore della coppia ionica.
Spettri vibrazionali[modifica | modifica wikitesto]
Sia la spettroscopia infrarossa che la spettroscopia Raman possono essere utilizzate per misurare le frequenze di stretching negli acquoioni. La spettroscopia Raman è particolarmente utile perché lo spettro Raman dell'acqua è debole mentre lo spettro infrarosso dell'acqua è intenso. L'interpretazione delle frequenze di vibrazione è complicata negli ioni tetraedrici e ottaedrici per la presenza di due modi di vibrazione, uno simmetrico osservabile nello spettro Raman, e uno asimmetrico osservabile nello spettro infrarosso.
Vibrazioni di stretching simmetrico M-O per alcuni acquoioni in soluzione[18] Ione metallico numero d'onda (cm−1) Be2+ 530-543 Mg2+ 360-365 Mn2+ 395 Fe2+ 389 Ni2+ 405 Cu2+ 440 Zn2+ 385-400 Hg2+ 380[19] Al3+ 520-526 Ga3+ 475 In3+ 400
Anche se non esiste una relazione semplice tra la frequenza di vibrazione e la costante di forza, i dati riportati permettono di trarre la conclusione generale che la forza del legame M–O cresce all'aumentare della carica ionica e al calare della dimensione dello ione. Le frequenze di stretching M–O per un acquoione in soluzione possono essere confrontate con i rispettivi valori ottenuti in cristalli di struttura nota. Se i valori di frequenza sono molto simili si può concludere che il numero di coordinazione dello ione metallico è lo stesso in soluzione e allo stato solido.
Metodi dinamici[modifica | modifica wikitesto]
Il movimento degli ioni in soluzione si può studiare con misure di conduttività, mobilità e diffusione. Quando uno ione si muove attraverso una soluzione tende a trascinare con sé sia la prima sia la seconda sfera di solvatazione. Per questo motivo i numeri di solvatazione ottenuti con metodi dinamici tendono ad essere molto più elevati di quelli ricavati con metodi statici.
Numeri di solvatazione ottenuti da metodi dinamici[20] Li+ Na+ Cs+ Mg2+ Ca2+ Ba2+ Zn2+ Cr3+ Al3+ Numero di trasporto 13-22 7-13 4 12-14 8-12 3-5 10-13 Mobilità ionica 3-21 2-10 10-13 7-11 5-9 10-13 Diffusione 5 3 1 9 9 8 11 17 13
Numeri di solvatazione e strutture[modifica | modifica wikitesto]
Metalli alcalini[modifica | modifica wikitesto]
Per acquoioni di litio sono stati osservati numeri di solvatazione nell'intervallo 3–6. Valori inferiori a 4 possono essere dovuti alla formazione di coppie ioniche a contatto. I valori più elevati possono essere interpretati considerando molecole d'acqua che si avvicinano alle facce del tetraedro formato dallo ione [Li(H2O)4]+, anche se simulazioni di dinamica molecolare indicano la possibile esistenza di uno ione ottaedrico [Li(H2O)6]+.[21] Lo ione Na+ ha molto probabilmente sei molecole d'acqua nella prima sfera di solvatazione. Per gli ioni potassio, rubidio e cesio anche la prima sfera di solvatazione è poco definita.[22]
Metalli alcalino terrosi[modifica | modifica wikitesto]
Il berillio ha una prima sfera di solvatazione molto ben definita, con quattro molecole d'acqua; la specie [Be(H2O)4]2+ ha geometria tetraedrica.[23] Anche la specie di magnesio [Mg(H2O)6]2+ è ben caratterizzata, con geometria ottaedrica. Per il calcio la situazione è più complicata. Dati di diffrazione neutronica indicano che per il cloruro di calcio il numero di solvatazione dipende notevolmente dalla concentrazione: si trova 10,0 ± 0,6 alla concentrazione di 1 mol·dm−3, e il valore cala a 6,4 ± 0,3 a 2,8 mol·dm−3. Il raggio di Shannon del calcio esacoordinato è 100 pm rispetto ai 72 pm del magnesio, con una crescita del 28%; questo rende possibili numeri di solvatazione maggiori, mentre la minore densità di carica (z 2/ r) rende più deboli i legami M–O, facilitando la formazione di coppie ioniche. Si conoscono vari solidi idrati dove il calcio ha coordinazione otto con geometria tipo antiprisma quadrato e dodecaedro.[24] Per gli acquoioni di stronzio e bario è stato determinato un numero di solvatazione di 8,1 ± 0,3, con distanze Sr–O = 263 pm e Ba–O = 281 pm.[25]
Metalli del gruppo 3, lantanoidi e attinoidi[modifica | modifica wikitesto]
Ci sono ormai varie evidenze indirette che l'acquoione dello scandio(III) contenga sette molecole di acqua.[26] Lo ione ittrio(III) ha approssimativamente lo stesso raggio di Shannon dell'olmio(III) e proprietà simili; il suo acquoione contiene presumibilmente otto molecole di acqua. L'acquoione del lantanio(III) dovrebbe contenerne nove, analogamente ai lantanoidi più leggeri.
Gli ioni trivalenti dei lantanoidi hanno dimensioni regolarmente decrescenti passando da lantanio a lutezio; questo effetto è noto come contrazione lantanoidea. Ad ogni modo, vi sono forti evidenze che il numero di idratazione cali da 9 a 8 attorno al gadolinio.[27] Allo stato solido le strutture più comuni di questi acquoioni sono il prisma trigonale tricappato per la coordinazione nove nei lantanoidi più leggeri, e l'antiprisma quadrato per la coordinazione otto nei lantanoidi più pesanti. Non esistono invece dati sperimentali per la solvatazione di cerio(IV) e europio(II), unici ioni lantanoidi comuni con numero di ossidazione diverso da +3.[28]
Per gli attinoidi nello stato di ossidazione +3 e +4 si presume un numero di solvatazione di 9 o più, ma si conoscono dati sperimentali solo per il torio(IV).
Metalli di transizione e del gruppo 12[modifica | modifica wikitesto]

Gli acquoioni di questi metalli nello stato di ossidazione +2 e +3 hanno numero di solvatazione 6. Hanno tutti una struttura ottaedrica regolare, con l'eccezione degli acquoioni di cromo(II) e rame(II) che sono soggetti alla distorsione di Jahn-Teller.[30] Nel caso del rame allo stato solido le due distanze Cu–O assiali risultano di 238 pm, mentre le quattro distanze Cu–O equatoriali sono di 195 pm.[31] Tuttavia in soluzione ci sono dati sperimentali contrastanti, e non è chiaro se il numero di solvatazione del rame(II) sia 5 o 6.[30] L'argento(I) è probabilmente tetracoordinato, [Ag(H2O)4]+.[32]
Per gli acquoioni zinco(II) e cadmio(II) in soluzione diluita è ben dimostrato un numero di solvatazione 6 con struttura ottaedrica. In soluzione concentrata lo ione Zn2+ può essere tetracoordinato con struttura tetraedrica, ma ciò potrebbe essere dovuto alla formazione di coppie ioniche o a reazioni di idrolisi.[33]
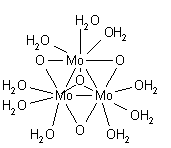
Per il mercurio(II) il numero di solvatazione più probabile è 6.[34] Lo ione di mercurio(I) ha struttura [(H2O)-Hg-Hg-(OH2)]2+, determinata sia in solido che in soluzione.[35][36] Un altro acquoione contenente un (quadruplo) legame metallo-metallo è la specie di molibdeno(II) [(H2O)4-Mo≣Mo-(OH2)4]4+.[37] Ogni molibdeno è attorniato da quattro molecole d'acqua con geometria planare quadrata, con una struttura simile a quella nota per il complesso [Mo2Cl8]4–; non si può però escludere la presenza di una quinta molecola d'acqua in posizione assiale.[35]
Nella seconda e terza serie di transizione ci sono pochissimi acquoioni con numero di ossidazione +2 o +3. Nello stato di ossidazione +4 esistono solo specie idrolizzate.
Metalli dei gruppi 13, 14 e 15[modifica | modifica wikitesto]
L'acquoione dell'alluminio, [Al(H2O)6]3+ è molto ben caratterizzato sia allo stato solido che in soluzione. Il nucleo AlO6 ha simmetria ottaedrica. Anche gli acquoioni di gallio(III), indio(III) e tallio(III) hanno numero di solvatazione 6. Si presume che l'acquoione di tallio(I) sia esacoordinato, ma non ci sono valide prove sperimentali.[38] Il raggio di Shannon di Tl+ è 150 pm, non molto diverso da quello di K+, 138 pm, per cui alcune somiglianze chimiche tra Tl+ e K+ sono prevedibili, e sono state osservate.[39]
Il numero di solvatazione dell'acquoione stagno(II), [Sn(H2O)n]2+, non è noto con precisione a causa dell'idrolisi presente nelle soluzioni concentrate necessarie per le misure di scattering dei raggi X.[40] Lo stesso vale per l'acquoione del piombo(II).
Nel bismuto(III) si ha evidenza indiretta per un numero di solvatazione 9. Allo stato solido è stata caratterizzata una specie nonaidrata, con struttura di prisma trigonale tricappato. Il raggio di Shannon per il bismuto a coordinazione nove è 115 pm, comparabile con quello del neodimio (116,3 pm) per il quale il numero di solvatazione 9 è ampiamente provato.[41]
Osso acquo-cationi[modifica | modifica wikitesto]
Quando lo stato di ossidazione diventa maggiore di +3 alcuni elementi formano specie acquate contenenti il legante osso. Due esempi ben noti sono gli ioni vanadile(IV) e uranile(VI). La formazione di queste specie può essere vista come risultato di una ipotetica reazione di idrolisi tipo
- [V(H2O)6]4+ → [VO(H2O)5]2+ + 2H+
Il vanadio ha una coordinazione ottaedrica distorta (simmetria C4v), attorniato da cinque molecole d'acqua e da uno ione ossido.[42] A pH minore di 2 si ritiene che il vanadio(V) esista come ione diosso [VO2(H2O)4]+, ma le prove dipendono da studi su complessi con leganti ossalato, nei quali allo stato solido esistono unità VO2+, con i due legami V–O in cis.[43]. La struttura dell'acquoione di cromo(IV), [CrO(H2O)5]2+, simile all'analogo di vanadio, è stata proposta sulla base di evidenze indirette.[44]
Lo ione uranile UO22+ ha struttura trans. Sulla base di evidenze indirette si suppone che l'acquoione abbia cinque molecole d'acqua nel piano perpendicolare all'asse O–U–O, in modo da formare una struttura a bipiramide pentagonale, simmetria D5h. Tuttavia il piano equatoriale potrebbe contenere anche sei molecole d'acqua, formando una bipiramide esagonale, simmetria D6h, dato che si conoscono molti complessi con questa struttura.[45] Il modo di solvatazione dello ione plutonile PuO22+ non è noto.
Termodinamica[modifica | modifica wikitesto]
Nel contesto degli acquoioni la termodinamica si prefigge di ottenere dati termodinamici sui singoli ioni, come ad esempio entalpia ed entropia di idratazione. Queste quantità si riferiscono alla reazione
- Mz+ (gas) + solvente → Mz+ (in soluzione)
L'entalpia di questa reazione non è misurabile direttamente, dato che tutte le soluzioni contenenti sali contengono inevitabilmente sia cationi che anioni. La maggior parte delle misure sperimentali determinano il calore sviluppato quando un sale è disciolto in acqua, e per questa via si ottiene la somma delle entalpie di solvatazione di catione e anione. Successivamente, per ottenere i valori dei singoli ioni si considerano i dati ottenuti per diversi anioni con lo stesso catione e i dati per diversi cationi con lo stesso anione, fissando uno zero arbitrario.
Entalpia di idratazione standard di ioni singoli (kJ/mol)[46] Li+
-514,6Be2+
-2487.0Na+
-404,6Mg2+
-1922,1Al3+
-4659,7K+
-320,9Ca2+
-1592,4Sc3+
-3960,2... Ga3+
-4684,8Rb+
-296,2Sr2+
-1444,7Y3+
-3620,0... In3+
-4108,7Sn2+
-1554,4Cs+
-263,2Ba2+
-1303,7La3+
-3282,8... Tl3+
-4184,0Pb2+
-1479,9
Altri valori sono Zn2+ -2044,3; Cd2+ -1805,8; Ag+ -475,3 kJ/mol.
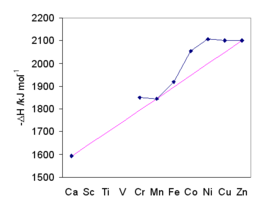
Esiste una eccellente correlazione lineare tra l'entalpia di idratazione e il rapporto tra la carica dello ione al quadrato, z2, e la distanza M–O, reff.[47]
I valori ottenuti per i metalli di transizione sono però influenzati dalla energia di stabilizzazione del campo cristallino (CFSE). In figura, l'andamento generale è mostrato dalla linea di colore magenta che passa per gli ioni Ca2+, Mn2+ e Zn2+, per i quali non c'è stabilizzazione nel campo cristallino ottaedrico. L'energia di idratazione cresce col diminuire delle dimensioni ioniche, e la CFSE contribuisce a stabilizzare gli acquoioni; la massima stabilizzazione si verifica per Ni2+. L'accordo dei valori di entalpia di idratazione con le previsioni è stato un fattore che ha contribuito a validare la teoria del campo cristallino.[48]
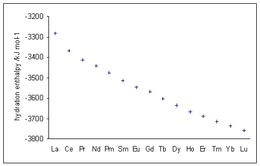
Per gli ioni trivalenti dei lantanoidi si osservano valori di entalpia di idratazione sempre più negativi al crescere del numero atomico, in accordo con la diminuzione del raggio ionico (contrazione lantanoidea).
Si possono derivare anche i valori di entropia di idratazione dei singoli ioni; i dati sono mostrati nella tabella successiva. Più il valore è negativo, più la formazione dell'acquoione produce ordine nella soluzione. Si può notare che i metalli alcalini più pesanti hanno valori di entropia piuttosto piccoli, suggerendo che sia la prima sia la seconda sfera di solvatazione siano alquanto indistinte.
Entropia di idratazione standard di ioni singoli a 25 °C (J deg−1 mol−1)[49] Li+
-118,8Na+
-87,4Mg2+
-267,8Al3+
-464,4K+
-51,9Ca2+
-209,2... Ga3+
-510,4Rb+
-40,2Sr2+
-205,0... In3+
-426,8Cs+
-36,8Ba2+
-159,0La3+
-368,2...
Idrolisi di acquoioni[modifica | modifica wikitesto]
Gli acquoioni in soluzione possono dar luogo a reazioni di idrolisi. Ci sono vari modi di descrivere questo processo; il più semplice è considerare equilibri di dissociazione nei quali vengono via via rilasciati ioni H+. Questo significa anche che tutti gli acquoioni in soluzione manifestano un grado di acidità più o meno elevato.[50] Il primo di questi processi si può scrivere come
- [M(H2O)n]z+ - H+ ⇄ [M(H2O)n-1(OH)](z-1)+
e la relativa costante di equilibrio di prima idrolisi risulta
- [ [M(OH)]{(z-1)+ ] = K1,-1 [Mz+] [H+] −1
Lo studio delle varie reazioni idrolisi che avvengono in soluzione si basa in genere sulla misura delle rispettive costanti di equilibrio a partire da misure di titolazione potenziometrica di pH. Il processo è tutt'altro che semplice per un insieme di motivi.[51] A volte la specie in soluzione può essere precipitata come sale per confermarne la struttura tramite cristallografia a raggi X. In altri casi i sali precipitati non hanno alcuna relazione con la struttura ipotizzata in soluzione, dato che una particolare sostanza cristallina può avere solubilità molto bassa ed essere presente in soluzione in bassissima concentrazione.
Una volta misurate un gran numero di costanti di prima idrolisi, si è trovata una relazione lineare tra il logaritmo della costante e il rapporto tra la carica dello ione (z) e la distanza M–O (d). I vari ioni possono essere raggruppati in quattro gruppi. La pendenza della retta di regressione è la stessa per i quattro gruppi, ma l'intercetta A è differente.[52]
log K1,-1 = A + 11,0 z/d cation A Mg2+, Ca2+, Sr2+, Ba2+
Al3+, Y3+, La3+-22,0 ± 0,5 Li+, Na+, K+
Be2+, Mn2+, Fe2+, Co2+, Ni2+, Cu2+, Zn2+, Cd2+
Sc3+, Ti3+, V3+, Cr3+, Fe3+, Rh3+, Ga3+, In3+
Ce4+, Th4+, Pa4+, U4+, Np4+, Pu4+,-19,8 ± 1 Ag+, Tl+
Pb2+
Ti3+, Bi3+,-15,9 ± 1 Sn2+, Hg2+, Pd2+ ca. 12
I cationi che hanno meno tendenza ad idrolizzare sono in genere ioni metallici di pre-transizione o lantanoidi (più Al3+); tutte specie di questo gruppo sono classificate come acidi duri in base alle dimensioni e alla carica. Il secondo gruppo comprende gli ioni dei metalli alcalini e dei metalli di transizione, che risultano un po' meno resistenti all'idrolisi. Il terzo gruppo contiene principalmente ioni soffici di post-transizione. Infine gli ioni che hanno la maggior tendenza ad idrolizzare sono Sn2+, Hg2+ e Pd2+.[52]
Reazioni di idrolisi multipla[modifica | modifica wikitesto]


I processi di idrolisi possono essere molto più complicati del semplice rilascio di uno ione H+, come visto in precedenza, e si arriva spesso alla formazione di specie polinucleari. Le reazioni del berillio esemplificano molte caratteristiche delle reazioni di idrolisi multipla. La figura a lato mostra come varia la concentrazione di varie specie in funzione del pH, passando attraverso specie polinucleari fino ad arrivare alla precipitazione dell'idrossido insolubile. L'idrolisi del berillio è inusuale perché la concentrazione di [Be(H2O)3(OH)]+ è troppo piccola per essere misurata. Si ha invece la formazione del trimero [Be3(H2O)6(OH)3]3+, la cui struttura è stata confermata in sali solidi. La formazione di specie polinucleari è favorita dalla riduzione della densità di carica che si ottiene nella molecola nel suo complesso. Attorno ad ogni ione berillio si ha una coordinazione tipo [Be(H2O)2(OH)2]+. La riduzione di carica effettiva rilascia energia libera dato che c'è un aumento di entropia dovuto al maggior disordine della soluzione.[53]
Struttura di alcuni prodotti di idrolisi polinucleari. Le molecole d'acqua direttamente coordinate al metallo sono omesse[54] Specie Cationi Struttura M2(OH)+ Be2+, Mn2+, Co2+, Ni2+
Zn2+, Cd2+, Hg2+, Pb2+un singolo ione idrossido a ponte tra due cationi M2(OH)(2z-2)+2 Cu2+, Sn2+
Al3+, Sc3+, Ln3+, Ti3+, Cr3+
Th4+
VO2+, UO2+2, NpO2+2, PuO2+2due ioni idrossido a ponte tra due cationi M3(OH)3+3 Be2+, Hg2+ anello a sei termini con gruppi Mn+ e OH− alternati M3(OH)(3z-4)+4 Sn2+, Pb2+
Al3+, Cr3+, Fe3+, In3+cubo con vertici alternati di gruppi Mn+ e OH−, con un vertice mancante M4(OH)4+4 Mg2+, Co2+, Ni2+, Cd2+, Pb2+ cubo con vertici alternati di gruppi Mn+ e OH− M4(OH)8+8 Zr4+, Th4+ quadrato di ioni Mn+ con due ioni idrossido a ponte su ciascun lato del quadrato
Il prodotto di idrolisi dell'alluminio di formula [Al13O4(OH)24(H2O)12]7+ è molto ben caratterizzato e può essere presente in acque naturali a pH circa 5,4.[55]
La reazione complessiva per il rilascio di due protoni da un acquoione si può scrivere come
- [M(H2O)n]z+ - 2 H+ ⇄ [M(H2O)n-2(OH)2](z-2)+
Tuttavia, la stessa costante per il rilascio di due protoni vale anche per l'equilibrio
- [M(H2O)n]z+ - 2 H+ ⇄ [MO(H2O)n-2](z-2)+ + H2O
dato che la concentrazione dell'acqua si assume sia costante. Questo è valido in generale: la costante di equilibrio è la stessa sia che il prodotto di idrolisi contenga uno ione ossido sia che contenga due ioni idrossido. Le due possibilità possono essere distinte solo determinando la struttura del sale allo stato solido. I ponti osso si formano più facilmente quando lo stato di ossidazione del metallo è elevato.[56] Un esempio di ponti osso è dato dal complesso di molibdeno(IV) [Mo3O4(H2O)9]4+ che contiene tre atomi di molibdeno connessi da legami σ ai vertici di un triangolo, mentre c'è un ponte osso sopra ciascun lato del triangolo, e un quarto ione osso è a ponte su tutti e tre gli atomi di molibdeno.[57]
Ossoanioni[modifica | modifica wikitesto]
Ci sono pochissimi osso acquoioni con metalli nello stato di ossidazione +5 o superiore, dato che avrebbero una carica troppo elevata per essere stabili. In soluzione acquosa si formano invece ossoanioni monomerici o polimerici. Gli ossoanioni possono essere considerati come i prodotti finali dei processi di idrolisi: dopo che tutti i protoni sono stati persi, rimangono attaccati al metallo solo gli ioni ossido.
Cinetica della reazione di scambio[modifica | modifica wikitesto]
Una molecola d'acqua presente nella prima sfera di solvatazione di un acquoione può scambiarsi di posto con una molecola d'acqua nel corpo della soluzione. In genere si considera che lo stadio cineticamente determinante sia la reazione di dissociazione
- [M(H2O)n]z+ → [M(H2O)n-1]z+* + H2O
Il simbolo * significa che questo è lo stato di transizione della reazione. La velocità della reazione è proporzionale alla concentrazione dell'acquoione, [A].
- .
La costante di proporzionalità k è una costante di velocità di primo ordine valida alla temperatura T. In genere questa costante di velocità per lo scambio di acqua è espressa nelle unità mol dm−3s−1. Il tempo di dimezzamento di questa reazione è loge2 / k e dimensionalmente è un tempo. Questa misura risulta utile perché è indipendente dalla concentrazione. La quantità 1/k, uguale al tempo di dimezzamento diviso 0,6932 è nota come tempo di residenza o costante di tempo.[58]
Il tempo di residenza di una molecola d'acqua nella prima sfera di solvatazione può variare da circa 10−10 s per Cs+ a circa 10+10 s (più di 200 anni) per Ir3+. Ciò dipende da fattori come dimensioni e carica dello ione, e nel caso di ioni dei metalli di transizione anche da effetti del campo cristallino. Reazioni molto veloci o molto lente sono difficili da studiare, e la maggior parte delle informazioni cinetiche sulle reazioni di scambio di acqua sono state ottenute da sistemi dove il tempo di residenza è compreso tra 1 μs and 1 s. Misurando le variazioni del tempo di residenza in funzione della temperatura si possono ricavare l'entalpia e l'entropia di attivazione, ΔH‡ and ΔS‡.
Alcuni parametri cinetici per la reazione di scambio d'acqua a 25 °C[59] ione tempo di residenza
(μs)ΔH‡
(kJ mol−1)ΔS‡
(J deg−1mol−1)Be2+ 1,0×103 - Mg2+ 2,0 43 8 V2+ 1,3×104 - 69 21 Cr2+ 0,0032 13 -13 Mn2+ 0,0316 34 12 Fe2+ 0,32 32 -13 Co2+ 0,79 33 -17 Ni2+ 40 43 -22 Cu2+ 5,0×10−4 - 23 25 Zn2+ 0,032 Al3+ 6,3×106 - 11 117 Ti3+ 16 26 -63 Cr3+ 2,0×1012 - 109 0 Fe3+ 316 37 -54 Ga3+ 501 26 -92 Rh3+ 3,2×1013 - 134 59 In3+ 50 17 La3+ 0.050 U2+2 1,3
Nei metalli di transizione i parametri sono influenzati dalla energia di stabilizzazione del campo cristallino (CFSE), sia per quanto riguarda l'acquoione sia per i suoi prodotti di dissociazione che hanno perso una o più molecole d'acqua dalla prima sfera di solvatazione. Questo spiega la particolare inerzia (tempo di residenza lungo) delle specie ottaedriche Cr3+ (configurazione elettronica d3), Rh3+ e Ir3+ (entrambi d6); in questi casi il livello d è pieno o semipieno conferendo una particolare stabilità. Gli ioni trivalenti hanno tempo di residenza più lungo dei divalenti, tranne che per lantanoidi molto grandi. I valori nella tabella mostrano che ciò è dovuto sia all'entalpia che all'entropia di attivazione.[60]
Meccanismi[modifica | modifica wikitesto]
L'assegnazione del meccanismo della reazione di scambio dell'acqua è particolarmente complessa, essendo un caso particolare di reazione di sostituzione dei leganti. Il semplice meccanismo dissociativo deve essere modificato per tener conto della presenza della seconda sfera di solvatazione. In ogni caso lo scambio tra le molecole nella seconda sfera e l'acqua nel corpo della soluzione è veloce rispetto allo stadio cineticamente determinante. Ci sono tre meccanismi possibili:[61]
- Id (meccanismo di interscambio dissociativo). Una molecola d'acqua esce dalla prima sfera di solvatazione e entra nella seconda sfera, mentre una molecola d'acqua è in arrivo dal corpo della soluzione, ma nello stato di transizione l'interazione più significativa è tra il metallo e la molecola uscente.
- Ia (meccanismo di interscambio associativo). Si ha la stessa reazione di scambio, ma nello stato di transizione si ha una significativa interazione tra la molecola d'acqua in arrivo e lo ione metallico.
- A (meccanismo associativo). Si ha l'arrivo di una molecola d'acqua dal corpo della soluzione prima della dissociazione.
Questa classificazione descrive casi estremi; il meccanismo effettivo può avere un decorso intermedio. Il parametro più utile per distinguere tra i possibili meccanismi è la variazione del volume di attivazione, ΔV‡, che si ottiene da misure di velocità di reazione al variare della pressione.[62][63]
Il volume di attivazione cresce in meccanismi dissociativi e cala in meccanismi associativi.
Note[modifica | modifica wikitesto]
- ^ Burgess 1978, Sezione 1.2.
- ^ Burgess 1978, p. 20.
- ^ Richens 1997, p. 25.
- ^ Burgess 1978, p. 181.
- ^ Shannon 1976
- ^ Burgess 1978, Cap. 11.
- ^ Burgess 1978, Cap. 6.
- ^ Chipperfield 1999
- ^ Mido et al. 2001
- ^ Stumm e Morgan 1995
- ^ Burgess 1978, p. 53.
- ^ Johansson 1992
- ^ Ohtaki e Radnai 1993
- ^ Magini 1988
- ^ Neilson e Enderby 1989
- ^ Neilson e Enderby 1983
- ^ Enderby 1987
- ^ Burgess 1978, p. 85.
- ^ Adams 1967, p. 254.
- ^ Richens 1997, p. 40.
- ^ Richens 1997, p. 126.
- ^ Richens 1997, p. 127.
- ^ Richens 1997, p. 129.
- ^ Richens 1997, sez. 2.3.
- ^ Persson et al. 1995
- ^ Richens 1997, p. 176.
- ^ Richens 1997, p. 185.
- ^ Richens 1997, p. 198.
- ^ Frank et al. 2005
- ^ a b Persson 2010
- ^ Richens 1997, cap. 4 e 12.
- ^ Richens 1997, p. 521.
- ^ Richens 1997, p. 544.
- ^ Richens 1997, p. 555.
- ^ a b Richens 1997, p. 551.
- ^ Rich 2007, p. 296.
- ^ Rich 2007, p. 127.
- ^ Richens 1997, sez. 2.4.
- ^ Greenwood e Earnshaw 1997, p. 241.
- ^ Richens 1997, pp. 152-153.
- ^ Richens 1997, p. 157.
- ^ Richens 1997, p. 236.
- ^ Richens 1997, p. 240.
- ^ Richens 1997, p. 278.
- ^ Richens 1997, p. 202.
- ^ a b c Burgess 1978, p. 182.
- ^ Richens 1997, fig. 1.2.
- ^ Orgel 1966
- ^ Burgess 1978, p. 187.
- ^ Cotton e Wilkinson 1988
- ^ Baes e Mesmer 1976, cap. 3.
- ^ a b Baes e Mesmer 1976, p. 407.
- ^ Baes e Mesmer 1976, sez 18.2.
- ^ Baes e Mesmer 1976, Tab. 18.3.
- ^ Richens 1997, p. 145.
- ^ Baes e Mesmer 1976, p. 420.
- ^ Richens 1997, Fig. 6.26.
- ^ Atkins e de Paula 2006, cap. 22.
- ^ Burgess 1978, Tabelle 11.4 e 11.5.
- ^ Burgess 1978, p. 326.
- ^ Burgess 1978, p. 319.
- ^ Burgess 1978, p. 323.
- ^ Richens 1997, p. 74.
Bibliografia[modifica | modifica wikitesto]
- (EN) D. M. Adams, Metal-Ligand and Related Vibrations, London, Edward Arnold, 1967.
- (EN) P. W. Atkins e J. de Paula, Physical Chemistry, 8ª ed., Oxford University Press, 2006, ISBN 0-19-870072-5.
- (EN) C. F. Baes e R. E. Mesmer, The Hydrolysis of Cations, 2ª ed., Krieger, 1976, ISBN 0-89874-892-5.
- (EN) J. Burgess, Metal ions in solution, Chichester, Ellis Horwood, 1978, ISBN 0-85312-027-7.
- (EN) J. R. Chipperfield, Non-aqueous Solvents, Oxford University Press, 1999, ISBN 0-19-850259-1.
- (EN) F. A. Cotton e G. Wilkinson, Advanced Inorganic Chemistry, 5ª ed., New York, Wiley-Interscience, 1988, ISBN 0-471-84997-9.
- (EN) J.E. Enderby, Diffraction Studies of Aqueous Ionic Solutions, in M.-C. Bellisent-Funel e G. W. Neilson (a cura di), The Physics and Chemistry of Aqueous Ionic Solutions, Reidel, 1987, pp. 129-145, ISBN 90-277-2534-9.
- (EN) P. Frank, M. Benfatto, R. K. Szilagyi, P. D'Angelo e altri, The Solution Structure of [Cu(aq)]2+ and Its Implications for Rack-Induced Bonding in Blue Copper Protein Active Sites, in Inorg. Chem., vol. 44, n. 6, 2005, pp. 1922–1933, DOI:10.1021/ic0400639.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) G. Johansson, Structures of Compexes in Solution Derived from X-ray Diffraction Measurements, in Adv. Inorg. Chem., vol. 39, 1992, pp. 159-232, DOI:10.1016/S0898-8838(08)60260-3.
- (EN) M. Magini (a cura di), X-ray diffraction of ions in aqueous solutions: hydration and complex formation, Boca Raton, CRC Press, 1988, ISBN 0-8493-6945-2.
- (EN) Y. Mido, S. Taguchi, M. S. Sethi e S. A. Iqbal, Chemistry in Aqueous and Non-aqueous Solvents, New Delhi, Discovery Publishing House, 2001, ISBN 81-7141-331-5.
- (EN) G. W. Neilson e J. E. Enderby, The Structure of an Aqueous Solution of Nickel Chloride, in Proc. R. Soc. Lond. A, vol. 390, n. 1799, 1983, pp. 353-371, DOI:10.1098/rspa.1983.0136.
- (EN) G. W. Neilson e J. E. Enderby, The Coordination of Metal Aquaions, in Adv. Inorg. Chem., vol. 34, 1989, pp. 195-218, DOI:10.1016/S0898-8838(08)60017-3.
- (EN) L. E. Orgel, An Introduction to Transition-metal Chemistry: Ligand-field Theory, Methuen, 1966.
- (EN) I. Persson, M. Sandström e H. Yokoyama, Structure of the Solvated Strontium and Barium Ions in Aqueous, Dimethyl Sulfoxide and Pyridine Solution, and Crystal Structure of Strontium and Barium Hydroxide Octahydrate, in Zeitschrift für Naturforschung A, vol. 50, n. 1, 1995, pp. 21–37, DOI:10.1515/zna-1995-0105.
- (EN) H. Ohtaki e T. Radnai, Structure and dynamics of hydrated ions, in Chem. Rev., vol. 93, n. 3, 1993, pp. 1157-1204, DOI:10.1021/cr00019a014.
- (EN) I. Persson, Hydrated metal ions in aqueous solution: How regular are their structures?, in Pure Appl. Chem., vol. 82, n. 10, 2010, pp. 1901–1917, DOI:10.1351/PAC-CON-09-10-22.
- (EN) R. L. Rich, Inorganic Reactions in Water, 1ª ed., Berlino, Springer, 2007, DOI:10.1007/978-3-540-73962-3, ISBN 978-3-540-73961-6.
- (EN) D. T. Richens, The Chemistry of Aqua Ions: Synthesis, Structure and Reactivity, Wiley, 1997, ISBN 0-471-97058-1.
- (EN) R. D. Shannon, Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides, in Acta Cryst., A32, 1976, pp. 751-767, DOI:10.1107/S0567739476001551.
- (EN) W. Stumm e J. J. Morgan, Aquatic Chemistry: Chemical Equilibria and Rates in Natural Waters, 3ª ed., John Wiley & Sons, 1995, ISBN 0-471-51185-4.

![{\displaystyle \mathrm {velocita'} =-\left({\frac {d[A]}{dt}}\right)_{T}=k[A]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/911c0e096f412ff3ad65ac02b04c49fa980003c4)
