Triossido di uranio
| Triossido di uranio | |
|---|---|
 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | UO3 |
| Massa molecolare (u) | 286,29 |
| Aspetto | polvere arancio-gialla |
| Numero CAS | |
| Numero EINECS | 215-701-9 |
| PubChem | 74013 |
| SMILES | O=[U](=O)=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5.5–8.7 |
| Indice di rifrazione | ? |
| Solubilità in acqua | ? |
| Temperatura di fusione | ~200-650 °C (decomposizione) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 330 - 300 - 373 - 411 |
| Consigli P | ---[1] |
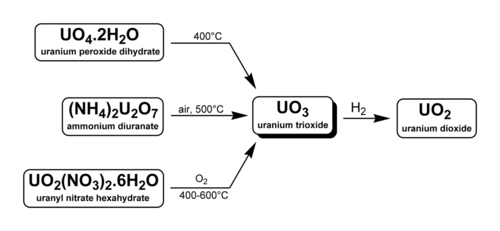
Il triossido di uranio, anche chiamato ossido di uranile, ossido di uranio(VI) o ossido uranico, è l'ossido esavalente dell'uranio. Il solido può essere ottenuto riscaldando il nitrato di uranile a 400 °C. Il suo polimorfo più comunemente riscontrato (UO3), è una polvere giallo-arancio.
Produzione e utilizzo
[modifica | modifica wikitesto]Esistono tre metodi per generare triossido di uranio. Come indicato di seguito, due sono utilizzati industrialmente nel ritrattamento del combustibile nucleare e nell'arricchimento dell'uranio.
- U3O8 può essere ossidato a 500 °C con ossigeno[2]. Si noti che sopra i 750 °C anche a 5 atm O2UO3 si decompone in U3O8[3]
- Il nitrato di uranile, UO2(NO3)2·6H2O può essere riscaldato per produrre triossido di uranio. Ciò si verifica durante il ritrattamento del combustibile nucleare. Le barre di combustibile vengono disciolte in acido nitrico (HNO3) per separare il nitrato di uranile dal plutonio e dai prodotti di fissione (metodo PUREX). Il nitrato di uranile puro viene convertito in triossido di uranio solido mediante riscaldamento a 400 °C. Dopo la riduzione con idrogeno (in presenza di altro gas inerte) a diossido di uranio, l'uranio può essere utilizzato in nuove barre di combustibile MOX.
- Il diuranato di ammonio ((NH4)2U2O7) o il diuranato di sodio (Na2U2O7·6H2O) possono essere decomposti. Il diuranato di sodio, noto anche come yellowcake, viene convertito in triossido di uranio nell'arricchimento dell'uranio. Il diossido di uranio e il tetrafluoruro di uranio sono intermedi nel processo che termina in esafluoruro di uranio[4].
Il triossido di uranio viene spedito tra gli impianti di lavorazione sotto forma di gel, il più delle volte dalle miniere agli impianti di conversione. Quando vengono utilizzati per la conversione, tutti gli ossidi di uranio sono spesso chiamati uranio ritrattato (RepU)[5].
La Cameco Corporation, che opera presso la più grande raffineria di uranio del mondo a Blind River, nell'Ontario, produce triossido di uranio di elevata purezza.
È stato riportato che la corrosione dell'uranio in una soluzione acquosa ricca di silice forma diossido di uranio, triossido di uranio[6] e coffinite[7]. In acqua pura, nella prima settimana si forma lo schoepite (UO2)8O2(OH)12·12(H2O))[8] e dopo quattro mesi si produce la studtite ((UO2)O2·4(H2O)). Questa alterazione dell'ossido di uranio porta anche alla formazione di metastudtite[9] [10], un perossido di uranile più stabile, spesso presente sulla superficie del combustibile nucleare esaurito esposta all'acqua. Rapporti sulla corrosione dell'uranio metallico sono stati pubblicati dalla Royal Society[11][12].
Pericoli per la salute e la sicurezza
[modifica | modifica wikitesto]Come tutti i composti di uranio esavalente, il triossido di uranio è pericoloso per inalazione, ingestione e contatto con la pelle. È una sostanza velenosa, leggermente radioattiva, che può causare mancanza di respiro, tosse, lesioni arteriose acute e cambiamenti nei cromosomi dei globuli bianchi e delle gonadi che portano a malformazioni congenite se inalato[13][14]. Tuttavia, una volta ingerito, l'uranio è principalmente tossico per i reni e può influire gravemente sulla loro funzione.
Struttura
[modifica | modifica wikitesto]Struttura allo stato solido
[modifica | modifica wikitesto]L'unico triossido binario ben caratterizzato di qualsiasi attinide è il triossido di uranio, di cui sono noti diversi polimorfi. Il triossido di uranio solido perde O2 per riscaldamento per dare U3O8 di colore verde: i rapporti della temperatura di decomposizione nell'aria variano da 200-650 °C. Il riscaldamento a 700 °C sotto H2 fornisce biossido di uranio marrone scuro (UO2), che viene utilizzato nelle barre di combustibile nucleare MOX.
Alpha
[modifica | modifica wikitesto] |
La forma (alfa): un solido stratificato in cui gli strati 2D sono collegati da atomi di ossigeno (in rosso) | Il perossido di uranile idrato formato dall'aggiunta di acqua ossigenata a una soluzione acquosa di nitrato di uranile quando riscaldato a 200–225 °C forma un triossido di uranio amorfo che, riscaldandosi a 400–450 °C, forma triossido di alfa-uranio.[3] È stato affermato che la presenza di nitrati abbasserà la temperatura alla quale si verifica il passaggio esotermico dalla forma amorfa alla forma alfa[15] |
Beta
[modifica | modifica wikitesto] |
UO3. Questo solido ha una struttura che sconfigge la maggior parte dei tentativi di descriverlo. | Questa forma può essere formata riscaldando diuranato di ammonio, mentre P.C. Debets e B.O. Loopstra, hanno trovato quattro fasi solide nel sistema UO3-H2O-NH3 che potrebbero essere tutte considerate UO2(OH)2·H2O dove parte dell'acqua è stata sostituita con ammoniaca.[16][17] Non importa quale sia l'esatta stechiometria o struttura, si è scoperto che la calcinazione a 500 °C in aria forma la forma beta del triossido di uranio.[3] |
Gamma
[modifica | modifica wikitesto] |
La forma (gamma), con i diversi ambienti di uranio in verde e giallo | Il polimorfo più frequentemente riscontrato è UO3, la cui struttura a raggi x è stata risolta dai dati di diffrazione da polvere. Il composto cristallizza nel gruppo spaziale I41/amd con due atomi di uranio nell'unità asimmetrica. Entrambi sono circondati da ottaedri alquanto distorti di atomi di ossigeno. Un atomo di uranio ha due atomi di ossigeno più vicini e quattro più distanti mentre l'altro ha quattro atomi di ossigeno vicini e due più distanti come vicini. Quindi non è scorretto descrivere la struttura come [UO2]2+[UO4]2− , cioè uranile uranato.[18] |
Delta
[modifica | modifica wikitesto] |
La forma delta è un solido cubico in cui gli atomi di ossigeno sono disposti tra gli atomi di uranio.[19] |
Forma ad alta pressione
[modifica | modifica wikitesto]C'è una forma solida ad alta pressione con anelli di U2O2 e U3O3 al suo interno.[20]
Idrati
[modifica | modifica wikitesto]-
Forma idrata (a sinistra) e anidrata (a destra) del UO3
-
Forme anidre di UO3
Sono noti diversi idrati di triossido di uranio, ad esempio UO3·6H2O.[3]
Parametri di valenza del legame
[modifica | modifica wikitesto]È possibile, mediante calcoli della valenza del legame[21], stimare quanto grande sia il contributo che un dato atomo di ossigeno sta apportando alla presunta valenza dell'uranio[22]. I calcoli della valenza del legame utilizzano parametri che vengono stimati dopo aver esaminato un gran numero di strutture cristalline di ossidi di uranio (e relativi composti di uranio); si noti che gli stati di ossidazione forniti da questo metodo sono solo una guida che aiuta nella comprensione di una struttura cristallina.
La formula da usare è:
- .
La somma dei valori è uguale allo stato di ossidazione del centro metallico.
Per il legame dell'uranio con l'ossigeno, le costanti e sono elencate nella tabella seguente:
| Stato di ossidazione | ||
|---|---|---|
| U(VI) | 2,08 Å | 0,35 |
| U(V) | 2,10 Å | 0,35 |
| U(IV) | 2,13 Å | 0,35 |
Forme molecolari
[modifica | modifica wikitesto]Mentre il triossido di uranio si incontra in condizioni ambientali come solido polimerico, è stato svolto un lavoro sulla forma molecolare in fase gassosa, negli studi di isolamento della matrice e nel calcolo.[senza fonte]
Fase gassosa
[modifica | modifica wikitesto]A temperature elevate l'UO3 gassosa è in equilibrio con l'octaossido di triuranio (U3O8) solido e ossigeno molecolare.
All'aumentare della temperatura l'equilibrio si sposta a destra. Questo sistema è stato studiato a temperature comprese tra 900 °C e 2500 °C. La tensione di vapore del triossido di uranio monomerico in equilibrio con l'aria e il solido U3O8 a pressione ambiente, circa 10−5 mbar (1 mPa) a 980 °C, salendo a 0,1 mbar (10 Pa) a 1400 °C, 0,34 mbar (34 Pa) a 2100 °C, 1,9 mbar (193 Pa) a 2300 °C e 8,1 mbar (809 Pa) a 2500 °C.[23][24]
Isolamento della matrice
[modifica | modifica wikitesto]La spettroscopia infrarossa del triossido di uranio molecolare isolato in una matrice di argon indica una struttura a forma di T (gruppo C2v) per la molecola. Questo è in contrasto con la comunemente incontrata simmetria molecolare D3h esibita dalla maggior parte dei triossidi. Dalle costanti di forza si deduce che le lunghezze del legame UO sono comprese tra 1,76 e 1,79 Å.[25]
Studio computazionale
[modifica | modifica wikitesto]
I calcoli prevedono che il gruppo di punti del triossido di uranio molecolare sia a simmetria C2v, con una lunghezza del legame assiale di 1,75 Å, una lunghezza del legame equatoriale di 1,83 Å e un angolo di 161° tra gli ossigeni assiali. La specie D3h (più simmetrica) è un punto di sella, 49 kJ/mol sopra il minimo C2v. Gli studi pensano all'effetto Jahn–Teller come spiegazione.[26]
Reattività
[modifica | modifica wikitesto]Il triossido di uranio reagisce a 400 °C con freon-12 per formare cloro, fosgene, anidride carbonica e tetrafluoruro di uranio. Il freon-12 può essere sostituito con freon-11 che forma tetracloruro di carbonio al posto dell'anidride carbonica. Questo è un caso di un freon peralogenato duro che è normalmente considerato inerte e che viene convertito chimicamente a una temperatura moderata.[27]
- .
Il triossido di uranio può essere sciolto in una miscela di tributilfosfato e tenoiltrifluoroacetone in anidride carbonica supercritica, durante la dissoluzione sono stati impiegati gli ultrasuoni.[28]
Modifica elettrochimica
[modifica | modifica wikitesto]È stato studiato l'inserimento reversibile di cationi magnesio nel reticolo del triossido di uranio mediante ciclovoltammetria utilizzando un elettrodo di grafite modificato con particelle microscopiche dell'ossido di uranio. Questo esperimento è stato fatto anche per l'U3O8. Questo è un esempio di elettrochimica con un elettrodo solido modificato. È anche possibile ridurre il triossido di uranio con sodio metallico per formare ossidi di sodio e uranio.[29]
È stato possibile inserire il litio[30][31][32] nel reticolo del triossido di uranio per via elettrochimica: questa procedura è simile al modo in cui funzionano alcune batterie agli ioni di litio ricaricabili. In queste celle ricaricabili uno degli elettrodi è un ossido metallico che contiene un metallo come cobalto che può essere ridotto per mantenere l'elettroneutralità: per ogni elettrone che viene aggiunto al materiale dell'elettrodo, uno ione di litio entra nel reticolo di questo elettrodo di ossido.
Anfoterismo e reattività per formare anioni e cationi correlati all'uranio(VI)
[modifica | modifica wikitesto]L'ossido di uranio è anfotero e reagisce come acido e come base, a seconda delle condizioni:
Come acido:
- .
La dissoluzione dell'ossido di uranio in una base forte come idrossido di sodio forma l'anione uranato a doppia carica negativa (UO42-). Gli uranati tendono a concatenare, formando diuranato, (U2O72-), o altri poliuranati. Diuranati importanti includono il diuranato di ammonio ((NH4)2U2O7), il diuranato di sodio (Na2U2O7) e il diuranato di magnesio (MgU2O7), che fa parte di alcuni yellowcake. Vale la pena notare che gli uranati della forma M2UO4 non contengono ioni UO42-, ma piuttosto ottaedri appiattiti di UO6, contenenti un gruppo uranilico e ponti a ossigeno.[33]
Come base:
- .
La dissoluzione dell'ossido di uranio in un acido forte come l'acido solforico o l'acido nitrico forma il catione uranile con doppia carica positiva. Il nitrato di uranile formato (UO2(NO3)2·6H2O) è solubile in etere, alcool, chetone ed estere, come per esempio il tributilfosfato. Questa solubilità viene utilizzata per separare l'uranio da altri elementi nel riprocessamento nucleare, che inizia con la dissoluzione delle barre di combustibile nucleare in acido nitrico. Il nitrato di uranile viene quindi convertito in triossido di uranio mediante riscaldamento.
Da acido nitrico si ottiene nitrato di uranile, transUO2(NO3)2·2H2O, costituito da uranio a otto coordinate con due ligandi nitrato bidentati e due ligandi dell'acqua, nonché il nucleo familiare O=U=O.
Ossidi di uranio nelle ceramiche
[modifica | modifica wikitesto]Le ceramiche a base di triossido di uranio diventano verdi o nere se cotte in atmosfera riducente e da gialle ad arancioni se cotte con ossigeno. Il colore arancione Fiestaware è un noto esempio di prodotto con smalto a base di uranio. UO3- è stato utilizzato anche in formulazioni di smalto, vetro all'uranio e porcellana.
Prima del 1960, il triossido di uranio veniva utilizzato come agente di cristallizzazione negli smalti colorati cristallini. È possibile determinare con un contatore Geiger se uno smalto o un vetro è stato realizzato con UO3.
Note
[modifica | modifica wikitesto]- ^ Scheda generica dei composti dell'uranio su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive. consultata il 19.08.2014
- ^ (EN) I. Sheft, S. Fried e N. Davidson, Preparation of Uranium Trioxide, in Journal of the American Chemical Society, vol. 72, n. 5, 1950, pp. 2172–2173, DOI:10.1021/ja01161a082.
- ^ a b c d (EN) V.J. Wheeler, R.M. Dell e E. Wait, Uranium trioxide and the UO3 hydrates, in Journal of Inorganic and Nuclear Chemistry, vol. 26, n. 11, 1964, pp. 1829–1845, DOI:10.1016/0022-1902(64)80007-5.
- ^ (EN) R.M. Dell e V.J. Wheeler, Chemical Reactivity of Uranium Trioxide Part 1. — Conversion to U3O8, UO2 and UF4, in Transactions of the Faraday Society, vol. 58, 1962, pp. 1590–1607, DOI:10.1039/TF9625801590.
- ^ (EN) Transport of Radioactive Materials - World Nuclear Association, su www.world-nuclear.org. URL consultato il 12 aprile 2018 (archiviato dall'url originale il 5 febbraio 2015).
- ^ (EN) E.R. Trueman, S. Black, D. Read e M.E. Hodson, Alteration of Depleted Uranium Metal, in Goldschmidt Conference Abstracts, 2003, p. A493. abstract
- ^ (EN) X. Guo, S. Szenknect, A. Mesbah, S. Labs, N. Clavier, C. Poinssot, S.V. Ushakov, H. Curtius, D. Bosbach, R.C. Rodney, P. Burns e A. Navrotsky, Thermodynamics of Formation of Coffinite, USiO4, in Proc. Natl. Acad. Sci. USA, vol. 112, n. 21, 2015, pp. 6551–6555, DOI:10.1073/pnas.1507441112.
- ^ (EN) Schoepite Mineral Data, su webmineral.com. URL consultato il 4 novembre 2024.
- ^ (EN) P.F. Weck, E. Kim, C.F. Jove-Colon e D.C. Sassani, Structures of uranyl peroxide hydrates: a first-principles study of studtite and metastudtite, in Dalton Trans, vol. 111, n. 41, 2012, p. 9748–52, DOI:10.1039/C2DT31242E.
- ^ (EN) X. Guo, S.V. Ushakov, S. Labs, H. Curtius, D. Bosbach e A. Navrotsky, Energetics of Metastudtite and Implications for Nuclear Waste Alteration, in Proc. Natl. Acad. Sci. USA, vol. 111, n. 20, 2015, p. 17737–17742, DOI:10.1073/pnas.1421144111.
- ^ (EN) L. Ander e B. Smith, Groundwater transport modelling The health hazards of depleted uranium munitions, part II, su royalsoc.ac.uk, Londra, The Royal Society.
- ^ (EN) B. Smith, Annexe G: Corrosion of DU and DU alloys: a brief discussion and review The health hazards of depleted uranium munitions, part II, su royalsoc.ac.uk, Londra, The Royal Society, 2002.
- ^ (EN) P.E. Morrow, F.R. Gibb e H.D. Beiter, Inhalation studies of uranium trioxide, in Health Physics, vol. 23, n. 3, 1972, p. 273–280, DOI:10.1097/00004032-197209000-00001. abstract
- ^ (EN) M. Sutton e S.R. Burastero, Uranium(VI) solubility and speciation in simulated elemental human biological fluids, in Chemical Research in Toxicology, vol. 17, n. 11, 2004, p. 1468–1480, DOI:10.1021/tx049878k.
- ^ (EN) T. Sato, Preparation of uranium peroxide hydrates, in Journal of Applied Chemistry, vol. 13, n. 8, 1963, p. 361–365, DOI:10.1002/jctb.5010130807.
- ^ (EN) P.C. Debets e B.O. Loopstra, On the Uranates of Ammonium II: X-Ray Investigation of the Compounds in the system NH3-UO3-H2O, in Journal of Inorganic and Nuclear Chemistry, vol. 25, n. 8, 1963, p. 945–953, DOI:10.1016/0022-1902(63)80027-5.
- ^ (EN) P.C. Debets, The Structure of β-UO3, in Acta Crystallographica, vol. 21, n. 4, 1966, p. 589–593, DOI:10.1107/S0365110X66003505.
- ^ (EN) R. Engmann e P.M. de Wolff, The Crystal Structure of γ-UO3 (PDF), in Acta Crystallographica, vol. 16, n. 10, 1963, p. 993–996, DOI:10.1107/S0365110X63002656.
- ^ (EN) M. T. Weller, P. G. Dickens e D. J. Penny, The structure of δ-UO3>, in Polyhedron, vol. 7, n. 3, 1988, p. 243–244, DOI:10.1016/S0277-5387(00)80559-8.
- ^ (EN) S. Siegel, H.R. Hoekstra e E. Sherry, The crystal structure of high-pressure UO3, in Acta Crystallographica, vol. 20, n. 2, 1966, p. 292–295, DOI:10.1107/S0365110X66000562.
- ^ (EN) Copia archiviata, su Kristall.uni-mki.gwdg.de. URL consultato il 14 luglio 2012 (archiviato dall'url originale il 14 luglio 2012).
- ^ (EN) Zachariasen, Bond lengths in oxygen and halogen compounds of d and f elements, in J. Less Common Met., vol. 62, 1978, pp. 1–7, DOI:10.1016/0022-5088(78)90010-3.
- ^ (EN) R.J. Ackermann, P.W. Gilles e R.J. Thorn, High-Temperature Thermodynamic Properties of Uranium Dioxide, in Journal of Chemical Physics, vol. 25, n. 6, 1956, p. 11089, DOI:10.1063/1.1743156.
- ^ (EN) C.A. Alexander, Volatilization of urania under strongly oxidizing conditions, in Journal of Nuclear Materials, vol. 346, 2–3, 2005, p. 312–318, DOI:10.1016/j.jnucmat.2005.07.013.
- ^ (EN) S.D. Gabelnick, G.T. Reedy e M.G. Chasanov, Infrared spectra of matrix-isolated uranium oxide species. II: Spectral interpretation and structure of UO3, in Journal of Chemical Physics, vol. 59, n. 12, 1973, p. 6397–6404, DOI:10.1063/1.1680018.
- ^ (EN) P. Pyykkö e J. Li, Quasirelativistic pseudopotential study of species isoelectronic to uranyl and the equatorial coordination of uranyl, in Journal of Physical Chemistry, vol. 98, n. 18, 1994, p. 4809–4813, DOI:10.1021/j100069a007.
- ^ (EN) H.S. Booth, W. Krasny-Ergen e R.E. Heath, Uranium Tetrafluoride, in Journal of the American Chemical Society, vol. 68, n. 10, 1946, p. 11969–1970, DOI:10.1021/ja01214a028.
- ^ (EN) T.I. Trofimov, M.D. Samsonov, S.c. Lee, B.F. Myasoedov e C.M. Wai, Dissolution of uranium oxides in supercritical carbon dioxide containing tri-n-butyl phosphate and thenoyltrifluoroacetone, in Mendeleev Communications, vol. 11, n. 4, 2001, p. 129–130, DOI:10.1070/MC2001v011n04ABEH001468.
- ^ (EN) R. E. Dueber, Investigation of the Mechanism of Formation of Insertion Compounds of Uranium Oxides by Voltammetric Reduction of the Solid Phase after Mechanical Transfer to a Carbon Electrode, in Journal of the Electrochemical Society, vol. 139, n. 9, 1992, p. 2363–2371, Bibcode:1992JElS..139.2363D, DOI:10.1149/1.2221232.
- ^ (EN) P.G. Dickens, S.D. Lawrence, D.J. Penny e A.v. Powell, Insertion compounds of uranium oxides, in Solid State Ionics, 32–33, 1989, p. 77–83, DOI:10.1016/0167-2738(89)90205-1.
- ^ (EN) P.G. Dickens, S.V. Hawke e M.T. Weller, Lithium insertion into UO3 and U3O8, in Materials Research Bulletin, vol. 20, n. 6, 1985, p. 635–641, DOI:10.1016/0025-5408(85)90141-2.
- ^ (EN) P.G. Dickens, S.V. Hawke e M.T. Weller, Hydrogen insertion compounds of UO3, in Materials Research Bulletin, vol. 19, n. 5, 1984, p. 543–547, DOI:10.1016/0025-5408(84)90120-X.
- ^ (EN) Simon Cotton, Lanthanides and Actinides, New York, Oxford University Press, 1991, p. 128, ISBN 978-01-95-07366-9.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sul triossido di uranio
Wikimedia Commons contiene immagini o altri file sul triossido di uranio