Diossido di cloro
| Diossido di cloro | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| diossido di cloro | |
| Caratteristiche generali | |
| Formula bruta o molecolare | ClO2 |
| Peso formula (u) | 67.45 |
| Aspetto | gas giallo-rosso pallido, con odore pungente |
| Numero CAS | |
| Numero EINECS | 233-162-8 |
| PubChem | 24870 |
| DrugBank | DB12453 |
| SMILES | O=Cl[O] |
| Proprietà chimico-fisiche | |
| Densità (g/l, in c.s.) | 1,6 kg/L (a 0 °C, liquido) |
| Solubilità in acqua | 8 g/L |
| Temperatura di fusione | −59 °C (214 K) |
| Temperatura di ebollizione | 11 °C (284 K) |
| Tensione di vapore (Pa) a 293 K | 101000 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 104.60 kJ/mol |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 292 (ORL MUS)[1] |
| Indicazioni di sicurezza | |
| TLV (ppm) | 0.1 ppm |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 270 - 330 - 314 - 400 [2] |
| Consigli P | --- |
Il dicloro diossidante è un gas di colore giallo-verde pallido con formula chimica ClO2. Cristallizza a −59 °C in cristalli arancioni. Come molti altri ossidi di cloro, è un potente ossidante ed è utilizzato nel candeggiamento e nel trattamento delle acque per la disinfezione.
Applicazioni[modifica | modifica wikitesto]
Il composto viene utilizzato principalmente (più del 95%) nello sbiancamento della cellulosa e della farina e nel trattamento delle acque.
Nel 1956 a Bruxelles viene sostituito il cloro con il biossido nel trattamento delle acque. Adesso viene usato come ossidante finale nella potabilizzazione. Rispetto al più economico ipoclorito, non produce trialometani per reazione con i fenoli derivanti dalla decomposizione degli acidi umici; viene inoltre diminuita la formazione di bromati.
Il diossido di cloro ha un'azione disinfettante migliore del cloro in acque a pH neutro, riesce a controllare meglio i batteri della legionella e diversi virus, ed è anche meno corrosivo. L'unico inconveniente è la produzione di cloriti.
È anche utilizzato nella disinfezione dell'aria; fu ad esempio l'agente chimico principale impiegato nelle minacce di contaminazione con antrace del 2001 negli Stati Uniti. Recentemente, dopo l'uragano Katrina a New Orleans, il diossido di cloro è stato usato per disinfettare la pericolosa melma che inondò le case.
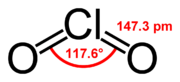
Struttura e Legami[modifica | modifica wikitesto]
La molecola ClO2 ha un numero dispari di elettroni di valenza e quindi è un radicale paramagnetico. Si tratta di un insolito "esempio di molecola con elettroni spaiati stabile alla dimerizzazione" (l'ossido nitrico è un altro esempio).
Nel 1933, Lawrence O. Brockway, studente di Linus Pauling, propose una struttura che prevedeva un legame a tre elettroni e due legami singoli. Tuttavia, Pauling nella sua Chimica generale mostra un doppio legame per un ossigeno e un legame singolo più un legame a tre elettroni per l'altro. La struttura del legame di valenza sarebbe rappresentata come l'ibrido di risonanza descritto da Pauling. Il legame a tre elettroni rappresenta un legame più debole del doppio legame. Nella teoria degli orbitali molecolari questa idea è comune se il terzo elettrone è posto in un orbitale di antilegame. Lavori successivi hanno confermato che l'orbitale molecolare più alto occupato è effettivamente un orbitale di antilegame incompletamente riempito.
Una cella unitaria del cristallo ortorombico del ClO2 mostrata in una direzione arbitraria.
La struttura cristallina del ClO2 è ortorombica e presenta la simmetria del gruppo spaziale Pbca.
Sintesi[modifica | modifica wikitesto]

In laboratorio, questo ossido è preparato dall'ossidazione del clorito di sodio:
- 2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
Oltre il 95% del diossido di cloro è prodotto dal clorato di sodio.
È prodotto con grande efficienza riducendo il clorito di sodio in una soluzione a pH molto basso con un agente riducente, quale l'acido cloridrico o l'anidride solforosa. La reazione tra il clorito di sodio e l'acido cloridrico è illustrata di seguito:
- HClO3 + HCl → HClO2 + HClO
- HClO3 + HClO2 → 2 ClO2 + Cl2 + 2 H2O
- HOCl + HCl → Cl2 + H2O
Una parte più piccola di diossido di cloro è utilizzata come disinfettante. Può essere anche prodotta dall'elettrolisi di una soluzione di clorito di sodio:
- 2 NaClO2 + 2 H2O 2 ClO2 + 2 NaOH + H2
In alternativa, si può produrre in laboratorio riscaldando una miscela di clorato di potassio e acido ossalico:
- 2 KClO3 + H2C2O4 → 2 ClO2 + K2CO3 + CO2 + H2O
Note[modifica | modifica wikitesto]
- ^ (EN) Chlorine dioxide toxicity Archiviato il 26 marzo 2010 in Internet Archive.
- ^ scheda del diossido di cloro su [1]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su diossido di cloro
Wikimedia Commons contiene immagini o altri file su diossido di cloro
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) chlorine dioxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 783 · LCCN (EN) sh94003518 · GND (DE) 4131414-1 · J9U (EN, HE) 987007537150605171 · NDL (EN, JA) 00575747 |
|---|
