Carcinoma della bocca: differenze tra le versioni
Creazione pagina carcinoma della bocca |
(Nessuna differenza)
|
Versione delle 21:46, 17 feb 2013
| Carcinoma della bocca | |
|---|---|
 | |
| Tipo | Maligno |
| Cellula di origine | Epitelio orale |
| Fattori di rischio | · Fumo · Alcool · Alimentazione · HPV |
| Incidenza | 3,8/100 000 (globale) 4,0/100 000 (Italia) |
| Età media alla diagnosi | oltre 50 anni |
| Rapporto M:F | 2:1 (globale) 3:1 (Italia) |
| Classificazione e risorse esterne | |
| ICD-9-CM | (EN) 140-146 |
| ICD-10 | (EN) C00-C06 |
Con il termine di carcinoma della bocca o carcinoma orale si intende l'insieme delle neoplasie maligne che si originano dai tessuti epiteliali che rivestono la cavità orale. Non rientrano quindi nella categoria le neoplasie benigne (papillomi, lipomi, angiomi) e le neoplasie maligne di origine non epiteliale (melanomi, tumori delle ghiandole salivari, sarcomi) che possono talvolta manifestarsi nel cavo orale. Allo stesso modo, non vi rientrano le forme secondarie.
Il Carcinoma orale rappresenta all'incirca il 90% di tutte le neoplasie maligne della bocca. Colpisce più frequentemente oltre i cinquant'anni di età, ed i maschi in misura maggiore delle donne, in un rapporto di circa 2:1 a livello globale, di 3:1 nel nostro paese. I principali fattori di rischio sono il fumo e l'abuso di alcolici. La tipologia istologica di gran lunga più frequente è il carcinoma a cellule squamose o spinocellulare.
Nelle fasi inziali l'aspetto è di piccola lesione superficiale rossa o bianca (eritroplachia o leucoplachia), o di una ulcerazione non tendente a guarigione spontanea. Talvolta può assumere l'aspetto di lesione infiltrativa nodulare, in forma di ispessimento più o meno regolare rilevato sui bordi, che tende ad ulcerarsi superficialmente, ma non è infrequente anche una forma a crescita esofitica o papillare. In alcuni casi può presentare più di uno di questi aspetti contemporaneamente. La tendenza prevalente è per la crescita invasiva locale, con rapido interessamento linfonodale, ma bassa frequenza di metastasi a distanza.
I sintomi più frequenti sono la sensazione di aumento di consistenza della mucosa interessata, successivamente il dolore, inizialmente in forma di bruciore lieve ma ingravescente, a cui col tempo si possono accompagnare il rigonfiamento dei linfonodi, difficoltà a deglutire e difficoltà alla fonazione. L'esame diagnostico principale è la biopsia.
La terapia per questo tipo di tumore prevede l'utilizzo di chirurgia o radioterapia, a seconda della sede, mentre nelle lesioni più avanzate le due tecniche vengono utilizzate in associazione, talvolta con chemioterapia di supporto. La prognosi è mediamente buona, ma dipende notevolmente dall'estensione della patologia al momento della diagnosi, fondamentale quindi risulta la diagnosi precoce.
Epidemiologia
Il cancro orale e delle labbra si colloca al quindicesimo posto a livello globale come incidenza relativa di tutti i tumori (2,1% di tutte le neoplasie), con un dato (standardizzato per età) di 3,8 nuovi casi per anno ogni 100.000 abitanti, valori che differiscono significativamente tra uomini e donne, per un rapporto indicativo di circa 2:1. Raggiunge infatti il decimo posto tra gli uomini con un valore di 5,2 casi ogni 100.000 abitanti (2,6% di tutte le neoplasie) ed il diciassettesimo tra le donne (2,5 casi ogni 100.000, 1,5%). Il tasso di mortalità è di 1,9 decessi ogni 100.000 abitanti, ed anche in questo caso gli uomini sopravanzano le donne per un fattore di circa 2:1 (2,6 contro 1,2 decessi ogni 100.000)[1]. Nel confronto con i dati di indagini precedenti (2002) è possibile notare una lieve diminuzione nell'incidenza nel tempo, ma un leggero aumento nel dato mortalità, in entrambi i sessi[2].
La distribuzione globale di questa patologia varia considerevolmente sia per quanto riguarda i valori assoluti che relativi, con un picco in alcuni paesi dell' Asia meridionale e nell'Europa centro-orientale, legato alla ampia diffusione di comportamenti a rischio come fumo, abuso di alcolici e masticazione del paan (betel), raggiungendo in India il terzo posto come incidenza relativa tra tutte le neoplasie[3]. I paesi di minore diffusione sono quelli africani e del sud america [4].
In Italia il cancro orale e delle labbra presenta un'incidenza media di 4,0 nuovi casi all'anno ogni 100.000 abitanti (standardizzato per età), il che lo pone al diciottesimo posto tra tutte le neoplasie nel nostro paese. Dividendo i dati per sesso, si hanno 6,0 nuovi casi ogni 100.000 abitanti maschi all’anno e di 2,3 per le donne, con un rapporto tra i due sessi di poco inferiore a 3:1. Il tasso di mortalità annuo è di 1,3 persone ogni 100.000 abitanti, ed anche in questo caso è di circa tre volte più alto tra gli uomini (2,0) rispetto alle donne (0,7)[5]. Analizzando i dati degli anni passati (periodo 1986-1997), è possibile notare una tendenza al riavvicinamento nei dati di incidenza e mortalità tra uomini e donne, fino al raggiungimento del rapporto odierno di 3:1, mantenutosi stabile negli ultimi anni[6].
Le dati epidemiologici mostrano chiaramente il legame di questa neoplasia con l'aumento dell'età, che risulta in un'incidenza che partendo dal dato (globale) di 0,1 casi ogni 100.000 abitanti nella fascia d'età 0-14 anni, sale gradualmente fino a raggiungere il livello massimo di 21,9 nella fascia oltre i 75 anni[7].
Eziologia
Alcuni fattori di rischio si sono rivelati particolarmente significativi per questa forma di neoplasia [8][9][10]. Tra questi assumono particolare importanza l'uso del tabacco, sia nelle forme che ne prevedono la combustione che per masticazione, e l'abuso di alcolici, in grado di dare conto di circa i tre quarti di tutti i tumori orali nei paesi dove queste abitudini rappresentano la principale fonte di rischio. Nel paesi medio orientali e nel sud dell'asia, la diffusa abitudine alla masticazione voluttuaria di particolari miscele vegetali (paan e qāt) sembra parimenti comportare livelli di rischio molto elevati. Altri fattori di rischio che si sono potuti correlare all'aumento di incidenza di tumori orali sono le infezioni virali da HPV, alcuni fattori legati alla dieta ed alle abitudini igieniche, situazioni di immunodeficienza sia acquisita che congenita, e la presenza di alcune patologie che sembrano poter essere promotori della neoplasia, per questo classificate dall'Oms come condizioni precancerose. Anche la familiarità è stata chiamata in causa da alcuni studi come possibile fattore di rischio[11].
Tabacco

Il collegamento tra tabagismo, nelle sue varie forme, ed il carcinoma orale è ben conosciuta da tempo, e dimostrata da numerosi studi epidemiologici[12]. Il fumo di sigaretta in particolare è considerato la prima causa di tumore orale in assoluto, ed il riavvicinamento graduale tra incidenza e mortalità nei due sessi sembra legato proprio al diffondersi di questa abitudine anche nel sesso femminile, dove sembra in grado di rivelarsi persino più dannosa che tra i maschi[13]. L'abitudine al fumo di sigaro, meno correlata ai tumori delle vie aeree inferiori e del polmone rispetto alle sigarette, in quanto si ha una minore aspirazione del fumo, sembra invece comportare un rischio maggiore per le vie aeree superiori, cavità orale in primis, proprio per l'abitudine di mantenere il fumo in bocca, allo scopo di assaporare il gusto del tabacco. I livelli di rischio rilevati risultano da sette a dieci volte superiori ai non fumatori, e sono correlati al numero di sigari fumati ed al livello di inspirazione del fumo[14]. Problemi simili sono legati all'uso della pipa[15]. L'uso in alcune popolazioni (prevalentemente nel sesso femminile) di fumare tenendo la parte accesa dentro la bocca è stato a sua volta correlato con una maggiore incidenza della patologia orale, fatto che sembra coinvolgere anche il calore come fattore di rischio[16][17]. Anche l'uso del tabacco per la masticazione è stato segnalato in relazione ad un aumento nel rischio di carcinoma orale, secondo alcuni studi in maniera altrettanto significativa rispetto alle modalità che ne prevedono la combustione[18][19].
Alcolismo
La correlazione tra l'uso di alcoolici e neoplasia orale è ben documentata da numerosi studi, sia da sola che in concomitanza con il fumo, due abitudini che tipicamente tendono ad accompagnarsi, fatto che sembra in grado di potenziare di molto l'azione di promozione carcinogenetica[19][20]. Il legame tra abuso di alcolici e diversi tipi di tumore è del resto ben conosciuto da tempo, tanto che le bevande alcoliche sono inserite dall'IARC nella prima classe di rischio, anche se non sono ancora del tutto chiare le modalità con cui l'effetto oncogeno si sviluppa, visto che l'etanolo non sembra possedere azione mutagena diretta. Sono stati comunque proposti vari effetti diretti od indiretti in grado di spiegare i meccanismi con cui questa azione si verifica[21]. Sono stati avanzati dubbi anche riguardo l'uso di colluttori contenenti alcol, ma gli studi condotti non sono riusciti a stabilire un collegamento significativo[22][23]. Comunque, probabilmente per precauzione, da tempo alcune tra le maggiori marche hanno eliminato o ridotto drasticamente la presenza di alcol nei colluttori.
Paan e qāt

L'abitudine molto comune nei paesi asiatici di masticare il paan (da noi meglio conosciuto con il nome di uno dei componenti, il betel), miscela vegetale contenente alcune molecole appartenenti alla classe degli alcaloidi dall'effetto paragonabile a quello della nicotina, è stata correlata epidemiologicamente all'alta incidenza di questo tumore nelle regioni sud orientali.[24]Il paan viene tradizionalmente preparato mescolando la noce di Areca e le foglie del betel (Piper betel), base che nelle diverse regioni presenta molte varianti, tra cui l'aggiunta di tabacco, usanza che sembra in grado di amplificarne ulteriormente l'azione carcinogena.
Anche l' abitudine molto diffusa in alcuni paesi arabi di masticare le foglie di qāt, contenenti una sostanza alcaloide dotata di effetto euforizzante simile a quello delle anfetamine, è stata correlata alla presenza di neoplasie orali[25].
HPV
L'associazione tra papillomavirus (HPV) e carcinoma è ben conosciuta per le zone genitali (carcinoma della cervice uterina), in particolare riguardo alcuni ceppi specifici (16,18,31 e 33), in grado di produrre proteine con effetto di promozione tumorale, effetti in grado di produrre modificazioni anche a lungo termine. Un ruolo simile dell'HPV in relazione ai tumori orali sembra oramai sufficientemente dimostrato, ed in particolare il DNA del sottotipo 16 viene frequentemente isolato nelle cellule dei carcinomi in sede orale[26]. Alcuni studi hanno anche messo in relazione neoplasie orali con alcune abitudini sessuali, suggerendo l'utilità della vaccinazione a scopo profilattico, similmente a quanto già avviato nella popolazione femminile riguardo ai tumori genitali[27].
Alimentazione
Il legame tra neoplasia orale ed abitudini alimentari si è dimostrato particolarmente significativo riguardo alcune tipologie di cibi, in analogia con quanto è stato riscontrato per altri tumori del sistema digerente. In particolare diversi studi hanno messo in luce il ruolo delle verdure fresche e degli agrumi come alimenti in grado di contrastare l'insorgenza della patologia[28][29], così come si è registrato un ruolo protettivo legato al consumo regolare di caffé[9][30]. Il consumo di alimenti ricchi di fibre non si è invece rivelato un fattore particolarmente significativo[31].
Immunodeficienza
Il ruolo dell'immunosoppressione nella promozione dei tumori è ben conosciuto. Anche in sede orale, alcune condizioni in grado di indebolire le normali capacità del sistema immunitario dell'organismo sembrano essere significativamente correlate ad un aumento nel rischio di neoplasie orali. Questo è stato osservato in relazione alle terapie anti-rigetto, ed in patologie con effetto immunosoppressivo come l'AIDS, e si ritiene che anche nel caso dell'HPV, del linfoepitelioma legato al virus Epstein-Barr e di alcune patologie congenite che interferiscono con il corretto funzionamento del sistema immunitario (vedi sotto condizioni precancerose), il meccanismo immunosoppressivo sia uno dei fattori principali della promozione oncogenica. Questo sembra essere confermato anche dalla correlazione tra livello di sostanze immunosoppressive e progressione neoplastica nei soggetti malati[32].
Igiene orale e patologie dentarie
L'associazione tra scadente igiene orale o presenza di stimoli irritativi (protesi incongrue o lesioni cariose e patologia parodontale) ed il cancro orale viene frequentemente osservata clinicamente. La tipica presenza contemporanea di scarsa igiene orale, in grado di dare conto della scadente salute degli elementi dentari, ed abitudini come fumo ed alcolismo, a loro volta implicati nel processo di promozione cancerogena, hanno però reso molto difficile ad oggi stabilire una correlazione sicura su basi statistiche.
Condizioni precancerose
Alcune condizioni patologiche sono state correlate in maniera significativa con lo sviluppo del carcinoma in sede orale. In accordo con l'Oms le patologie a maggior rischio sono: il lichen planus orale, in particolare nella sua forma erosiva, la fibrosi orale sottomucosa, il lupus eritematoso sistemico, lo xeroderma pigmentoso, la disfagia sideropenica o sindrome di Plummer-Vinson, l'epidermolisi bollosa e la discheratosi congenita[33]. In presenza di queste patologie, è fortemente consigliata una valutazione periodica dello stato di salute delle mucose orali.
Patogenesi
Come per gran parte dei tumori, il processo patogenetico che porta allo sviluppo della neoplasia (carcinogenesi) non è ancora completamente conosciuto. L'ipotesi maggiormente condivisa è quella multistadio, che prevede un'accumulo graduale di alterazioni in grado di agire sui meccanismi che mantengono l'equilibrio delle cellule (omeostasi), causandone come effetto finale una proliferazione incontrollabile e, nel caso delle forme maligne, l'azione aggressiva nei confronti dei tessuti circostanti. A dare il via alla trasformazione sarebbe l'esposizione ad un fattore promotore oncogeno in grado di modificare il corredo cromosomico di una singola cellula, sia agendo a livello strutturale, che modificandone l'espressione. In particolare sono stati individuati molti geni specifici che quando attivati (oncogeni), o bloccati nella loro usuale funzione protettiva (geni oncosoppressori), possono spingere una cellula verso la trasformazione neoplastica. Nel caso delle neoplasie orali, sono state identificate numerose anomalie genetiche ricorrenti[34]t, in particolare la [[delezione[]] di alcune specifiche regioni di determinati cromosomi, alterazioni nelle sequenze che riguardano l'espressione della proteina p53, alcune cicline e relativi enzimi CKD, i geni K-ras e numerosi altri oncogeni ed oncosoppressori[35]. Un ruolo importante sembrano inoltre svolgerlo i geni che regolano una classe di recettori tipici delle cellule epiteliali, denominati EGFR (Epidermal Grow Factor Receptor), la cui azione è in grado di promuovere la crescita degli epiteli[36].
Lesioni precancerose
In accordo al modello che prevede una progressione graduale verso la patologia neoplastica, esistono alcune condizioni delle mucose orali che sono risultate significativamente correlate ad una evoluzione di questo tipo, e per questo ne viene consigliato il monitoraggio ai fini del suo intercettamento precoce. Secondo alcuni studi, circa il 70% delle neoplasie orali si sviluppa a partire da queste condizioni predisponenti[37]. Secondo l'Oms possono essere considerate lesioni precancerose la cheilite attinica, la leucoplachia e l' eritroplachia, distinguendole dalle condizioni precancerose, in quanto, a differenza di quest'ultime, sono lesioni esclusivamente correlate alle zone orali, e più specificatamente portate allo sviluppo della patologia neoplastica in questa sede[33]. Il monitoraggio della progressione verso il quadro neoplastico richiede l'esame bioptico, alla ricerca delle alterazioni istologiche e citologiche in grado di predire o meno questa evenienza. A tal riguardo è stata proposta e viene talora utilizzata una scala di valutazione (grading) che misura il grado di displasia osservabile, e quindi il livello di pericolosità (OIN). Il carcinoma in situ, in cui il grado di displasia raggiunge il grado più elevato ma senza che le atipie abbiano superato la membrana basale, viene considerato come lesione di confine tra lesione precancerosa e neoplasia vera.
La cheilite attinica è una forma di ipercheratosi dell'epitelio delle porzione esterna delle labbra, e si presenta come macchia rilevata di colore variabile, più frequentemente sul labbro inferiore, ed è strettamente legata all'esposizione solare.
Con il termine di leucoplachia o leucoplasia si intende una lesione di colore chiaro sulla superficie delle mucose non correlabile ad altre patologie[38]. Si tratta quindi di un'entità clinica, non facile da identificare con precisione, che può includere entità patologiche diverse a seconda degli autori e che ha visto cambiare nel tempo i criteri di definizione[39]. Anche dal punto di vista istopatologico gli aspetti possono variare molto, con prevalenza però del quadro dell'ipercheratosi, associato a vari livelli di displasia. La lesione può essere uniforme o alternata ad aree erosive, con una variante chiamata leucolpachia verrucosa, considerata a maggior rischio di trasformazione neoplastica[40]. Le cause della comparsa possono essere molteplici, tra cui le più comuni sono i traumi cronici da protesi mobile e le abitudini viziate. Tipicamente asintomatica, prevede terapia chirurgica solo nelle forme a maggior rischio, nel caso di aspetto non omogeneo, mentre nelle forme più comuni è previsto il monitoraggio, ed eventualmente la biopsia periodica, per valutare il grado di displasia raggiunto.
L'eritroplachia o eritroplasia viene definita una lesione di aspetto rosso eritematoso non correlabile ad altre patologie. Di solito si presenta nelle zone a minor livello di cheratinizzazione, può mostrare aspetti di maggiore o minore omogeneità, ed è spesso correlata ad abitudini viziate come fumo ed alcolismo. Presenta il maggior rischio di trasformazione neoplastica, tanto da essere considerata la lesione predisponente per eccellenza[41].
Anatomia patologica
Classificazione istologica
I vari tipi di carcinomi vengono distinti usando una classificazione basata sul riconoscimento istologico. In accordo con l'Oms[42], vengono classificate come neoplasie maligne orali di origine epiteliale i seguenti istotipi:
- Carcinoma a cellule squamose o spinocellulare
- Carcinoma verrucoso o squamoso verrucoso
- Carcinoma squamoso basaloide
- Carcinoma squamoso papillare
- Carcinoma squamoso a cellule fusate
- Carcinoma a cellule squamose acantolitiche
- Carcinoma adenosquamoso
- Carcinoma cuniculatum
- Linfoepitelioma
Se tra i tumori orali vengono compresi anche quelli della porzione esterna delle labbra, è necessario includere anche il basalioma, neoplasia particolarmente legata all'esposizione solare, per questo praticamente inesistente in localizzazione intraorale.
Carcinoma a cellule squamose
Si tratta della tipologia di gran lunga più comune, contribuendo nelle sue forme più o meno differenziate al 90% di tutta la casisitica del carcinoma in sede orale[43]. Istologicamente nelle prime fasi è caratterizzato da cellule epiteliali proliferanti, di forma poligonale, disposte a nidi o prolungamenti che si proiettano oltre la membrana basale. Saranno osservabili differenti gradi di trasformazione, con presenza di cheratinizzazione più o meno marcata, nuclei di forma irregolare, allungati ed ipercromatici. Le cellule possono talvolta riunirsi a formare perle cornee o cellule giganti plurinucleate, e si possono riconoscere ponti intercellulari (desmosomi), simili all'aspetto di spine, da cui il nome un tempo molto usato di carcinoma spinocellulare. Nelle forme meno differenziate il polimorfismo cellulare aumenta, fino al punto di non permettere più il riconoscimento dei caratteri definibili della cellula epiteliale di partenza, così come aumenta il numero di mitosi osservabili, crescono gli aspetti di cheratinizzazione anomala, e spariscono i ponti intercellulari. Frequentemente i diversi aspetti possono coesistere, rendendo difficile classificare il diverso grado di differenziazione. La lesione neoplastica tende tipicamente all'aggressività locale, con rapida invasione delle strutture circostanti, sia tessuti molli che ossei, e metastasi ai linfonodi di riferimento. La metastatizzazione a distanza per via ematica è invece rara.
Carcinoma squamoso verrucoso
Variante del carcinoma a cellule squamose, è la seconda tipologia per frequenza, ed è caratterizzato da un alto grado di differenziazione cellulare, poche perle cornee e scarse mitosi, e bassa tendenza ad oltrepassare la membrana basale, comportamento in grado talvolta di rendere complicata la diagnosi tramite biopsia, lasciando il dubbio di semplice lesione precancerosa o benigna. Il superamento della membrana basale è comunque accompagnato da intensa reazione infiammatoria degli strati inferiori sottomucosi. Il nome della neoplasia è dovuto all'aspetto macroscopico di lesione esofitica papillare-verrucosa, dalla superficie molto irregolare e consistente, raramente ulcerata, ed è caratterizzato da bassa tendenza alla metastatizzazione, e quindi prognosi favorevole. La localizzazione tipica è sulla mucosa orale e sulle gengive.
Carcinoma basaloide
Forma rara ed aggressiva, tipica del pavimento orale, ma che può colpire anche la zona orofaringea. Istologicamente si distingue per la presenza contemporanea delle cellule tipiche del carcinoma squamoso, a volte con aspetti di cheratinizzazione, mescolate alle strutture a nidi caratteristiche della neoplasia di origine basale, con cellule di piccola dimensione ma con nuclei voluminosi, e talvolta presenza della tipica disposizione periferica delle cellule a palizzata. Tende rapidamente alla diffusione tramite metastasi linfonodali, e presenta per questo prognosi piuttosto severa.
Carcinoma squamoso papillare
Variante del carcinoma squamoso che macroscopicamente presenta un aspetto tipicamente esofitico-papillare, moderata tendenza delle cellule neoplastiche al superamento dello strato basale e prognosi favorevole, anche se con spiccata tendenza alla recidiva.
Carcinoma a cellule fusate
Anche denominato carcinoma sarcomatoide o pseudosarcoma, in quanto l'aspetto istologico simula quello del sarcoma vero, per la presenza di cellule di forma allungata che compongono il corpo principale del tumore, in un quadro che però presenta aspetti di mescolanza con le cellule tipiche del carcinoma squamoso, frammiste ad atipie cellulari, il che lo rende non facile da identificare. L'aspetto macroscopico è spesso di lesione polipoide esofitica che tende ad ulcerarsi. Il comportamento non è particolarmente aggressivo, ma con variazioni notevoli. Non frequenti comunque le metastasi a distanza.
Linfoepitelioma
Anche denominato carcinoma linfoepiteliale Epstein-Barr like, per la frequente associazione con il virus Epstein-Barr, è una rara forma di carcinoma (quindi ad origine epiteliale, malgrado il nome) in cui gli aspetti istologici di raggruppamenti di cellule poligonali od indifferenziate con nuclei molto cromatici si associano ad una massiccia presenza di infiltrazione linfocitaria. Macroscopicamente si presenta come una massa infiltrante che tende all'invasione in profondità piuttosto che verso la superficie, e tipicamente si localizza nelle zone dove è maggiormente presente tessuto linfatico, ovvero nelle strutture che compongono l'anello di Waldeyer, quindi al confine tra cavità orale ed orofaringe.
Profilo clinico
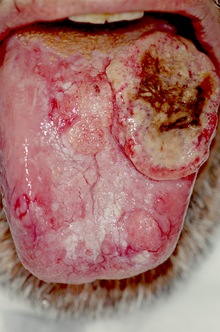
I segni e sintomi del carcinoma della bocca nei primi stadi possono essere molto lievi, quando non del tutto assenti. La lesione negli stadi iniziali si può presentare come piccola ulcerazione non tendente a guarigione spontanea, od evolvere da una lesione eritroplasica o leucoplasica, e l'unico sintomo potrà essere un lieve bruciore o dolore allo stimolo meccanico. Talvolta si potrà avere un aspetto già in partenza esofitico-papillare o polipoide, od infiltrativo-nodulare, di consistenza dura e con bordi leggermente rilevati. In questo caso il sintomo sarà quello della sensazione di variazione di consistenza o presenza di massa solida. In alcuni casi i diversi aspetti potranno coesistere, o presentarsi in zone differenti (lesioni sincrone). Il sintomo doloroso può comparire piuttosto tardivamente ed in forma lieve ed intermittente, o nella forma di bruciore, per poi aggravarsi, raggiungendo livelli estremamente elevati. In relazione a questo, e per l'interessamento dei muscoli linguali si può avere disfagia, difficoltà e/o dolore alla fonazione, e talvolta sanguinamento spontaneo o provocato dal traumatismo. Nel caso di estensione al distretto orofaringeo e rinofaringeo ci potrebbe essere otalgia e nei casi più gravi si può arrivare alla difficoltà alla respirazione. Altri sintomi legati all'estensione locale, qualora ci sia invasione delle strutture ossee, saranno la mobilità e successiva perdita dei denti per distruzione dei tessuti di supporto, e la parestesia o l'anestesia di nervi per compressione, in particolare il nervo alveolare inferiore, in caso di invasione del canale in cui decorre. Nel caso di interessamento dei muscoli masticatori, in particolare massetere e pterigoidei, si può innescare un trisma di difficile remissione.
Il coinvolgimento linfonodale, avvertibile come rigonfiamento dei linfonodi, interessa circa il 40% dei pazienti con carcinoma orale al momento della diagnosi[44], e può essere in alcuni casi precoce, e non raramente può risultare il primo sintomo avvertito della patologia neoplastica. Non necessariamente però questo sintomo sarà da correlare sempre a metastatizzazione, in quanto a volte si tratta della reazione specifica alla presenza della neoplasia in sede originaria. I linfonodi interessati dipendono dalla sede di insorgenza della lesione, venendo solitamente colpiti per primi i tributari, che raccolgono il drenaggio linfatico dalla sede di partenza. Nel caso di localizzazione anteriore (labbra, pavimento anteriore della bocca e porzione anteriore della lingua) i linfonodi coinvolti in via primaria sono i sottomentali e sottomandibolari, mentre nella zone orali posteriori (palato, trigoni retromolari) possono essere coinvolti i linfonodi periauricolari e parotidei. Successivamente vengono interessati i distretti cervicali inferiori, in successione, ma sono comunque possibili salti di stazioni linfonodali, o localizzazioni controlaterali, soprattutto nel caso di neoplasie poste vicino alla linea mediana..
La disseminazione a distanza per via ematica è invece piuttosto rara, e di solito tardiva, quindi solitamente correlata ad una stadiazione del tumore originario già molto avanzata.
Profilo diagnostico
Esami di laboratorio e strumentali
L'esame obbiettivo può solo individuare la presenza di uno stato di alterazione della normale struttura delle mucose. L'esame diagnostico principale per la determinazione sicura della presenza della neoplasia orale è quello bioptico, che permette tramite l'esame istologico del campione raccolto la determinazione delle modificazioni cellulari (citologia) e dell'alterazione della morfologia tissutale (istologia) tipiche della patologia neoplastica.
La citologia esfoliativa, che prevede la rimozione tramite spazzolamento con strumento apposito (citobrush) di una porzione superficiale di tessuto, da esaminare contestualmente al prelievo, era stata già tempo fa proposta come metodica diagnostica a bassa invasività[45], ma non sembra esserci accordo sulla reale efficacia diagnostica della metodica, in particolare sul grado di sensibilità[46][47]. Per superare questi problemi sono stati proposti alcuni miglioramenti nella tecnica di analisi citologica, avvalendosi delle maggiori conoscenze sulla biochimica delle cellule neoplastiche[48].

Ad oggi quindi il prelievo tramite biopsia viene ancora considerato il gold standard[49], ed in particolare trova maggiore indicazione la tecnica incisionale, a meno di non trovarsi di fronte a lesioni di piccole dimensioni, ben delimitate. La biopsia escissionale, infatti, nel caso frequente di lesioni infiltranti comporta il facile rischio di non comprendere totalmente la lesione neoplastica, aumentando nel caso di conferma della presenza di malignità il pericolo di disseminazione e una maggiore difficoltà nell'identificare i margini della lesione nel successivo intervento chirurgico. Il prelievo bioptico deve comprendere anche una parte di tessuto sano, e nel caso di lesioni di aspetto ampio e non uniforme, è consigliabile un prelievo multiplo, per non incorrere in falsi negativi. L'uso di una tecnica di colorazione vitale come il blu di toluidina, proposto a suo tempo come metodica diagnostica, ma rivelatosi inadatto allo scopo, può in alcuni casi aiutare a definire meglio i limiti del prelievo, particolarmente nel caso di lesioni in cui predomina l'aspetto atrofico su quello ipercheratosico.

L'uso della diagnostica per immagini nel caso dei carcinomi orali non risulta utile per la diagnosi primaria, ma è fondamentale per determinarne la stadiazione, monitorando il livello di progressione locale ed a distanza, per stabilire l'efficacia delle terapie, e per escludere la comparsa di nuove manifestazioni della patologia nel tempo. La semplice indagine radiografica ha valore molto limitato, e permette al massimo di mostrare l'eventuale estensione alle strutture osseee circostanti. L'uso della tomografia computerizzata (CT) ottiene migliori risultati, anche grazie alle nuove tecnologie di ricostruzione tridimensionale, ma non permette una buona visualizzazione dei tessuti molli, a meno di usare mezzi di contrasto specifici. La Risonanza Magnetica (RMN) permette una miglior visuale dei tessuti molli, ma una minor risoluzione rispetto alla CT. La tomografia a emissione di positroni o PET è l'esame principale per la determinazione di eventuale disseminazione metastatica, usando allo scopo dei radiotraccianti, principalmente il fluorodesossiglucosio, che viene assorbito in quantità molto maggiore dai tessuti tumorali rispetto alle cellule sane, venendo poi rilevato dal sensore di positroni della macchina, anche se con una definizione non molto elevata. Le nuove apparecchiature, combinando le tecnolgie PET e CT, permettono di unire i pregi di entrambe le metodiche, ottenendo così i migliori risultati possibili a livello di definizione e risposta diagnostica. Malgrado questo, il livello di precisione raggiunto non sembra ancora sufficiente per orientare in modo sicuro la scelta terapeutica[50][51].
Diagnosi differenziale
Vista la grande variabilità di aspetti con cui il carcinoma orale può manifestarsi, sono numerose le patologie orali che pongono necessità di diagnosi differenziale con la patologia neoplastica, il che spiega la difficoltà nel riuscire ad effettuare una diagnosi precoce.
La lesione iniziale limitata di aspetto ulcerante andrà prima di tutto differenziata dalle comuni lesioni da decubito, da ustione o da traumatismo, frequenti soprattutto nei portatori di protesi mobili, e dalle comuni ulcere di origine erpetica od aftosa. In questi casi è considerata valida la regola delle due settimane, per cui qualunque lesione ulcerata che non guarisce spontaneamente in massimo 15 giorni, dopo aver eliminato le possibili cause quando presenti, richiederà una diagnosi più approfondita, tramite biopsia.
La candidosi orale o mughetto, soprattutto nella sua forma erosiva od eritomatosa, ma anche nelle sue forme di lesione chiara (pseudomembranosa), può simulare gli aspetti di una lesione neoplastica iniziale, o di lesione precancerosa. Un trattamento antifungino topico, accompagnato da sciacqui con bicarbonato permetterà l'eliminazione della patologia, qualora di origine micotica.
Alcune lesioni di origine infettiva acute o croniche legate a patologie dentarie (parodontiti, osteiti), soprattutto se associate a stati di immunodepressione, possono in casi comunque rari assumere caratteri di aggressività locale tali da porre il sospetto di lesioni neoplastiche. Un problema simile si può presentare per le osteonecrosi da bifosfonati. La storia clinica dei pazienti raccolta con una corretta anamnesi dovrebbe essere sufficiente per eliminare il dubbio.
Altre lesioni ulcerative di aspetto simile a quella neoplastica, di tipo persistente, sono quelle da sifilide, ma solo la lesione iniziale (sifiloma primario), che può durare parecchie settimane, può creare veri problemi di diagnosi differenziale, in quanto le lesioni secondarie e terziarie (gomme) si presentano in un quadro molto più ampio.
Il papilloma a cellule squamose, la più comune neoplasia benigna orale, così come l'affine condiloma da HPV, può creare allarme per l'aspetto di escrescenza sessile o peduncolata in grado talvolta di ulcerarsi in seguito a traumatismo, ma queste escrescenze rimangono tipicamente di piccole dimensioni, presentando rivestimento epiteliale solitamente integro e crescita molto lenta. La trasformazione maligna è molto rara ma possibile, per cui se ne consiglia il monitoraggio periodico o, in caso di traumatismo frequente, l'escissione. Altre neoplasie benigne dei tessuti molli come il fibroma o il raro tumore a cellule granulose, di origine neurogena, possono richiedere l'esame istologico per eliminare il dubbio diagnostico.
La sialometaplasia necrotizzante è una lesione degenerativa acuta a carico delle ghiandole salivari minori di incerta origine (probabilmente ischemica), che compare come un nodulo che evolve in ulcerazione superficiale. Il dolore può essere acuto, e la risoluzione avviene solitamente nell'arco di alcune settimane.
Per quanto riguarda la cresta gengivale, zona comunque di non frequente localizzazione del carcinoma orale, la lesione benigna più comune in grado di indurre allarme è l'epulide, piccola neoformazione fibrosa polipoide di varia origine ed aspetto isologico, tipicamente associata ad un dente, quasi sempre asintomatica.
La glossite rombica mediana, entità patologica oggi considerata una particolare forma di candidosi cronica, si manifesta come arrossamento o lesione rilevata al centro della lingua, poco o per niente sintomatica, non sanguinante. Istologicamente si osserva ipercheratosi associata ad un modesto grado di alterazione della normale struttura tissutale, ma senza aspetti di malignità. Può essere associata all'uso di spray contenenti corticosteroidi per il trattamento di patologie respiratorie su base allergica.
Una formazione simile è lo struma tiroideo linguale, dato dalla presenza di tessuto tiroideo in sede ectopica, al centro della lingua, davanti al foro cieco. Può associarsi ad ipoplasia della tiroide, ed è tipica del sesso femminile. L'esame bioptico mostrerà la presenza delle tipiche cellule tiroidee.
Diagnosi precoce
La presenza di un gran numero di patologie a carattere benigno in grado di confondersi con la neoplasia nei suoi primi stadi, quando è scarsamente sintomatica, è la causa maggiore della diagnosi tardiva tipica di questa forma di tumore. Per superare questo problema, nel tempo sono state proposte alcune tecniche diagnostiche di rapida esecuzione ed a minor tasso di impegno per paziente e medico allo scopo di poter essere utilizzate come screening. Tra questi vanno citati la citologia esfoliativa ed i coloranti vitali, e negli ultimi tempi l'uso di fonti di emissioni luminose in grado di visualizzare zone di mucosa con caratteristiche anomale previa un lavaggio con una soluzione di acido acetico all1% (Microlux DL, Orascoptic DK) [52] o senza (Velscope VX). Esistono pochi studi sufficientemente ampi sulla capacità diagnostiche di queste procedure, ed i risultati non sono univoci[53][54]. Al momento comunque non sembrano ancora esistere dati sufficienti per certificare l'utilità di queste metodiche per un uso routinario[55].
Stadiazione
La classificazione di questi tumori utilizza una specifica codifica TNM per quantificare l'estensione locale e l'eventuale diffusione linfonodale ed a distanza della neoplasia, e per creare una scala di gradazione (stadiazione) utile per indirizzare l'approccio terapeutico[56][57]. Per quanto riguarda la tipologia istologica più frequente, quella a cellule squamose, viene anche utilizzata una classificazione di gravità legata al livello di differenziazione cellulare (grading), che però risulta meno significativa a livello prognostico, in quanto una notevole percentuale di queste neoplasie non presenta omogeneità istologica. Per superare questo problema, sono state proposte delle sistematiche di classificazione meno legate al giudizio soggettivo, come quella di Anneroth, che assegna un punteggio da 1 a 4 a sei differenti parametri istologici, per poi ottenere il valore del grading attraverso un punteggio finale complessivo[58].
| Stadio | Descrizione |
|---|---|
| TX | Tumore primitivo non definibile |
| T0 | Non segni di tumore primitivo |
| Tis | Tumore in situ (non invasivo) |
| T1 | Dimensione massima < 2 cm di diametro |
| T2 | Dimensione massima compresa tra i 2 e 4 cm di diametro |
| T3 | Dimensione massima > 4 cm senza invasione delle strutture adiacenti |
| T4a (labbra) | Invasione delle strutture adiacenti (osso corticale, nervo alveolare inferiore, pavimento della bocca, pelle) |
| T4a (cavità orale) | Invasione delle strutture adiacenti (osso corticale, muscoli della lingua, seno mascellare, pelle) |
| T4b (labbra e cavità orale) | Invasione delle strutture adiacenti (spazi masticatori, spazi pterigoidei, base del cranio; inglobamento carotide interna) |
| NX | Metastasi linfonodali non definibili |
| N0 | Metastasi linfonodali non rilevabili |
| N1 | Metastasi in singolo linfonodo omolaterale, < 3 cm |
| N2 | Metastasi come specificato da N2a,b,c |
| N2a | Metastasi in singolo linfonodo omolaterale con dimensione maggiore tra 3 e 6 cm |
| N2b | Metastasi in più linfonodi omolaterali, nessuno dei quali di dimensione > 6 cm |
| N2c | Metastasi in più linfonodi bilaterali o controlaterali, nessuno dei quali di dimensione > 6 cm |
| N3 | Metastasi linfonodali di dimensione > 6 cm |
| MX | Metastasi a distanza non rilevabili |
| M0 | Assenza di metastasi a distanza |
| M1 | Presenza di metastasi a distanza |
| Stadio 0 | Tis N0 M0 |
|---|---|
| Stadio I | T1 N0 M0 |
| Stadio II | T2 N0 M0 |
| Stadio III | T1,T2 N1 M0 |
| T3 N0,N1 M0 | |
| Stadio IVa | T1-3 N2 M0 |
| T4a N0-2 M0 | |
| Stadio IVb | T1-4 N3 M0 |
| T4b N1-3 M0 | |
| Stadio IVc | T1-4 N1-3 M1 |
| Grado | Descrizione |
|---|---|
| G X: | Livello di differenziazione non definibile |
| Grado 1: | Ben differenziato < 25% cellule non differenziate |
| Grado 2: | Moderatamente differenziato < 50% cellule non differenziate |
| Grado 3: | Scarsamente differenziato < 75% cellule non differenziate |
| Grado 4: | Indifferenziato (anaplastico) > 75% cellule non differenziate |
Terapia
La scelta terapeutica per il carcinoma orale dipende principalmente dalla stadiazione del tumore al momento della diagnosi[59]. Negli stadi precoci, con lesione limitata, la terapia di scelta è quella chirurgica, a bassa invasività. Con la progressione e l'espansione locale (S I-II), la scelta può variare tra chirurgia e radioterapia, entrambi considerate ugualmente valide, a seconda delle sedi coinvolte. Con la progressione in S III-IV diventa indicato l'uso combinato delle due tecniche, associando anche la chemioterapia di supporto[60]. Questa può essere utilizzata sia successivamente all'intervento primario (terapia adiuvante) che in via preventiva (terapia neoadiuvante), approccio che sembra in grado di ottenere i risultati migliori [61].
Nella tecnica chirurgica, l'intervento di asportazione richiede necessariamente una escissione con margini sufficientemente ampi della lesione, a cui quando richiesto si associa lo svuotamento linfonodale, fasi sempre accompagnate dal necessario esame istologico dei reperti, in caso di dubbio già in fase intraoperatoria. In passato questi interventi erano pesantemente lesivi per la qualità di vita dei pazienti, comportando notevoli deficit funzionali e spesso anche estetici. Le moderne tecniche di microchirurgia ricostruttiva ed estetica, applicate in alcuni casi contestualmente all'intervento di asportazione della massa tumorale, o pianificate come seconda fase, permettono oggi di diminuire sensibilmente queste problematiche, consentendo un recupero mediamente soddisfacente dal punto di vista funzionale ed estetico, con un valido reinserimento nella vita sociale. Fondamentale risulta anche a questo scopo il supporto dello specialista in logopedia per il recupero di una corretta funzione fonatoria, di deglutizione e respirazione.
La radioterapia può essere del tipo a sorgente esterna, il cui utilizzo è stato implementato grazie alle nuove tecnologie, in grado di raggiungere un livello di precisione sempre più elevato (IMRT o radioterapia a intensità modulata)[62], oppure del tipo interno (brachiterapia), o una combinazione delle due.
Di recente hanno fatto la loro comparsa una nuova categoria di farmaci basati su meccanismi di tipo selettivo (targeted therapy), nati dalle scoperte nel campo della biologia molecolare delle cellule tumorali. Nel caso della neoplasia orale, prevede l'uso di un anticorpo monoclonale (cetuximab) che ha come bersaglio il recettore del fattore di crescita dell'epidermide (EGFR), da solo o in associazione alla radioterapia e a chemioterapici classici come il cisplatino ed il fluorouracile[63]. Recenti studi sembrano però mettere in dubbio il rapporto costo/beneficio di questo approccio[64].
Prognosi
La prognosi per questa tipologia di tumori è mediamente abbastanza favorevole, assestandosi in media su un valore di poco superiore al 50% di sopravvivenza a 5 anni[39][65], dato che però varia in maniera sensibile rispetto ad alcuni parametri. Tra tutti il più importante è la precocità della diagnosi, e quindi il profilo tnm della neoplasia al momento della diagnosi stessa[66][67].
Altri elementi in grado di influire sulla prognosi sono la posizione della lesione nel cavo orale e l'età del paziente, con una prognosi peggiore per i tumori della lingua rispetto alla localizzazione orale e delle labbra[68], il grado di differenziazione cellulare (grading), e l'istotipo[69]. Nel caso di pazienti in età pediatrica, i tassi di sopravvivenza non sembrano discostarsi da quelli dell'età adulta[70].
Prevenzione
Visto lo stretto legame tra precocità della diagnosi e prospettive di guarigione, e la scarsa conoscenza di questa forma di neoplasia tra la popolazione e gli stessi medici ed odontoiatri, da alcuni anni sono state attivate delle campagne mirate allo scopo di aumentare la consapevolezza sui pericoli e le cause che possono condurre alla comparsa della patologia (prevenzione primaria), e sulla necessità di non sottovalutare alcuni tipi di lesioni orali quando non tendono alla guarigione spontanea in tempi brevi, recandosi presso il proprio dentista di fiducia per un controllo (prevenzione secondaria). L'OMS ha creato a tal fine delle linee guida all'interno del proprio programma globale per la promozione della salute orale, in modo da indirizzare le iniziative dei paesi più a rischio[71].
Nel nostro paese un progetto in tale senso è stato avviato nel 2009 dalla Federazione Nazionale Ordini Medici Chirurghi e Odontoiatri (FNOMCeO)[72], individuando una specifica strategia d'azione (approccio tetra), basata sull'informazione degli operatori sanitari più presenti sul territorio, odontoiatri, medici di base ed igienisti dentari, e creando una più stretta collaborazione tra questi e le strutture pubbliche del servizio sanitario nazionale meglio attrezzate per la diagnostica ed il trattamento avanzato di questa patologia[73].
Un'altra iniziativa è stata avviata su base volontaria da parte della maggior organizzazione di dentisti italiani, l'Andi, sempre allo scopo di intercettare in fase precoce la malattia, ed informare sui rischi e necessità di controlli in caso di presenza di segni premonitori[74]. In particolare, nel mese designato, solitamente a maggio, viene organizzata una giornata dedicata all'informazione e alla sensibilizzazione denominata "Oral Cancer Day", e per tutto il mese sono previste visite gratuite mirate specificatamente alla ricerca dei segni di patologia o di condizioni precancerose presso i dentisti partecipanti[75].
Note
- ^ (EN) Fast stats-world, in Globocan 2008, International Agency for research on Cancer-WHO. URL consultato il 18 gennaio 2013.
- ^ (EN) Parkin DM, Bray F, Ferlay J, Pisani P, Global cancer statistics, 2002, in CA Cancer J Clin., vol. 55, n. 2, John Wiley & Sons, Mar-Apr 2005, pp. 74-108, DOI:10.3322/canjclin.55.2.74, PMID 15761078. URL consultato il 15 febbraio 2013.
- ^ (EN) India estimated cancer incidence, all ages: both sexes, in Globocan 2008, International Agency for research on Cancer-WHO. URL consultato il 30 gennaio 2013.
- ^ (EN) Jemal A, Bray F, Center MM, Ferlay J, Ward E, Forman D, Global cancer statistics, in CA Cancer J Clin., vol. 61, n. 2, John Wiley & Sons, Mar-Apr 2011, pp. 69-90, DOI:10.3322/caac.20107, PMID 21296855. URL consultato il 30 Gennaio 2013.
- ^ (EN) Fast stats-Italy, in Globocan 2008, International Agency for research on Cancer-WHO. URL consultato il 26 gennaio 2013.
- ^ (EN) Analisi e interpretazioni per sede tumorale i dati dei registri tumori 1986-1997 (PDF), in Gli andamenti temporali della patologia oncologica in Italia: i dati dei Registri tumori (1986-1997), Associazione italiana dei registri tumori (AIRTUM). URL consultato il 12 febbraio 2013.
- ^ (EN) World- Both Sexes estimated incidence by age, in Globocan 2008, International Agency for research on Cancer-WHO. URL consultato il 26 gennaio 2013.
- ^ (EN) Zygogianni A. G., Kyrgias G, Karakitsos P, Psyrri A, Kouvaris J, Kelekis N, Kouloulias V, Oral squamous cell cancer: early detection and the role of alcohol and smoking, in Head Neck Oncology, vol. 3, n. 2, 6 gennaio 2011, DOI:10.1186/1758-3284-3-2, PMC 3022893.
- ^ a b (EN) Rodriguez T., Altieri A, Chatenoud L, Gallus S, Bosetti C, Negri E, Franceschi L, Levi F, Talamini R, La Vecchia C, Risk factors for oral and pharyngeal cancer in young adults (abstract), in Oral Oncology, vol. 40, n. 2, Febbraio 2004, pp. 207-213, DOI:10.1016/j.oraloncology.2003.08.014, PMID 14693246.
- ^ (EN) Rosenquist K, Risk factors in oral and oropharyngeal squamous cell carcinoma: a population-based case-control study in southern Sweden, in Swed Dent J Suppl, n. 179, 2005, pp. 1-66, PMID 16335030.
- ^ (EN) Foulkes WD, Brunet JS, Sieh W, Black MJ, Shenouda G, Narod SA, Familial risks of squamous cell carcinoma of the head and neck: retrospective case-control study, in BMJ, vol. 313, n. 7059, British Medical Association, 21 settembre 1996, pp. 716-721, PMID 8819440 PMC 2352110.
- ^ (EN) Johnson N, Tobacco use and oral cancer: a global perspective, in J Dent Educ, vol. 65, n. 4, American Dental Education Association, aprile 2001, pp. 328-339, PMID 11336118. URL consultato il 14 febbraio 2013.
- ^ (EN) Freedman ND, Abnet CC, Leitzmann MF, Hollenbeck AR, Schatzkin A, Prospective investigation of the cigarette smoking-head and neck cancer association by sex, in Cancer, vol. 110, n. 7, American Cancer Society, 1º ottobre 2007, pp. 1593-1601, DOI:10.1002/cncr.22957, PMID 17724671.
- ^ (EN) Cancer Control and Population Sciences, Cigars: Health Effects and Trends (PDF), in Smoking and Tobacco Control Monographs, vol. 9, National Cancer Institute, 1998, 120-127. URL consultato il 2 febbraio 2013.
- ^ (EN) Henley SJ, Thun MJ, Chao A, Calle EE, Association between exclusive pipe smoking and mortality from cancer and other diseases, in J Natl Cancer Inst, vol. 96, n. 11, Oxford University Press, 2 giugno 2004, pp. 853-861, DOI:10.1093/jnci/djh144, PMID 15173269.
- ^ (EN) Gupta P. C., Meht F. S., Pindborg J., Mortality among reverse chutta smokers in south India (PDF), in British Medical Journal (Clin Res Ed), vol. 289, n. 6449, 6 ottobre 1984, pp. 865-866, PMC 1443430. URL consultato il 2 febbraio 2013.
- ^ (EN) Alvarez Gómez G J, et al., Reverse smokers's and changes in oral mucosa. Department of Sucre, Colombia (PDF), in Med Oral Patol Oral Cir Bucal, vol. 13, n. 2, 1º gennaio 2008, pp. E 1-8, PMID:18167472. URL consultato il 2 febbraio 2013.
- ^ (EN) The World Health Organization IARC Expert Group, Tobacco Habits other than Smoking;Betel-Quid and Areca-Nut Chewing; and some Related Nitrosamines (PDF), in IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 37, IARCPress, 1985, p. 37. URL consultato il 20 gennaio 2013.
- ^ a b (EN) Znaor A, Brennan P, Gajalakshmi V, Mathew A, Shanta V, Varghese C, Boffetta P, Independent and combined effects of tobacco smoking, chewing and alcohol drinking on the risk of oral, pharyngeal and esophageal cancers in Indian men, in int J Cancer, vol. 105, n. 5, John Wiley & Sons, 10 luglio 2003, pp. 681-686, DOI:10.1002/ijc.11114, PMID 12740918. URL consultato il 10 febbraio 2013.
- ^ (EN) Takezaki T, Hirose K, Inoue M, Hamajima N, Kuroishi T, Nakamura S, Koshikaw T, Matsuura H, Tajima K, Tobacco, alcohol and dietary factors associated with the risk of oral cancer among Japanese, in Jpn J Cancer Res, vol. 87, n. 6, John Wiley & Sons, Giugno 1996, pp. 555-562, DOI:10.1111/j.1349-7006.1996.tb00259.x, PMID 8766517.
- ^ (EN) Boffetta P., Hashibe M., Alcohol and cancer. (PDF), in Lancet Oncol., vol. 7, n. 2, Elsevier, febbraio 2006, pp. 149-156, PMID 16455479. URL consultato il 20 gennaio 2013.
- ^ (EN) Lachenmeier DW, Alcohol-containing mouthwash and oral cancer--can epidemiology prove the absence of risk?, in Ann Agric Environ Med, vol. 19, n. 3, 2012, pp. 609-610, PMID 23020065. URL consultato il 15 febbraio 2013.
- ^ (EN) Gandini S, Negri E, Boffetta P, La Vecchia C, Boyle P, Mouthwash and oral cancer risk quantitative meta-analysis of epidemiologic studies, in Ann Agric Environ Med, vol. 19, n. 2, 2012, pp. 173-180, PMID 22742785. URL consultato il 15 febbraio 2013.
- ^ (EN) The World Health Organization IARC Expert Group, Tobacco Habits other than Smoking;Betel-Quid and Areca-Nut Chewing; and some Related Nitrosamines (PDF), in IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, vol. 37, IARCPress, 1985, p. 141. URL consultato il 20 gennaio 2013.
- ^ (EN) The impact of qat-chewing on health: a re-evaluation, su al-bab.com, The British-Yemeni Society, Agosto 2005. URL consultato il 19 gennaio 2013.
- ^ (EN) Elango K J, et al., Role of human papilloma virus in oral tongue squamous cell carcinoma (PDF), in Asian Pacific Journal of Cancer Prevention, vol. 12, n. 4, National Cancer Center of Korea, Editorial Office, 2011, pp. 889-896, PMID 21790221. URL consultato il 6 febbraio 2013.
- ^ (EN) Gillison M L, Human papillomavirus-related diseases: oropharynx cancers and potential implications for adolescent HPV vaccination., in J Adolesc Health, vol. 43, 4 Supl, Elsevier, ottobre 2008, pp. S52-60, DOI:10.1016/j.jadohealth.2008.07.002, PMID: 18809146 PMC 3037092. URL consultato il 6 febbraio 2013.
- ^ (EN) Winn D. M., Ziegler R G, Pickle R W, Gridley G, Blot W J, Hoover R N, Diet in the etiology of oral and pharyngeal cancer among women from the southern United States. (PDF), in Cancer Research, vol. 44, n. 3, American Association for Cancer Research, Marzo 1984, pp. 1216-1222, PMID 6692405. URL consultato il 26 Gennaio 2013.
- ^ (EN) Pavia M., Pileggi C, Nobile C G, Angelillo I F, Association between fruit and vegetable consumption and oral cancer: a meta-analysis of observational studies, in Am J Clin Nutr., vol. 83, n. 5, The American Society for Nutrition, Maggio 2006, pp. 1126-1134, PMID 16685056. URL consultato il 26 Gennaio 2013.
- ^ (EN) Galeone C., et al., Coffee and tea intake and risk of head and neck cancer: pooled analysis in the international head and neck cancer epidemiology consortium, in Cancer Epidemiol Biomarkers Prev., vol. 19, n. 7, American Association for Cancer Research, 6 Luglio 2010, pp. 1723-1736, DOI:10.1158/1055-9965.EPI-10-0191, PMC 3047460.
- ^ (EN) Lam TK, Cross AJ, Freedman N, Park Y, Hollenbeck AR, Schatzkin A, Abnet C, Dietary fiber and grain consumption in relation to head and neck cancer in the NIH-AARP Diet and Health Study, in cancer causes Control, vol. 22, n. 10, Springer Science+Business Media, Ottobre 2011, pp. 1405-1414, DOI:10.1007/s10552-011-9813-9, PMID 21785948 PMC 3215506. URL consultato il 15 febbraio 2013.
- ^ (EN) Kubota E, Kurokawa H, Katsuki T, Evaluation of the serum level of immunosuppressive substance in oral cancer patients (abstract), in J Oral Maxillofac Surg, vol. 49, n. 2, Elsevier, febbraio 1991, pp. 121-126, DOI:10.1016/0278-2391(91)90097-6, PMID 1990088. URL consultato il 17 febbraio 2013.
- ^ a b (EN) A digital manual for the early diagnosis of oral neoplasia, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 27 gennaio 2013.
- ^ (EN) Martin C L, et al., Chromosomal imbalances in oral squamous cell carcinoma. Examination of 31 cell lines and review of the literature, in Oral Oncol., vol. 44, n. 4, Elsevier, Agosto 2007, pp. 369-382, PMID 17681875 PMC 2362065.
- ^ (EN) Perez-Ordoñez B, Beauchemin M, Jordan RCK, Molecular biology of squamous cell carcinoma of the head and neck, in J Clin Pathol, vol. 59, n. 5, Association of Clinical Pathologists - BMJ Group, Maggio 2006, pp. 445-453, PMID 16644882 PMC 1860277.
- ^ (EN) Wong DT, Todd R, Tsuji T, Donoff RB, Molecular biology of human oral cancer, in Crit Rev Oral Bio Med, vol. 7, n. 4, Sage Publications, 1996, pp. 319-328, DOI:10.1177/10454411960070040201, PMID 8986394. URL consultato il 9 febbraio 2013.
- ^ (EN) Tanaka T, Ishigamori R, Understanding Carcinogenesis for Fighting Oral Cancer, in J Oncol, Hindawi, 2011, DOI:10.1155/2011/603740, PMID 21772845 PMC 3136173. URL consultato il 17 febbraio 2013.
- ^ (EN) Leukoplakia, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 17 febbraio 2013.
- ^ a b (EN) Neville BW, Day TA, Oral cancer and precancerous lesions, in CA Cancer J Clin, vol. 52, n. 4, John Wiley & Sons, Luglio-Ago 2002, pp. 195-215, DOI:10.3322/canjclin.52.4.195, PMID 12139232. URL consultato il 17 febbraio 2013.
- ^ (EN) Wang YP, Chen HM, Kuo RC, Yu CH, Sun A, Liu BY, Kuo YS, Chiang CP, Oral verrucous hyperplasia: histologic classification, prognosis, and clinical implications (abstract), in J Oral Pathol Med, vol. 38, n. 8, John Wiley & Sons, settembre 2009, pp. 651-656, DOI:10.1111/j.1600-0714.2009.00790.x, PMID 19656267. URL consultato il 17 febbraio 2013.
- ^ (EN) Reichart PA, Philipsen HP, Oral erythroplakia--a review (PDF) (abstract), in Oral Oncol, vol. 3841, n. 6, Elsevier, Luglio 2005, pp. 551-561, PMID 15975518. URL consultato il 17 febbraio 2013.
- ^ (EN) WHO histological classification of tumours of the oral cavity and oropharynx, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 27 gennaio 2013.
- ^ (EN) Sixto-Requeijo R, Diniz-Freitas M, Torreira-Lorenzo JC, García-García A, Gándara-Rey JM, An analysis of oral biopsies extracted from 1995 to 2009, in an oral medicine and surgery unit in Galicia (Spain), in Med Oral Patol Oral Cir Bucal, vol. 17, n. 1, 1º gennaio 2012, pp. e16-22, DOI:10.4317/medoral.17143, PMC 3448179.
- ^ (EN) Noguti J, De Moura CF, De Jesus GP, Da Silva VH, Hossaka TA, Oshima CT, Ribeiro DA, Metastasis from oral cancer: an overview, in Cancer Genomics Proteomics, vol. 9, n. 5, International Institute of Anticancer Research, sett-ott 2012, pp. 329-335, PMID 22990112. URL consultato il 16 febbraio 2013.
- ^ (EN) Epstein JB, Epstein JB, Zhang L, Rosin M, Advances in the diagnosis of oral premalignant and malignant lesions (PDF), in J Can Dent Assoc, vol. 68, n. 10, Canadian Dental Association, Novembre 2002, pp. 617-621, PMID 12410942. URL consultato il 9 febbraio 2013.
- ^ (EN) Hohlweg-Majert B, Deppe H, Metzger MC, Schumm S, Hoefler H, Kesting MR, Hölzle F, Wolff KD, Sensitivity and specificity of oral brush biopsy (abstract), in Cancer Invest, vol. 27, n. 3, Informa, marzo 2009, pp. 293-297, DOI:10.1080/07357900802266515, PMID 19160103. URL consultato il 16 febbraio 2013.
- ^ (EN) Mehrotra R, Mishra S, Singh M, Singh M, The efficacy of oral brush biopsy with computer-assisted analysis in identifying precancerous and cancerous lesions, in Head Neck Oncol, vol. 3, Springer Science+Business Media, 24 agosto 2011, p. 39, DOI:10.1186/1758-3284-3-39, PMID 21864339 PMC 3177776. URL consultato il 16 febbraio 2013.
- ^ (EN) Mehrotra R, Hullmann M, Smeets R, Reichert TE, Driemel O, Oral cytology revisited, in J Oral Pathol Med, vol. 38, n. 2, John Wiley & Sons, febbraio 2009, pp. 161-166, PMID 19213102.
- ^ (DE) Hullmann M, Reichert TE, Dahse R, von Eggeling F, Pistner H, Kosmehl H, Driemel O, Oral cytology: historical development, current status, and perspectives, in Mund Kiefer Gesichtschir, vol. 11, n. 1, Springer Science+Business Media, Gennaio 2007, pp. 1-9, PMID 17177045.
- ^ (EN) Schöder H, et al, 18F-FDG PET/CT for detecting nodal metastases in patients with oral cancer staged N0 by clinical examination and CT/MRI, in J Nucl Med, vol. 47, n. 5, Society of Nuclear Medicine and Molecular Imaging, maggio 2006, pp. 755-762, PMID 16644744. URL consultato il 16 febbraio 2013.
- ^ (EN) Ng SH, 'Yen TC, Liao CT, Chang JT, Chan SC, Ko SF, Wang HM, Wong HF, 18F-FDG PET and CT/MRI in oral cavity squamous cell carcinoma: a prospective study of 124 patients with histologic correlation, in J Nucl Med, vol. 46, n. 7, Society of Nuclear Medicine and Molecular Imaging, luglio 2005, pp. 1136-1143, PMID 16000282. URL consultato il 16 febbraio 2013.
- ^ (EN) Mendes SF, de Oliveira Ramos G, Rivero ER, Modolo F, Grando LJ, Meurer MI, Epub 2011 Jan 13 Techniques for precancerous lesion diagnosis, in J Oncol, vol. 59, n. 5, Hindawi Publishing Corporation, 13 gennaio 2011, pp. 445-453, DOI:10.1155/2011/326094. Epub 2011 Jan 13, PMID 21318165 PMC 3026985.
- ^ (EN) Ujaoney S, Motwani MB, Degwekar S, Wadhwan V, Zade P, Chaudhary M, Hazarey V, Thakre TP, Mamtani M, Evaluation of chemiluminescence, toluidine blue and histopathology for detection of high risk oral precancerous lesions: A cross-sectional study, in BMC Clin Pathol, BioMed Central, 12 marzo 2012, DOI:10.1186/1472-6890-12-6, PMID 22410295 PMC 3315728. URL consultato il 17 febbraio 2013.
- ^ (EN) Rajmohan M, Rao UK, Joshua E, Rajasekaran ST, Kannan R, Assessment of oral mucosa in normal, precancer and cancer using chemiluminescent illumination, toluidine blue supravital staining and oral exfoliative cytology, in J Oral Maxillofac Pathol, vol. 16, n. 3, Indian Association of Oral and Maxillofacial Pathologists, settembre 2012, pp. 325-329, DOI:10.4103/0973-029X.102476, PMID 23248459 PMC 3519202. URL consultato il 17 febbraio 2013.
- ^ (EN) Patton LL, Epstein JB, Kerr AR, Adjunctive techniques for oral cancer examination and lesion diagnosis: a systematic review of the literature, in J Am Dent Assoc, vol. 139, n. 7, American Dental Association, Luglio 2008, pp. 896-905, PMID 18594075. URL consultato il 16 febbraio 2013.
- ^ (EN) TNM classification of carcinomas of the oral cavity, su screening.iarc.fr, International Agency for Research on Cancer-WHO. URL consultato il 17 gennaio 2013.
- ^ (EN) Snehal G. Patel, Jatin P. Shah, TNM Staging of Cancers of the Head and Neck: Striving for Uniformity Among Diversity (PDF), in CA: A Cancer Journal for Clinicians, vol. 55, John Wiley & Sons, Luglio 2005, pp. 242-258, PMID 16020425. URL consultato il 15 Gennaio 2013.
- ^ (EN) M. Akhter, Hossain S.; Rahman Q.B.; Molla M.R., A study on histological grading of oral squamous cell carcinoma and its co-relationship with regional metastasis, in J Oral Maxillofac Pathol., vol. 15, n. 2, Maggio-Agosto 2011, pp. 168-176, DOI:10.4103/0973-029X.84485, PMC 3329698.
- ^ (EN) Treatment options for oral cavity and oropharyngeal cancer by stage, su cancer.org, American Cancer Society. URL consultato il 7 febbraio 2013.
- ^ (EN) Huang SH, O'Sullivan B, Oral cancer: Current role of radiotherapy and chemotherapy (abstract), in Med Oral Patol Oral Cir Bucal, 5 Fabbraio 2013, DOI:10.4317/medoral.18772, PMID 23385513. URL consultato il 17 Febbraio 2013.
- ^ (EN) Kessler P, Grabenbauer G, Leher A, Bloch-Birkholz A, Vairaktaris E, Neukam FW, Neoadjuvant and adjuvant therapy in patients with oral squamous cell carcinoma Long-term survival in a prospective, non-randomized study (abstract), in Br J Oral Maxillofac Surg, vol. 46, n. 1, Elsevier, gennaio 2008, pp. 1-5, DOI:10.1016/j.bjoms.2007.08.006, PMID 17931758. URL consultato il 20 gennaio 2013.
- ^ (EN) Studer G, et al, Follow up after IMRT in oral cavity cancer: update, in Radiat Oncol, n. 7, Bio Med Central, 11 giugno 2012, p. 84, DOI:10.1186/1748-717X-7-84, PMID 22686297 PMC &tool=pmcentrez 3488022 .
- ^ (EN) Vermorken JB, et al, Platinum-based chemotherapy plus cetuximab in head and neck cancer, in N Engl J Med, vol. 359, n. 11, Massachusetts Medical Society, 11 settembre 2008, pp. 1116-1127, DOI:10.1056/NEJMoa0802656, PMID 18784101.
- ^ (EN) Hannouf MB, Sehgal C, Cao JQ, Mocanu JD, Winquist E, Zaric GS, Cost-effectiveness of adding cetuximab to platinum-based chemotherapy for first-line treatment of recurrent or metastatic head and neck cancer, in PLOS ONE, vol. 7, n. 6, Public Library of Science, 20 giugno 2012, pp. e38557, DOI:10.1371/journal.pone.0038557, PMID 22745668 PMC 3379991.
- ^ (EN) Kademani D, Bell RB, Bagheri S, Holmgren E, Dierks E, Potter B, Homer L, Prognostic factors in intraoral squamous cell carcinoma: the influence of histologic grade, in J Oral Maxillofac Surg, vol. 63, n. 11, Elsevier, Novembre 2005, pp. 1599-1605, PMID 16243176.
- ^ (EN) Kreppel M, Eich HT, Kübler A, Zöller JE, Scheer M, Prognostic value of the sixth edition of the UICC's TNM classification and stage grouping for oral cancer (abstract), in J Surg Oncol, vol. 102, n. 5, John Wiley & Sons, 1º ottobre 2010, pp. 443-449, DOI:10.1002/jso.21547, PMID 20872947. URL consultato l'11 febbraio 2013.
- ^ (EN) de Araújo RF Jr, Barboza CA, Clebis NK, de Moura SA, Lopes Costa Ade L, Prognostic significance of the anatomical location and TNM clinical classification in oral squamous cell carcinoma (PDF), in Med Oral Patol Oral Cir Bucal, vol. 13, n. 6, 1º Giugno 2008, pp. E344-347, PMID 17931758. URL consultato l'11 febbraio 2013.
- ^ (EN) Sopravvivenza: i dati dei Registri tumori (PDF), in I tumori in Italia - Rapporto 2007, Associazione italiana dei registri tumori (AIRTUM). URL consultato il 12 febbraio 2013.
- ^ (EN) Pereira MC, Oliveira DT, Landman G, Kowalski LP, Histologic subtypes of oral squamous cell carcinoma: prognostic relevance (PDF), in J Can Dent Assoc, vol. 73, n. 4, Canadian Dental Association, Maggio 2007, pp. 339-344, PMID 17484800. URL consultato l'11 febbraio 2013.
- ^ (EN) Morris LG, Ganly I, Outcomes of oral cavity squamous cell carcinoma in pediatric patients, in Oral Oncol, vol. 46, n. 4, Elsevier, aprile 2010, pp. 292-296, DOI:10.1016/j.oraloncology.2010.01.015, PMID 20188621 PMC 2889246. URL consultato il 15 febbraio 2013.
- ^ (EN) Petersen P E, Oral cancer prevention and control-the approach of the World Health Organization (PDF), in Oral Oncology, vol. 45, n. 4-5, Apr-Marzo 2009, pp. 454-460, DOI:10.1016/j.oraloncology.2008.05.023 Epub 2008 Sep 18, PMID 18804412. URL consultato il 2 febbraio 2013.
- ^ I dentisti sentinella dichiarano guerra al cancro della bocca, su portale.fnomceo.it, FNOMCeO. URL consultato il 1º febbraio 2013.
- ^ Lo Muzio L., Il carcinoma orale progetto di prevenzione primaria e secondaria per operatori sanitari odontoiatrici “t.a.c.c.o.” (tetra azione contro cancro orale) (PDF), su omco.pd.it, FNOMCeO. URL consultato il 1º febbraio 2013.
- ^ Le iniziative di ANDI e Fondazione ANDI a tutela della salute orale, su fondazioneandi.org, Fondazione ANDI Onlus. URL consultato il 18 gennaio 2013.
- ^ Oral Cancer Day, su andi.it, Associazione Nazionale Dentisti Italiani. URL consultato il 18 gennaio 2013.
Bibliografia
- Stanley L. Robbins, Ramzi S. Cotran; Vinay Kumar, La basi patologiche delle malattie, II, 4ª ed., Padova, Piccin, 1992 [1989], pp. 937-938, ISBN 88-299-1083-X.
- Bruno De Michelis, Remo Modica; Giorgio re, Clinica Odontostomatologica, Edizioni Minerva Medica, 1992, pp. 339-348, ISBN 88-7711-146-1.
- Fabrizio Montagna, Giuseppe Ferronato; Franco Martinelli, Patologia orale orientata per problemi: diagnosi differenziale e terapia, Edizioni Promoass, 2000, pp. 63-68, 324, ISBN 88-87109-02-8.
- Vito Terribile Wiel Marin, Lezioni di Anatomia Patologica Odontostomatologica, Cleup editrice, 1992, pp. 81-93.
- Stella Blandamura Piazza, Elementi di citologia del cavo orale, Cleup editrice, 1993, pp. 58-63, ISBN 88-7178-212-7.
Voci correlate
Collegamenti esterni
- Breve prospetto sul tumore orale dal sito del Ministero della Salute
- Faq sul cancro orale a cura della Società Italiana di Patologia e Medicina Orale (SIPMO)
- AIRC – Associazione Italiana Ricerca sul cancro: Tumore alla bocca
- (EN) - Tumore orale nel sito del National Cancer Institute
- (EN) - Tumore orale nel sito deiCenters for Disease Control and Prevention
- (EN) - sito della Oral Cancer Foundation, associazione non profit americana