Acido γ-amminobutirrico: differenze tra le versioni
m Bot: (ri)aggiungo asterisco prima del template {{Collegamenti esterni}} (come da manuale) |
Pre salvataggio per non perdere il lavoro svolto finora, c'è ancora tanto da fare e da scrivere sul GABA. Incredibile come la voce della wiki italiana su uno dei neurotrasmettitori più importanti, fosse lunga a malapena 1 paginetta |
||
| Riga 24: | Riga 24: | ||
}} |
}} |
||
L''''acido γ-amminobutirrico''' ('''GABA'''), noto anche come '''acido 4-amminobutanoico''', è un [[Amminoacidi non proteinogenici|γ-amminoacido]], [[Isomeria|isomero]] dell'[[acido amminobutirrico]]. |
L''''acido γ-amminobutirrico''' ('''GABA'''), noto anche come '''acido 4-amminobutanoico''', è un [[Amminoacidi non proteinogenici|γ-amminoacido]], [[Isomeria|isomero]] dell'[[acido amminobutirrico]] ed è il principale neurotrasmettitore inibitorio nel sistema nervoso centrale.<ref name=":0">{{Cita libro|nome=Anthony S.|cognome=de Leon|nome2=Prasanna|cognome2=Tadi|titolo=Biochemistry, Gamma Aminobutyric Acid|url=http://www.ncbi.nlm.nih.gov/books/NBK551683/|accesso=2023-08-05|data=2023|editore=StatPearls Publishing}}</ref><ref name=":1">{{Cita pubblicazione|nome=Martin J.|cognome=Spiering|data=2018-12|titolo=The discovery of GABA in the brain|rivista=Journal of Biological Chemistry|volume=293|numero=49|pp=19159–19160|lingua=en|accesso=2023-08-05|doi=10.1074/jbc.CL118.006591|url=https://linkinghub.elsevier.com/retrieve/pii/S0021925820311509}}</ref><ref>{{Cita web|url=https://go.drugbank.com/drugs/DB02530|titolo=gamma-Aminobutyric acid|sito=go.drugbank.com|accesso=2023-08-05}}</ref> |
||
Il suo ruolo neurologico nei mammiferi è rimasto sconosciuto fino alla fine degli anni '50<ref>{{Cita pubblicazione|nome=N. G.|cognome=Bowery|nome2=T. G.|cognome2=Smart|data=2006-01|titolo=GABA and glycine as neurotransmitters: a brief history|rivista=British Journal of Pharmacology|volume=147 Suppl 1|numero=Suppl 1|pp=S109–119|accesso=2023-08-05|doi=10.1038/sj.bjp.0706443|url=https://pubmed.ncbi.nlm.nih.gov/16402094/}}</ref>, fin quando gli studi sui neuroni corticali completati alla fine degli anni '60 hanno concluso che il GABA fosse inequivocabilmente inibitorio. Molte ulteriori ricerche sono state condotte per chiarire i meccanismi dell'inibizione indotta dall'GABA e il suo ruolo nelle patologie correlate all'GABA, tra cui disturbi d'ansia, disturbo da uso di alcol, epilessia, malattie spastiche e ipersonnia idiopatica.<ref>{{Cita pubblicazione|nome=Ognen A. C.|cognome=Petroff|data=2002-12|titolo=GABA and glutamate in the human brain|rivista=The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry|volume=8|numero=6|pp=562–573|accesso=2023-08-05|doi=10.1177/1073858402238515|url=https://pubmed.ncbi.nlm.nih.gov/12467378/}}</ref> L'azione della maggior parte dei farmaci ansiolitici, farmaci antiepilettici e farmaci anestetici agisce come agonisti dell'GABA.<ref>{{Cita pubblicazione|nome=Fabio|cognome=Caputo|nome2=Mauro|cognome2=Bernardi|data=2010|titolo=Medications acting on the GABA system in the treatment of alcoholic patients|rivista=Current Pharmaceutical Design|volume=16|numero=19|pp=2118–2125|accesso=2023-08-05|doi=10.2174/138161210791516468|url=https://pubmed.ncbi.nlm.nih.gov/20482512/}}</ref><ref>{{Cita pubblicazione|nome=Janette|cognome=Brohan|nome2=Basavana G.|cognome2=Goudra|data=2017-10|titolo=The Role of GABA Receptor Agonists in Anesthesia and Sedation|rivista=CNS drugs|volume=31|numero=10|pp=845–856|accesso=2023-08-05|doi=10.1007/s40263-017-0463-7|url=https://pubmed.ncbi.nlm.nih.gov/29039138/}}</ref> Alcuni farmaci antagonisti del GABA, come ad esempio il flumazenil, sono impiegati come antidoti nel trattamento contro il sovradosaggio da agonisti del GABA.<ref>{{Cita pubblicazione|nome=E. J.|cognome=Hoffman|nome2=E. W.|cognome2=Warren|data=1993-09|titolo=Flumazenil: a benzodiazepine antagonist|rivista=Clinical Pharmacy|volume=12|numero=9|pp=641–656; quiz 699–701|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/8306565/}}</ref>. |
|||
È il principale [[neurotrasmettitore]] inibitorio nei [[mammiferi]], del [[sistema nervoso]] centrale, responsabile nella regolazione dell'eccitabilità [[Neurone|neuronale]] in tutto il [[sistema nervoso]]; negli [[esseri umani]] è anche direttamente responsabile per la regolazione del [[tono muscolare]]; viene rilasciato da [[neurone|neuroni]] dei circuiti locali presenti nel [[cervello]] ([[neuroni gabaergici]]), i quali presentano un piccolo corpo neuronale e arborizzano a breve distanza formando principalmente [[sinapsi]] asso-assoniche con i neuroni di proiezione (eccitatori); esistono 3 tipi di [[recettore del GABA]], tutti con effetti inibitori; il GABA è un messaggero ubiquitario e l'attivazione o l'agonismo a livello dei suoi recettori è il meccanismo d'azione di un gran numero di [[farmaco|farmaci]] sedativi, [[miorilassante|miorilassanti]] e [[Farmaci sedativo-ipnotici|ipnotici]], tra cui le più conosciute [[benzodiazepine]]. |
|||
== |
== Storia == |
||
La scoperta dell'acido γ-aminobutirrico nel cervello risale al 1950, in uno studio pubblicato sul Journal of Biological Chemistry<ref name=":2">{{Cita pubblicazione|nome=E.|cognome=Roberts|nome2=S.|cognome2=Frankel|data=1950-11|titolo=gamma-Aminobutyric acid in brain: its formation from glutamic acid|rivista=The Journal of Biological Chemistry|volume=187|numero=1|pp=55–63|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/14794689/}}</ref>, preceduto da un breve rapporto conferenziale poco prima<ref>Roberts, E., and S. Frankel. "γ-Aminobutyric acid in brain." ''Federation Proceedings''. Vol. 9. 1950.</ref>, dove Eugene Roberts e Sam Frankel non solo hanno identificato il GABA come una delle ammine principali nel cervello, ma hanno anche riportato che viene prodotto e si accumula preferenzialmente in quest'organo.<ref name=":1" /> |
|||
In modo piuttosto sorprendente, la risposta iniziale a questa scoperta fu piuttosto contenuta. Nei primi 5 anni successivi alla relazione di Roberts e Frankel, accompagnata da altri due articoli sull'GABA nel cervello pubblicati nello stesso numero di JBC<ref name=":3">{{Cita pubblicazione|nome=J.|cognome=Awapara|nome2=A. J.|cognome2=Landua|nome3=R.|cognome3=Fuerst|data=1950-11|titolo=Free gamma-aminobutyric acid in brain|rivista=The Journal of Biological Chemistry|volume=187|numero=1|pp=35–39|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/14794686/}}</ref><ref>{{Cita pubblicazione|nome=S.|cognome=Udenfriend|data=1950-11|titolo=Identification of gamma-aminobutyric acid in brain by the isotope derivative method|rivista=The Journal of Biological Chemistry|volume=187|numero=1|pp=65–69|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/14794690/}}</ref>, secondo PubMed, furono pubblicati in quel periodo solo quattro studi aggiuntivi sull'GABA nel cervello.<ref name=":1" /> |
|||
L'attività dell'GABA nel cervello è stata successivamente chiarita nel 1957 quando ricercatori in Canada riportarono che un composto sconosciuto con attività inibitoria sui neuroni dei granchi d'acqua dolce era in realtà l'GABA<ref>{{Cita pubblicazione|nome=A. W.|cognome=Basemore|nome2=K. A.|cognome2=Elliot|nome3=E.|cognome3=Florey|data=1957|titolo=Isolation of factor I|rivista=Journal of Neurochemistry|volume=1|numero=4|pp=334–339|accesso=2023-08-05|doi=10.1111/j.1471-4159.1957.tb12090.x|url=https://pubmed.ncbi.nlm.nih.gov/13476199/}}</ref>.Baruch Kanner dell'Università Ebraica Hadassah di Israele, membro del Consiglio Editoriale del JBC che studia i trasportatori dell'GABA affermò: "''i recettori dell'GABA principalmente hanno un input inibitorio e sono i principali recettori inibitori nel cervello''".<ref name=":1" /> |
|||
Nel suo studio finale Roberts utilizzò la cromatografia su carta e un colorante chimico, la ninidrina, che reagisce e colora le ammine primarie, per isolare e identificare gli aminoacidi liberi negli estratti cerebrali di topo.<ref name=":1" /> |
|||
Mentre analizzava meticolosamente questi estratti, Roberts trovò un composto reattivo alla ninidrina la cui migrazione sui cromatogrammi su carta non corrispondeva a nessun composto conosciuto contenente ammine. Inoltre, questo misterioso metabolita simile a un aminoacido si accumulava apparentemente a livelli molto più elevati nel cervello rispetto agli altri tessuti. Trattamenti acidi dei tessuti cerebrali non aumentavano questi livelli, suggerendo che questa ammina si presenta esclusivamente nella forma libera nel cervello. Fortunatamente, trovandosi l'ammina singolarmente e migrando abbastanza lontano da altri composti che reagiscono alla ninidrina, permettè a Roberts e Frankel di estrarlo dalle strisce tagliate dai cromatogrammi.<ref name=":1" /> |
|||
I ricercatori eseguirono il composto estratto dalla striscia insieme a standard di riferimento accuratamente preparati in diversi sistemi solventi. Una tecnica sviluppata da un collega dell'Università di Washington, Sidney Udenfriend, chiamata metodo del derivato isotopico<ref name=":3" />, li aiutò anche a focalizzare l'attenzione sulla sconosciuta ammina. Attraverso questo approccio multiplo, Roberts e Frankel conclusero che questa ammina associata al cervello era l'GABA. Andando oltre, utilizzando l'etichettatura radioattiva dei potenziali precursori dell'GABA, il duo di ricerca dimostrò anche che i tessuti cerebrali possono convertire un altro comune aminoacido cerebrale, l'acido glutammico, in GABA.<ref name=":2" /> |
|||
La scoperta del 1957 che rivelò che l'GABA inibisce l'attivazione dei potenziali d'azione nei neuroni presentò un'altra novità. Altri neurotrasmettitori contenenti ammine di cui erano note le attività all'epoca, come la noradrenalina e l'acetilcolina, sono eccitatori. Kanner osserva che anche l'aminoacido glicina può inibire la neurotrasmissione cerebrale, ma "''il GABA è chiaramente quello più abbondante''".<ref name=":1" /> |
|||
== Biochimica == |
|||
=== Apparati coinvolti === |
|||
Il GABA è presente in tutto il corpo umano, anche se il ruolo che svolge in molte regioni rimane un'area di ricerca attiva. L'GABA è il principale neurotrasmettitore inibitorio nel cervello ed è un importante neurotrasmettitore inibitorio nel midollo spinale. Le cellule beta che producono insulina nel pancreas producono GABA. Esso funziona per inibire le cellule alfa del pancreas, stimolare la crescita delle cellule beta e convertire le cellule alfa in cellule beta. L'GABA è stato anche trovato in concentrazioni variabili e basse in altri sistemi organici, anche se il significato e la funzione di ciò non sono chiari.<ref>{{Cita pubblicazione|nome=Arjun|cognome=Khanna|nome2=Brian Patrick|cognome2=Walcott|nome3=Kristopher T.|cognome3=Kahle|data=2013|titolo=Limitations of Current GABA Agonists in Neonatal Seizures: Toward GABA Modulation Via the Targeting of Neuronal Cl(-) Transport|rivista=Frontiers in Neurology|volume=4|pp=78|accesso=2023-08-05|doi=10.3389/fneur.2013.00078|url=https://pubmed.ncbi.nlm.nih.gov/23805124/}}</ref><ref name=":4">{{Cita libro|nome=Benjamin E.|cognome=Jewett|nome2=Sandeep|cognome2=Sharma|titolo=Physiology, GABA|url=http://www.ncbi.nlm.nih.gov/books/NBK513311/|accesso=2023-08-05|data=2023|editore=StatPearls Publishing}}</ref> |
|||
=== Funzione === |
|||
L'GABA di solito provoca l'inibizione dei potenziali d'azione iperpolarizzando i neuroni postsinaptici e riducendo il rilascio di neurotrasmettitori da parte dei neuroni presinaptici. L'inibizione risultante diminuisce l'attività della cellula interessata, il che si manifesta in effetti che vanno dalla diminuzione della stimolazione motoria nei motoneuroni alla ridotta attività corticale in regioni che includono l'amigdala.<ref>{{Cita pubblicazione|nome=Uri Nimrod|cognome=Ramírez-Jarquín|nome2=Rafael|cognome2=Lazo-Gómez|nome3=Luis B.|cognome3=Tovar-Y-Romo|data=2014-07|titolo=Spinal inhibitory circuits and their role in motor neuron degeneration|rivista=Neuropharmacology|volume=82|pp=101–107|accesso=2023-08-05|doi=10.1016/j.neuropharm.2013.10.003|url=https://pubmed.ncbi.nlm.nih.gov/24157492/}}</ref><ref>{{Cita pubblicazione|nome=Fan|cognome=Jie|nome2=Guanghao|cognome2=Yin|nome3=Wei|cognome3=Yang|data=2018|titolo=Stress in Regulation of GABA Amygdala System and Relevance to Neuropsychiatric Diseases|rivista=Frontiers in Neuroscience|volume=12|pp=562|accesso=2023-08-05|doi=10.3389/fnins.2018.00562|url=https://pubmed.ncbi.nlm.nih.gov/30154693/}}</ref> |
|||
L'ipotesi che il GABA assuma un ruolo di neurotrasmettitore eccitatorio nel SNC è ancora in via di sviluppo ed ultriori studi sono necessari. Nei neuroni immaturi presenti nel SNC embrionale, l'GABA è eccitatorio e depolarizza queste cellule a causa di una concentrazione elevata di ioni cloruro intracellulari.<ref>{{Cita pubblicazione|nome=C. Guin Ting|cognome=Wong|nome2=Teodoro|cognome2=Bottiglieri|nome3=O. Carter|cognome3=Snead|data=2003|titolo=GABA, gamma-hydroxybutyric acid, and neurological disease|rivista=Annals of Neurology|volume=54 Suppl 6|pp=S3–12|accesso=2023-08-05|doi=10.1002/ana.10696|url=https://pubmed.ncbi.nlm.nih.gov/12891648/}}</ref> L'alta concentrazione di cloruro è principalmente dovuta all'elevata espressione del co-trasportatore attivo sodio-potassio-cloruro (NKCC1), che porta ioni cloruro nel neurone interneuronale in via di sviluppo. Man mano che il neurone si sviluppa, la quantità di NKCC1 attivo diminuisce mentre la quantità del co-trasportatore K-Cl attivo (KCC2) aumenta; KCC2 espelle gli ioni cloruro dal neurone interneuronale. L'effetto netto è che la concentrazione intracellulare di cloruro diminuisce fino a quando l'GABA passa dall'essere eccitatorio a inibitorio. Oltre al suo effetto eccitatorio nello sviluppo del SNC, l'GABA è implicato nella differenziazione, migrazione e proliferazione dei neuroni.<ref>{{Cita pubblicazione|nome=Zi-Wei|cognome=Chen|nome2=Richard W.|cognome2=Olsen|data=2007-01|titolo=GABAA receptor associated proteins: a key factor regulating GABAA receptor function|rivista=Journal of Neurochemistry|volume=100|numero=2|pp=279–294|accesso=2023-08-05|doi=10.1111/j.1471-4159.2006.04206.x|url=https://pubmed.ncbi.nlm.nih.gov/17083446/}}</ref> |
|||
=== Meccanismo d'azione === |
|||
L'azione dell'acido gamma-aminobutirrico coinvolge due recettori distinti, denominati recettore GABA-A e GABA-B.<ref>{{Cita pubblicazione|nome=Audrée|cognome=Pinard|nome2=Riad|cognome2=Seddik|nome3=Bernhard|cognome3=Bettler|data=2010|titolo=GABAB receptors: physiological functions and mechanisms of diversity|rivista=Advances in Pharmacology (San Diego, Calif.)|volume=58|pp=231–255|accesso=2023-08-05|doi=10.1016/S1054-3589(10)58010-4|url=https://pubmed.ncbi.nlm.nih.gov/20655485/}}</ref><ref>{{Cita pubblicazione|nome=Timothy A.|cognome=Simeone|nome2=Sean D.|cognome2=Donevan|nome3=Jong M.|cognome3=Rho|data=2003-01|titolo=Molecular biology and ontogeny of gamma-aminobutyric acid (GABA) receptors in the mammalian central nervous system|rivista=Journal of Child Neurology|volume=18|numero=1|pp=39–48; discussion 49|accesso=2023-08-05|doi=10.1177/08830738030180012101|url=https://pubmed.ncbi.nlm.nih.gov/12661937/}}</ref> |
|||
* Recettori GABA-A. Storicamente, il recettore GABA-A è stato differenziato dal recettore GABA-B poiché il baclofene si lega al recettore GABA-A, ma il bicucullina non si legava al recettore GABA-A e viceversa. Il recettore GABA-A è un canale ionico di cloruro legato al ligando transmembrana eteropentamerico presente in quasi tutti i neuroni del SNC. Sebbene esistano molte isoforme del recettore GABA-A, la maggior parte dei recettori GABA-A contiene subunità alfa e beta, oppure subunità alfa, beta e gamma. Le diverse combinazioni di subunità alfa, beta e gamma in diversi recettori GABA-A influenzano quali farmaci agonisti o antagonisti dell'GABA si legheranno ad essi. In generale, a causa dell'ingresso di ioni cloruro nel neurone postsinaptico maturo, l'attivazione del recettore GABA-A provoca iperpolarizzazione per ridurre la probabilità di un potenziale d'azione. |
|||
* Recettori GABA-B. Il recettore GABA-B è un recettore accoppiato alle proteine G che inibisce l'attività dell'adenilato ciclasi e dei canali del calcio voltaggio-dipendenti nei terminali assonali, risultando nella modulazione dell'attività intracellulare e nel rilascio di neurotrasmettitori, rispettivamente. I recettori GABA-B sono presenti come autorecettori che inibiscono il rilascio di GABA o come eterorecettori che riducono il rilascio di glutammato, noradrenalina, serotonina o dopamina. I recettori GABA-B presinaptici sono anche accoppiati ai canali del potassio rettificante verso l'interno accoppiati alle proteine G (GIRK) per stimolare l'assorbimento del potassio e causare iperpolarizzazione, limitando il rilascio di glutammato. |
|||
=== Metabolismo === |
|||
Il GABA è una molecola endogena ottenuta a partire dall'[[acido glutammico]] che viene [[decarbossilazione|decarbossilato]] ad opera dell'[[acido glutammico decarbossilasi]] (GAD). Il GABA viene poi degradato ad opera dell'enzima [[gaba-transaminasi]] (GABA-T) che catalizzando sulla molecola una reazione di [[deaminazione ossidativa]] dà come prodotto la [[semialdeide succinica]] che verrà successivamente ossidata ad [[acido succinico]], intermedio del [[ciclo di Krebs]]. |
Il GABA è una molecola endogena ottenuta a partire dall'[[acido glutammico]] che viene [[decarbossilazione|decarbossilato]] ad opera dell'[[acido glutammico decarbossilasi]] (GAD). Il GABA viene poi degradato ad opera dell'enzima [[gaba-transaminasi]] (GABA-T) che catalizzando sulla molecola una reazione di [[deaminazione ossidativa]] dà come prodotto la [[semialdeide succinica]] che verrà successivamente ossidata ad [[acido succinico]], intermedio del [[ciclo di Krebs]]. |
||
[[File:Metabolismogaba.jpg|700px|none]] |
[[File:Metabolismogaba.jpg|700px|none]] |
||
== Fisiopatologia == |
|||
==== Abuso di alcool ==== |
|||
L'alcol, o più specificamente l'etanolo, è un depressore del sistema nervoso centrale che agisce potenziando il recettore GABA-A, inibendo i recettori NMDA che si legano al glutammato e inibendo i canali del calcio voltaggio-dipendenti (VDCCs).<ref>{{Cita pubblicazione|nome=Ansel T.|cognome=Hillmer|nome2=Graeme F.|cognome2=Mason|nome3=Lisa M.|cognome3=Fucito|data=2015-12|titolo=How Imaging Glutamate, γ-Aminobutyric Acid, and Dopamine Can Inform the Clinical Treatment of Alcohol Dependence and Withdrawal|rivista=Alcoholism, Clinical and Experimental Research|volume=39|numero=12|pp=2268–2282|accesso=2023-08-05|doi=10.1111/acer.12893|url=https://pubmed.ncbi.nlm.nih.gov/26510169/}}</ref><ref>{{Cita pubblicazione|nome=Martin|cognome=Davies|data=2003-07|titolo=The role of GABAA receptors in mediating the effects of alcohol in the central nervous system|rivista=Journal of psychiatry & neuroscience: JPN|volume=28|numero=4|pp=263–274|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/12921221/}}</ref> Gli effetti euforici del consumo di etanolo sono associati alla modifica dei recettori GABA-A nel sistema di ricompensa della dopamina mesolimbica. Nei pazienti con consumo cronico di etanolo, l'mRNA del recettore GABA-A e la quantità di espressione del recettore GABA-A cambiano in modo tale da diventare meno sensibili all'GABA e ai suoi modulatori alosterici, segnalando una nuova omeostasi elevata dell'GABA.<ref name=":0" /> Di conseguenza, questi pazienti sono più inclini a sviluppare dipendenza, tolleranza e sintomi di astinenza dall'alcol (ansia, crisi epilettiche, delirio, tachicardia) a causa di livelli insufficienti di GABA nella nuova omeostasi dell'GABA.<ref name=":0" /> |
|||
==== Sindrome alcolica fetale ==== |
|||
La patofisiologia della sindrome alcolica fetale è mediata dalla legazione dell'etanolo ai recettori GABA-A e NMDA nel SNC in via di sviluppo.<ref>{{Cita pubblicazione|nome=Martin|cognome=Davies|data=2003-07|titolo=The role of GABAA receptors in mediating the effects of alcohol in the central nervous system|rivista=Journal of psychiatry & neuroscience: JPN|volume=28|numero=4|pp=263–274|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/12921221/}}</ref> Anche se il meccanismo non è ben compreso, l'idea attuale è che l'etanolo avvii una cascata pro-apoptotica in milioni di neuroni attivando i recettori GABA-A e i VDCC, causando eccitotossicità in questi neuroni.<ref name=":0" /> |
|||
==== Disturbi d'ansia ==== |
|||
Disturbi d'ansia come il disturbo di panico, il disturbo da stress post-traumatico e il disturbo d'ansia generalizzato sono associati a livelli ridotti di GABA.<ref>{{Cita pubblicazione|nome=Borwin|cognome=Bandelow|nome2=David|cognome2=Baldwin|nome3=Marianna|cognome3=Abelli|data=2017-04|titolo=Biological markers for anxiety disorders, OCD and PTSD: A consensus statement. Part II: Neurochemistry, neurophysiology and neurocognition|rivista=The World Journal of Biological Psychiatry: The Official Journal of the World Federation of Societies of Biological Psychiatry|volume=18|numero=3|pp=162–214|accesso=2023-08-05|doi=10.1080/15622975.2016.1190867|url=https://pubmed.ncbi.nlm.nih.gov/27419272/}}</ref><ref>{{Cita pubblicazione|nome=R. Bruce|cognome=Lydiard|data=2003|titolo=The role of GABA in anxiety disorders|rivista=The Journal of Clinical Psychiatry|volume=64 Suppl 3|pp=21–27|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/12662130/}}</ref> L'GABA è inibitorio nei confronti dell'ormone rilasciante la corticotropina (CRF) e della vasopressina, neuropeptidi rilasciati dal nucleo paraventricolare dell'ipotalamo per stimolare l'asse ipotalamo-ipofisi-surrene (HPA). L'HPA è associato allo stress, quindi l'iperattività cronica dell'HPA in parte dovuta all'azione dell'GABA è associata allo stress patologico, alla depressione e all'ansia.<ref name=":0" /> I pazienti con disturbi d'ansia hanno una risposta ridotta alle benzodiazepine e una ridotta liberazione di GABA. L'amigdala, un sito cerebrale per la creazione e la conservazione di memorie associate alla paura, è anche associata ai disturbi d'ansia poiché i pazienti con ansia spesso hanno un sovrattivazione dell'amigdala. Ci sono molti neuroni GABAergici nell'amigdala rispetto ad altre regioni cerebrali e il loro ruolo è ritenuto coinvolgere l'induzione di potenziamento a lungo termine per regolare la generalizzazione della paura.<ref name=":0" /> |
|||
==== Depressione ==== |
|||
Sebbene la depressione sia principalmente associata a alterazioni della dopamina, noradrenalina e serotonina, i deficit della segnalazione dell'GABA svolgono anche un ruolo nella depressione.<ref>{{Cita pubblicazione|nome=Hanns|cognome=Möhler|data=2012-01|titolo=The GABA system in anxiety and depression and its therapeutic potential|rivista=Neuropharmacology|volume=62|numero=1|pp=42–53|accesso=2023-08-05|doi=10.1016/j.neuropharm.2011.08.040|url=https://pubmed.ncbi.nlm.nih.gov/21889518/}}</ref> Uno studio PET con <sup>11</sup>C-flumazenil su pazienti con depressione maggiore ha trovato un numero ridotto di neuroni GABAergici nella corteccia orbitofrontale, nei titoli plasmatici di GABA e nella quantità di recettori GABA-A corticali.<ref name=":0" /> |
|||
==== Disturbi epilettici e tremori ==== |
|||
Si ritiene che le crisi epilettiche siano scariche elettriche parossistiche ipersincrone dovute a sovraeccitazione dei neuroni nel cervello.<ref>{{Cita pubblicazione|nome=D. M.|cognome=Treiman|data=2001|titolo=GABAergic mechanisms in epilepsy|rivista=Epilepsia|volume=42 Suppl 3|pp=8–12|accesso=2023-08-05|doi=10.1046/j.1528-1157.2001.042suppl.3008.x|url=https://pubmed.ncbi.nlm.nih.gov/11520315/}}</ref> I tremori sono in parte causati dalla morte dei neuroni GABAergici nel cervelletto.<ref>{{Cita pubblicazione|nome=Alexandre|cognome=Gironell|data=2014|titolo=The GABA Hypothesis in Essential Tremor: Lights and Shadows|rivista=Tremor and Other Hyperkinetic Movements (New York, N.Y.)|volume=4|pp=254|accesso=2023-08-05|doi=10.7916/D8SF2T9C|url=https://pubmed.ncbi.nlm.nih.gov/25120944/}}</ref> Queste sindromi spesso derivano da un disequilibrio nell'equilibrio glutammato-GABA dovuto a un'eccessiva eccitazione o a una scarsa inibizione. Diverse malattie e lesioni al cervello, tra cui ictus, malattia di Parkinson, paralisi cerebrale spastica e lesioni cerebrali traumatiche, hanno attività epilettiche o tremorose secondarie a danni agli interneuroni inibitori.<ref>{{Cita pubblicazione|nome=Tao|cognome=Gong|nome2=Yuanyuan|cognome2=Xiang|nome3=Muhammad G.|cognome3=Saleh|data=2018-06|titolo=Inhibitory motor dysfunction in parkinson's disease subtypes|rivista=Journal of magnetic resonance imaging: JMRI|volume=47|numero=6|pp=1610–1615|accesso=2023-08-05|doi=10.1002/jmri.25865|url=https://pubmed.ncbi.nlm.nih.gov/28960581/}}</ref><ref>{{Cita pubblicazione|nome=Connie|cognome=Wu|nome2=Dandan|cognome2=Sun|data=2015-04|titolo=GABA receptors in brain development, function, and injury|rivista=Metabolic Brain Disease|volume=30|numero=2|pp=367–379|accesso=2023-08-05|doi=10.1007/s11011-014-9560-1|url=https://pubmed.ncbi.nlm.nih.gov/24820774/}}</ref> |
|||
==== Malattia di Huntington ==== |
|||
La proteina coinvolta nella malattia di Huntington, l'Huntingtina, inibisce la trascrizione e il trasporto dei recettori GABA-A e del KCC2, causa neuroinfiammazione che indebolisce la risposta inibitoria e la disfunzione dei trasportatori astrocitici del glutammato.<ref>{{Cita libro|nome=Anthony S.|cognome=de Leon|nome2=Prasanna|cognome2=Tadi|titolo=Biochemistry, Gamma Aminobutyric Acid|url=http://www.ncbi.nlm.nih.gov/books/NBK551683/|accesso=2023-08-05|data=2023|editore=StatPearls Publishing}}</ref> Ciò porta a un'inibizione ridotta che potrebbe essere associata a corea di Huntington.<ref name=":0" /> |
|||
==== Patologie da eccesso di GABA ==== |
|||
Un rilascio eccessivo di GABA può essere anche patologico e si manifesta come ipersonnia idiopatica (IH), una condizione caratterizzata da sonnolenza diurna con sonno eccessivo e non ristoratore.<ref>{{Cita pubblicazione|nome=Lynn Marie|cognome=Trotti|data=2017-09|titolo=Idiopathic Hypersomnia|rivista=Sleep Medicine Clinics|volume=12|numero=3|pp=331–344|accesso=2023-08-05|doi=10.1016/j.jsmc.2017.03.009|url=https://pubmed.ncbi.nlm.nih.gov/28778232/}}</ref> Sebbene l'eziologia dell'ipersonnia idiopatica non sia ben compresa, si pensa che ci sia un'iperattività dei recettori GABA-A dovuta a un eccesso di GABA nella sinapsi e nel liquido cerebrospinale. La carenza di semialdeide succinato deidrogenasi (SSADH) è un disturbo autosomico recessivo raro in cui l'enzima coinvolto nella degradazione dell'GABA, la semialdeide succinato deidrogenasi, diventa difettoso.<ref>{{Cita pubblicazione|nome=Sara|cognome=Leo|nome2=Concetta|cognome2=Capo|nome3=Bianca Maria|cognome3=Ciminelli|data=2017-10|titolo=SSADH deficiency in an Italian family: a novel ALDH5A1 gene mutation affecting the succinic semialdehyde substrate binding site|rivista=Metabolic Brain Disease|volume=32|numero=5|pp=1383–1388|accesso=2023-08-05|doi=10.1007/s11011-017-0058-5|url=https://pubmed.ncbi.nlm.nih.gov/28664505/}}</ref> I pazienti con SSADH accumulano gamma-idrossibutirrato (GHB), un prodotto metabolico derivato dalla riduzione dell'eccessiva semialdeide succinato. La carenza di GABA transaminasi (GABA-T) è un difetto estremamente raro del primo enzima nella degradazione dell'GABA che si manifesta come iperreflessia e crisi epilettiche refrattarie.<ref>{{Cita pubblicazione|nome=L. K.|cognome=Medina-Kauwe|nome2=A. J.|cognome2=Tobin|nome3=L.|cognome3=De Meirleir|data=1999-06|titolo=4-Aminobutyrate aminotransferase (GABA-transaminase) deficiency|rivista=Journal of Inherited Metabolic Disease|volume=22|numero=4|pp=414–427|accesso=2023-08-05|doi=10.1023/a:1005500122231|url=https://pubmed.ncbi.nlm.nih.gov/10407778/}}</ref> |
|||
== Importanza clinica == |
|||
L'GABA ha una grande importanza clinica ed i farmaci che agiscono sul recettore GABA sono comunemente utilizzati come terapie e sostanze d'abuso.<ref>{{Cita pubblicazione|nome=G.|cognome=Ahnert-Hilger|nome2=U.|cognome2=Kutay|nome3=I.|cognome3=Chahoud|data=1996-05|titolo=Synaptobrevin is essential for secretion but not for the development of synaptic processes|rivista=European Journal of Cell Biology|volume=70|numero=1|pp=1–11|accesso=2023-08-05|url=https://pubmed.ncbi.nlm.nih.gov/8738414/}}</ref><ref>{{Cita pubblicazione|nome=Yun|cognome=Wan|nome2=Qinghua|cognome2=Wang|nome3=Gerald J.|cognome3=Prud'homme|data=2015|titolo=GABAergic system in the endocrine pancreas: a new target for diabetes treatment|rivista=Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy|volume=8|pp=79–87|accesso=2023-08-05|doi=10.2147/DMSO.S50642|url=https://pubmed.ncbi.nlm.nih.gov/25678807/}}</ref><ref>{{Cita pubblicazione|nome=Esa R.|cognome=Korpi|nome2=Saku T.|cognome2=Sinkkonen|data=2006-01|titolo=GABA(A) receptor subtypes as targets for neuropsychiatric drug development|rivista=Pharmacology & Therapeutics|volume=109|numero=1-2|pp=12–32|accesso=2023-08-05|doi=10.1016/j.pharmthera.2005.05.009|url=https://pubmed.ncbi.nlm.nih.gov/15996746/}}</ref><ref>{{Cita pubblicazione|nome=Maja Jazvinscak|cognome=Jembrek|nome2=Josipa|cognome2=Vlainic|data=2015|titolo=GABA Receptors: Pharmacological Potential and Pitfalls|rivista=Current Pharmaceutical Design|volume=21|numero=34|pp=4943–4959|accesso=2023-08-05|doi=10.2174/1381612821666150914121624|url=https://pubmed.ncbi.nlm.nih.gov/26365137/}}</ref> |
|||
Ci sono numerose applicazioni per i farmaci che modulano la segnalazione dell'GABA. Le benzodiazepine sono una classe di farmaci che esercitano i loro effetti legandosi al recettore GABA-A, aumentando la permeabilità degli ioni cloruro cambiando la frequenza con cui si aprono i canali del cloruro. Sono utilizzate nell'anestesia chirurgica, nel trattamento dell'epilessia, dei disturbi del sonno REM, del ritiro dall'alcol, del tremore essenziale e della spasticità muscolare. Sono anche farmaci comuni di abuso. L'etanolo, una delle sostanze psicoattive più antiche e ampiamente utilizzate, esercita anche effetti sul recettore GABA-A. Il ritiro dall'alcol è trattato con farmaci che modulano l'GABA, come le benzodiazepine. Inoltre, l'etanolo e le benzodiazepine mostrano tolleranza incrociata tra di loro a causa del loro meccanismo d'azione simile. Un sovradosaggio o l'assunzione di più farmaci che modulano l'GABA possono causare depressione respiratoria a causa dell'aumento della segnalazione dell'GABA nel midollo allungato del tronco cerebrale.<ref name=":4" /> |
|||
Molti altri farmaci modulano la segnalazione dell'GABA, tra cui: |
|||
* Barbiturici, farmaci sedativi che aumentano la durata dell'apertura del canale del cloruro quando l'GABA si lega al recettore GABA-A.<ref>{{Cita web|url=https://farmaci.agenziafarmaco.gov.it/aifa/servlet/PdfDownloadServlet?pdfFileName=footer_000141_030669_FI.pdf&sys=m0b1l3|titolo=AIFA FOGLIO ILLUSTRATIVO - Fenobarbitale sodico S.A.L.F. 30 mg/ml soluzione iniettabile/Fenobarbitale sodico S.A.L.F. 100 mg/2 ml soluzione iniettabile}}</ref><ref>{{Cita web|url=https://go.drugbank.com/drugs/DB00312|titolo=Pentobarbital|sito=go.drugbank.com|accesso=2023-08-05}}</ref> |
|||
* Vigabatrin, un antiepilettico inibitore della GABA transaminasi.<ref>{{Cita web|url=https://mediately.co/it|titolo=SABRIL 500 mg compresse rivestite - Mediately Farmaci|sito=Mediately|lingua=it|accesso=2023-08-05}}</ref> |
|||
* Propofol, un sedativo comunemente usato in anestesia generale e modulatore allosterico e agonista del recettore GABA-A.<ref>{{Cita web|url=https://mediately.co/it|titolo=PROPOFOL (B.BRAUN) 1% emulsione per infusione - Mediately Farmaci|sito=Mediately|lingua=it|accesso=2023-08-05}}</ref> |
|||
* Flumazenil, un antagonista delle benzodiazepine che si lega al recettore GABA-A e può invertire l'intossicazione da benzodiazepine e migliorare lo stato mentale nell'encefalopatia epatica.<ref>{{Cita web|url=https://mediately.co/it|titolo=FLUMAZENIL (B.BRAUN) 0.1 mg/ml soluzione iniettabile - Mediately Farmaci|sito=Mediately|lingua=it|accesso=2023-08-05}}</ref> |
|||
* Baclofene, un rilassante muscolare e agonista del recettore GABA-B.<ref>{{Cita web|url=https://mediately.co/it|titolo=BACLOFENE (BIOINDUSTRIA L.I.M.) 0,05 mg/ml soluzione iniettabile - Mediately Farmaci|sito=Mediately|lingua=it|accesso=2023-08-05}}</ref> |
|||
* Acido valproico, uno stabilizzatore dell'umore e antiepilettico che si ipotizza abbia un effetto inibitorio sul riassorbimento dell'GABA.<ref>{{Cita web|url=https://mediately.co/it|titolo=ACIDO VALPROICO (SANDOZ) 300 mg compresse divisibili rilascio modificato - Mediately Farmaci|sito=Mediately|lingua=it|accesso=2023-08-05}}</ref> |
|||
* Zolpidem, un sedativo-ipnotico, esercita i suoi effetti sul recettore GABA-A.<ref>{{Cita web|url=https://mediately.co/it|titolo=ZOLPIDEM (AUROBINDO) 10 mg compresse rivestite divisibili - Mediately Farmaci|sito=Mediately|lingua=it|accesso=2023-08-05}}</ref> |
|||
* Gabapentin, comunemente prescritto per trattare il dolore neuropatico, esercita parzialmente i suoi effetti aumentando la sintesi dell'GABA tramite la modulazione della glutammato deidrogenasi.<ref>{{Cita web|url=https://mediately.co/it|titolo=GABAPENTIN (ABC) 100 mg capsule rigide - Mediately Farmaci|sito=Mediately|lingua=it|accesso=2023-08-05}}</ref> |
|||
== Note == |
== Note == |
||
| Riga 50: | Riga 121: | ||
== Collegamenti esterni == |
== Collegamenti esterni == |
||
{{Collegamenti esterni}} |
|||
{{Amminoacido}}{{Portale|chimica}} |
{{Amminoacido}}{{Portale|chimica}} |
||
Versione delle 10:48, 5 ago 2023
| Acido γ-amminobutirrico | |
|---|---|
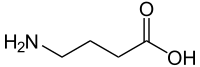 | |
 | |
| Nome IUPAC | |
| acido 4-amminobutanoico | |
| Nomi alternativi | |
| GABA acido γ-amminobutirrico acido piperidinico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H9NO2 |
| Massa molecolare (u) | 103,12 |
| Aspetto | polvere cristallina bianca |
| Numero CAS | |
| Numero EINECS | 200-258-6 |
| PubChem | 119 |
| DrugBank | DB02530 |
| SMILES | C(CC(=O)O)CN |
| Proprietà chimico-fisiche | |
| Solubilità in acqua | completa a 293 K |
| Temperatura di fusione | 200 °C (473 K); si decompone a 203 °C |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −581,0 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 315 - 319 - 335 |
| Consigli P | 261 - 305+351+338 [1] |
L'acido γ-amminobutirrico (GABA), noto anche come acido 4-amminobutanoico, è un γ-amminoacido, isomero dell'acido amminobutirrico ed è il principale neurotrasmettitore inibitorio nel sistema nervoso centrale.[2][3][4]
Il suo ruolo neurologico nei mammiferi è rimasto sconosciuto fino alla fine degli anni '50[5], fin quando gli studi sui neuroni corticali completati alla fine degli anni '60 hanno concluso che il GABA fosse inequivocabilmente inibitorio. Molte ulteriori ricerche sono state condotte per chiarire i meccanismi dell'inibizione indotta dall'GABA e il suo ruolo nelle patologie correlate all'GABA, tra cui disturbi d'ansia, disturbo da uso di alcol, epilessia, malattie spastiche e ipersonnia idiopatica.[6] L'azione della maggior parte dei farmaci ansiolitici, farmaci antiepilettici e farmaci anestetici agisce come agonisti dell'GABA.[7][8] Alcuni farmaci antagonisti del GABA, come ad esempio il flumazenil, sono impiegati come antidoti nel trattamento contro il sovradosaggio da agonisti del GABA.[9].
Storia
La scoperta dell'acido γ-aminobutirrico nel cervello risale al 1950, in uno studio pubblicato sul Journal of Biological Chemistry[10], preceduto da un breve rapporto conferenziale poco prima[11], dove Eugene Roberts e Sam Frankel non solo hanno identificato il GABA come una delle ammine principali nel cervello, ma hanno anche riportato che viene prodotto e si accumula preferenzialmente in quest'organo.[3]
In modo piuttosto sorprendente, la risposta iniziale a questa scoperta fu piuttosto contenuta. Nei primi 5 anni successivi alla relazione di Roberts e Frankel, accompagnata da altri due articoli sull'GABA nel cervello pubblicati nello stesso numero di JBC[12][13], secondo PubMed, furono pubblicati in quel periodo solo quattro studi aggiuntivi sull'GABA nel cervello.[3]
L'attività dell'GABA nel cervello è stata successivamente chiarita nel 1957 quando ricercatori in Canada riportarono che un composto sconosciuto con attività inibitoria sui neuroni dei granchi d'acqua dolce era in realtà l'GABA[14].Baruch Kanner dell'Università Ebraica Hadassah di Israele, membro del Consiglio Editoriale del JBC che studia i trasportatori dell'GABA affermò: "i recettori dell'GABA principalmente hanno un input inibitorio e sono i principali recettori inibitori nel cervello".[3]
Nel suo studio finale Roberts utilizzò la cromatografia su carta e un colorante chimico, la ninidrina, che reagisce e colora le ammine primarie, per isolare e identificare gli aminoacidi liberi negli estratti cerebrali di topo.[3]
Mentre analizzava meticolosamente questi estratti, Roberts trovò un composto reattivo alla ninidrina la cui migrazione sui cromatogrammi su carta non corrispondeva a nessun composto conosciuto contenente ammine. Inoltre, questo misterioso metabolita simile a un aminoacido si accumulava apparentemente a livelli molto più elevati nel cervello rispetto agli altri tessuti. Trattamenti acidi dei tessuti cerebrali non aumentavano questi livelli, suggerendo che questa ammina si presenta esclusivamente nella forma libera nel cervello. Fortunatamente, trovandosi l'ammina singolarmente e migrando abbastanza lontano da altri composti che reagiscono alla ninidrina, permettè a Roberts e Frankel di estrarlo dalle strisce tagliate dai cromatogrammi.[3]
I ricercatori eseguirono il composto estratto dalla striscia insieme a standard di riferimento accuratamente preparati in diversi sistemi solventi. Una tecnica sviluppata da un collega dell'Università di Washington, Sidney Udenfriend, chiamata metodo del derivato isotopico[12], li aiutò anche a focalizzare l'attenzione sulla sconosciuta ammina. Attraverso questo approccio multiplo, Roberts e Frankel conclusero che questa ammina associata al cervello era l'GABA. Andando oltre, utilizzando l'etichettatura radioattiva dei potenziali precursori dell'GABA, il duo di ricerca dimostrò anche che i tessuti cerebrali possono convertire un altro comune aminoacido cerebrale, l'acido glutammico, in GABA.[10]
La scoperta del 1957 che rivelò che l'GABA inibisce l'attivazione dei potenziali d'azione nei neuroni presentò un'altra novità. Altri neurotrasmettitori contenenti ammine di cui erano note le attività all'epoca, come la noradrenalina e l'acetilcolina, sono eccitatori. Kanner osserva che anche l'aminoacido glicina può inibire la neurotrasmissione cerebrale, ma "il GABA è chiaramente quello più abbondante".[3]
Biochimica
Apparati coinvolti
Il GABA è presente in tutto il corpo umano, anche se il ruolo che svolge in molte regioni rimane un'area di ricerca attiva. L'GABA è il principale neurotrasmettitore inibitorio nel cervello ed è un importante neurotrasmettitore inibitorio nel midollo spinale. Le cellule beta che producono insulina nel pancreas producono GABA. Esso funziona per inibire le cellule alfa del pancreas, stimolare la crescita delle cellule beta e convertire le cellule alfa in cellule beta. L'GABA è stato anche trovato in concentrazioni variabili e basse in altri sistemi organici, anche se il significato e la funzione di ciò non sono chiari.[15][16]
Funzione
L'GABA di solito provoca l'inibizione dei potenziali d'azione iperpolarizzando i neuroni postsinaptici e riducendo il rilascio di neurotrasmettitori da parte dei neuroni presinaptici. L'inibizione risultante diminuisce l'attività della cellula interessata, il che si manifesta in effetti che vanno dalla diminuzione della stimolazione motoria nei motoneuroni alla ridotta attività corticale in regioni che includono l'amigdala.[17][18]
L'ipotesi che il GABA assuma un ruolo di neurotrasmettitore eccitatorio nel SNC è ancora in via di sviluppo ed ultriori studi sono necessari. Nei neuroni immaturi presenti nel SNC embrionale, l'GABA è eccitatorio e depolarizza queste cellule a causa di una concentrazione elevata di ioni cloruro intracellulari.[19] L'alta concentrazione di cloruro è principalmente dovuta all'elevata espressione del co-trasportatore attivo sodio-potassio-cloruro (NKCC1), che porta ioni cloruro nel neurone interneuronale in via di sviluppo. Man mano che il neurone si sviluppa, la quantità di NKCC1 attivo diminuisce mentre la quantità del co-trasportatore K-Cl attivo (KCC2) aumenta; KCC2 espelle gli ioni cloruro dal neurone interneuronale. L'effetto netto è che la concentrazione intracellulare di cloruro diminuisce fino a quando l'GABA passa dall'essere eccitatorio a inibitorio. Oltre al suo effetto eccitatorio nello sviluppo del SNC, l'GABA è implicato nella differenziazione, migrazione e proliferazione dei neuroni.[20]
Meccanismo d'azione
L'azione dell'acido gamma-aminobutirrico coinvolge due recettori distinti, denominati recettore GABA-A e GABA-B.[21][22]
- Recettori GABA-A. Storicamente, il recettore GABA-A è stato differenziato dal recettore GABA-B poiché il baclofene si lega al recettore GABA-A, ma il bicucullina non si legava al recettore GABA-A e viceversa. Il recettore GABA-A è un canale ionico di cloruro legato al ligando transmembrana eteropentamerico presente in quasi tutti i neuroni del SNC. Sebbene esistano molte isoforme del recettore GABA-A, la maggior parte dei recettori GABA-A contiene subunità alfa e beta, oppure subunità alfa, beta e gamma. Le diverse combinazioni di subunità alfa, beta e gamma in diversi recettori GABA-A influenzano quali farmaci agonisti o antagonisti dell'GABA si legheranno ad essi. In generale, a causa dell'ingresso di ioni cloruro nel neurone postsinaptico maturo, l'attivazione del recettore GABA-A provoca iperpolarizzazione per ridurre la probabilità di un potenziale d'azione.
- Recettori GABA-B. Il recettore GABA-B è un recettore accoppiato alle proteine G che inibisce l'attività dell'adenilato ciclasi e dei canali del calcio voltaggio-dipendenti nei terminali assonali, risultando nella modulazione dell'attività intracellulare e nel rilascio di neurotrasmettitori, rispettivamente. I recettori GABA-B sono presenti come autorecettori che inibiscono il rilascio di GABA o come eterorecettori che riducono il rilascio di glutammato, noradrenalina, serotonina o dopamina. I recettori GABA-B presinaptici sono anche accoppiati ai canali del potassio rettificante verso l'interno accoppiati alle proteine G (GIRK) per stimolare l'assorbimento del potassio e causare iperpolarizzazione, limitando il rilascio di glutammato.
Metabolismo
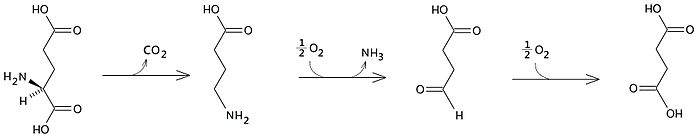
Il GABA è una molecola endogena ottenuta a partire dall'acido glutammico che viene decarbossilato ad opera dell'acido glutammico decarbossilasi (GAD). Il GABA viene poi degradato ad opera dell'enzima gaba-transaminasi (GABA-T) che catalizzando sulla molecola una reazione di deaminazione ossidativa dà come prodotto la semialdeide succinica che verrà successivamente ossidata ad acido succinico, intermedio del ciclo di Krebs.
Fisiopatologia
Abuso di alcool
L'alcol, o più specificamente l'etanolo, è un depressore del sistema nervoso centrale che agisce potenziando il recettore GABA-A, inibendo i recettori NMDA che si legano al glutammato e inibendo i canali del calcio voltaggio-dipendenti (VDCCs).[23][24] Gli effetti euforici del consumo di etanolo sono associati alla modifica dei recettori GABA-A nel sistema di ricompensa della dopamina mesolimbica. Nei pazienti con consumo cronico di etanolo, l'mRNA del recettore GABA-A e la quantità di espressione del recettore GABA-A cambiano in modo tale da diventare meno sensibili all'GABA e ai suoi modulatori alosterici, segnalando una nuova omeostasi elevata dell'GABA.[2] Di conseguenza, questi pazienti sono più inclini a sviluppare dipendenza, tolleranza e sintomi di astinenza dall'alcol (ansia, crisi epilettiche, delirio, tachicardia) a causa di livelli insufficienti di GABA nella nuova omeostasi dell'GABA.[2]
Sindrome alcolica fetale
La patofisiologia della sindrome alcolica fetale è mediata dalla legazione dell'etanolo ai recettori GABA-A e NMDA nel SNC in via di sviluppo.[25] Anche se il meccanismo non è ben compreso, l'idea attuale è che l'etanolo avvii una cascata pro-apoptotica in milioni di neuroni attivando i recettori GABA-A e i VDCC, causando eccitotossicità in questi neuroni.[2]
Disturbi d'ansia
Disturbi d'ansia come il disturbo di panico, il disturbo da stress post-traumatico e il disturbo d'ansia generalizzato sono associati a livelli ridotti di GABA.[26][27] L'GABA è inibitorio nei confronti dell'ormone rilasciante la corticotropina (CRF) e della vasopressina, neuropeptidi rilasciati dal nucleo paraventricolare dell'ipotalamo per stimolare l'asse ipotalamo-ipofisi-surrene (HPA). L'HPA è associato allo stress, quindi l'iperattività cronica dell'HPA in parte dovuta all'azione dell'GABA è associata allo stress patologico, alla depressione e all'ansia.[2] I pazienti con disturbi d'ansia hanno una risposta ridotta alle benzodiazepine e una ridotta liberazione di GABA. L'amigdala, un sito cerebrale per la creazione e la conservazione di memorie associate alla paura, è anche associata ai disturbi d'ansia poiché i pazienti con ansia spesso hanno un sovrattivazione dell'amigdala. Ci sono molti neuroni GABAergici nell'amigdala rispetto ad altre regioni cerebrali e il loro ruolo è ritenuto coinvolgere l'induzione di potenziamento a lungo termine per regolare la generalizzazione della paura.[2]
Depressione
Sebbene la depressione sia principalmente associata a alterazioni della dopamina, noradrenalina e serotonina, i deficit della segnalazione dell'GABA svolgono anche un ruolo nella depressione.[28] Uno studio PET con 11C-flumazenil su pazienti con depressione maggiore ha trovato un numero ridotto di neuroni GABAergici nella corteccia orbitofrontale, nei titoli plasmatici di GABA e nella quantità di recettori GABA-A corticali.[2]
Disturbi epilettici e tremori
Si ritiene che le crisi epilettiche siano scariche elettriche parossistiche ipersincrone dovute a sovraeccitazione dei neuroni nel cervello.[29] I tremori sono in parte causati dalla morte dei neuroni GABAergici nel cervelletto.[30] Queste sindromi spesso derivano da un disequilibrio nell'equilibrio glutammato-GABA dovuto a un'eccessiva eccitazione o a una scarsa inibizione. Diverse malattie e lesioni al cervello, tra cui ictus, malattia di Parkinson, paralisi cerebrale spastica e lesioni cerebrali traumatiche, hanno attività epilettiche o tremorose secondarie a danni agli interneuroni inibitori.[31][32]
Malattia di Huntington
La proteina coinvolta nella malattia di Huntington, l'Huntingtina, inibisce la trascrizione e il trasporto dei recettori GABA-A e del KCC2, causa neuroinfiammazione che indebolisce la risposta inibitoria e la disfunzione dei trasportatori astrocitici del glutammato.[33] Ciò porta a un'inibizione ridotta che potrebbe essere associata a corea di Huntington.[2]
Patologie da eccesso di GABA
Un rilascio eccessivo di GABA può essere anche patologico e si manifesta come ipersonnia idiopatica (IH), una condizione caratterizzata da sonnolenza diurna con sonno eccessivo e non ristoratore.[34] Sebbene l'eziologia dell'ipersonnia idiopatica non sia ben compresa, si pensa che ci sia un'iperattività dei recettori GABA-A dovuta a un eccesso di GABA nella sinapsi e nel liquido cerebrospinale. La carenza di semialdeide succinato deidrogenasi (SSADH) è un disturbo autosomico recessivo raro in cui l'enzima coinvolto nella degradazione dell'GABA, la semialdeide succinato deidrogenasi, diventa difettoso.[35] I pazienti con SSADH accumulano gamma-idrossibutirrato (GHB), un prodotto metabolico derivato dalla riduzione dell'eccessiva semialdeide succinato. La carenza di GABA transaminasi (GABA-T) è un difetto estremamente raro del primo enzima nella degradazione dell'GABA che si manifesta come iperreflessia e crisi epilettiche refrattarie.[36]
Importanza clinica
L'GABA ha una grande importanza clinica ed i farmaci che agiscono sul recettore GABA sono comunemente utilizzati come terapie e sostanze d'abuso.[37][38][39][40]
Ci sono numerose applicazioni per i farmaci che modulano la segnalazione dell'GABA. Le benzodiazepine sono una classe di farmaci che esercitano i loro effetti legandosi al recettore GABA-A, aumentando la permeabilità degli ioni cloruro cambiando la frequenza con cui si aprono i canali del cloruro. Sono utilizzate nell'anestesia chirurgica, nel trattamento dell'epilessia, dei disturbi del sonno REM, del ritiro dall'alcol, del tremore essenziale e della spasticità muscolare. Sono anche farmaci comuni di abuso. L'etanolo, una delle sostanze psicoattive più antiche e ampiamente utilizzate, esercita anche effetti sul recettore GABA-A. Il ritiro dall'alcol è trattato con farmaci che modulano l'GABA, come le benzodiazepine. Inoltre, l'etanolo e le benzodiazepine mostrano tolleranza incrociata tra di loro a causa del loro meccanismo d'azione simile. Un sovradosaggio o l'assunzione di più farmaci che modulano l'GABA possono causare depressione respiratoria a causa dell'aumento della segnalazione dell'GABA nel midollo allungato del tronco cerebrale.[16]
Molti altri farmaci modulano la segnalazione dell'GABA, tra cui:
- Barbiturici, farmaci sedativi che aumentano la durata dell'apertura del canale del cloruro quando l'GABA si lega al recettore GABA-A.[41][42]
- Vigabatrin, un antiepilettico inibitore della GABA transaminasi.[43]
- Propofol, un sedativo comunemente usato in anestesia generale e modulatore allosterico e agonista del recettore GABA-A.[44]
- Flumazenil, un antagonista delle benzodiazepine che si lega al recettore GABA-A e può invertire l'intossicazione da benzodiazepine e migliorare lo stato mentale nell'encefalopatia epatica.[45]
- Baclofene, un rilassante muscolare e agonista del recettore GABA-B.[46]
- Acido valproico, uno stabilizzatore dell'umore e antiepilettico che si ipotizza abbia un effetto inibitorio sul riassorbimento dell'GABA.[47]
- Zolpidem, un sedativo-ipnotico, esercita i suoi effetti sul recettore GABA-A.[48]
- Gabapentin, comunemente prescritto per trattare il dolore neuropatico, esercita parzialmente i suoi effetti aumentando la sintesi dell'GABA tramite la modulazione della glutammato deidrogenasi.[49]
Note
- ^ Sigma Aldrich; rev. del 02.11.2012
- ^ a b c d e f g h Anthony S. de Leon e Prasanna Tadi, Biochemistry, Gamma Aminobutyric Acid, StatPearls Publishing, 2023. URL consultato il 5 agosto 2023.
- ^ a b c d e f g (EN) Martin J. Spiering, The discovery of GABA in the brain, in Journal of Biological Chemistry, vol. 293, n. 49, 2018-12, pp. 19159–19160, DOI:10.1074/jbc.CL118.006591. URL consultato il 5 agosto 2023.
- ^ gamma-Aminobutyric acid, su go.drugbank.com. URL consultato il 5 agosto 2023.
- ^ N. G. Bowery e T. G. Smart, GABA and glycine as neurotransmitters: a brief history, in British Journal of Pharmacology, 147 Suppl 1, Suppl 1, 2006-01, pp. S109–119, DOI:10.1038/sj.bjp.0706443. URL consultato il 5 agosto 2023.
- ^ Ognen A. C. Petroff, GABA and glutamate in the human brain, in The Neuroscientist: A Review Journal Bringing Neurobiology, Neurology and Psychiatry, vol. 8, n. 6, 2002-12, pp. 562–573, DOI:10.1177/1073858402238515. URL consultato il 5 agosto 2023.
- ^ Fabio Caputo e Mauro Bernardi, Medications acting on the GABA system in the treatment of alcoholic patients, in Current Pharmaceutical Design, vol. 16, n. 19, 2010, pp. 2118–2125, DOI:10.2174/138161210791516468. URL consultato il 5 agosto 2023.
- ^ Janette Brohan e Basavana G. Goudra, The Role of GABA Receptor Agonists in Anesthesia and Sedation, in CNS drugs, vol. 31, n. 10, 2017-10, pp. 845–856, DOI:10.1007/s40263-017-0463-7. URL consultato il 5 agosto 2023.
- ^ E. J. Hoffman e E. W. Warren, Flumazenil: a benzodiazepine antagonist, in Clinical Pharmacy, vol. 12, n. 9, 1993-09, pp. 641–656; quiz 699–701. URL consultato il 5 agosto 2023.
- ^ a b E. Roberts e S. Frankel, gamma-Aminobutyric acid in brain: its formation from glutamic acid, in The Journal of Biological Chemistry, vol. 187, n. 1, 1950-11, pp. 55–63. URL consultato il 5 agosto 2023.
- ^ Roberts, E., and S. Frankel. "γ-Aminobutyric acid in brain." Federation Proceedings. Vol. 9. 1950.
- ^ a b J. Awapara, A. J. Landua e R. Fuerst, Free gamma-aminobutyric acid in brain, in The Journal of Biological Chemistry, vol. 187, n. 1, 1950-11, pp. 35–39. URL consultato il 5 agosto 2023.
- ^ S. Udenfriend, Identification of gamma-aminobutyric acid in brain by the isotope derivative method, in The Journal of Biological Chemistry, vol. 187, n. 1, 1950-11, pp. 65–69. URL consultato il 5 agosto 2023.
- ^ A. W. Basemore, K. A. Elliot e E. Florey, Isolation of factor I, in Journal of Neurochemistry, vol. 1, n. 4, 1957, pp. 334–339, DOI:10.1111/j.1471-4159.1957.tb12090.x. URL consultato il 5 agosto 2023.
- ^ Arjun Khanna, Brian Patrick Walcott e Kristopher T. Kahle, Limitations of Current GABA Agonists in Neonatal Seizures: Toward GABA Modulation Via the Targeting of Neuronal Cl(-) Transport, in Frontiers in Neurology, vol. 4, 2013, pp. 78, DOI:10.3389/fneur.2013.00078. URL consultato il 5 agosto 2023.
- ^ a b Benjamin E. Jewett e Sandeep Sharma, Physiology, GABA, StatPearls Publishing, 2023. URL consultato il 5 agosto 2023.
- ^ Uri Nimrod Ramírez-Jarquín, Rafael Lazo-Gómez e Luis B. Tovar-Y-Romo, Spinal inhibitory circuits and their role in motor neuron degeneration, in Neuropharmacology, vol. 82, 2014-07, pp. 101–107, DOI:10.1016/j.neuropharm.2013.10.003. URL consultato il 5 agosto 2023.
- ^ Fan Jie, Guanghao Yin e Wei Yang, Stress in Regulation of GABA Amygdala System and Relevance to Neuropsychiatric Diseases, in Frontiers in Neuroscience, vol. 12, 2018, pp. 562, DOI:10.3389/fnins.2018.00562. URL consultato il 5 agosto 2023.
- ^ C. Guin Ting Wong, Teodoro Bottiglieri e O. Carter Snead, GABA, gamma-hydroxybutyric acid, and neurological disease, in Annals of Neurology, 54 Suppl 6, 2003, pp. S3–12, DOI:10.1002/ana.10696. URL consultato il 5 agosto 2023.
- ^ Zi-Wei Chen e Richard W. Olsen, GABAA receptor associated proteins: a key factor regulating GABAA receptor function, in Journal of Neurochemistry, vol. 100, n. 2, 2007-01, pp. 279–294, DOI:10.1111/j.1471-4159.2006.04206.x. URL consultato il 5 agosto 2023.
- ^ Audrée Pinard, Riad Seddik e Bernhard Bettler, GABAB receptors: physiological functions and mechanisms of diversity, in Advances in Pharmacology (San Diego, Calif.), vol. 58, 2010, pp. 231–255, DOI:10.1016/S1054-3589(10)58010-4. URL consultato il 5 agosto 2023.
- ^ Timothy A. Simeone, Sean D. Donevan e Jong M. Rho, Molecular biology and ontogeny of gamma-aminobutyric acid (GABA) receptors in the mammalian central nervous system, in Journal of Child Neurology, vol. 18, n. 1, 2003-01, pp. 39–48; discussion 49, DOI:10.1177/08830738030180012101. URL consultato il 5 agosto 2023.
- ^ Ansel T. Hillmer, Graeme F. Mason e Lisa M. Fucito, How Imaging Glutamate, γ-Aminobutyric Acid, and Dopamine Can Inform the Clinical Treatment of Alcohol Dependence and Withdrawal, in Alcoholism, Clinical and Experimental Research, vol. 39, n. 12, 2015-12, pp. 2268–2282, DOI:10.1111/acer.12893. URL consultato il 5 agosto 2023.
- ^ Martin Davies, The role of GABAA receptors in mediating the effects of alcohol in the central nervous system, in Journal of psychiatry & neuroscience: JPN, vol. 28, n. 4, 2003-07, pp. 263–274. URL consultato il 5 agosto 2023.
- ^ Martin Davies, The role of GABAA receptors in mediating the effects of alcohol in the central nervous system, in Journal of psychiatry & neuroscience: JPN, vol. 28, n. 4, 2003-07, pp. 263–274. URL consultato il 5 agosto 2023.
- ^ Borwin Bandelow, David Baldwin e Marianna Abelli, Biological markers for anxiety disorders, OCD and PTSD: A consensus statement. Part II: Neurochemistry, neurophysiology and neurocognition, in The World Journal of Biological Psychiatry: The Official Journal of the World Federation of Societies of Biological Psychiatry, vol. 18, n. 3, 2017-04, pp. 162–214, DOI:10.1080/15622975.2016.1190867. URL consultato il 5 agosto 2023.
- ^ R. Bruce Lydiard, The role of GABA in anxiety disorders, in The Journal of Clinical Psychiatry, 64 Suppl 3, 2003, pp. 21–27. URL consultato il 5 agosto 2023.
- ^ Hanns Möhler, The GABA system in anxiety and depression and its therapeutic potential, in Neuropharmacology, vol. 62, n. 1, 2012-01, pp. 42–53, DOI:10.1016/j.neuropharm.2011.08.040. URL consultato il 5 agosto 2023.
- ^ D. M. Treiman, GABAergic mechanisms in epilepsy, in Epilepsia, 42 Suppl 3, 2001, pp. 8–12, DOI:10.1046/j.1528-1157.2001.042suppl.3008.x. URL consultato il 5 agosto 2023.
- ^ Alexandre Gironell, The GABA Hypothesis in Essential Tremor: Lights and Shadows, in Tremor and Other Hyperkinetic Movements (New York, N.Y.), vol. 4, 2014, pp. 254, DOI:10.7916/D8SF2T9C. URL consultato il 5 agosto 2023.
- ^ Tao Gong, Yuanyuan Xiang e Muhammad G. Saleh, Inhibitory motor dysfunction in parkinson's disease subtypes, in Journal of magnetic resonance imaging: JMRI, vol. 47, n. 6, 2018-06, pp. 1610–1615, DOI:10.1002/jmri.25865. URL consultato il 5 agosto 2023.
- ^ Connie Wu e Dandan Sun, GABA receptors in brain development, function, and injury, in Metabolic Brain Disease, vol. 30, n. 2, 2015-04, pp. 367–379, DOI:10.1007/s11011-014-9560-1. URL consultato il 5 agosto 2023.
- ^ Anthony S. de Leon e Prasanna Tadi, Biochemistry, Gamma Aminobutyric Acid, StatPearls Publishing, 2023. URL consultato il 5 agosto 2023.
- ^ Lynn Marie Trotti, Idiopathic Hypersomnia, in Sleep Medicine Clinics, vol. 12, n. 3, 2017-09, pp. 331–344, DOI:10.1016/j.jsmc.2017.03.009. URL consultato il 5 agosto 2023.
- ^ Sara Leo, Concetta Capo e Bianca Maria Ciminelli, SSADH deficiency in an Italian family: a novel ALDH5A1 gene mutation affecting the succinic semialdehyde substrate binding site, in Metabolic Brain Disease, vol. 32, n. 5, 2017-10, pp. 1383–1388, DOI:10.1007/s11011-017-0058-5. URL consultato il 5 agosto 2023.
- ^ L. K. Medina-Kauwe, A. J. Tobin e L. De Meirleir, 4-Aminobutyrate aminotransferase (GABA-transaminase) deficiency, in Journal of Inherited Metabolic Disease, vol. 22, n. 4, 1999-06, pp. 414–427, DOI:10.1023/a:1005500122231. URL consultato il 5 agosto 2023.
- ^ G. Ahnert-Hilger, U. Kutay e I. Chahoud, Synaptobrevin is essential for secretion but not for the development of synaptic processes, in European Journal of Cell Biology, vol. 70, n. 1, 1996-05, pp. 1–11. URL consultato il 5 agosto 2023.
- ^ Yun Wan, Qinghua Wang e Gerald J. Prud'homme, GABAergic system in the endocrine pancreas: a new target for diabetes treatment, in Diabetes, Metabolic Syndrome and Obesity: Targets and Therapy, vol. 8, 2015, pp. 79–87, DOI:10.2147/DMSO.S50642. URL consultato il 5 agosto 2023.
- ^ Esa R. Korpi e Saku T. Sinkkonen, GABA(A) receptor subtypes as targets for neuropsychiatric drug development, in Pharmacology & Therapeutics, vol. 109, n. 1-2, 2006-01, pp. 12–32, DOI:10.1016/j.pharmthera.2005.05.009. URL consultato il 5 agosto 2023.
- ^ Maja Jazvinscak Jembrek e Josipa Vlainic, GABA Receptors: Pharmacological Potential and Pitfalls, in Current Pharmaceutical Design, vol. 21, n. 34, 2015, pp. 4943–4959, DOI:10.2174/1381612821666150914121624. URL consultato il 5 agosto 2023.
- ^ AIFA FOGLIO ILLUSTRATIVO - Fenobarbitale sodico S.A.L.F. 30 mg/ml soluzione iniettabile/Fenobarbitale sodico S.A.L.F. 100 mg/2 ml soluzione iniettabile, su farmaci.agenziafarmaco.gov.it.
- ^ Pentobarbital, su go.drugbank.com. URL consultato il 5 agosto 2023.
- ^ SABRIL 500 mg compresse rivestite - Mediately Farmaci, su Mediately. URL consultato il 5 agosto 2023.
- ^ PROPOFOL (B.BRAUN) 1% emulsione per infusione - Mediately Farmaci, su Mediately. URL consultato il 5 agosto 2023.
- ^ FLUMAZENIL (B.BRAUN) 0.1 mg/ml soluzione iniettabile - Mediately Farmaci, su Mediately. URL consultato il 5 agosto 2023.
- ^ BACLOFENE (BIOINDUSTRIA L.I.M.) 0,05 mg/ml soluzione iniettabile - Mediately Farmaci, su Mediately. URL consultato il 5 agosto 2023.
- ^ ACIDO VALPROICO (SANDOZ) 300 mg compresse divisibili rilascio modificato - Mediately Farmaci, su Mediately. URL consultato il 5 agosto 2023.
- ^ ZOLPIDEM (AUROBINDO) 10 mg compresse rivestite divisibili - Mediately Farmaci, su Mediately. URL consultato il 5 agosto 2023.
- ^ GABAPENTIN (ABC) 100 mg capsule rigide - Mediately Farmaci, su Mediately. URL consultato il 5 agosto 2023.
Bibliografia
- Chen K., Lia H.Z., Yea N., Zhanga J., and Wang J.J. 2005. Role of GABAB receptors in GABA and baclofen-induced inhibition of adult rat cerebellar interpositus nucleus neurons in vitro. Brain Research Bulletin, 67(4), 310-318.
- Colquhoun D. and Sivilotti L.G. 2004. Function and structure in glycine receptors and some of their relatives. Trends in Neurosciences, 27(6), 337-344.
- Martin I.L., and Dunn S.M.J. 2002. GABA Receptors. Tocris Cookson Ltd.
- Siegel G.J., Agranoff B.W., Fisher S.K., Albers R.W., and Uhler M.D. 1999. Basic Neurochemistry: Molecular, Cellular and Medical Aspects, Sixth Edition. GABA Receptor Physiology and Pharmacology. American Society for Neurochemistry. Lippincott Williams and Wilkins.
Voci correlate
Altri progetti
 Wikimedia Commons contiene immagini o altri file su acido γ-amminobutirrico
Wikimedia Commons contiene immagini o altri file su acido γ-amminobutirrico
Collegamenti esterni
- (EN) gamma-aminobutyric acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 1007 · LCCN (EN) sh85052647 · GND (DE) 4155919-8 · BNF (FR) cb12244469n (data) · J9U (EN, HE) 987007555553805171 · NDL (EN, JA) 01112907 |
|---|