Anidride borica
| Anidride borica | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| triossido di diboro | |
| Nomi alternativi | |
| boria | |
| Caratteristiche generali | |
| Formula bruta o molecolare | B2O3 |
| Massa molecolare (u) | 69,6182 g/mol |
| Aspetto | solido bianco cristalli incolori |
| Numero CAS | |
| Numero EINECS | 215-125-8 |
| PubChem | 518682 |
| SMILES | B(=O)OB=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,460 (20 °C) |
| Costante di dissociazione acida (pKa) a K | ~ 4 |
| Solubilità in acqua | 11 g/l (10 °C) 33 g/l (20 °C) ~ 36 g/l (25 °C) 157 g/l (100 °C) |
| Temperatura di fusione | 450 °C (723 K) |
| Temperatura di ebollizione | 1860 °C (~2133 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -1254 |
| ΔfG0 (kJ·mol−1) | -832 |
| S0m(J·K−1mol−1) | 80.8 |
| C0p,m(J·K−1mol−1) | 66.9 J/mol K |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 3163 mg/kg |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 360 |
| Consigli P | 201 - 202 - 281 - 308+313 - 405 - 501 [1] |
L'anidride borica (nome sistematico: triossido di diboro) è uno degli ossidi del boro, avente formula minima B2O3. Si presenta generalmente come una polvere bianca igroscopica, ma è ottenibile, sebbene non facilmente, anche in forma cristallina incolore. Come materiale ceramico viene detta anche boria.[2] Si trova quasi sempre sotto forma vetrosa (amorfa); tuttavia, può essere cristallizzata dopo un'estesa ricottura (cioè sotto riscaldamento prolungato sotto pressione).
L'anidride borica, insieme alla silice e al carbonato di sodio, è un ingrediente per la produzione di vetri borosilicati.[3]
L'anidride borica è un ossido acido non molto solubile in acqua a freddo, ma comunque reagisce con essa facilmente dando una serie di acidi borici a seconda della concentrazione e della temperatura; in particolare, viene formato il comune acido borico (ortoborico):[4]
B2O3 + 3 H2O → 2 H3BO3
Strutture
[modifica | modifica wikitesto]Si pensa che lanidride borica vetrosa (γ-B2O3) sia composta da anelli a sei membri, analoghi a quelli della borossina H3B3O3[5] (o anche della borazina), nei quali c'è un'alternanza di atomi di boro (tricoordinato) e di ossigeno (bicoordinato). A causa della difficoltà di costruire modelli con molti anelli borossinici disordinati ottenendo la densità corretta del materiale, questa visione è stata inizialmente controversa, ma tali modelli sono stati recentemente costruiti e mostrano proprietà in eccellente accordo con i dati sperimentali.[6][7] È ora riconosciuto, da studi sperimentali e teorici[8][9][10][11][12] che la frazione di atomi di boro appartenenti agli anelli borossinici nella B2O3 vetrosa è compresa tra 0,73 e 0,83, con 0,75 corrispondente a un rapporto 1:1 tra unità ad anello e unità non ad anello. Il numero di anelli borossinici decade allo stato liquido con l'aumentare della temperatura.[13]
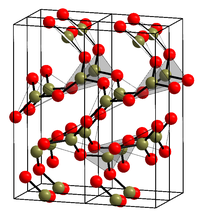
La forma cristallina (si veda la struttura nell'infobox[14]) è composta esclusivamente da triangoli BO3. Questa rete trigonale, simile al quarzo, subisce una trasformazione simile alla coesite in monoclina a diversi gigapascal (9,5 GPa).[15]
Preparazione
[modifica | modifica wikitesto]L'anidride borica viene prodotta trattando il borace con acido solforico in un forno a fusione. A temperature superiori a 750 °C, lo strato di ossido di boro fuso si separa dal solfato di sodio. Viene quindi decantato, raffreddato e ottenuto con una purezza del 96–97%.[16]
Un altro metodo è il riscaldamento dell'acido borico sopra ~ 300 °C. L'acido borico inizialmente si decompone in vapor d'acqua, (H2O(g)) e acido metaborico (HBO2) a circa 170 °C, e un ulteriore riscaldamento oltre i 300 °C produrrà più vapore e anidride borica. Le reazioni sono:
L'acido borico va al corrispondente microcristallino anidro in un letto fluido riscaldato.[17] La velocità di riscaldamento accuratamente controllata evita la gommatura durante l'evoluzione dell'acqua. L'ossido di boro fuso attacca i silicati. I tubi grafitati internamente tramite decomposizione termica dell'acetilene vengono passivati.[18]
Da un punto di vista cinetico la cristallizzazione dell' fuso a pressione ambiente è fortemente sfavorevole. Le condizioni di soglia per la cristallizzazione del solido amorfo sono 10 kbar e ~200 °C.[19] La sua struttura cristallina proposta nei gruppi spaziali enantiomorfi P31 (gruppo nº144); P32 (gruppo nº145)[20][21] (ad esempio γ-glicina) è stata rivista nei gruppi spaziali enantiomorfi P3121 (gruppo nº152);P3221 (gruppo nº154)[22](ad esempio, α-quarzo).
L'anidride borica si formerà anche quando il diborano (B2H6) reagisce con l'ossigeno nell'aria o con tracce di umidità:
Applicazioni
[modifica | modifica wikitesto]- Agente fondente per vetri e smalti
- Materiale di partenza per la sintesi di altri composti del boro come il carburo di boro
- Additivo utilizzato nelle fibre ottiche
- Componente utilizzato nella produzione di vetro borosilicato
- Lo strato di copertura inerte nel processo Czochralski di incapsulamento liquido per la produzione di monocristallo di arseniuro di gallio
- Come catalizzatore acido nella sintesi organica.
Note
[modifica | modifica wikitesto]- ^ scheda dell'anidride borica su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ I. Vishnevetsky e M. Epstein, Solar carbothermic reduction of alumina, magnesia and boria under vacuum, in Solar Energy, vol. 111, 1º gennaio 2015, pp. 236–251, DOI:10.1016/j.solener.2014.10.039. URL consultato il 21 aprile 2024.
- ^ I. Vishnevetsky e M. Epstein, Solar carbothermic reduction of alumina, magnesia and boria under vacuum, in Solar Energy, vol. 111, 2015-01, pp. 236–251, DOI:10.1016/j.solener.2014.10.039. URL consultato il 21 aprile 2024.
- ^ Annex XV dossier PROPOSAL FOR IDENTIFICATION OF A SUBSTANCE AS A CATEGORY 1A OR 1B CMR , PBT, vPvB OR A SUBSTANCE OF AN EQUIVALENT LEVEL OF CONCERN, su ECHA, p. 6.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, 16 - Catene, anelli, gabbie e 'clusters' nella chimica inorganica, in Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Piccin Nuova Libraria, Padova, 1999, p. 800, ISBN 88-299-1470-3.
- ^ (EN) Ferlat, G., Charpentier, T., Seitsonen, A.P., Takada, A., Lazzeri, M., Cormier, L., Calas, G. e Mauri. F., Boroxol Rings in Liquid and Vitreous B2O3 from First Principles, in Phys. Rev. Lett., vol. 101, n. 6, 2008, p. 065504, DOI:10.1103/PhysRevLett.101.065504.
- ^ (EN) G. Ferlat, A. P. Seitsonen, M. Lazzeri e F. Mauri, Hidden polymorphs drive vitrification in B2O3, in Nature Materials Letters, vol. 11, n. 11, 2012, pp. 925–929, DOI:10.1038/NMAT3416.
- ^ (EN) I. Hung, Determination of the bond-angle distribution in vitreous B2O3 by rotation (DOR) NMR spectroscopy, in Journal of Solid State Chemistry, vol. 182, n. 9, 2009, pp. 2402–2408, DOI:10.1016/j.jssc.2009.06.025.
- ^ (EN) A. K. Soper, Boroxol rings from diffraction data on vitreous boron trioxide, in J. Phys.: Condens. Matter, vol. 23, n. 36, 2011, p. 365402, DOI:10.1088/0953-8984/23/36/365402.
- ^ (EN) C. Joo, The ring structure of boron trioxide glass, in Journal of Non-Crystalline Solids, vol. 261, 1–3, 2000, pp. 282–286, DOI:10.1016/s0022-3093(99)00609-2.
- ^ (EN) J. W. Zwanziger, The NMR response of boroxol rings: a density functional theory study, in Solid State Nuclear Magnetic Resonance, vol. 27, 1–2, 2005, pp. 5–9, DOI:10.1016/j.ssnmr.2004.08.004.
- ^ (EN) M. Micoulaut, The structure of vitreous B2O3 obtained from a thermostatistical model of agglomeration, in Journal of Molecular Liquids, vol. 71, 2–3, 1997, pp. 107–114, DOI:10.1016/s0167-7322(97)00003-2.
- ^ (EN) Alderman, O.L G., Ferlat, G., Baroni, A., Salanne, M., Micoulaut, M., Benmore, C.J., Lin, A., Tamalonis, A. e Weber, J.K.R., Liquid B2O3 up to 1700K: X-ray diffraction and boroxol ring dissolution (PDF), in Journal of Physics: Condensed Matter, vol. 27, n. 45, 2015, p. 455104, DOI:10.1088/0953-8984/27/45/455104.
- ^ (EN) Gurr, G.E., Montgomery, P.W., Knutson, C.D. e Gorres, B.T., The Crystal Structure of Trigonal Diboron Trioxide, in Acta Crystallographica B, vol. 26, n. 7, 1970, pp. 906–915, DOI:10.1107/S0567740870003369.
- ^ (EN) Brazhkin, V.V., Katayama, Y., Inamura, Y., Kondrin, M.V., Lyapin, A.G., Popova, S.V. e Voloshin, R.N., Structural transformations in liquid, crystalline and glassy B2O3 under high pressure, in JETP Letters, vol. 78, n. 6, 2003, pp. 393–397, DOI:10.1134/1.1630134.
- ^ (EN) P. Patnaik, Handbook of Inorganic Chemical Compounds, McGraw-Hill, 2003, p. 119, ISBN 978-00-70-49439-8. URL consultato il 6 giugno 2009.
- ^ (EN) Kocakuşak, S., Akçay, K., Ayok, T., Koöroğlu, H.J., Koral, M., Savaşçi, Ö.T. e Tolun, R., Production of anhydrous, crystalline boron oxide in fluidized bed reactor, in Chemical Engineering and Processing, vol. 35, n. 4, 1996, pp. 311–317, DOI:10.1016/0255-2701(95)04142-7.
- ^ (EN) Morelock, C.R., Research Laboratory Report #61-RL-2672M, General Electric, 1961.
- ^ (EN) Aziz, M.J., Nygren, E., Hays, J.F. e Turnbull, D., Crystal Growth Kinetics of Boron Oxide Under Pressure, in Journal of Applied Physics, vol. 57, n. 6, 1985, p. 2233, DOI:10.1063/1.334368.
- ^ (EN) G.E. Gurr, P.W. Montgomery, C.D. Knutson e B.T. Gorres, The crystal structure of trigonal diboron trioxide, in Acta Crystallographica B, vol. 26, n. 7, 1970, pp. 906–915, DOI:10.1107/S0567740870003369.
- ^ (EN) S.L. Strong, A.F. Wells e R. Kaplow, On the crystal structure of B2O3, in Acta Crystallographica B, vol. 27, n. 8, 1971, pp. 1662–1663, DOI:10.1107/S0567740871004515.
- ^ (EN) H. Effenberger, C.L. Lengauer e E. Parthé, Trigonal B2O3 with Higher Space-Group Symmetry: Results of a Reevaluation, in Monatshefte für Chemie, vol. 132, n. 12, 2001, pp. 1515–1517, DOI:10.1007/s007060170008.
- ^ (EN) AirProducts, Diborane Storage & Delivery (PDF), 2011. URL consultato il 21 agosto 2013 (archiviato dall'url originale il 4 febbraio 2015).
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su anidride borica
Wikimedia Commons contiene immagini o altri file su anidride borica
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) boric oxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4146385-7 |
|---|






