Tumore alla mammella
| Tumore alla mammella | |
|---|---|
 | |
| Specialità | oncologia |
| Classificazione e risorse esterne (EN) | |
| ICD-10 | C50 |
| OMIM | 114480 |
| MedlinePlus | 000913 |
| eMedicine | 1947145, 345979 e 1276001 |
Per tumore alla mammella si intende una patologia in cui un tumore viene a svilupparsi nel tessuto mammario.[1] I segni di questa condizione possono comprendere un nodulo palpabile nella mammella, un suo cambiamento di forma, la formazione di fossette nella pelle, del fluido proveniente dal capezzolo, la comparsa di una macchia rossa squamosa sulla pelle.[2] In coloro che sviluppano una diffusione a distanza della malattia (metastasi), vi può essere comparsa di dolore alle ossa, ingrossamento dei linfonodi, mancanza di respiro e ittero.[3]
I fattori di rischio per lo sviluppo di questo tumore sono l'obesità, una vita sedentaria, l'assunzione eccessiva di bevande alcoliche, alcuni tipi di terapia ormonale sostitutiva per la menopausa (e comunque se protratti per oltre 10 anni), l'esposizione alle radiazioni ionizzanti, l'età precoce della prima mestruazione e avere figli in età avanzata o non averne proprio.[2][4] Il 5-10% dei casi sono dovuti a geni ereditati dai genitori, compresi tra gli altri il BRCA1 e il BRCA2. Il tumore alla mammella si sviluppa più comunemente nelle cellule di rivestimento dei dotti galattofori e nei lobuli che forniscono i condotti di latte materno. I primi sono noti come carcinomi duttali, mentre i secondi come carcinomi lobulari.[2] In aggiunta, vi sono più di 18 altri sotto-tipi di tumore alla mammella classificati. Alcuni tipi si sviluppano da lesioni pre-invasive come il carcinoma duttale in situ.[4] La diagnosi viene confermata tramite biopsia e una volta che è fatta, ulteriori test possono essere effettuati per determinare se e quanto il tumore si è espanso e quale trattamento preferire.[2]
L'equilibrio tra i vantaggi e gli svantaggi dello screening per questo tumore è oggetto di controversie e dibattiti. Una review del 2013 della Cochrane Collaboration ha puntualizzato che non vi sono prove conclusive che lo screening mammografico sia utile o meno.[5] Una rassegna del 2009 per la Task Force US Preventive Services ha trovato evidenza di un beneficio in coloro che sono nella fascia di età tra i 40 e i 70 anni[6] e l'organizzazione raccomanda lo screening ogni due anni nelle donne dai 50 ai 74 anni.[7] Come misure preventive per coloro che sono ad alto rischio, l'assunzione di farmaci come il tamoxifene o raloxifene e la rimozione chirurgica di entrambe le mammelle.[4] A coloro a cui è stato diagnosticato un tumore mammario, possono essere proposti una serie di trattamenti e approcci come la chirurgia, la radioterapia, la chemioterapia e la terapia mirata.[2],[8]
La prognosi per il tumore alla mammella varia a seconda del tipo, dell'estensione della malattia, e dell'età del paziente.[9] I tassi di sopravvivenza nel mondo sviluppato sono alti, con valori stimati che variano tra l'80% e il 90% a 5 anni dalla diagnosi.[10][11][12] Nei paesi in via di sviluppo questi valori sono molto più bassi.[4] In tutto il mondo, il tumore alla mammella rappresenta il tipo principale di neoplasia nelle donne e il 25% di tutti i casi di tumore.[13] Nel 2012 si sono registrati 1,68 milioni di casi che hanno portato a 522.000 decessi.[13] È più comune nei paesi sviluppati[4] ed è più di 100 volte più comune nelle donne rispetto agli uomini.[10][14]
Storia[modifica | modifica wikitesto]

Per via della sua visibilità esterna, il tumore alla mammella è il tumore più descritto nei documenti antichi.[15] Poiché le autopsie erano rare, i tumori degli organi interni erano praticamente invisibili e sconosciuti alla medicina antica, mentre quello alla mammella è palpabile attraverso la pelle e nel suo stadio più avanzato si manifesta esteriormente tramite necrosi, ulcerazioni e fuoriuscite di liquido scuro.[15]
La più antica descrizione di questo tumore di cui si abbia conoscenza, appartiene al Papiro Edwin Smith, risalente al 1.600 a.C. in Egitto, in cui vengono descritti 8 casi di tumori o ulcerazioni della mammella, trattati con cauterizzazione. Il papiro a proposito della malattia asserisce che: "non vi è nessun trattamento".[16] Per secoli i medici descrissero casi simili e sempre con la stessa infausta conclusione. La medicina antica, dai tempi dell'antica Grecia fino al XVII secolo si basava sulla teoria umorale e quindi si riteneva che il tumore alla mammella fosse riconducibile a squilibri nei fluidi fondamentali che controllavano il corpo, in particolare a un eccesso di bile nera.[17] In alternativa, a volte i pazienti lo vedevano come una punizione divina.[18] Nel corso del XVIII secolo furono formulate una grande varietà di spiegazioni mediche, tra cui la mancanza di attività sessuale, troppa attività sessuale, lesioni fisiche alla mammella, latte materno bloccato e varie forme di blocchi linfatici sia interni sia a causa di un abbigliamento troppo stretto.[17][19] Nel XIX secolo, il chirurgo scozzese John Rodman asseriva che il timore di sviluppare il tumore fosse una causa stessa del tumore.[19]
Anche se il tumore alla mammella era noto fin da tempi antichi, la sua presentazione fu rara almeno fino al XIX secolo quando i miglioramenti delle condizioni igienico-sanitarie e il controllo delle malattie infettive mortali comportarono forti aumenti nell'aspettativa di vita. In precedenza, la maggior parte delle donne morivano a un'età troppo precoce per sviluppare il tumore.[19] Inoltre, la precoce e frequente gravidanza e l'allattamento probabilmente contribuivano a ridurne il rischio nelle donne che sopravvivevano alla mezza età.[19]
Poiché la medicina antica riteneva che la causa fosse sistemica, anziché locale, e poiché la chirurgia comportava un alto tasso di mortalità, i trattamenti preferiti tendevano essere farmacologici. Preparati vegetali e minerali, in particolare derivanti dall'arsenico, erano relativamente comuni.
La prima mastectomia fu eseguita almeno già nel 548, quando fu proposta dal medico di corte di Teodora.[15] Non è stata comunque praticata con successo fino a quando i medici, a partire al XVII secolo, non ottennero una miglior comprensione del sistema circolatorio e poterono correlare la diffusione del tumore ai linfonodi ascellari. Il chirurgo francese Jean Louis Petit (1674-1750) e in seguito il chirurgo scozzese Benjamin Bell (1749-1806) furono i primi a rimuovere i linfonodi, il tessuto mammario e il sottostante muscolo pettorale.[20]
Il loro lavoro è stato in seguito portato avanti da William Stewart Halsted che iniziò a eseguire la mastectomia radicale nel 1882, grazie agli enormi contributi avuti dai progressi della tecnologia chirurgica generale, come ad esempio il ricorso a un ambiente asettico e all'anestesia. La mastectomia radicale di Halsted spesso comprendeva la rimozione di entrambe le mammelle, i linfonodi associati e i muscoli pettorali sottostanti. Ciò spesso significava un dolore a lungo termine e disabilità, ma tale tecnica era ritenuta necessaria per evitare che il tumore si ripresentasse.[21] Prima dell'avvento della mastectomia radicale di Halsted, i tassi di sopravvivenza a 20 anni erano solo del 10%, le pazienti di Halsted arrivavano fino al 50%. Migliorando la tecnica di Halsted, Jerome Urban propose una mastectomia meno radicale che si dimostrò dal 1963 parimenti efficace e meno invasiva.[21]
A partire dal 1970, una migliore comprensione delle metastasi ha portato a percepire il tumore come una malattia sia sistemica sia localistica e procedure meno invasive si rivelarono altrettanto efficaci. La moderna chemioterapia si sviluppò al termine della seconda guerra mondiale.[22]
Epidemiologia[modifica | modifica wikitesto]

nessun dato
<2
2–4
4–6
6–8
8–10
10–12
12–14
14–16
16–18
18–20
20–22
>22
In tutto il mondo, il tumore alla mammella è il tumore invasivo più comune nelle donne (la forma più comune di cancro non-invasivo è il tumore cutaneo non-melanoma, i tumori non invasivi sono in genere facilmente curabili, causano pochissimi decessi e sono regolarmente esclusi dalle statistiche dei tumori). Il tumore alla mammella rappresenta il 22,9% dei tumori invasivi nelle donne[24] e il 16% di tutti i tumori femminili.[25] Nel 2012, il 25,2% dei casi di tumore diagnosticati nelle donne era stato il tumore alla mammella, il che lo ha reso il tumore femminile più comune.[26]
Nel 2008, il tumore alla mammella ha causato 458.503 morti nel mondo (il 13,7% dei decessi per tumore nelle donne e il 6,0% di tutti i decessi per tumore tra uomini e donne insieme).[24] Il tumore al polmone, la seconda causa più comune di morte per neoplasia nelle donne, per fare un confronto, ha causato il 12,8% dei decessi (18,2% di tutte le morti per cancro sia negli uomini sia nelle donne).[24]
L'incidenza del tumore alla mammella varia notevolmente in tutto il mondo: è più bassa nei paesi meno sviluppati e più elevata nei paesi più sviluppati. Nelle dodici regioni del mondo, i tassi di incidenza annuali standardizzati per età per 100.000 donne sono i seguenti: Asia Orientale, 18; South Asia centrale, 22; Africa sub-sahariana, 22; Sud-est Asiatico, 26; Nord Africa e Asia occidentale, 28; Sud e Centro America, 42; Europa orientale, 49; Europa meridionale, 56; Nord Europa, 73; Oceania, 74; Europa occidentale, 78; Nord America, 90,[27]
Dal 1970, il numero di casi in tutto il mondo è aumentato significativamente, un fenomeno in parte attribuito agli stili di vita moderni.[28][29] Il tumore alla mammella è fortemente correlato all'età, con solo il 5% di tutti i casi che si verificano nelle donne sotto i 40 anni.[30] A titolo di esempio, vi sono stati più di 41.000 nuovi casi diagnosticati in Inghilterra nel 2011, circa l'80% di essi riguardavano donne di età superiore ai 50 anni.[31]
Dato che il tessuto della mammella è identico nella femmina e nel maschio, il carcinoma mammario può colpire anche quest'ultimo (anche se rappresenta meno dell'1% di tutti i tumori maschili)[32], sebbene sia alquanto raro. In entrambi i sessi, l'incidenza è maggiore nella mammella sinistra e nel quadrante mammario supero-esterno.[33][34][35][36]
Fattori di rischio[modifica | modifica wikitesto]
I fattori di rischio principali per il tumore alla mammella sono il sesso femminile e l'età avanzata.[37] Altri potenziali fattori includono: genetica[38], la mancanza di procreazione o la mancanza di allattamento al seno[39], elevati livelli di alcuni ormoni[40][41], la dieta e l'obesità. Recenti studi hanno indicato che l'esposizione all'inquinamento luminoso è un ulteriore fattore di rischio.[42]
Stile di vita[modifica | modifica wikitesto]
Il fumo sembra aumentare il rischio di cancro alla mammella, con un rischio maggiore incontrabile in coloro che hanno iniziato presto e fumano a grande quantità.[43] In coloro che hanno fumato per un periodo molto prolungato, si stima che il rischio correlato possa aumentare tra il 35% e il 50%.[43] La mancanza di attività fisica è stata individuata come fattore di rischio per il circa 10%.[44]
Vi può essere una correlazione tra uso di contraccettivi orali e lo sviluppo del tumore alla mammella in premenopausa[45], ma se i contraccettivi orali possono effettivamente essere causa del tumore in premenopausa è una questione, al 2014, ancora dibattuta. Se vi è davvero un legame, l'effetto assoluto è marginale.[46][47] In coloro con suscettibilità dei geni BRCA1 o BRCA2 o che hanno una storia familiare di cancro alla mammella, l'uso dei moderni contraccettivi orali non sembra influenzare il rischio di incorrere nella condizione neoplastica.[48]
L'associazione tra allattamento al seno e il tumore alla mammella non è al 2014 ancora stata chiaramente determinata; alcuni studi hanno trovato una certa correlazione, mentre altri l'hanno smentita.[49] Nel 1980, era stata avanzata l'ipotesi che il tumore alla mammella avrebbe avuto delle correlazioni con l'aborto.[50] Questa ipotesi è stata oggetto di un'ampia indagine scientifica che ha concluso che né gli aborti spontanei e nemmeno quelli volontari sono associati a un incremento di rischio di tumore alla mammella.[51][52]
Esiste una relazione tra dieta e tumore alla mammella, tra cui un aumento del rischio in seguito a una dieta ricca di grassi[53], l'assunzione di alcol[54], l'obesità[55] ed elevati livelli di colesterolo (ipercolesterolemia).[56] Una carenza di iodio assunto con l'alimentazione può anch'esso svolgere un ruolo.[57]
Altri fattori di rischio includono l'esposizione a radiazioni ionizzanti[58] e lavoro su turni .[59] Un certo numero di prodotti chimici sono stati correlati con il rischio di sviluppare un tumore alla mammella; tra questi: policlorobifenili, idrocarburi policiclici aromatici, solventi organici[60] e una serie di pesticidi.[61] Anche se l'esposizione ai raggi X in sede di mammografia fornisce una dose bassa di radiazioni, si stima che lo screening annuale tra i 40 e gli 80 anni sarà responsabile di circa 225 casi di tumore alla mammella fatale per milioni di donne sottoposte allo screening.[62]
Genetica[modifica | modifica wikitesto]

Caratteristiche genetiche specifiche possono giocare un ruolo nella maggior parte dei casi di tumore alla mammella.[63] Nel complesso, tuttavia, si crede che specifici geni (oltre a quelli normalmente implicati in tutti i cancri) possano essere la causa primaria attribuibile al 5-10% di tutti i casi.[64] In coloro con nessuno, uno o due parenti che hanno già affrontato la condizione, il rischio di sviluppare il tumore alla mammella prima dell'età di 80 anni è rispettivamente del 7,8%, 13,3% e 21,1%, e con una conseguente mortalità rispettivamente del 2,3%, 4,2% e 7,6%.[65] In coloro con un parente di primo grado affetto dalla condizione, il rischio di cancro alla mammella in una età compresa tra i 40 e i 50 anni è il doppio rispetto a quello riscontrabile nella popolazione generale.[66]
In meno del 5% dei casi geni specifici giocano un ruolo più significativo, arrivando a essere causa della sindrome del cancro ereditario della mammella e dell'ovaio.[63] Ciò include gli individui che sono portatori del gene BRCA1 e BRCA2.[63] Queste mutazioni rappresentano fino al 90% dell'influenza genetica totale, con un rischio di cancro al mammella che varia dal 60% all'80% nei soggetti colpiti.[64] Altre mutazioni significative sono quelle legate alla proteina p53 (sindrome di Li-Fraumeni), PTEN (sindrome di Cowden) e STK11 (sindrome di Peutz-Jeghers) , CHEK2, ATM, BRIP1 e PALB2.[64] Nel 2012, i ricercatori hanno dimostrato che vi sono quattro tipi di tumore alla mammella distinti geneticamente.[67]
Altre patologie[modifica | modifica wikitesto]
Cambiamenti della mammella, come l'iperplasia duttale atipica[68] e il carcinoma lobulare in situ[69][70][71], che si riscontrano in condizioni mammarie benigne quali i cambiamenti fibrocistici della mammella, sono situazioni correlate a un aumentato del rischio di incorrere in un tumore. Si ipotizza che il diabete mellito possa anch'esso aumentare il rischio di tumore alla mammella.[72]
Contraccezione ed estroprogestinici[modifica | modifica wikitesto]
Le donne sopravvissute al tumore dovrebbero utilizzare metodi contraccettivi non ormonali come opzioni di prima linea. Metodi basati su progestinici, come il deposito di medrossiprogesterone acetato, lo IUD con progestinici o la pillola progestinica possono presentare un aumento del rischio, seppur al 2015 ancora non del tutto studiato, di recidiva del tumore, tuttavia possono essere utilizzati se gli effetti positivi superano questo possibile rischio.[73]
Alle donne che hanno avuto un tumore alla mammella si consiglia di prendere in considerazione tempestivamente le opzioni non-ormonali per gli effetti della menopausa, come i bifosfonati o i modulatori selettivi del recettore degli estrogeni (SERM) per l'osteoporosi, e gli estrogeni vaginali per i sintomi locali. Studi osservazionali della terapia ormonale sostitutiva sistemica assunta dopo un tumore alla mammella sono generalmente rassicuranti. Se la terapia ormonale sostitutiva si rendesse necessaria, solitamente si può ricorrere all'assunzione di soli estrogeni o a un dispositivo intrauterino con progestinico, entrambe opzioni più sicure rispetto alla terapia sistemica combinata.[74]
Clinica[modifica | modifica wikitesto]
Segni e sintomi[modifica | modifica wikitesto]

Il primo sintomo evidente del tumore alla mammella è tipicamente la presenza di un nodulo che si avverte come diverso dal resto del tessuto mammario. Più dell'80% dei casi di cancro al mammella vengono scoperti quando la donna si accorge di avere un nodulo.[75] I tumori al mammella primitivi, tuttavia, possono essere rilevati grazie a una mammografia.[76] Un nodulo trovato nei linfonodi situati sotto le ascelle[75] può inoltre essere un indizio di un tumore mammario.
Altri segni che possono far sospettare questa condizione possono includere un ispessimento diverso dagli altri tessuti della mammella, una mammella che diventa più grande o più bassa, un capezzolo che cambia posizione, morfologia o si ritrae, presenza di una increspatura della pelle o di fossette, un arrossamento cutaneo intorno a un capezzolo o una secrezione da quest'ultimo, del dolore costante in una zona della mammella o dell'ascella e un gonfiore sotto l'ascella o intorno alla clavicola.[77] La presenza di dolore ("mastodinia") è uno indice affidabile per determinare la presenza o l'assenza di cancro alla mammella, ma può tuttavia essere indicativo di altre patologie.[75][76][78]
Il carcinoma mammario infiammatorio è un particolare tipo di tumore alla mammella che può rappresentare una sfida diagnostica. I sintomi possono assomigliare a una infiammazione della mammella e possono includere prurito, dolore, gonfiore, inversione del capezzolo, calore e rossore in tutto l'organo, così come un aspetto della pelle a “buccia d'arancia”;[75] tale condizione, tuttavia, non mostra la presenza di un nodulo e pertanto alle volte vi è un ritardo nella diagnosi.

Un'altra serie di sintomi vi è nella Malattia di Paget del capezzolo. Questa sindrome si presenta con alterazioni cutanee simili a eczema, come arrossamento, scolorimento o lieve sfaldamento della pelle capezzolo. Come nella malattia di Paget, i sintomi possono includere formicolio, prurito, aumento della sensibilità, bruciore e dolore. Si può presentare anche secrezione dal capezzolo. Circa la metà delle donne con diagnosi di malattia di Paget del capezzolo hanno anche un nodulo al mammella.[79]
In rari casi, quello che inizialmente appare come un fibroadenoma (un nodulo duro, mobile e non canceroso) potrebbe in realtà essere un tumore filloide. Essi si formano all'interno dello stroma (tessuto connettivo) della mammella e contengono tessuto stromale e ghiandolare. I tumori filloidi vengono classificati sulla base del loro aspetto al microscopio come benigni, "borderline" o maligni.[senza fonte]
Di tanto in tanto, il tumore alla mammella si presenta come malattia metastatica che è la diffusione del cancro oltre all'organo di origine. I sintomi causati dipenderanno dalla localizzazione delle metastasi le cui sedi più comuni sono ossa, fegato, polmoni e cervello.[80] Inspiegabile, una perdita di peso può talvolta preannunciare un tumore alla mammella occulto, così come la presenza di febbre o brividi. Dolori alle ossa o alle articolazioni possono a volte essere manifestazioni della presenza di metastasi, così come l'ittero o sintomi neurologici. Questi sintomi sono definiti non-specifici, nel senso che potrebbero essere anche manifestazioni di molte altre malattie.[81]
La maggior parte dei sintomi correlati alla mammella, tra cui la maggior parte dei noduli, non risultano poi essere indice di un tumore sottostante. Meno del 20% dei noduli, per esempio, sono cancerogeni[82] e le patologie mammarie benigne, quali mastiti e fibroadenoma della mammella sono le cause più comuni dei sintomi. Tuttavia, la comparsa di un nuovo sintomo deve essere presa seriamente in considerazione sia dal paziente sia dal medico, per via della possibilità di incorrere in un tumore alla mammella a qualsiasi età.[83]
Diagnosi[modifica | modifica wikitesto]
La maggior parte delle tipologie di tumore alla mammella sono facili da diagnosticare mediante l'analisi microscopica di un campione o tramite una biopsia della zona colpita. Vi sono, tuttavia, più rari tipi di tumore che richiedono esami di laboratorio specializzati.
I due metodi di screening più comunemente usati, esame fisico della mammella da parte di un fornitore di assistenza sanitaria e la mammografia, in grado di offrire una probabilità approssimativa che un nodulo è il cancro, e può anche rilevare alcune altre lesioni, come ad esempio una semplice cisti.[84] Quando questi gli esami non sono conclusivi, un operatore sanitario può rimuovere un campione del nodulo per l'analisi microscopica (una procedura nota come agoaspirato, o citologia agoaspirativa (FNAC: Fine Needle Aspiration Cytology) per arrivare a stabilire una diagnosi. La presenza nel prelievo di un liquido chiaro, rende il nodulo altamente improbabile di essere cancerogeno mentre un liquido sanguinoso può essere indice della presenza di cellule tumorali. L'esame fisico della mammella, la mammografia e il prelievo citologico, se utilizzate insieme, sono metodiche che possono permettere una diagnosi di tumore alla mammella con un buon grado di accuratezza.
Altre opzioni riguardanti la biopsia, possono includere una biopsia core eco-guidata o una biopsia con sistema di vuoto assistito[85], che sono entrambe procedure in cui viene rimossa una porzione del nodulo per essere analizzato. Molto spesso i risultati di un esame fisico da parte di un operatore sanitario, una mammografia e ulteriori test che possono essere eseguiti in circostanze particolari (come l'ecografia e la risonanza magnetica della mammella) sono sufficienti a giustificare una biopsia escissionale come metodo di trattamento diagnostico e primario definitivo.
-
Tessuto mammario umano asportato che mostra una densa superficie irregolare bianca stellata di 2 cm di diametro, all'interno del tessuto adiposo.
-
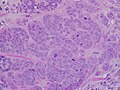
Carcinoma duttale invasivo di alto grado
-
Micrografia che mostra un linfonodo invaso da un carcinoma duttale.
-
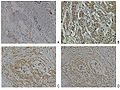
Espressione della neuropilina-2 nel tessuto normale e nel tessuto con carcinoma
Classificazione[modifica | modifica wikitesto]
Vi sono diversi sistemi di classificazione per il tumore alla mammella. Ognuna di queste può influenzare la prognosi e la risposta al trattamento. Una descrizione ottimale di una neoplasia alla mammella deve includere tutti questi fattori:

Classificazione istopatologica[modifica | modifica wikitesto]
Il cancro alla mammella in primo luogo è solitamente classificato per il suo aspetto istologico. La maggior parte dei tumori alla mammella sono derivati dall'epitelio di rivestimento dei dotti galattofori o dei lobuli e questi tumori sono classificati rispettivamente come duttali o lobulari. Per carcinoma in situ si intende la crescita di cellule cancerose o precancerose di basso grado all'interno di un compartimento tissutale particolare, come il dotto mammario, senza che vi sia una invasione dei tessuti circostanti. Al contrario, il carcinoma invasivo non si limita al compartimento tissutale iniziale.[86]
Grado[modifica | modifica wikitesto]
Questa classificazione confronta l'aspetto delle cellule tumorali della mammella con il tessuto mammario normale. Le cellule normali in un organo come la mammella si differenziano, il che significa che esse assumono forme e forme specifiche a seconda della loro funzione che rivestono nell'organo. Le cellule tumorali perdono tale differenziazione. Nel tumore, le cellule che normalmente si dovrebbero schierare in modo ordinato per formare i condotti del latte, diventano disorganizzate. La divisione cellulare diventa incontrollata. I nuclei delle cellule perdono di uniformità. I patologi descrivono le cellule come ben differenziate (basso grado), moderatamente differenziate (grado intermedio) e scarsamente differenziati (alto grado), a seconda di come le cellule perdono progressivamente le caratteristiche proprie delle cellule normali. Tumori scarsamente differenziati hanno una prognosi peggiore.
Stadiazione[modifica | modifica wikitesto]
La stadiazione del cancro della mammella utilizza il classificazione TNM che si basa sulle dimensioni del tumore (T), sulla sua diffusione ai linfonodi (N) ascellari e se vi è la presenza di metastasi (M), cioè la sua diffusione a una parte più lontana del corpo. Una dimensione più grande del tumore, la diffusione linfonodale e la presenza di metastasi, comporta un punteggio TNM elevato e una prognosi peggiore.
Le tappe principali sono:
- Stadio 0 è una condizione pre-cancerosa o marcatore, o il carcinoma duttale in situ o carcinoma lobulare in situ.
- Fasi 1-3 sono all'interno della mammella o linfonodi regionali.
- Fase 4 è il cancro 'metastatico' che ha una prognosi meno favorevole.
-
Stadio T1
-
Stadio T2
-
Stadio T3
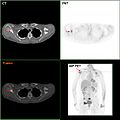
Se disponibili, gli studi di imaging biomedico possono essere utilizzati come parte del processo diagnostico nei casi selezionati per la ricerca di metastasi. Tuttavia, nei casi di tumore mammario con basso rischio di metastasi, i rischi associati alle scansioni PET, TAC o scintigrafia ossea, superano i possibili vantaggi, in quanto queste procedure espongono il paziente a una notevole quantità di radiazioni ionizzanti potenzialmente pericolose.[87][88]
| T Dimensioni |
N Coinvolgimento linfonodale |
M Metastasi | |||||
|---|---|---|---|---|---|---|---|
| T0 | Nessun tumore rilevabile | N0 | Nessuno | M0 | Non rilevabili | ||
| Tis | Carcinoma in situ, non invasivo | N1 | 1–3 nell'ascella | M1 | Rilevabili (per lo più al polmone, fegato e ossa) | ||
| T1 | fino a 2 cm | N2 | 4–9 nell'ascella | ||||
| T1mic | Microinvasione fino a 0,1 cm | N3 | 10 o più nell'ascella o al di sotto/sopra della clavicola | ||||
| T1a | >0,1 cm ma ≤ 0,5 cm | ||||||
| T1b | > 0,5 cm fino a 1 cm | ||||||
| T1c | > 1 cm fino a 2 cm | ||||||
| T2 | > 2 cm fino a 5 cm | ||||||
| T3 | > di 5 cm | ||||||
| T4 | Qualsiasi dimensione con estensione alla parete toracica o alla pelle | ||||||
-
Stadio 1A
-
Stadio 1B
-
Stadio 2A
-
Stadio 2A
-
Stadio 2B
-
Stadio 2B
-
Stadio 2B
-
Stadio 3A
-
Stadio 3A
-
Stadio 3A
-
Stadio 3B
-
Stadio 3B
-
Stadio 4
Analisi genomica[modifica | modifica wikitesto]
Le cellule del cancro alla mammella possiedono dei recettori sulla loro superficie, nel loro citoplasma e nel nucleo. Alcuni messaggeri chimici, come gli ormoni si legano ai recettori e questo provoca variazioni nella cellula. Le cellule del cancro al mammella possono avere o non avere tre recettori importanti: il recettore dell'estrogeno (ER), il recettore del progesterone (PR), e l'HER2/neu. Le cellule tumorali ER+ (cioè le cellule tumorali che hanno recettori per gli estrogeni) dipendono dagli estrogeni per la loro crescita; questo implica che esse possono essere colpite con farmaci che bloccano gli effetti degli estrogeni (ad esempio il tamoxifene) e generalmente la malattia ha una prognosi migliore. Senza trattamento, i tumori mammari HER2+ sono generalmente più aggressivi di quelli HER2-[89][90], tuttavia le cellule tumorali HER2 + rispondono ai farmaci, come l'anticorpo monoclonale trastuzumab (in combinazione con la chemioterapia convenzionale), e ciò ha migliorato in modo significativo la prognosi.[91] Le cellule prive di questi tre recettori vengono chiamate triplo-negative, anche se spesso esprimono recettori per altri ormoni, come il recettore degli androgeni e il recettore della prolattina.
Il test del DNA può essere di vario tipo, tra cui quello a microarray, e ha come obbiettivo il confronto tra le cellule normali e le cellule del carcinoma. Le specifiche modifiche, in un particolare per il cancro al mammella, possono essere usate per classificare il tumore in diversi modi e possono aiutare nella scelta del trattamento più efficace.
Trattamento[modifica | modifica wikitesto]
La scelta del trattamento del tumore alla mammella dipende da vari fattori, tra cui lo stadio della malattia e l'età del paziente. Trattamenti più aggressivi sono scelti quando la prognosi del paziente è non positiva e quando vi è un alto rischio di recidiva a seguito del trattamento.
La terapia standard rimane comunque l'intervento chirurgico, che può essere seguito da chemioterapia e/o radioterapia. Un approccio multidisciplinare è preferibile.[92] I tumori positivi per il recettore ormonale sono spesso trattati con la terapia del blocco ormonale per diversi anni. Gli anticorpi monoclonali, o altri trattamenti immuno-modulanti, possono essere prescritti in alcuni casi di metastasi e di altri stadi avanzati della malattia.
Chirurgia[modifica | modifica wikitesto]


L'approccio chirurgico consiste nella rimozione fisica del tumore, tipicamente insieme ad alcuni dei tessuti circostanti. Uno o più linfonodi possono essere sottoposte a biopsia durante l'intervento chirurgico. Viene sempre eseguito un esame del linfonodo sentinella.
Gli interventi chirurgici standard includono:
- Mastectomia: rimozione di tutta la mammella.
- Quadrantectomia: rimozione di un quarto della mammella.
- Lumpectomia: rimozione di una piccola parte della mammella.
Una volta che il tumore è stato rimosso, se la paziente lo desidera possibile ricorrere alla chirurgia della ricostruzione della mammella, un tipo di chirurgia plastica, al fine di migliorare l'aspetto estetico. In alternativa, le donne possono indossare sotto i vestiti delle protesi che simulino la presenza della mammella.
Trattamenti farmacologici[modifica | modifica wikitesto]
Il trattamento farmacologico utilizzato dopo e in aggiunta alla chirurgia viene chiamato terapia adiuvante. La chemioterapia o altri tipi di terapia prima dell'intervento sono chiamati terapia neoadiuvante.
Radioterapia[modifica | modifica wikitesto]
La radioterapia viene eseguita dopo l'intervento chirurgico per rimuovere eventuali cellule tumorali che sono sfuggite alla chirurgia sul letto tumorale e nei linfonodi regionali.[93][94] La radioterapia può essere eseguita mediante tecnica a fasci esterni o tramite brachiterapia (radioterapia interna). La radioterapia, convenzionalmente, viene eseguita dopo l'operazione chirurgica. Le radiazioni possono anche essere somministrate durante l'intervento chirurgico (radioterapia intraoperatoria). Il più grande studio randomizzato per testare questo approccio è stato il TAR-GIT-A Trial[95] che ha dimostrato che l'approccio radioterapico intraoperatorio aveva la stessa efficacia, a 4 anni, della classica radioterapia a fasci esterni.[96] La radioterapia solitamente è in grado di ridurre il rischio di recidiva dal 50% al 66%[97] ed è considerata essenziale quando l'intervento chirurgico sia stato non radicale (quadrantectomia o lumpectomia).
Crioablazione[modifica | modifica wikitesto]
Al 2014, la crioablazione era in fase di valutazione per poter essere un approccio sostitutivo della lumpectompia per i piccoli tumori[98] e si è dimostrata un'evidenza sperimentale nelle donne con neoplasie inferiori ai 2 centimetri.[99] Questa metodica può essere utilizzata anche per coloro per cui la chirurgia non è praticabile.[99] Ulteriori studi dimostrano che la crioablazione possa essere promettente per i tumori mammari in fase iniziale e di piccole dimensioni.[100]
Prognosi[modifica | modifica wikitesto]
Solitamente la prognosi viene formulata sulla probabilità di sopravvivenza senza progressione (PFS) o di sopravvivenza senza malattia (DFS). Queste previsioni si basano su serie storiche statistiche di casi con classificazione simile. Tuttavia la prognosi rimane una stima, in quanto ogni paziente avrà una storia a sé e le classificazioni non sempre sono precise. La sopravvivenza è solitamente espressa come un numero medio di mesi (o anni) in cui il 50% dei pazienti sopravvive o la percentuale di pazienti che sono vivi dopo 1, 5, 15, e 20 anni. La prognosi è importante per le decisioni riguardo al trattamento poiché ai pazienti con una buona prognosi solitamente vengono offerti trattamenti meno invasivi, come la lumpectomia e la radioterapia o la terapia ormonale, mentre a coloro che hanno una prognosi più negativa viene generalmente prescritto un trattamento più aggressivo, come una più ampia mastectomia e/o un ciclo chemioterapico.
Prevenzione[modifica | modifica wikitesto]
Il rischio di incorrere in un tumore alla mammella può essere ridotto mantenendo un peso corporeo corretto, riducendo il consumo di bevande alcoliche, praticando attività fisica e allattando alla mammella i propri figli.[101] Si stima che l'adozione di queste pratiche potrebbe ridurre del 38% i casi di questa neoplasia negli Stati Uniti, del 42% nel Regno Unito, del 28% in Brasile e del 20% in Cina.[101] I benefici di praticare una moderata attività fisica, come camminare a ritmo sostenuto, sono riscontrabili a tutte le età.[101][102] Gli acidi grassi omega-3 sembrano in grado di ridurre il rischio.[103]
La rimozione chirurgica preventiva di entrambe le mammelle, prima che una qualsiasi forma di tumore sia stato diagnosticato o qualsiasi nodulo o altra lesione sospetta siano apparsi (una procedura nota come mastectomia bilaterale profilattica) può essere presa in considerazione nelle persone con mutazioni dei geni BRCA1 e BRCA2.[104][105] Tuttavia non vi è una evidenza sufficientemente forte per sostenere questa procedura per chiunque ma solo in coloro ad alto rischio.[106] Il test BRCA è raccomandato nei pazienti con un rischio famigliare elevato. Esso non è tuttavia raccomandato di routine, ma solo dopo una consulenza genetica[107], ciò perché vi sono molte forme diverse di mutazioni dei geni BRCA, che vanno dai polimorfismi innocui alle pericolose mutazioni frame-shift. L'effetto della maggior parte dei cambiamenti identificabili nei geni è incerta. Al 2014, non vi sono studi che fanno chiarezza sui benefici della rimozione profilattica della mammella sana in coloro che hanno già avuto un tumore all'altra mammella.[106]
I modulatori selettivi del recettore degli estrogeni (come il tamoxifene) riducono il rischio di cancro al mammella, ma aumentano il rischio di tromboembolia e di carcinoma endometriale.[108][109] Essi non sono quindi consigliati per la prevenzione del tumore alla mammella nelle donne a rischio medio, ma possono essere prescritti per coloro che sono classificate ad alto rischio.[110] Il beneficio nella riduzione del cancro alla mammella si mantiene per almeno cinque anni dopo l'interruzione di un ciclo di trattamento eseguito con questi farmaci.[111]
Screening[modifica | modifica wikitesto]

Con screening per il tumore mammella, ci si riferisce ai test proposti alle altrimenti donne sane, nel tentativo di ottenere una eventuale diagnosi precoce, sotto l'ipotesi che essa migliorerà la prognosi. Un certo numero di test sono stati suggeriti, tra cui: l'esame clinico della mammella e l'auto-esame, la mammografia, lo screening genetico, l'ecografia e la risonanza magnetica.
Un esame clinico o autonomo della mammella comporta la palpazione dell'organo al fine di ricercare eventuali noduli o altre anomalie. L'esame clinico è svolto da personale sanitario, mentre l'auto-esame viene eseguito dalla persona stessa.[112] Tuttavia, le evidenze scientifiche non supportano pienamente l'efficacia di entrambi i tipi di esame.[7][113] La mammografia è un esame che utilizza i raggi X per esaminare il mammella per evidenziare eventuali masse inusuali o noduli. Durante l'esame la mammella viene compressa e vengono eseguite diverse proiezioni con diversa angolatura ed eventualmente con diversi ingrandimenti.[7][113]
Un certo numero di organismi sanitari nazionali raccomanda lo screening del cancro al mammella. Per una donna in condizioni nella media, la statunitense Preventive Services Task Force consiglia l'esame mammografico ogni due anni in coloro che hanno un'età compresa tra i 50 e i 74 anni[7], il Consiglio d'Europa la raccomanda biennalmente alle donne tra i 50 e i 69 anni[114] mentre in Canada lo screening è raccomandato a una età compresa tra i 50 e 74 anni e con una frequenza di 2 o 3 anni.[115] Si è evidenziato che, oltre al rischio di incorrere inutilmente all'intervento chirurgico, i rischi di mammografie più frequenti includono un piccolo, ma significativo, aumento di cancro alla mammella indotto dalle radiazioni ionizzanti, quali sono i raggi X.[116]
La Cochrane Collaboration nel 2013 ha affermato che non vi sono prove evidenti di qualità che dimostrino una riduzione dei casi di tumori né una riduzione della mortalità per tutte le cause a seguito dell'effettuazione della mammografia di screening.[5] Quando gli studi meno rigorosi vengono aggiunti all'analisi, si riscontra una riduzione della mortalità dovuta al cancro al mammella dello 0,05%.[5] Una proiezione a oltre 10 anni si traduce in un aumento del 30% nei tassi di eccesso di diagnosi e trattamento (da 3 a 14 per 1 000) e oltre la metà avrà almeno un test falsamente positivo.[5][117][118] Questo ha portato a ritenere non chiaro se lo screening mammografico sia positivo o negativo.[5][118] Lo studio della Cochrane afferma inoltre che, a causa dei recenti miglioramenti nel trattamento del tumore al mammella e il rischio di falsi positivi che portano a interventi non necessari, "pertanto non sembra ragionevole eseguire lo screening per il tumore della mammella" a qualsiasi età.[119] Inoltre, non è stato dimostrato che la risonanza magnetica come metodo di screening abbia maggiori vantaggi o svantaggi rispetto alla mammografia tradizionale.[120]
Il tumore alla mammella in gravidanza[modifica | modifica wikitesto]
I tumori alla mammella si verificano durante la gravidanza con la stessa probabilità rispetto alle donne non gravide. Nei 5-10 anni successivi al parto, il tumore alla mammella si verifica con maggiore frequenza, per poi diventare meno comune rispetto alla popolazione generale.[121] Questi tumori sono noti come "tumori alla mammella post-partum" e solitamente hanno una prognosi peggiore, tra cui un aumento del rischio di diffusione a distanza della malattia e della mortalità.[122] Tumori che si sviluppano durante o subito dopo la gravidanza appaiono approssimativamente con la stessa probabilità di altri tumori nelle donne della stessa età.[123]
La diagnosi di tumore in una donna incinta è difficile, in parte perché i sintomi possono essere scambiati per il normale disagio normale associato alla gravidanza.[123] Di conseguenza, il tumore viene generalmente scoperto in una fase leggermente più avanzata rispetto alla media. Alcuni esami di imaging biomedico, come la risonanza magnetica, tomografia computerizzata, ecografia, mammografia, con l'utilizzo di una schermatura fetale, sono considerati sicuri durante la gravidanza; altri, come le scansioni PET non lo sono.[123]
Il trattamento è in genere lo stesso sia per le donne gravide sia no.[123] Tuttavia, l'esposizione a radiazioni ionizzanti viene normalmente evitata durante la gravidanza, soprattutto se la dose al feto possa superare i 100 cGy. In alcuni casi, alcuni o tutti i trattamenti sono rinviati a dopo il parto. Il ricorso all'anticipazione della nascita per accelerare l'inizio del trattamento non è una soluzione infrequente. La chirurgia è generalmente considerata sicura durante la gravidanza, ma alcuni altri trattamenti, in particolare quelli che richiedono alcuni farmaci chemioterapici durante il primo trimestre, aumentano il rischio di difetti alla nascita e interruzioni di gravidanza (aborti spontanei e nati morti).[123] L'aborto elettivo non è necessario e non migliora la probabilità di sopravvivenza e di guarigione della madre.[123]
Trattamenti radioterapici possono interferire con la capacità della madre di allattare il suo bambino poiché viene ridotta la capacità di quella mammella a produrre latte e aumenta il rischio di mastite. Inoltre, quando la chemioterapia viene somministrata dopo la nascita, molti dei farmaci passano attraverso il latte materno verso il bambino, rischiando di provocargli dei danni.[123]
Per quanto riguarda la possibilità di una futura gravidanza tra le donne sopravvissute al tumore alla mammella, vi è spesso la paura di recidiva del tumore. D'altra parte, molti ancora considerano la gravidanza e la genitorialità una rappresentazione della normalità, della felicità e della soddisfazione di vita.[124]
Società e cultura[modifica | modifica wikitesto]
Prima del XX secolo, il tumore alla mammella veniva spesso nascosto e se ne parlava di rado, come se fosse una vergogna. Le donne spesso tendevano a soffrirne in silenzio, piuttosto che cercare una, seppur rudimentale, cura. Nel momento in cui la chirurgia riuscì a compiere dei passi in avanti e il tasso di sopravvivenza a lungo termine migliorò sensibilmente, le donne iniziarono a valutare la consapevolezza della malattia e la possibilità di successo di un trattamento. Il "Women's Field Army", promosso dall'American Society for the Control of Cancer (in seguito l'American Cancer Society) tra il 1930 e il 1940 è stata una delle prime campagne informative organizzate. Nel 1952, il primo gruppo di supporto, denominato "Reach to Recovery", iniziò a fornire assistenza post-mastectomia alle donne.[125]
Il "movimento del tumore alla mammella", fondato tra gli anni 1980 e 1990, si sviluppò dai più grandi movimenti femministi del XX secolo.[126] Questa serie di campagne politiche ed educative, in parte ispirate alle campagne di sensibilizzazione all'AIDS, ebbero un risultato politico e sociale efficace, portando a una diffusa richiesta di un secondo parere prima della chirurgia, allo sviluppo di procedure chirurgiche meno invasive, alla creazione di gruppi di sostegno e di altri progressi nella cura della malattia.[127]
Nastro rosa[modifica | modifica wikitesto]

Un nastro rosa è il simbolo più importante per la consapevolezza del tumore alla mammella e talvolta vengono venduti durante le raccolte di fondi. Essi possono essere indossati per onorare coloro che soffrono di tale condizione o per identificare i prodotti dedicati ai consumatori che ne sono interessati, solitamente donne istruite, di mezza età, di classe media e superiore.[128]
Il nastro rosa è associato alla generosità individuale, alla fede nel progresso scientifico e a un atteggiamento proattivo. Esso incoraggia i consumatori a concentrarsi sulla visione di una possibile futura cura per il tumore alla mammella, piuttosto che sul percorso tra le attuali conoscenze e le eventuali cure future.[129]
Indossare o esporre un nastro rosa è stato tuttavia oggetto di critica da parte di alcuni oppositori, che la ritengono una sorta di pigro attivismo, poiché non ha alcun effetto pratico positivo. È stata anche criticata come azione di ipocrisia poiché alcune persone indossano il nastro rosa al fine di mostrare buona volontà verso le donne il tumore ma poi si oppongono verso gli obiettivi pratici, come i diritti dei pazienti e la legislazione anti-inquinamento.[130][131] I critici affermano anche che l'enfasi verso il nastro rosa distrae la società verso la mancanza di progressi in materia di prevenzione e sulla cura del tumore alla mammella.[132] È stato anche criticato secondo l'opinione che possa rafforzare gli stereotipi sessisti e oggettivare le donne e le loro mammelle.[133]
Stato della ricerca[modifica | modifica wikitesto]
I vari trattamenti attualmente proposti sono costantemente oggetto di valutazioni in studi randomizzati e controllati al fine di confrontare i singoli farmaci, le combinazioni farmacologiche e le tecniche chirurgiche e radioterapiche. La ricerca include sperimentazioni su nuovi tipi di terapia mirata e vaccini anti cancro.
Il fenretinide, un retinoide (farmaci legati alla vitamina A), è in fase di studio come un modo per ridurre il rischio di tumore alla mammella.[134][135]
Note[modifica | modifica wikitesto]
- ^ Breast Cancer, su NCI. URL consultato il 29 giugno 2014.
- ^ a b c d e Breast Cancer Treatment (PDQ®), su NCI, 23 maggio 2014. URL consultato il 29 giugno 2014.
- ^ Christobel Saunders e Sunil Jassal, Breast cancer, 1. ed., Oxford, Oxford University Press, 2009, p. Chapter 13, ISBN 978-0-19-955869-8.
- ^ a b c d e World Cancer Report 2014, World Health Organization, 2014, pp. Chapter 5.2, ISBN 92-832-0429-8.
- ^ a b c d e Gøtzsche PC, Jørgensen KJ, Screening for breast cancer with mammography., in The Cochrane database of systematic reviews, vol. 6, 4 giugno 2013, pp. CD001877, DOI:10.1002/14651858.CD001877.pub5, PMID 23737396.
- ^ HD Nelson, K Tyne, A Naik, C Bougatsos, B Chan, P Nygren e L Humphrey, Screening for Breast Cancer: Systematic Evidence Review Update for the US Preventive Services Task Force [Internet]., novembre 2009, PMID 20722173.
- ^ a b c d Screening for Breast Cancer, su US Preventative Services Task Force, dicembre 2009. URL consultato il 24 dicembre 2012 (archiviato dall'url originale il 2 gennaio 2013).
- ^ S Santamaria, MC Gagliani, G Bellese, S Marconi, C Aiello, Tagliatti, P Castagnola e K Cortese, Imaging of Endocytic Trafficking and Extracellular Vesicles Released Under Neratinib Treatment in ERBB2 + Breast Cancer Cells, in J Histochem Cytochem, 2021, DOI:10.1369/00221554211026297, PMID 34126793.
- ^ Breast Cancer Treatment (PDQ®), su NCI, 26 giugno 2014. URL consultato il 29 giugno 2014.
- ^ a b World Cancer Report (PDF), su iarc.fr, International Agency for Research on Cancer, 2008. URL consultato il 26 febbraio 2011 (archiviato dall'url originale il 20 luglio 2011).
- ^ Cancer Survival in England: Patients Diagnosed 2007–2011 and Followed up to 2012 (PDF), su Office for National Statistics, 29 ottobre 2013. URL consultato il 29 giugno 2014.
- ^ SEER Stat Fact Sheets: Breast Cancer, su NCI. URL consultato il 18 giugno 2014.
- ^ a b World Cancer Report 2014, World Health Organization, 2014, pp. Chapter 1.1, ISBN 92-832-0429-8.
- ^ Male Breast Cancer Treatment, su cancer.gov, National Cancer Institute, 2014. URL consultato il 29 giugno 2014.
- ^ a b c James Stuart Olson, Bathsheba's breast: women, cancer & history, Baltimore, The Johns Hopkins University Press, 2002, pp. 9.–13, ISBN 0-8018-6936-6.
- ^ The History of Cancer, su American Cancer Society, 25 marzo 2002. URL consultato il 9 ottobre 2006 (archiviato dall'url originale il 9 ottobre 2006).
- ^ a b Olson, 2002, pp. 32–33.
- ^ Yalom, Marilyn, A history of the breast, New York, Alfred A. Knopf, 1997, p. 234., ISBN 0-679-43459-3.
- ^ a b c d Aronowitz, Robert A., Unnatural history: breast cancer and American society, Cambridge, UK, Cambridge University Press, 2007, pp. 22.–24, ISBN 0-521-82249-1.
- ^ History of Breast Cancer, su randomhistory.com, Random History, 27 febbraio 2008. URL consultato l'8 maggio 2010 (archiviato dall'url originale il 30 luglio 2010).
- ^ a b Olson, pp. 102–6.
- ^ Marc Lacroix, A Concise History of Breast Cancer, USA, Nova Science Publishers, 2011, pp. 59-68, ISBN 978-1-61122-305-7.
- ^ WHO Disease and injury country estimates, su World Health Organization, 2009. URL consultato l'11 novembre 2009.
- ^ a b c World Cancer Report, su globocan.iarc.fr, International Agency for Research on Cancer, 2008. URL consultato il 26 febbraio 2011 (archiviato dall'url originale il 14 gennaio 2011).
- ^ Breast cancer: prevention and control, su World Health Organization (archiviato dall'url originale il 6 settembre 2015).
- ^ World Cancer Report 2014, International Agency for Research on Cancer, World Health Organization, 2014, ISBN 978-92-832-0432-9.
- ^ Stewart B. W. and Kleihues P. (Eds): World Cancer Report. IARCPress. Lyon 2003.
- ^ Jeremy Laurance, Breast cancer cases rise 80% since Seventies, in The Independent, London, 29 settembre 2006. URL consultato il 9 ottobre 2006.
- ^ Breast Cancer: Statistics on Incidence, Survival, and Screening, su imaginis.com, 2006. URL consultato il 9 ottobre 2006.
- ^ Template:Cita wb
- ^ Nearly 85% of women diagnosed with breast cancer now survive for 5 year or more. Office for National Statistics, 2013
- ^ La mammella maschile (ginecomastia- carcinoma- patologia mammaria).
- ^ Perkins CI, Hotes J, Kohler BA, Howe HL, Association between breast cancer laterality and tumor location, United States, 1994-1998, in Cancer Causes Control, vol. 15, n. 7, settembre 2004, pp. 637-45, DOI:10.1023/B:CACO.0000036171.44162.5f, PMID 15280621.
- ^ Weiss HA, Devesa SS, Brinton LA, Laterality of breast cancer in the United States, in Cancer Causes Control, vol. 7, n. 5, settembre 1996, pp. 539-43, PMID 8877052.
- ^ Ekbom A, Adami HO, Trichopoulos D, Lambe M, Hsieh CC, Pontén J, Epidemiologic correlates of breast cancer laterality (Sweden), in Cancer Causes Control, vol. 5, n. 6, novembre 1994, pp. 510-6, PMID 7827237.
- ^ Roychoudhuri R, Putcha V, Møller H, Cancer and laterality: a study of the five major paired organs (UK), in Cancer Causes Control, vol. 17, n. 5, giugno 2006, pp. 655-62, DOI:10.1007/s10552-005-0615-9, PMID 16633912.
- ^ Reeder JG, Vogel VG, Breast cancer prevention., in Cancer treatment and research, vol. 141, 2008, pp. 149-64, DOI:10.1007/978-0-387-73161-2_10, PMID 18274088.
- ^ Am I at risk?, su breastcancercare.org.uk, Breast Cancer Care. URL consultato il 22 ottobre 2013 (archiviato dall'url originale il 25 ottobre 2013).
- ^ Collaborative Group on Hormonal Factors in Breast Cancer, Breast cancer and breastfeeding: collaborative reanalysis of individual data from 47 epidemiological studies in 30 countries, including 50302 women with breast cancer and 96973 women without the disease., in Lancet, vol. 360, n. 9328, agosto 2002, pp. 187-95, DOI:10.1016/S0140-6736(02)09454-0, PMID 12133652.
- ^ Yager JD, Davidson NE, Estrogen carcinogenesis in breast cancer, in New Engl J Med, vol. 354, n. 3, 2006, pp. 270-82, DOI:10.1056/NEJMra050776, PMID 16421368.
- ^ Santoro, E., DeSoto, M., and Hong Lee, J, Hormone Therapy and Menopause, su center4research.org, National Research Center for Women & Families, febbraio 2009. URL consultato il 20 novembre 2014 (archiviato dall'url originale il 12 luglio 2013).
- ^ Light Pollution as new risk factor for human Breast and Prostate Cancers- Haim, Abraham; Portnov, Biris P. ,2013, ISBN 978-94-007-6220-6
- ^ a b Johnson KC, Miller AB, Collishaw NE, Palmer JR, Hammond SK, Salmon AG, Cantor KP, Miller MD, Boyd NF, Millar J, Turcotte F, Active smoking and secondhand smoke increase breast cancer risk: the report of the Canadian Expert Panel on Tobacco Smoke and Breast Cancer Risk (2009)., in Tobacco control, vol. 20, n. 1, Jan 2011, pp. e2, DOI:10.1136/tc.2010.035931, PMID 21148114.
- ^ Lee IM, Shiroma EJ, Lobelo F, Puska P, Blair SN, Katzmarzyk PT, Effect of physical inactivity on major non-communicable diseases worldwide: an analysis of burden of disease and life expectancy, in The Lancet, vol. 380, n. 9838, 1º luglio 2012, pp. 219-29, DOI:10.1016/S0140-6736(12)61031-9, PMC 3645500, PMID 22818936.
- ^ Kahlenborn C, Modugno F, Potter DM, Severs WB, Oral contraceptive use as a risk factor for premenopausal breast cancer: a meta-analysis., in Mayo Clinic proceedings. Mayo Clinic, vol. 81, n. 10, Oct 2006, pp. 1290-302, DOI:10.4065/81.10.1290, PMID 17036554.
- ^ Veljković M, Veljković S, [The risk of breast cervical, endometrial and ovarian cancer in oral contraceptive users]., in Medicinski pregled, vol. 63, 9–10, Sep 2010, pp. 657-61, DOI:10.2298/mpns1010657v, PMID 21446095.
- ^ Casey PM, Cerhan JR, Pruthi S, Oral contraceptive use and risk of breast cancer., in Mayo Clinic proceedings. Mayo Clinic, vol. 83, n. 1, gennaio 2008, pp. 86–90; quiz 90–1, DOI:10.4065/83.1.86, PMID 18174010.
- ^ Beral V, Bull D, Doll R, Peto R, Reeves G, Breast cancer and abortion: collaborative reanalysis of data from 53 epidemiological studies, including 83?000 women with breast cancer from 16 countries., in Lancet, vol. 363, n. 9414, 27 marzo 2004, pp. 1007-16, DOI:10.1016/S0140-6736(04)15835-2, PMID 15051280.
- ^ Yang L, Jacobsen KH, A systematic review of the association between breastfeeding and breast cancer., in Journal of women's health (2002), vol. 17, n. 10, dicembre 2008, pp. 1635-45, DOI:10.1089/jwh.2008.0917, PMID 19049358.
- ^ Russo J, Russo IH, Susceptibility of the mammary gland to carcinogenesis. II. Pregnancy interruption as a risk factor in tumor incidence, in Am J Pathol, vol. 100, n. 2, 1980, pp. 505-506, PMC 1903536, PMID 6773421.«In contrast, abortion is associated with increased risk of carcinomas of the breast. The explanation for these epidemiologic findings is not known, but the parallelism between the DMBA-induced rat mammary carcinoma model and the human situation is striking. ... Abortion would interrupt this process, leaving in the gland undifferentiated structures like those observed in the rat mammary gland, which could render the gland again susceptible to carcinogenesis.»
- ^ Iodice S, Barile M, Rotmensz N, Feroce I, Bonanni B, Radice P, Bernard L, Maisonneuve P, Gandini S, Oral contraceptive use and breast or ovarian cancer risk in BRCA1/2 carriers: a meta-analysis., in European journal of cancer (Oxford, England : 1990), vol. 46, n. 12, agosto 2010, pp. 2275-84, DOI:10.1016/j.ejca.2010.04.018, PMID 20537530.
- ^ Gaffield ME, Culwell KR, Ravi A, Oral contraceptives and family history of breast cancer., in Contraception, vol. 80, n. 4, ottobre 2009, pp. 372-80, DOI:10.1016/j.contraception.2009.04.010, PMID 19751860.
- ^ Blackburn GL, Wang KA, Dietary fat reduction and breast cancer outcome: results from the Women's Intervention Nutrition Study (WINS)., in The American journal of clinical nutrition, vol. 86, n. 3, settembre 2007, pp. s878–81, PMID 18265482.
- ^ Boffetta P, Hashibe M, La Vecchia C, Zatonski W, Rehm J, The burden of cancer attributable to alcohol drinking, in International Journal of Cancer, vol. 119, n. 4, agosto 2006, pp. 884-7, DOI:10.1002/ijc.21903, PMID 16557583.
- ^ BBC report Weight link to breast cancer risk.
- ^ Kaiser J, Cancer. Cholesterol forges link between obesity and breast cancer., in Science, vol. 342, n. 6162, 29 novembre 2013, p. 1028, DOI:10.1126/science.342.6162.1028, PMID 24288308.
- ^ Aceves C, Anguiano B, Delgado G, Is iodine a gatekeeper of the integrity of the mammary gland?, in Journal of Mammary Gland Biology and Neoplasia, vol. 10, n. 2, aprile 2005, pp. 189-96, DOI:10.1007/s10911-005-5401-5, PMID 16025225.
- ^ American Cancer Society, Breast Cancer Facts & Figures 2005–2006 (PDF), su cancer.org, 2005. URL consultato il 26 aprile 2007 (archiviato dall'url originale il 13 giugno 2007).
- ^ Wang XS, Armstrong ME, Cairns BJ, Key TJ, Travis RC, Shift work and chronic disease: the epidemiological evidence., in Occupational medicine (Oxford, England), vol. 61, n. 2, marzo 2011, pp. 78-89, DOI:10.1093/occmed/kqr001, PMC 3045028, PMID 21355031.
- ^ Brody JG, Rudel RA, Michels KB, Moysich KB, Bernstein L, Attfield KR, Gray S, Environmental pollutants, diet, physical activity, body size, and breast cancer: where do we stand in research to identify opportunities for prevention?, in Cancer, vol. 109, 12 Suppl, giugno 2007, pp. 2627-34, DOI:10.1002/cncr.22656, PMID 17503444.
- ^ Roberto Ferro, Pesticides and Breast Cancer, in Advances in Breast Cancer Research, vol. 01, n. 03, 1º gennaio 2012, pp. 30-35, DOI:10.4236/abcr.2012.13005.
- ^ Hendrick RE, Radiation doses and cancer risks from breast imaging studies., in Radiology, vol. 257, n. 1, ottobre 2010, pp. 246-53, DOI:10.1148/radiol.10100570, PMID 20736332.
- ^ a b c Boris Pasche, Cancer Genetics (Cancer Treatment and Research), Berlin, Springer, 2010, pp. 19.-20, ISBN 1-4419-6032-5.
- ^ a b c Gage M, Wattendorf D, Henry LR, Translational advances regarding hereditary breast cancer syndromes, in Journal of surgical oncology, vol. 105, n. 5, 1º aprile 2012, pp. 444-51, DOI:10.1002/jso.21856, PMID 22441895.
- ^ Familial breast cancer: collaborative reanalysis of individual data from 52 epidemiological studies including 58,209 women with breast cancer and 101,986 women without the disease., in Lancet, vol. 358, n. 9291, 27 ottobre 2001, pp. 1389-99, DOI:10.1016/S0140-6736(01)06524-2, PMID 11705483.
- ^ Nelson HD, Zakher B, Cantor A, Fu R, Griffin J, O'Meara ES, Buist DS, Kerlikowske K, van Ravesteyn NT, Trentham-Dietz A, Mandelblatt JS, Miglioretti DL, Risk factors for breast cancer for women aged 40 to 49 years: a systematic review and meta-analysis., in Annals of Internal Medicine, vol. 156, n. 9, 1º maggio 2012, pp. 635-48, DOI:10.1059/0003-4819-156-9-201205010-00006, PMC 3561467, PMID 22547473.
- ^ Gina Kolata, Genetic Study Finds 4 Distinct Variations of Breast Cancer, in The New York Times, 23 settembre 2012. URL consultato il 23 settembre 2012.
- ^ Understanding Breast Changes – National Cancer Institute, su cancer.gov (archiviato dall'url originale il 27 maggio 2010).
- ^ Lobular carcinoma in situ: Marker for breast cancer risk, su mayoclinic.com.
- ^ Breast Cancer Treatment, su cancer.gov, National Cancer Institute.
- ^ Afonso N, Bouwman D, Lobular carcinoma in situ, in Eur. J. Cancer Prev., vol. 17, n. 4, agosto 2008, pp. 312-6, DOI:10.1097/CEJ.0b013e3282f75e5d, PMID 18562954.
- ^ Anothaisintawee T, Wiratkapun C, Lerdsitthichai P, Kasamesup V, Wongwaisayawan S, Srinakarin J, Hirunpat S, Woodtichartpreecha P, Boonlikit S, Teerawattananon Y, Thakkinstian A, Risk factors of breast cancer: a systematic review and meta-analysis, in Asian Pacific Journal of Public Health, vol. 25, n. 5, 2013, pp. 368-387, DOI:10.1177/1010539513488795, PMID 23709491.
- ^ McNaught J, Reid RL, Provencher DM, Progesterone-only and non-hormonal contraception in the breast cancer survivor: Joint Review and Committee Opinion of the Society of Obstetricians and Gynaecologists of Canada and the Society of Gynecologic Oncologists of Canada, in J Obstet Gynaecol Can, vol. 28, n. 7, luglio 2006, pp. 616-39, PMID 16924781.
- ^ Management of the menopause after breast cancer (archiviato dall'url originale il 7 aprile 2016)., from The Royal Australian and New Zealand College of Obstetricians and Gynaecologists. College Statement C-Gyn 15. 1st Endorsed: February 2003. Current: November 2011. Review: November 2014
- ^ a b c d Merck Manual of Diagnosis and Therapy, Breast Disorders: Breast Cancer, su merckmanuals.com, febbraio 2003. URL consultato il 5 febbraio 2008.
- ^ a b American Cancer Society, Cancer Facts & Figures 2007 (PDF), su cancer.org, 2007. URL consultato il 26 aprile 2007 (archiviato dall'url originale il 10 aprile 2007).
- ^ Watson M, Assessment of suspected cancer, in InnoAiT, vol. 1, n. 2, 2008, pp. 94-107, DOI:10.1093/innovait/inn001.
- ^ eMedicine, Breast Cancer Evaluation, su emedicine.com, 23 agosto 2006. URL consultato il 5 febbraio 2008 (archiviato dall'url originale il 12 febbraio 2008).
- ^ National Cancer Institute, Paget's Disease of the Nipple: Questions and Answers, su cancer.gov, 27 giugno 2005. URL consultato il 6 febbraio 2008.
- ^ Lacroix M, Significance, detection and markers of disseminated breast cancer cells, in Endocrine-related Cancer, vol. 13, n. 4, dicembre 2006, pp. 1033-67, DOI:10.1677/ERC-06-0001, PMID 17158753.
- ^ National Cancer Institute, Metastatic Cancer: Questions and Answers, su cancer.gov, 1º settembre 2004. URL consultato il 6 febbraio 2008 (archiviato dall'url originale il 27 agosto 2008).
- ^ [executive publisher, Judith A. Shilling McCann], Nursing., Ambler, PA, Lippincott Williams & Wilkins, 2008, p. 99, ISBN 978-1-58255-668-0.
- ^ Merck Manual of Diagnosis and Therapy, Breast Disorders: Overview of Breast Disorders, su merckmanuals.com, febbraio 2003. URL consultato il 5 febbraio 2008 (archiviato dall'url originale il 3 ottobre 2011).
- ^ Saslow D, Hannan J, Osuch J, Alciati MH, Baines C, Barton M, Bobo JK, Coleman C, Dolan M, Gaumer G, Kopans D, Kutner S, Lane DS, Lawson H, Meissner H, Moorman C, Pennypacker H, Pierce P, Sciandra E, Smith R, Coates R, Clinical breast examination: practical recommendations for optimizing performance and reporting, in CA: a cancer journal for clinicians, vol. 54, n. 6, 2004, pp. 327-344, DOI:10.3322/canjclin.54.6.327, PMID 15537576.
- ^ Yu YH, Liang C, Yuan XZ, Diagnostic value of vacuum-assisted breast biopsy for breast carcinoma: a meta-analysis and systematic review., in Breast cancer research and treatment, vol. 120, n. 2, 2010, pp. 469-79, DOI:10.1007/s10549-010-0750-1, PMID 20130983.
- ^ Merck Manual, Professional Edition., Ch. 253, Breast Cancer.
- ^ American Society of Clinical Oncology, Five Things Physicians and Patients Should Question (PDF), in Choosing Wisely: an initiative of the ABIM Foundation, American Society of Clinical Oncology. URL consultato il 14 agosto 2012 (archiviato dall'url originale il 31 luglio 2012).
- ^ Carlson RW, Allred DC, Anderson BO, Burstein HJ, Carter WB, Edge SB, Erban JK, Farrar WB, Goldstein LJ, Gradishar WJ, Hayes DF, Hudis CA, Jahanzeb M, Kiel K, Ljung BM, Marcom PK, Mayer IA, McCormick B, Nabell LM, Pierce LJ, Reed EC, Smith ML, Somlo G, Theriault RL, Topham NS, Ward JH, Winer EP, Wolff AC, Breast cancer. Clinical practice guidelines in oncology, in Journal of the National Comprehensive Cancer Network : JNCCN, vol. 7, n. 2, 2009, pp. 122-192, PMID 19200416.
- ^ Vinay Kumar e Abul Abbas, Robbins and Cotran Pathologic Basis of Disease, Philadelphia, Saunders, an imprint of Elsevier inc., 2010, p. 1090, ISBN 978-1-4160-3121-5.
- ^ Sotiriou C, Pusztai L, Gene-expression signatures in breast cancer, in N. Engl. J. Med., vol. 360, n. 8, febbraio 2009, pp. 790-800, DOI:10.1056/NEJMra0801289, PMID 19228622.
- ^ Romond EH, Perez EA, Bryant J, Suman VJ, Geyer CE, Davidson NE, Tan-Chiu E, Martino S, Paik S, Kaufman PA, Swain SM, Pisansky TM, Fehrenbacher L, Kutteh LA, Vogel VG, Visscher DW, Yothers G, Jenkins RB, Brown AM, Dakhil SR, Mamounas EP, Lingle WL, Klein PM, Ingle JN, Wolmark N, Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer, in N. Engl. J. Med., vol. 353, n. 16, ottobre 2005, pp. 1673-84, DOI:10.1056/NEJMoa052122, PMID 16236738.
- ^ Saini KS, Taylor C, Ramirez AJ, Palmieri C, Gunnarsson U, Schmoll HJ, Dolci SM, Ghenne C, Metzger-Filho O, Skrzypski M, Paesmans M, Ameye L, Piccart-Gebhart MJ, de Azambuja E, Role of the multidisciplinary team in breast cancer management: results from a large international survey involving 39 countries, in Annals of Oncology, vol. 23, n. 4, agosto 2011, pp. 853-9, DOI:10.1093/annonc/mdr352, PMID 21821551.
- ^ Massarut S, Baldassare G, Belleti B, Reccanello S, D'Andrea S, Ezio C, Perin T, Roncadin M, Vaidya JS, Intraoperative radiotherapy impairs breast cancer cell motility induced by surgical wound fluid, in J Clin Oncol, vol. 24, 18S, 2006, p. 10611. URL consultato il 30 dicembre 2014 (archiviato dall'url originale il 12 gennaio 2012).
- ^ Belletti B, Vaidya JS, D'Andrea S, Entschladen F, Roncadin M, Lovat F, Berton S, Perin T, Candiani E, Reccanello S, Veronesi A, Canzonieri V, Trovò MG, Zaenker KS, Colombatti A, Baldassarre G, Massarut S, Targeted intraoperative radiotherapy impairs the stimulation of breast cancer cell proliferation and invasion caused by surgical wounding, in Clin. Cancer Res., vol. 14, n. 5, marzo 2008, pp. 1325-32, DOI:10.1158/1078-0432.CCR-07-4453, PMID 18316551.
- ^ http://www.targit.org.uk/
- ^ Vaidya JS, Joseph DJ, Tobias JS, Bulsara M, Wenz F, Saunders C, Alvarado M, Flyger HL, Massarut S, Eiermann W, Keshtgar M, Dewar J, Kraus-Tiefenbacher U, Sütterlin M, Esserman L, Holtveg HM, Roncadin M, Pigorsch S, Metaxas M, Falzon M, Matthews A, Corica T, Williams NR, Baum M, Targeted intraoperative radiotherapy versus whole breast radiotherapy for breast cancer (TARGIT-A trial): an international, prospective, randomised, non-inferiority phase 3 trial, in Lancet, vol. 376, n. 9735, luglio 2010, pp. 91-102, DOI:10.1016/S0140-6736(10)60837-9, PMID 20570343.
- ^ Breast cancer.org Treatment Options.
- ^ MS Sabel, Nonsurgical ablation of breast cancer: future options for small breast tumors., in Surgical oncology clinics of North America, vol. 23, n. 3, luglio 2014, pp. 593-608, PMID 24882353.
- ^ a b MA Roubidoux, W Yang e RJ Stafford, Image-guided ablation in breast cancer treatment., in Techniques in vascular and interventional radiology, vol. 17, n. 1, marzo 2014, pp. 49-54, PMID 24636331.
- ^ Current Status of Imaging-Guided Percutaneous Ablation of Breast Cancer, vol. 203, n. 2, agosto 2014, pp. 442-448, DOI:10.2214/AJR.13.11600.
- ^ a b c (NE) Food, Nutrition, Physical Activity and the Prevention of Cancer: a Global Perspective, su dietandcancerreport.org, American Institute for Cancer Research/World Cancer Research Fund. URL consultato il 25 novembre 2014.
- ^ Eliassen AH, Hankinson SE, Rosner B, Holmes MD, Willett WC, Physical activity and risk of breast cancer among postmenopausal women, in Arch. Intern. Med., vol. 170, n. 19, ottobre 2010, pp. 1758-64, DOI:10.1001/archinternmed.2010.363, PMC 3142573, PMID 20975025.
- ^ Zheng JS, Hu XJ, Zhao YM, Yang J, Li D, Intake of fish and marine n-3 polyunsaturated fatty acids and risk of breast cancer: meta-analysis of data from 21 independent prospective cohort studies, in BMJ, vol. 346, 2013, pp. f3706, DOI:10.1136/bmj.f3706, PMID 23814120.
- ^ Hartmann LC, Schaid DJ, Woods JE, Crotty TP, Myers JL, Arnold PG, Petty PM, Sellers TA, Johnson JL, McDonnell SK, Frost MH, Jenkins RB, Efficacy of bilateral prophylactic mastectomy in women with a family history of breast cancer, in N Engl J Med, vol. 340, n. 2, 1999, pp. 77-84, DOI:10.1056/NEJM199901143400201, PMID 9887158.
- ^ Meijers-Heijboer H, van Geel B, van Putten WL, Henzen-Logmans SC, Seynaeve C, Menke-Pluymers MB, Bartels CC, Verhoog LC, van den Ouweland AM, Niermeijer MF, Brekelmans CT, Klijn JG, Breast cancer after prophylactic bilateral mastectomy in women with BRCA1 and BRCA2 mutations, in N Engl J Med, vol. 345, n. 3, 2001, pp. 159-164, DOI:10.1056/NEJM200107193450301, PMID 11463009.
- ^ a b L Lostumbo, NE Carbine e J Wallace, Prophylactic mastectomy for the prevention of breast cancer., in The Cochrane database of systematic reviews, n. 11, 10 novembre 2010, pp. CD002748, DOI:10.1002/14651858.CD002748.pub3, PMID 21069671.
- ^ Risk Assessment, Genetic Counseling, and Genetic Testing for BRCA-Related Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement, in Annals of Internal Medicine, 24 dicembre 2013, DOI:10.7326/M13-2747.
- ^ Nelson HD, Smith ME, Griffin JC, Fu R, Use of medications to reduce risk for primary breast cancer: a systematic review for the U.S. Preventive Services Task Force., in Annals of Internal Medicine, vol. 158, n. 8, 16 aprile 2013, pp. 604-14, DOI:10.7326/0003-4819-158-8-201304160-00005, PMID 23588749.
- ^ Cuzick J, Sestak I, Bonanni B, Costantino JP, Cummings S, DeCensi A, Dowsett M, Forbes JF, Ford L, LaCroix AZ, Mershon J, Mitlak BH, Powles T, Veronesi U, Vogel V, Wickerham DL, Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data., in Lancet, vol. 381, n. 9880, 25 maggio 2013, pp. 1827-34, DOI:10.1016/S0140-6736(13)60140-3, PMID 23639488.
- ^ Moyer VA, Medications for Risk Reduction of Primary Breast Cancer in Women: U.S. Preventive Services Task Force Recommendation Statement., in Annals of Internal Medicine, 24 settembre 2013, DOI:10.7326/0003-4819-159-10-201311190-00718, PMID 24061472.
- ^ Cuzick J, Sestak I, Bonanni B, Costantino JP, Cummings S, DeCensi A, Dowsett M, Forbes JF, Ford L, LaCroix AZ, Mershon J, Mitlak BH, Powles T, Veronesi U, Vogel V, Wickerham DL, Selective oestrogen receptor modulators in prevention of breast cancer: an updated meta-analysis of individual participant data, in The Lancet, vol. 381, n. 9880, 31 marzo 2013, pp. 1827-34, DOI:10.1016/S0140-6736(13)60140-3, PMID 23639488.
- ^ Screening, su Centers for Disease Control and Prevention.
- ^ a b Kösters JP, Gøtzsche PC, Cochrane Database of Systematic Reviews, in Cochrane Database Syst Rev, n. 2, 2003, pp. CD003373, DOI:10.1002/14651858.CD003373, PMID 12804462.
- ^ Biesheuvel C, Weigel S, Heindel W, Mammography Screening: Evidence, History and Current Practice in Germany and Other European Countries., in Breast care (Basel, Switzerland), vol. 6, n. 2, 2011, pp. 104-109, DOI:10.1159/000327493, PMID 21673820.
- ^ Tonelli M, Connor Gorber S, Joffres M, Dickinson J, Singh H, Lewin G, Birtwhistle R, Fitzpatrick-Lewis D, Hodgson N, Ciliska D, Gauld M, Liu YY, Recommendations on screening for breast cancer in average-risk women aged 40–74 years., in CMAJ : Canadian Medical Association journal = journal de l'Association medicale canadienne, vol. 183, n. 17, 22 novembre 2011, pp. 1991-2001, DOI:10.1503/cmaj.110334, PMC 3225421, PMID 22106103.
- ^ Breast Cancer: Screening, su United States Preventive Services Task Force.
- ^ Welch HG, Passow HJ, Quantifying the Benefits and Harms of Screening Mammography., in JAMA internal medicine, vol. 174, n. 3, 30 dicembre 2013, pp. 448-54, DOI:10.1001/jamainternmed.2013.13635, PMID 24380095.
- ^ a b Gøtzsche PC, Nielsen M, Screening for breast cancer with mammography, in Cochrane Database Syst Rev, n. 1, 2011, pp. CD001877, DOI:10.1002/14651858.CD001877.pub4, PMID 21249649.
- ^ Welcome | Cochrane Nordic, su cochrane.dk. URL consultato il 25 novembre 2014 (archiviato dall'url originale il 4 ottobre 2013).
- ^ Screening for breast cancer: U.S. Preventive Services Task Force recommendation statement., in Annals of internal medicine, vol. 151, n. 10, 17 novembre 2009, pp. 716–26, W–236, DOI:10.1059/0003-4819-151-10-200911170-00008, PMID 19920272. URL consultato il 20 novembre 2014 (archiviato dall'url originale il 2 gennaio 2013).
- ^ Jr Azim HA, L Santoro, W Russell-Edu, G Pentheroudakis, N Pavlidis e FA Peccatori, Prognosis of pregnancy-associated breast cancer: a meta-analysis of 30 studies., in Cancer treatment reviews, vol. 38, n. 7, novembre 2012, pp. 834-42, PMID 22785217.
- ^ P Schedin, Pregnancy-associated breast cancer and metastasis., in Nature reviews. Cancer, vol. 6, n. 4, aprile 2006, pp. 281-91, PMID 16557280.
- ^ a b c d e f g Connie Henke Yarbro, Debra Wujcik, Barbara Holmes Gobel (a cura di), Cancer nursing: principles and practice, 7ª ed., Jones & Bartlett Publishers, 2011, pp. 901-905, ISBN 978-1-4496-1829-2.
- ^ Gonçalves V, Sehovic I, Quinn G, Childbearing attitudes and decisions of young breast cancer survivors: A systematic review, in Human Reproduction Update, vol. 20, n. 2, 2013, pp. 279-92, DOI:10.1093/humupd/dmt039, PMC 3922144, PMID 24077938.
- ^ Sulik, pp. 37-38
- ^ Sulik, p.4
- ^ Bob Riter, History of Breast Cancer Advocacy, su crcfl.net, Cancer Resource Center of the Finger Lakes. URL consultato il 29 giugno 2013 (archiviato dall'url originale il 23 giugno 2013).
- ^ Sulik, p. 27-72
- ^ Sulik, p. 359-361
- ^ Sulik, 2010, pp. 366–8.
- ^ Landeman, Anne, Pinkwashing: Can Shopping Cure Breast Cancer?, su prwatch.org, Center for Media and Democracy, 11 giugno 2008.
- ^ Sulik, pp. 365–6.
- ^ Sulik, pp. 372–4.
- ^ What`s new in breast cancer research and treatment?, in Cancer. URL consultato il 21 agosto 2015 (archiviato dall'url originale il 12 novembre 2015).
- ^ Fenretinide (4-HPR): A Preventive Chance for Women at Genetic and Familial Risk?, in hindawi.
Bibliografia[modifica | modifica wikitesto]
- Robbins e Cotran, Le basi patologiche delle malattie, 7ª ed., Torino-Milano, Elsevier Masson, 2008, ISBN 978-88-85675-53-7.
- Sanguinetti, Bistoni, Aventa, Chirurgia della mammella, testo atlante, Terni, Morphena editrice, 2010, ISBN 978-88-96051-07-8.
- (EN) Sulik, Gayle A., Pink Ribbon Blues: How Breast Cancer Culture Undermines Women's Health, Oxford University Press, 2010, ISBN 0-19-974045-3.
Voci correlate[modifica | modifica wikitesto]
- Capecitabina
- Radial scar
- Autoesame della mammella
- Chirurgia della mammella
- Storia della mastectomia
- Chirurgia plastica ricostruttiva della mammella
- Lumpectomia
- Mammografia ottica
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su tumore della mammella
Wikimedia Commons contiene immagini o altri file su tumore della mammella
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) breast cancer / Tumore alla mammella, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Tumore alla mammella, su airc.it.
- Tumore alla mammella, su andosonlusnazionale.it.
| Controllo di autorità | LCCN (EN) sh85016679 · GND (DE) 4008528-4 · J9U (EN, HE) 987007583504205171 · NDL (EN, JA) 00568758 |
|---|