Diossido di selenio
| Diossido di selenio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| diossido di selenio | |
| Nomi alternativi | |
| biossido di selenio anidride seleniosa | |
| Caratteristiche generali | |
| Formula bruta o molecolare | SeO2 |
| Massa molecolare (u) | 110,96 |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 231-194-7 |
| PubChem | 24007 |
| SMILES | O=[Se]=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 3,954 g/cm3 (20 °C) |
| Solubilità in acqua | 384 g/L (14 °C) |
| Temperatura di fusione | 340 °C (613 K) sotto pressione |
| Temperatura di ebollizione | 317 °C (590 K) sublima |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 68 mg/kg |
| Indicazioni di sicurezza | |
| TLV (ppm) | 0,0002 |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 301 - 331 - 373 - 410 |
| Consigli P | 261 - 273 - 301+310 - 311 - 501 [1][2] |
Il diossido di selenio è un ossido del selenio di formula bruta SeO2 e massa molecolare 110,96 uma. Pertanto il numero di ossidazione del selenio è +4.
Si può formare per combustione del selenio o dei seleniuri:
per ossidazione del selenio con acido solforico concentrato e caldo:
e per decomposizione del triossido di selenio:
Il composto è solubile in solventi apolari (benzene), mentre in acqua reagisce dando acido selenioso:
Da cui il nome anidride seleniosa.
L'anidride reagisce con gli alcali per dare l'anione selenito:
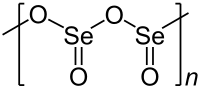
Allo stato solido è un polimero la cui catena principale è formata da un'alternanza di atomi di selenio e di ossigeno, allo stato gassoso ha una struttura trimera simile a quella dell'anidride solforosa. La sua volatilità a temperature moderatamente alte lo rende adatto ad essere separato dai fanghi anodici dell'elettrolisi del rame, difatti esistono processi commerciali di produzione sfruttando questo metodo.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- I. Bertini, F. Mani, Chimica Inorganica, CEDAM ISBN 88-13-16199-9
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Diossido di selenio
Wikimedia Commons contiene immagini o altri file su Diossido di selenio




